Способ селективного выделения популяции жизнеспособных клеток из биологических жидкостей
Иллюстрации
Показать всеИзобретение относится к области молекулярной, клеточной биологии и диагностической медицины. Для селективного выделения популяции жизнеспособных клеток образец биологической жидкости помещают в ячейку микрофлюидного устройства, содержащую в качестве фильтрующего материала кремниевую микроканальную матрицу со сквозными отверстиями размером 3-30 мкм и длиной каналов 50-300 мкм, и пропускают ее через матрицу со скоростью 0,1-4 мл/мин. В случае разделения клеток по размеру, фракцию клеток, имеющих размер меньше, чем размер сквозных отверстий в матрице, собирают после прохождения микроканальной матрицы, а более крупные клетки элюируют с каналов микроканальной матрицы обратным током элюента. В случае рецептор-специфичного выделения клеток поверхность матрицы предварительно модифицируют антителами против специфических рецепторов клеток, а целевые клетки элюируют с каналов матрицы изотипическими иммуноглобулинами или гаптенами. Использование способа позволяет повысить эффективность и ускорить селективное выделение популяции жизнеспособных клеток из биологических жидкостей. 2 з.п. ф-лы, 2 ил., 4 табл.
Реферат
Изобретение относится к области молекулярной/клеточной биологии и диагностической медицины, а именно к разработке способов выделения клеток определенного типа из биологических образцов.
Способы, позволяющие быстро и недорого выделять индивидуальные популяции жизнеспособных клеток из биологических образцов, требуются для исследования механизмов клеточных взаимодействий, клеточной дифференцировки, тканевой инженерии и в ряде смежных областей. Особенный интерес такие способы представляют для диагностической медицины, в частности выделение редких клеток из крови позволяет выделять клетки плода из материнской крови, а также циркулирующие клетки опухолей. Такие циркулирующие клетки могут быть эффективно использованы для анализа хромосомных аберраций, а методология их выделения позволяет не только перейти к малоинвазивной онкодиагностике, но и получать принципиально новые диагностические данные (оценка метастатического потенциала, генетического профиля, лекарственной устойчивости и т.д.).
Известен способ выделения редких онкотрансформированных клеток метастазирующих опухолей из крови пациентов с использованием микрофлюидных устройств (Nature, 2007, v.450, 1235-1239). Устройство состоит из микрофлюидной ячейки, представляющей из себя плоскую прозрачную камеру с множеством стержней, предназначенных для создания развитой поверхности. Поверхность микростержней модифицирована тиольными группами, к которым в дальнейшем ковалентно присоединяют биотин, а затем авидин. Далее ячейку инкубируют с антителами против поверхностных рецепторов онкотрансформированных клеток, например ЕрСАМ (молекулы адгезии эпителиальных клеток), меченных биотином. Клетки прокачивают через микрофлюидное устройство при помощи микродозаторов, затем визуализуют при помощи флуоресцентно меченых моноклональных антител против цитокератинов и анализируют при помощи флуоресцентной микроскопии. Способ требует уникального оборудования как для изготовления микроячеек, так и для анализа результатов и обеспечивает только рецептор-специфичное выделение клеток.
Известен способ непрерывного разделения частиц по размеру в микропроточной системе, содержащей асимметричную, относительно направления силы действия, микроструктурированную матрицу с системой микроканалов (патент US 7150812, кл. C12N 15/06, опубл. 19.12.2006). В микроканалах матрицы создана упорядоченная структура препятствий, в которой каждый ряд препятствий смещен относительно предыдущего на определенную величину; тем самым создается асимметричное направление столбца препятствий по сравнению с направлением приложенного поля силы, что позволяет сохранять направление движения, совпадающее с направлением приложенного поля силы более мелким частицам, в то время как более крупные частицы совершают боковое движение под углом к направлению основного потока. Варьируя размер щелей и величину смещения рядов препятствий, а также размер самих препятствий, можно добиться разделения частиц в широком диапазоне размеров.
Недостатком известного способа является сложность ячейки, необходимость точного контроля давления и расхода жидкости, низкая эффективность разделения клеток по размеру и отсутствие возможности рецептор-специфичного разделения клеток.
Известен способ серийной сортировки клеток, включающий в себя обеспечение разделения потока жидкости при движении клеток через серию клеточных разделителей в первом направлении с выходом на предшествующий серии клеточный разделитель, сообщающийся с входом на последующий клеточный разделитель серии (патент US 7390387, кл. G01N 27/447, опубл. 24.06.2008). В пределах каждого клеточного разделителя первая порция клеток отделяется от второй порции клеток с помощью приложения переменного электрического поля через первый электрод, чтобы вызвать движение первой порции клеток во втором направлении, отличном от движения потока жидкости, пересекающемся с первым потоком, направляющимся к выходу соответствующего клеточного разделителя. Такая серия разделителей позволяет выделять из образца несколько разновидностей клеток, различающихся по электрическим свойствам.
Известен способ разделения, очистки и подсчета клеточных субпопуляций в микропроточной системе, имеющей управление потоками жидкости в микроканалах в районе клеточной фокусировки (международная заявка WO 2005/108963, кл. G01N 21/64, опубл. 17.11.2005). Участок оптической детекции обнаруживает различные типы клеток, находящиеся в едином потоке. Электромагнитные поля используются для управления потоками клеток согласно сигналам от участка оптической детекции, направляя их в ветви каналов под действием источника силы для разделения образца. Система может иметь параллельные структуры, которые повышают производительность или последовательно включают системы для обеспечения некоторых аналитических шагов. Оптическая система и микролинзы могут быть вставлены в отливаемый материал в процессе отливки.
Недостатками известного способа являются сложность в изготовлении и управлении микропроточной системы, низкая эффективность разделения клеточных субпопуляций. Кроме того, система требует предварительной пробоподготовки для маркировки искомых клеточных популяций.
Известен способ разделения клеток по размеру в микрофлюидном устройстве (Wu Z, Hjort K, Wicher G, Fex Svenningsen A. Microfluidic high viability neural cell separation using viscoelastically tuned hydrodynamic spreading. Biomed Microdevices. 2008 Oct; 10(5): 631-8). Микроканальная матрица выполнена из полидиметоксисилана методом литографии и разделяет клетки в вязкой среде, содержащей альгинат натрия, за счет сил, возникающих в токе вязких жидкостей.
Известный способ позволяет делить клетки только по размеру, причем после разделения двух популяций клеток, отличающихся по размеру в 5 раз, чистота каждой популяции составляет не более 70%. Т.е. способ характеризуется низкой эффективностью, а кроме того, требования к равномерности потоков и стабилизации входного давления очень высоки, что требует специальной оснастки.
Наиболее ближайшим к заявляемому способу - прототипом, является способ селективного выделения как минимум одного компонента из биологической жидкости организма с использованием микрофлюидного устройства, включающий подготовку образца, пропускание последнего через ячейку с микроканальной матрицей с последующим сбором и анализом выделенных клеток, при этом кровь или жидкость пропускают через микроканальную матрицу, содержащую сквозные отверстия (поры) размером от 5 до 500 мкм (международная заявка WO 03/090924, кл. B01J 20/32, опубл. 06.11.2003). Матрица может быть изготовлена из полимеров или природных силикатов, глиноземов, минеральных волокон, имеет губчатую структуру и предназначена для удаления низкомолекулярных компонентов из крови. Для разделения клеток используют дополнительную модификацию клеток микробусами. Эффективность удаления фагоцитирующих клеток из крови составляет не более 50%.
Недостатками прототипа является низкая эффективность удаления клеток за счет высокого сопротивления потоку жидкости, создаваемого губчатой структурой, отсутствие возможности использования способа для размер-специфичного разделения интактных, не модифицированных специальными реагентами клеток, отсутствие возможности выделения клеток из матрицы и отсутствие возможности получения жизнеспособных клеток.
Технической задачей изобретения является повышение эффективности способа и расширение его функциональных возможностей.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем.
Подготовленный образец биологической жидкости (кровь, лимфу, ликвор, бронхиальные смывы, мочу и др.) пропускают через кремниевую микроканальную матрицу со сквозными отверстиями квадратного сечения с размером 3-30 мкм и длиной каналов 50-300 мкм со скоростью 0,1-4 мл/мин. При этом, в случае разделения клеток по размеру, фракцию клеток, имеющих размер меньше, чем размер сквозных отверстий в матрице, собирают после микроканальной матрицы, а клетки с размерами больше, чем размер сквозных отверстий в матрице, элюируют из каналов микроканальной матрицы обратным током элюента (т.е. в обратном направлении относительно направления потока нанесения клеток). В качестве элюента используют преимущественно буферный раствор, содержащий 20-50 мМ динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). В случае рецептор-специфичного выделения клеток, поверхность матрицы предварительно модифицируют антителами против специфических рецепторов клеток, а целевые клетки элюируют из каналов матрицы изотипическими (по отношению к рецептор-специфическим антителам) иммуноглобулинами или гаптенами. В частном случае, когда биологической жидкостью является кровь, последнюю разводят 0,2-5 раз буферным раствором, содержащим 20-50 мМ ЭДТА.
Определяющими отличительными признаками предлагаемого способа, по сравнению с прототипом, являются следующие.
1. Образец биологической жидкости пропускают через микроканальную матрицу, выполненную из кремния, со сквозными отверстиями квадратного сечения с размером 3-30 мкм и длиной каналов 50-300 мкм, что позволяет исключить сопротивление потоку жидкости за счет высокой пористости поверхности и гладких стенок отверстий матрицы, перпендикулярных направлению потока, что обеспечивает ламинарный поток жидкости и минимальное разрушение жизнеспособных клеток, а также обеспечивает максимально эффективное выделение клеток заданного размера и возможность эффективного выделения больших и малых клеток, диаметром от 3 до 30 микрон. Отсутствие сопротивления потоку и большое количество отверстий на единицу поверхности позволяют выделять более 96% жизнеспособных клеток.
2. Образец биологической жидкости пропускают через микроканальную матрицу со скоростью 0,1-4 мл/мин самотеком, что позволяет исключить необходимость комплектации устройства дополнительным оборудованием. Требуемую скорость задают простым перепадом давления за счет вертикального перемещения приемного резервуара и резервуара-коллектора, что позволяет значительно удешевить процесс. Например, длительность процесса выделения клеток по размеру для одного образца крови составляет не более 20 минут.
3. Для разделения клеток по размеру фракцию клеток, имеющих размер меньше, чем размер сквозных отверстий в матрице, собирают после прохождения микроканальной матрицы, а более крупные клетки элюируют с каналов микроканальной матрицы обратным током элюента, что позволяет выделять крупные клетки с высокой эффективностью.
4. Для рецептор-специфичного выделения клеток поверхность матрицы модифицируют антителами против специфических рецепторов клеток, а затем целевые клетки элюируют из каналов матрицы изотипическими иммуноглобулинами или гаптенами, что позволяет расширить функциональные возможности способа.
Кроме этого, способ позволяет многократно использовать одну матрицу за счет предусмотренных стадий регенерации, промывки и прокаливания последней.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1
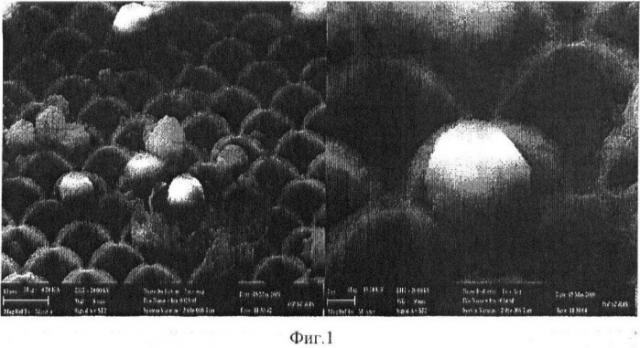
Для оценки эффективности выделения крупных клеток из периферической крови в последнюю были добавлены клетки HeLa. В предварительном эксперименте было показано, что размер клеток HeLa не позволяет им проходить через каналы микроканальной матрицы со сквозными отверстиями (порами) размером 7×7 мкм. На фиг.1 представлена электронная сканирующая микроскопия клеток HeLa на поверхности микроканальной матрицы с порами размером 7×7 мкм.
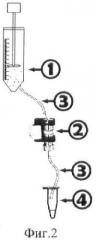
Для выделения популяции жизнеспособных клеток использовали микрофлюидное устройство, представленное на фиг.2, включающее емкость для сепарируемых клеток (1), микрофлюидную ячейку с установленной микроканальной матрицей (2), входящий и выходящий капилляры (3) и емкость для сбора клеток (4).
В 1 мл крови, предварительно пропущенной через микроканальное устройство для удаления крупных клеток (моноцитов и гранулоцитов), вносили 0,5×106 клеток HeLa, клеточную суспензию разводили фосфатным буфером, содержащим 20 мМ ЭДТА (ФБР-ЭДТА), в 5 раз и пропускали со скоростью 2,5 мл в минуту через кремниевую микроканальную матрицу с размером сквозных отверстий квадратного сечения размером 7×7 мкм и длиной каналов 150 мкм. Перепад давления составлял 30 см водного столба.
При этом эритроциты и другие клетки с размером меньше, чем размер отверстий в матрице, проходили через матрицу, а более крупные клетки HeLa задерживались на матрице.
Далее матрицу промывали 3 мл фосфатного буфера, содержащего 20 мМ ЭДТА, и обратным током буферного раствора со скоростью 4 мл/мин элюировали целевые клетки 10 мл фосфатного буфера, содержащего 20 мМ ЭДТА. Клетки осаждали центрифугированием и ресуспендировали в 1 мл физиологического раствора, брали аликвоту 10 мкл и производили подсчет клеток в камере Горяева. Кроме этого, эффективность выделения клеток оценивали по количественному ПЦР-анализу аберрантно метилированного гена RARβ2, как описано в заявке RU №2008132233/15, решение о выдаче патента от 22.06.2009.
Данные о количестве клеток Hela до и после выделения, определенные методом прямого подсчета клеток и количественного ПЦР, представлены в таблице 1. Из таблицы 1 видно, что эффективность выделения крупных клеток составляет не менее 90%. Количество клеток Hela составляло не менее 82%.
Для повторного использования матрицы после разделения клеток ее последовательно промывали 10 мл физиологического раствора в прямом и 10 мл в обратном направлениях, 5 мл 10% водного раствора додецилсульфата натрия (SDS) и затем 20 мл дистиллированной воды. После отмывки матрицу инкубировали 30 минут в 3%-ном растворе бихромата калия в концентрированной серной кислоте, отмывали 50 мл дистиллированной воды и высушивали на воздухе.
Данный пример иллюстрирует возможность быстрого выделения крупных клеток, циркулирующих в крови, не требующего дополнительных реагентов (таких как среда для разделения лейкоцитов и т.д.).
Пример 2
Для оценки рисков метастазирования опухолей молочной железы циркулирующие эпителиальные клетки опухоли выделяли из образцов крови больных раком молочной железы (n=5, Т2, NxM1) заявляемым способом.
Венозную кровь от 3 пациентов (4 мл) помещали в 1 мл физиологического раствора, содержащего 50 мМ ЭДТА (ФБР-ЭДТА). Далее полученный образец крови (5 мл) пропускали со скоростью 0,5 мл/мин через кремниевую микроканальную матрицу с размером сквозных отверстий квадратного сечения 8×8 мкм и длиной каналов 300 мкм, установленную в микрофлюидную ячейку, как описано в примере 1.
Далее матрицу промывали 10 мл фосфатного буфера, содержащего 20 мМ ЭДТА, со скоростью 3 мл/мин и обратным током буферного раствора со скоростью 4 мл/мин элюировали целевые клетки 10 мл фосфатного буфера, содержащего 20 мМ ЭДТА. Клетки осаждали центрифугированием и ресуспендировали в 50 мкл физиологического раствора. ДНК выделяли из клеток с использованием набора для выделения ДНК («БиоСилика», Росиия). Для оценки количества онкотрансформированных клеток использовали измерение аберранто метилированного гена Cyclin D2, как было описано ранее (Fackler MJ, McVeigh М, Mehrotra J, et all. Cancer Res. 2004 Jul 1; 64(13): 4442-52). В качестве контроля использовали количественный анализ гена β-актина (Т.Е.Skvortsova, V.V.Vlassov, P.P.Laktionov. Ann NY Acad Sci. 2008, 1137: 36-40). Результаты анализа представлены в таблице 2. Полученные результаты демонстрируют, что в крови 2 пациентов присутствуют онкотрансформированные клетки. Таким образом, заявляемый способ может быть использован для размер-специфичного выделения онкотрансформированных клеток.
Пример 3. Выделение клеток из мочи
Ядерные клетки мочи представляют интерес для неинвазивной диагностики рака предстательной железы и могут быть использованы в качестве материала для генетических исследований.
Для выделения ядерных клеток из мочи были взяты образцы мочи у здоровых мужчин (n=10) и больных раком предстательной железы (n=5, Т1-2, NxMx) с целью дальнейшего поиска онкотрансформированных клеток.
50 мл мочи от каждого донора пропускали со скоростью 4 мл/минуту через кремниевую микроканальную матрицу с размером сквозных отверстий квадратного сечения 3×3 мкм и длиной каналов 50 мкм, установленную в микрофлюидную ячейку, как описано в примере 1. При этом микроканальная матрица не препятствовала прохождению свободной жидкости, белковых агрегатов и веществ, ингибирующих ПЦР, но задерживала ядерные клетки. Далее матрицу промывали 10 мл фосфатного буфера, содержащего 20 мМ ЭДТА, со скоростью 4 мл/мин и обратным током буферного раствора со скоростью 4 мл/мин элюировали целевые клетки 10 мл фосфатного буфера, содержащего 20 мМ ЭДТА. ФБР-ЭДТА, ядерные клетки собирали обратным током жидкости со скоростью 4 мл/мин. Клетки осаждали центрифугированием при 1200 об/мин в течение 5 мин на настольной центрифуге (Eppendorf, Германия) и ресуспендировали в 50 мкл физиологического раствора. ДНК выделяли из клеток с использованием набора для выделения ДНК («БиоСилика», Росиия) и анализировали наличие аберрантно метилированного гена GSTP-1, как описано ранее (Jeronimo С, Usadel Н, Henrique R, Silva С, Oliveira J, Lopes С, Sidransky D. Urology. 2002 Dec; 60(6): 1131-1135). Количество клеток определяли при помощи количественного ПЦР однокопийного гена β-актина, как описано (Т.Е.Skvortsova, V.V.Vlassov, P.P.Laktionov. Ann NY Acad Sci. 2008, 1137: 36-40). Данные представлены в таблице 3. В моче здоровых доноров не было обнаружено трансформированных клеток, в то время как в 3 образцах мочи, полученных от больных раком предстательной железы, обнаружены раковые клетки.
Данный пример иллюстрирует возможность быстрого и эффективного выделения ядерных клеток мочи, не требующего дополнительных реагентов для дальнейшего анализа.
Пример 4
Для рецептор-специфичного выделения циркулирующих клеток из крови больных раком молочной железы венозную кровь от 5 доноров (Т2, NxMx) собирали в ФБР-ЭДТА, как описано в примере 2. Для рецептор-специфичного выделения была использована микроканальная матрица со сквозными отверстиями квадратного сечения размером 30×30 мкм и длиной каналов 300 мкм. Антивидоспецифические антитела ковалентно иммобилизовали на стенки каналов микроканальной матрицы следующим образом. Поверхность микроканальной матрицы активировали (окисляли) путем выдерживания в растворе хромовой смеси в течение 15 минут, затем тщательно промывали матрицу дистиллированной водой и трижды ополаскивали этиловым спиртом, после чего матрицу помещали в 5% спиртовой раствор аминопропилтриэтоксисилана и инкубировали в течение 2 часов, затем отмывали спиртом (3 раза), ополаскивали ацетоном и высушивали при 80°С в течение часа. Далее поверхность микроканальной матрицы обрабатывали раствором бифункционального реагента цианур хлорида в ацетонитриле с концентрацией 4 мг/мл в течение 2 часов при комнатной температуре. После реакции матрицу три раза промывали ацетонитрилом. Блокирование активированной поверхности, во избежание неспецифической сорбции, проводили 0,02 М раствором глицина в буферном растворе, содержащем 0,02 М трис, 0,1 М NaCl, 0,002 М MgCl2, 0,05% Твин-20, рН 7,5, в течение 30 минут при комнатной температуре. Затем матрицу модифицировали инкубированием в растворе козьих поликлональных антител против иммуноглобулина кролика. Удаляли несвязавшиеся молекулы антител путем отмывок раствором, содержащим: 0,02 М трис, 0,1 М NaCl, 0,05% Твин-20, рН 7,5, и инкубировали матрицу с раствором кроличьих поликлональных антител против цитокератина 18 в концентрации 0,72 мг/мл в растворе 0,15 М NaCl в течение 12 часов. Удаляли несвязавшиеся молекулы антител путем отмывок раствором, содержащим: 0,02 М трис, 0,1 М NaCl, 0,002 М MgCl2, 0,05% Твин-20, рН 7,5. Промывали матрицу физиологическим раствором и использовали для рецептор-специфичного выделения клеток в течение не более чем 48 часов от конца процедуры связывания специфических антител.
Образцы цельной крови разводили в 3 раза раствором ФБР с 20 мМ ЭДТА и пропускали через микрофлюидное устройство со скоростью 0,1 мл/мин. После нанесения клеток ячейку отмывали 5 мл ФБР с 20 мМ ЭДТА со скоростью 0,5 мл/мин. Для элюции клеток использовали раствор кроличьего иммуноглобулина G с концентрацией 2 мг/мл в ФБР. Клетки элюировали со скоростью 0,2 мл/мин, осаждали центрифугированием при 1200 об/мин в течение 5 мин на настольной центрифуге (Eppendorf, Германия) и выделяли ДНК с использованием набора «БиоСилика». Анализировали наличие аберрантно метилированного гена Cyclin D2, как описано ранее (Fackler MJ, McVeigh М, Mehrotra J, Blum MA, Lange J, Lapides A, Garrett E, Argani P, Sukumar S. Cancer Res. 2004 Jul 1; 64(13): 4442-52). Количество клеток определяли при помощи количественного ПЦР однокопийного гена β-актина, как описано (Т.Е.Skvortsova, V.V.Vlassov, P.P.Laktionov. Ann NY Acad Sci. 2008, 1137: 36-40). Данные представлены в таблице 4. Результаты демонстрируют, что рецептор-специфичное выделение клеток позволило детектировать циркулирующие опухолевые клетки в крови 4 из 5 больных раком молочной железы.
Предложенный способ позволяет быстро и эффективно выделять популяции жизнеспособных клеток из биологических жидкостей, в частности клетки-мишени, циркулирующие в крови, из общего пула циркулирующих клеток крови.
| Таблица 1 | ||
| Подготовленный образец | До выделения на МКМ | После выделения на МКМ |
| Количество клеток Hela по данным количественного ПЦР метилированной формы гена RAR β 2 | 100% | 82% |
| Количество клеток, определенное методом прямого подсчета клеток (считали клетки, содержащие ядро) | 100% | 90% |
| Таблица 2 | ||
| Пациенты | Здоровые (n=10) | Рак молочной железы (n=2) |
| Количество клеток по данным количественной ПЦР на аберранто метилированную форму гена Cyclin D2 | 0% | 85±7% |
| Количество клеток по данным ПЦР гена β-актина | 100% | 100% |
| Таблица 3 | ||
| Пациенты | Здоровые (n=10) | Рак предстательной железы (n=3) |
| Количество клеток по данным ПЦР гена β-актина | 100% | 100% |
| Количество клеток по данным ПЦР гена GSTP-1 | 0% | 20% |
| Таблица 4 | |||||
| № пациента | 1 | 2 | 3 | 4 | 5 |
| Количество копий последовательности гена β-актина по данным количественной ПЦР | 305±20 | 210±10 | 320±40 | 202±7 | 316±40 |
| Количество копий метилированной формы гена Cyclin D2 по данным количественной ПЦР | 50±10 | 65±8 | 47±9 | 70±8 | 0 |
1. Способ селективного выделения популяции жизнеспособных клеток из биологических жидкостей с использованием микрофлюидного устройства, включающий подготовку образца, пропускание последнего через ячейку с микроканальной матрицей с последующим сбором и анализом выделенных клеток, отличающийся тем, что подготовленный образец биологической жидкости пропускают через кремниевую микроканальную матрицу со сквозными отверстиями квадратного сечения размером 3-30 мкм и длиной каналов 50-300 мкм со скоростью 0,1-4 мл/мин, при этом, в случае разделения клеток по размеру, фракцию клеток, имеющих размер меньше, чем размер сквозных отверстий в матрице, собирают после прохождения микроканальной матрицы, а более крупные клетки элюируют с каналов микроканальной матрицы обратным током элюента, а в случае рецептор-специфичного выделения клеток поверхность матрицы предварительно модифицируют антителами против специфических рецепторов клеток, а целевые клетки элюируют с каналов матрицы изотипическими иммуноглобулинами или гаптенами.
2. Способ по п.1, отличающийся тем, что в случае, когда биологической жидкостью является кровь, последнюю разводят в 0,2-5 раз буферным раствором, содержащим 20-50 мМ ЭДТА.
3. Способ по п.1, отличающийся тем, что в качестве элюента используют буферный раствор, содержащий 20-50 мМ ЭДТА.