Способ моделирования инфицированного уретерогидронефроза
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к оперативной урологии. Для этого полоской целлофана шириной 1-1,5 см в два слоя окутывают мочеточник без сдавления. После чего в изолированный участок мочеточника в его стенку и парауретеральную клетчатку вводят микродозу взвеси микроба. Способ позволяет изучить диагностику и лечение ранних форм уретерогидронефроза, и для микробиологической диагностики, изучения свойств инфекционного начала, патоморфологической характеристики воспаления верхних мочевыводящих путей, гидронефротической трансформации почки как при банальной, так и специфической инфекции. 3 ил.
Реферат
Изобретение относится к медицине, в частности к оперативной урологии, и может быть использовано для изучения патогенеза, способов ранней диагностики патологии почки и верхних мочевыводящих путей и их лечения.
Изучение патогенеза хронического уретерогидронефроза моделированием патологии мочеточника у экспериментальных животных расположением вокруг него в забрюшинном пространстве целлофановой полоски приведено в ряде работ [1, 2, 3]. В результате хронического асептического воспаления вокруг инородного тела в забрюшинной клетчатке происходит изменение сократительной функции мочеточника с развитием гидронефротической трансформации почки.
Моделирование инфекционного процесса в почке и мочевыводящих путях прямым введением инфекционного начала в орган, как правило, нерегулируемо, часто безрезультатно [4, 5, 6]. Для изучения патогенеза, признаков (симптомов) ранних стадий хронического инфицированного уретерогидронефроза описание экспериментальной модели в литературе не нашли.
Предлагается способ моделирования уретерогидронефроза у экспериментальных животных изолированием участка мочеточника обертыванием его полоской целлофана, отличающийся тем, что с целью изучения динамики развития воспалительного процесса в мочевыводящих путях и почке полоску целлофана шириной 1-1,5 см располагают в забрюшинном пространстве в строго определенном отделе мочеточника, окутывая в два слоя ею орган без сдавления; установленную дозу инфекционного начала (кишечная палочка, стафилококк и др.) вводят в изолированном участке мочеточника в его стенку и парауретеральную клетчатку.
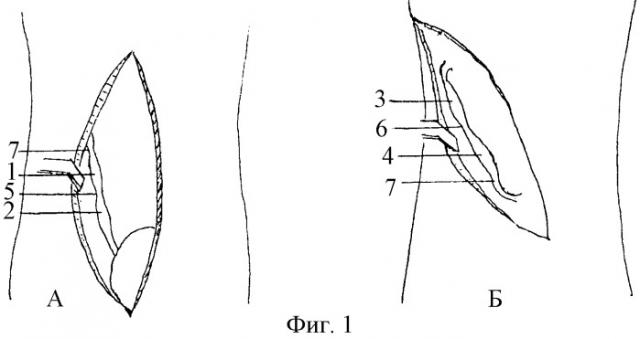
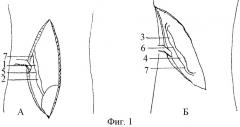
На Фиг.1 представлены доступы к мочеточнику:
А - чрезбрюшинный доступ к тазовой части мочеточника нижним срединным разрезом (нижняя срединная лапаротомия), где:
1 - пристеночный отдел мочеточника;
2 - висцеральный отдел мочеточника;
5 - нижнее промежуточное сужение;
7 - среднее (анатомическое) сужение.
Б - внебрюшинный доступ к брюшной части мочеточника поясничным разрезом:
3 - поясничный отдел мочеточника;
4 - подвздошный отдел мочеточника;
6 - верхнее промежуточное сужение.
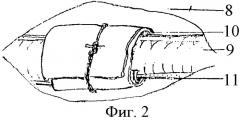
На Фиг.2 представлено выделение отдела мочеточника в забрюшинном пространстве, окутывание его целлофановой полоской («автономизация»):
8 - периуретеральная фасция;
9 - мочеточник;
10 - целлофановая полоска;
11 - мочеточниковые сосуды, парауретеральная клетчатка.
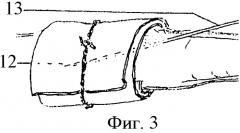
На Фиг.3 представлено введение дозированной взвеси микробов в парауретеральную клетчатку и адвентициальную оболочку мочеточника:
12 - парауретеральная клетчатка, имбибированная под целлофановой полоской взвесью микробов;
13 - инъекционная игла.
Предлагаемый способ моделирования инфицированного уретерогидронефроза выполняли у крупных экспериментальных животных (собака) под тиопенталовым наркозом в соответствии с правилами работы с экспериментальными животными. Нижним срединным чрезбрюшинным или поясничным внебрюшинным доступом (Фиг.1, А, Б) обнажали тазовую или брюшную часть мочеточника. В зависимости от цели эксперимента выделяли на протяжении 2 см один из отделов названных частей мочеточника: пристеночный 1 или висцеральный 2, поясничный 3 или подвздошный 4, нижнее 5 или верхнее 6 промежуточное, среднее 7 сужения. Мочеточник выделяли после рассечения над ним периуретеральной фасции 8 (Фиг.2). Вокруг выделенного участка мочеточника 9 в забрюшинном пространстве располагали полоску целлофана 10 шириной 1 - 1,5 см, в два слоя оборачивая ею орган вместе с проходящими вдоль его медиального и латерального краев сосудами 11 без сдавливания их. В парауретеральную клетчатку 12 и в стенку (Фиг.3) изолированного целлофановой муфтой участка мочеточника вводили микродозу маркированной взвеси банального или специфического инфекционного начала 13. Послойно ушивали операционный доступ, начиная с периуретеральной фасции.
В качестве инфекционного начала при создании модели использовали лабораторную культуру вирулентного золотистого стафилококка в разведении 1:150-1:200. Микродозу этого раствора от 0,5 до 1,0 мл вводили в парауретеральную клетчатку и в адвентициальную оболочку мочеточника.
В послеоперационном периоде изучали, во-первых, динамику развития инфекционного процесса и, во-вторых, стадии развития инфицированного уретерогидронефроза.
По приведенной технике выполнили моделирование инфицированного уретерогидронефроза у 10 животных на обоих мочеточниках. Модель оказалась эффективной при изучении динамики морфофункциональных изменений мочевыводящих путей и почки как по локализации инфекционного начала в отделах органа, так и по его виду.
Выраженность воспалительного процесса в парауретеральной клетчатке и в стенке инфицированного участка мочеточника и сроки его развития у разных животных оказались аналогичны. Иными словами, процесс формирования хронического уретерогидронефроза оказался регулируемым. Полагаем, что в основе успеха использования предложенной модели для изучения динамики развития хронического уретерогидронефроза наряду с точным определением дозы и вида инфекционного начала является прием «автономизации» конкретного отдела (участка) органа, то есть его частичное изолирование от окружающих слоев и структур организма. Модель окажется полезной не только в клинической и оперативной урологии для изучения диагностики и лечения ранних форм уретерогидронефроза, но и для микробиологической диагностики, изучения свойств инфекционного начала, патоморфологической характеристики воспаления верхних мочевыводящих путей, гидронефротической трансформации почки как при банальной, так и специфической инфекции.
Литература
1. Назаришвили Р.И. Функция почки и мочеточника при механическом уростазе в верхних мочевых путях и компенсаторная функция почки. // Автореф. дисс… д.м.н. - Тбилиси, 1973. - 51 с.
2. Неймарк А.И. Изменение гемодинамики и секреторно-экскреторная функция почек при острой экспериментальной окклюзии мочеточника. // Эксперим. хирург. и анестезиол. - 1976. - 6. - С.55-56.
3. Паникратов Е.Д., Тетеркин А.П. Нарушение уродинамики при обструкции верхних мочевых путей. // Соврем. медицина. - 1974. - 1974. - 4. - С.110-112.
4. Кернесюк Н.Л. Топографоанатомическое и экспериментальное обоснование восстановительных операций на тазовой части мочеточника в условиях растущего организма. / Дисс. д.м.н. - Свердловск, 1987. - 430 с.
Способ моделирования инфицированного уретерогидронефроза у экспериментальных животных изолированием участка мочеточника обертыванием его полоской целлофана, отличающийся тем, что полоской целлофана шириной 1-1,5 см в два слоя окутывают мочеточник без сдавливания и вводят микродозу взвеси микробов в изолированный участок мочеточника в адвентициальную оболочку его стенки и в парауретеральную клетчатку.