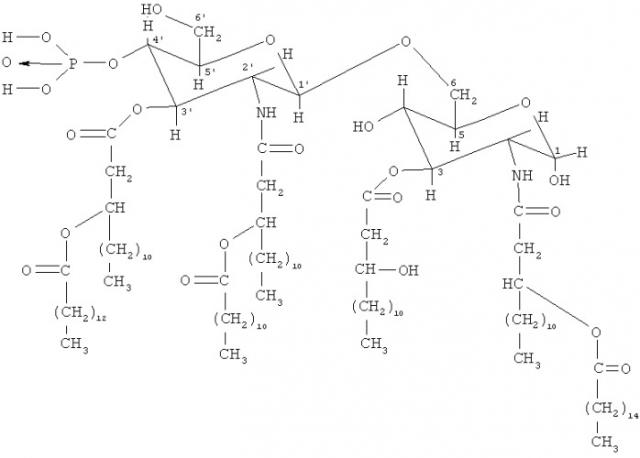
Вакцины, содержащие антиген plasmodium
Иллюстрации
Показать всеИзобретение относится к области медицины и касается вакцины, содержащей антиген Plasmodium. Сущность изобретения включает новое применение вакцины RTS,S/AS02A, представляющей собой белок циркумспорозоита Р.falciparum (CS), соответствующий аминокислотам 207-395 белка CS клона 3D7 штамма NF54 Р.falciparum, слитый в рамке считывания через линейный линкер с N-концом HBSAg и поверхностный антиген гепатита В (HBSAg) в комбинации с фармацевтически приемлемым адъювантом, содержащим 3D-MPL и QS21 для вакцинации детей в возрасте младше 5 лет против тяжелой малярии. Преимущество изобретения заключается в расширении области применения. 6 з.п. ф-лы, 3 табл., 3 ил.
Реферат
Настоящее изобретение относится к новому применению малярийного антигена для иммунизации против малярии. Данное изобретение относится, в частности, к применению антигенов спорозоита, в частности белка циркумспорозоита (CS) или его фрагментов для иммунизации против тяжелой формы малярии.
Малярия является одной из главных мировых проблем в области здравоохранения. В течение 20-го века экономическое и социальное развитие вместе с противомалярийными кампаниями привели к ликвидации малярии во многих регионах мира, уменьшив опасную зону на мировой поверхности с 50% до 27%. Тем не менее, при установленном ожидаемом приросте населения предполагается, что к 2010 году половина населения мира, приблизительно 3,5 миллиарда людей, будет проживать в районах, где передается малярия1. Текущие оценки позволяют предположить, что число смертей из-за малярии составляет значительно больше 1 миллиона ежегодно, а ошеломляющие экономические затраты только для Африки эквивалентны 100 миллиардам US$ в год2.
Эти цифры подчеркивают глобальный малярийный кризис и проблемы, которые он ставит перед международным медицинским сообществом. Причины данного кризиса многочисленны и варьируются от возникновения широко распространенной резистентности к имеющимся, доступным и ранее эффективным лекарственным средствам до упадка и несостоятельности систем здравоохранения из-за недостатка ресурсов. Пока не будут найдены способы контроля этого заболевания, глобальные попытки улучшения здоровья и детской выживаемости, снижения уровня бедности, повышения безопасности и укрепления наиболее уязвимых слоев общества будут терпеть неудачи.
Одну из наиболее острых форм заболевания вызывает протозойный паразит Plasmodium falciparum, ответственный за большую часть смертей, относимых на счет малярии.
Жизненный цикл Р.falciparum является сложным, требующим для завершения двух хозяев, человека и комара. Инфицирование человека инициируется заражением спорозоитами в слюне инфицированного комара. Спорозоиты мигрируют в печень и там инфицируют гепатоциты (печеночная стадия), где дифференцируются через экзоэритроцитарную внутриклеточную стадию в мерозоитную стадию, которую инфицируют красные кровяные клетки (RBC) для инициации циклической репликации на бесполой стадии в крови. Цикл завершается дифференциацией ряда мерозоитов в RBC в гаметоциты половой стадии, которые всасывает комар, где они развиваются через ряд последовательных стадий в средней кишке для воспроизведения спорозоитов, которые мигрируют в слюнную железу.
Стадию спорозоита Р.falciparum определяют в качестве одной из потенциальных мишеней противомалярийной вакцины. Основной поверхностный белок спорозоита известен как белок циркумспорозоита (CS-белок). Этот белок клонировали, экспрессировали и секвенировали для множества штаммов, например штамма NF54, клона 3D7 (Caspers et al., Mol. Biochem. Parasitol. 35, 185-190, 1989). Для белка из штамма 3D7 характерно наличие области центральной иммунодоминантной повторяющейся области, включающей тетрапептид Asn-Ala-Asn-Pro, повторяющийся 40 раз, но перемежаемый четырьмя минорными повторами Asn-Val-Asp-Pro. В других штаммах число главных и минорных повторов варьируется так же, как и их относительное положение. На концах этого центрального участка расположены N- и С- концевые участки, состоящие из неповторяющихся аминокислотных последовательностей, обозначенных как бесповторный участок CS-белка.
Противомалярийная вакцина GlaxoSmithKline Biologicals' RTS,S, основанная на CS-белке, находится в разработке с 1987 года и в настоящее время является наиболее перспективным из изучаемых кандидатов противомалярийной вакцины4. Эта вакцина специфически нацелена на преэритроцитарную стадию Р.falciparum и обеспечивает защиту против инфицирования спорозоитами Р.falciparum, доставляемыми разводимыми в лаборатории инфицированными комарами, у незараженных малярией взрослых добровольцев и против естественного воздействия у полуиммунных взрослых5, 6.
RTS,S/AS02A (RTS,S плюс адъювант) применяли в последовательных исследованиях I фазы, предпринятых в Гамбии, где участвовали дети 6-11 и 1-5-летнего возраста, и которое подтвердило, что вакцина являлась безопасной, хорошо переносимой и иммуногенной7. Затем была выбрана педиатрическая доза вакцины, и она изучалась в исследовании I фазы, в котором участвовали мозамбикские дети в возрасте 1-4 года, и где она была признана безопасной, хорошо переносимой и иммуногенной8.
Тем не менее, существует укоренившееся мнение, что для достижения защиты от клинического заболевания, вызываемого Р.falciparum в условиях естественного воздействия, требуется более чем один антиген, и требуются множественные антигены, представляющие множественные стадии жизненного цикла паразита (Page: 3 Webster, Daniel and Hill, Adrian V.S. Progress with new malaria vaccines. Bull World Health Organ, Dec. 2003, vol.81, no.12, p.902-909. ISSN 0042-9686; Hoffman S. Save the children. Nature. 2004 Aug. 19; 430 (7002):940-1). Также общепринятым является представление о том, что антиген, такой как CS, с преэритроцитарных стадий паразита не может быть предпочтительным антигеном для обеспечения защиты против тяжелой формы заболевания, поскольку тяжелую форму заболевания вызывают паразиты на бесполой стадии, и преэритроцитарные антигены, такие как CS, не экспрессируются у паразитах на бесполой стадии.
В настоящее время получены неожиданные результаты с преэритроцитарным малярийным антигеном в клиническом испытании с участием африканских детей младшего возраста. Было обнаружено, что RTS,S вакцина на основе CS-белка может обеспечить не только защиту против инфекции при естественном воздействии, но также защиту против широкого спектра клинических заболеваний, вызываемых Р.falciparum. У детей, получавших RTS,S-вакцину, отмечено меньшее количество серьезных неблагоприятных явлений, госпитализаций и тяжелых осложнений малярии, включая смерть, по сравнению с результатами в контрольной группе.
В частности, обнаружение того, что заболеваемость тяжелой формой малярии может быть снижена с помощью данной вакцины на основе CS, оказалось непредвиденным и неожиданным. Тяжелая форма малярии описана в руководстве ВОЗ (Всемирная организация здравоохранения) по клинической практике (Page: 3 World Health Organization. Management of severe malaria, a practical handbook. Second edition, 2000. http://mosquito.who.int/docs/hbsm.pdf). Классификация детей в соответствии с определением тяжелой формы малярии по ВОЗ позволяет определить тех детей, которые очень ослаблены или имеют высокий риск смерти. За высокий риск можно принимать риск смерти примерно 30% или более.
Кроме того, представляется, что эффективность вакцины RTS,S против как новых заражений, так и клинических случаев либо не уменьшается, либо уменьшается медленно. Через 6 месяцев наблюдения в клиническом испытании вакцина оставалась эффективной, хотя имело место значительное различие в частоте инфицирования. Это находится в резком противоречии с предыдущими испытаниями на добровольцах, не зараженных малярией, или взрослых гамбийцах, которые наводили на мысль о том, что эффективность вакцины недолговечна6,23.
Следовательно, в настоящем изобретении предложено применение антигена Plasmodium, который экспрессируется на преэритроцитарной стадии, предпочтительно антигена спорозоита, в изготовлении лекарственного средства для вакцинирования против тяжелой формы малярии в комбинации с фармацевтически приемлемым адъювантом или носителем.
Изобретение, в частности, касается снижения частоты заболеваемости тяжелой формой заболевания, вызываемого Р.falciparum.
Предпочтительной популяцией-мишенью для такой вакцины являются дети, в частности дети в возрасте младше 5 лет и особенно дети в возрасте 1-4 года.
Предпочтительно антиген Plasmodium представляет собой антиген Р.falciparum.
Антиген может быть выбран из любого антигена, экспрессируемого на спорозоите или на другой преэритроцитарной стадии паразита, такой как печеночная стадия. Предпочтительно антиген выбирают из белка циркумспорозоита (CS), антигена-1 печеночной стадии (LSA-1), антигена-3 печеночной стадии (LSA-3), родственного тромбоспондину безымянного белка (TRAP) и апикального мерозоитного антигена-1 (АМА-1), который, как было недавно показано, присутствует на печеночной стадии (в дополнение к эритроцитарной стадии). Все эти антигены хорошо известны в данной области. Антиген может представлять собой целый белок или его иммуногенный фрагмент. Иммуногенные фрагменты малярийных антигенов хорошо известны, например эктодомен из АМА-1.
Предпочтительно антиген Plasmodium сливают с поверхностным антигеном гепатита В (HBsAg).
Предпочтительный антиген для применения в данном изобретении происходит из белка циркумспорозоита (CS) и предпочтительно находится в форме гибридного белка с HBsAg. Антиген может представлять собой целый CS-белок или его часть, включающую фрагмент или фрагменты CS-белка, которые могут быть слиты друг с другом.
Предпочтительно антиген на основе CS-белка находится в форме гибридного белка, включающего в себя, по существу, весь С-терминальный участок CS-белка Plasmodium, четыре или более тандемных повторов иммунодоминантной области CS-белка и поверхностный антиген гепатита В (HBsAg). Предпочтительно гибридный белок включает последовательность, содержащую по меньшей мере 160 аминокислот, которые, по существу, гомологичны С-терминальному участку CS-белка. В частности, «по существу весь» С-терминальный участок CS-белка включает С-конец без гидрофобной якорной последовательности. CS-белок может быть лишен по меньшей мере 12 аминокислот С-конца.
Наиболее предпочтительно гибридный белок для применения по данному изобретению представляет собой белок, включающий участок CS-белка Р.falciparum, по существу соответствующий аминокислотам 207-395 3D7 клона Р.falciparum, полученного из штамма NF54 (Caspers et al., выше), слитый в рамке с N-концом HBsAg посредством линейного линкера. Линкер может включать участок преS2 из HBsAg.
Предпочтительные CS-структуры для применения в настоящем изобретении описаны в WO 93/10152. Наиболее предпочтительным является гибридный белок, известный как RTS, как описано в WO 93/10152 (где он обозначен RTS*) и WO 98/05355, полные содержания этих заявок включены в данное описание изобретения посредством ссылки.
Особенно предпочтительным гибридным белком является гибридный белок, известный как RTS, состоящий из:
- остатка метионина, кодируемого нуклеотидами с 1059 по 1061, полученными из генной последовательности Saccharomyces cerevisiae TDH3 (Musti A.M. et al., Gene, 1983, 25 133-143);
- трех аминокислот, Met Ala Pro, полученных с нуклеотидной последовательности (с 1062 по 1070), созданной посредством процедуры клонирования, использованной для построения гибридного гена;
- отрезка из 189 аминокислот, кодируемого нуклеотидами с 1071 по 1637, представляющего аминокислоты с 207 по 395 белка циркумспорозоита (CSP) Plasmodium falciparum штамма 3D7 (Caspers et al., см. выше);
- аминокислоты (Gly), кодируемой нуклеотидами с 1638 по 1640, созданными посредством процедуры клонирования, использованной для конструирования гибридного гена;
- четырех аминокислот, Pro Val Thr Asn, кодируемых нуклеотидами с 1641 по 1652 и представляющих четыре карбокси-концевых остатка вируса гепатита В (серотип adw) преS2 белка (Nature 280: 815-819, 1979);
- отрезка из 226 аминокислот, кодируемых нуклеотидами с 1653 по 2330 и специфичных для S-белка вируса гепатита В (серотип adw).
Предпочтительно RTS находится в форме смешанных частиц RTS,S.
Предпочтительная PTS,S-конструкция включает два полипептида RTS и S, синтезируемых одновременно и во время очистки спонтанно формирующих комбинированные корпускулярные структуры (RTS,S).
RTS-белок предпочтительно экспрессируют в дрожжах, наиболее предпочтительно в S.cerevisiae. У такого хозяина RTS будет экспрессироваться в виде липопротеиновой частицы. Предпочтительные реципиентные штаммы дрожжей предпочтительно уже несут в своем геноме несколько интегрированных копий кассеты экспрессии S гепатита В. Итоговый штамм, следовательно, синтезирует два полипептида, S и RTS, которые спонтанно объединяются в смешанные (RTS,S) липопротеиновые частицы. У этих частиц преимущественно на поверхности представлены CSP-последовательности гибрида. Преимущественно соотношение RTS:S в этих смешанных частицах составляет 1:4.
Изобретение обеспечивает возможность применения одного малярийного антигена в вакцине, что противоречит существовавшему ранее мнению о требованиях для вырабатывания защиты, в частности защиты против тяжелой формы заболевания. Следовательно, согласно изобретению RTS или другой антиген предпочтительно представляет собой единственный малярийный антиген в вакцине.
В другом аспекте данного изобретения предложено применение антигена из одного малярийного белка в изготовлении лекарственного средства для применения в вакцинировании против тяжелой формы малярии. Малярийный белок может представлять собой любой из белков, описанных здесь, включая CS-белок, АМА-1, TRAP, LSA-1 и LSA-3. Наиболее предпочтительным является CS-белок в гибридной форме, как описано в данном описании.
В изобретении также предложен способ предупреждения или ослабления тяжелой формы малярии, включающий введение субъекту композиции, содержащей малярийный антиген, экспрессируемый на преэритроцитарной стадии, и адъювант. Антигены и адъюванты такие, как описано в данной заявке. Предпочтительными субъектами являются дети, предпочтительно в возрастных интервалах, описанных в данной заявке.
Подходящий график вакцинирования для применения в изобретении включает введение 3 доз вакцины с интервалами один месяц.
Тяжелая форма малярии может быть определена согласно руководству по клинической практике ВОЗ (см. выше). В исследовании, описанном в данной заявке, критерии для определения тяжелой формы малярии были взяты из руководства по клинической практике ВОЗ и приведены в таблице ниже.
В качестве первостепенного критерия для клинических случаев малярии, определенных в ходе исследования, требовалось наличие паразитемии бесполых Р.falciparum > 15000 на мкл в окрашенных по Гимзе толстых каплях крови и наличие лихорадки (подмышечная температура ≥37,5°С) ≥37,5°С.
Распознаванию тяжелой формы малярии способствовало дополнительное наличие одного или более из следующего: тяжелой малярийной анемии (PCV (packed cell volume, показатель гематокрита) <15%), церебральной малярии (значение по коматозной шкале Blantyre <2) или тяжелого заболевания других систем организма, которое может включать множественные судороги (две или более генерализованных конвульсии за предыдущие 24 часа), прострацию (определяемую как неспособность сохранять сидячее положение без посторонней помощи), гипогликемию <2,2 ммоль/дл или <40 мг/дл), клинические подозреваемый ацидоз или циркуляторный коллапс. Они представлены в Таблице 1 ниже.
Определение случаев тяжелой формы малярии
| Тяжелая малярийная анемия | - Отличительные показатели бесполой паразитемии | |
| - Гематокрит <15% | ||
| - Отсутствие других более вероятных причин заболевания | ||
| Церебральная малярия | - Отличительные показатели бесполой паразитемии | Оценка значения по коматозной шкале после коррекции гипогликемии и через 60 мин после сдерживания приступов. Если приступы не удается сдерживать в пределах 30 мин, ребенка включают |
| - Значение по коматозной шкале ≤2 | ||
| - Отсутствие других идентифицируемых причин потери сознания | ||
| Тяжелая форма малярии (другие) | - Характерные показатели бесполой паразитемии | |
| - Отсутствие других вероятных причин заболевания | ||
| - Не удовлетворяет критериям тяжелой малярийной анемии или церебральной малярии | ||
| - Одно из следующего: | ||
| - Множественные судороги | Две или более генерализованных конвульсии в течение 24-часового периода, предшествующего допуску | |
| - Прострация | Неспособность сохранять сидячее положение без посторонней помощи | |
| - Гипогликемия | <2,2 ммоль/дл или <40 мг/дл | |
| - Ацидоз | Документально подтвержденные симптомы и/или лабораторные данные | |
| - Циркуляторный коллапс | Документально подтвержденные симптомы и/или лабораторные данные |
Согласно данному изобретению водный раствор очищенного гибридного белка можно применять непосредственно или в комбинации с подходящим адъювантом или носителем. Альтернативно белок может быть лиофилизирован перед смешиванием с подходящим адъювантом или носителем.
Предпочтительная доза вакцины согласно данному изобретению составляет от 1 до 100 мкг RTS,S на дозу, более предпочтительно от 5 до 75 мкг RTS,S, наиболее предпочтительно 25 мкг PTS,S-белка, предпочтительно в 250 мкл (конечная жидкая композиция). Это предпочтительная доза для применения у детей, в частности детей младше пяти лет и, более конкретно, детей в возрасте 1-4 года, и представляет собой половину предпочтительной дозы для взрослых. Предпочтительная доза для взрослых составляет от 1 до 100 мкг RTS,S на дозу, более предпочтительно от 5 до 75 мкг RTS,S, наиболее предпочтительно дозу в 50 мкг RTS,S на 500 мкл (конечная жидкая композиция).
Согласно данному изобретению антиген комбинируют с адъювантом или носителем. Предпочтительно присутствует адъювант, в частности адъювант, представляющий собой преимущественный стимулятор ответа Th1-типа.
Подходящие адъюванты включают, без ограничения ими, детоксифицированный липид А из любого источника и нетоксичные производные липида А, сапонины и другие иммуностимуляторы, которые являются преимущественными стимуляторами Th1-клеточного ответа (в данной заявке также называемого ответом Th1-типа).
Иммунный ответ может быть ориентировочно разделен на две крайние категории: гуморальный или клеточно-опосредованный иммунный ответ (традиционно характеризующиеся опосредованными антителами и клеточными эффекторными механизмами защиты соответственно). Эти категории ответа были названы ответ Th1-типа (клеточно-опосредованный ответ) и иммунный ответ Th2-типа (гуморальный ответ).
Крайний иммунный ответ Th1-типа может быть охарактеризован образованием антигенспецифичных цитотоксических Т-лимфоцитов с ограниченным гаплотипом и естественными киллерными ответами. У мышей ответы Th1-типа часто характеризуются выработкой антител подтипа IgG2a, в то время как у человека они соответствуют антителам IgG1-типа. Иммунный ответ Th2-типа характеризуется выработкой ряда изотипов иммуноглобулинов, включая IgG1 у мышей.
Можно считать, что движущей силой в развитии этих двух типов иммунных ответов являются цитокины. Высокие уровни цитокинов Th1-типа имеют тенденцию способствовать индукции клеточно-опосредованных иммунных ответов на данный антиген, в то время как высокие уровни цитокинов Th2-типа имеют тенденцию способствовать индукции гуморальных иммунных ответов на антиген.
Отличие иммунных ответов Th1- и Th2-типа не абсолютно и может принимать форму континуума между этими двумя крайностями. В действительности у субъекта поддерживается иммунный ответ, который описан как преимущественно Th1 или преимущественно Th2. Однако часто удобно рассматривать семейства цитокинов в терминах, описанных Mosmann и Coffmann (Mossman T.R. and Coffmann R.L. (1989). TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annual Review of Immunology, 7, p. 145-173) для мышиных Т-клеточных клонов CD4 +ve. Традиционно ответы Тh1-типа связаны с продуцированием Т-лимфоцитами цитокинов INF-γ. Другие цитокины, часто напрямую связанные с индукцией иммунного ответа Th1-типа, такие как IL-12, не продуцируются Т-клетками. Для сравнения, ответы Th2-типа связаны с секрецией IL-4, IL-5, IL-6, IL-10 и фактора некроза опухолей-β (TNF-β).
Известно, что некоторые адъюванты вакцин особенно подходят для стимуляции цитокиновых ответов либо Th1-, либо Th2-типа. Традиционно, индикаторы баланса Th1:Th2 иммунного ответа после вакцинирования или инфицирования включают непосредственное измерение продуцирования Th1- и Th2-цитокинов Т-лимфоцитами in vitro после рестимуляции антигеном и/или измерение (по меньшей мере на мышах) соотношения IgG1:IgG2a антигенспецифических опосредованных антителами ответов.
Таким образом, адъювант Th1-типа представляет собой адъювант, который стимулируют продуцирование высоких уровней цитокинов Th1-типа отдельными популяциями Т-клеток при рестимуляции антигеном in vitro и индуцируют антигенспецифические иммуноглобулиновые ответы, ассоциированные с изотипом Th1-типа.
Адъюванты, способные к преимущественной стимуляции Th1-клеточного ответа, описаны в WO 94/00153 и WO 95/17209.
Предпочтительные иммуностимуляторы Th1-типа, которые могут быть разработаны для получения адъювантов, подходящих для применения по настоящему изобретению, включают нижеследующие, но не ограничены ими.
Давно известно, что энтеробактериальный липополисахарид (LPS) является сильнодействующим стимулятором иммунной системы, хотя его применение в адъювантах было ограничено из-за его токсических эффектов. Нетоксичное производное LPS, монофосфориллипид A (MPL), получаемый отщеплением сердцевинной углеводной группы и фосфата от глюкозамина с редуцирующим концом, описан Ribi et al. (1986, Immunology and Immunopharmacology of bacterial endotoxins, Plenum Publ. Corp., NY, p. 407-419) и имеет следующую структуру:
Дополнительно детоксифицированный вариант MPL получают отщеплением ацильной цепи по положению 3 дисахаридного остова и называют 3-O-деацилированный монофосфориллипид A (3D-MPL). Он может быть очищен и приготовлен способами, раскрытыми в GB 2122204 В, этот документ также раскрывает получение дифосфориллипида А и его 3-O-деацилированного варианта.
Предпочтительной формой 3D-MLP является форма эмульсии с небольшим размером частиц, менее 0,2 мкм в диаметре, и способ ее получения раскрыт в WO 94/21292. Водные композиции, содержащие монофосфориллипид А и поверхностно-активное вещество, описаны в WO 9843670.
Адъюванты, полученные из бактериального липополисахарида, для применения по настоящему изобретению можно очистить и обработать из бактериальных источников или, альтернативно, они могут быть синтезированы. Например, очищенный монофосфориллипид А описан в Ribi et al., 1986 (см. выше), а 3-O-деацилированный монофосфорил- или дифосфориллипид А, полученные из Salmonella sp., описаны в GB 2220211 и US 4912094. Были описаны другие очищенные и синтезированные липополисахариды (Hilgers et al., 1986, Int. Arch. Allergy. Immunol., 79 (4); 392-6; Hilgers et al., 1987, Immunology, 60 (1): 141-6; и ЕР 0549074 B1). Особенно предпочтительным бактериальным липополисахаридным адъювантом является 3D-MLP.
Соответственно производные LPS, которые можно применять по данному изобретению, представляют собой иммуностимуляторы, аналогичные по структуре LPS, или MPL, или 3D-MLP. Согласно другому варианту производные LPS могут представлять собой ацилированный моносахарид, который является субфрагментом вышеуказанной MLP-структуры.
Сапонины также являются предпочтительными Th1 иммуностимуляторами согласно изобретению. Сапонины представляют собой хорошо известные адъюванты и раскрыты в: Lacaille-Dubois, M and Wagner H. (1996. A review of the biological and pharmacological activities of saponins. Phytomedicine vol. 2 pp. 363-386). Например, Quil А (полученный из коры южноамериканского дерева Quillaja Saponaria Molina (Квиллайя мыльная)) и его фракции описаны в US 5057540 и «Saponins as vaccine adjuvants», Kensil C.R., Crit Rev Ther Drug Carrier Syst, 1996, 12 (1-2): 1-55; и ЕР 0362279 B1. Гемолитические сапонины QS21 и QS17 (очищенные ВЭЖХ фракции Quil А) описаны как сильнодействующие системные адъюванты, а способ из получения раскрыт в патенте США 5057540 и ЕР 0362279 B1. В этих документах также описано применение QS7 (негемолитической фракции Quil А), который выполняет функцию сильнодействующего адъюванта для системных вакцин. Применение QS21 также описано у Kensil et al. (1991. J. Immunology vol. 146, 431-437). Также известны комбинации QS21 и полисорбата или циклодекстрина (WO 99/10008). Корпускулярные адъювантные системы, содержащие фракции Quil А, такие как QS21 и QS7, описаны в WO 96/33739 и WO 96/11711.
Другим предпочтительным иммуностимулятором является иммуностимулирующий олигонуклеотид, содержащий неметилированные CpG-динуклеотиды («CpG»). CpG представляет собой аббревиатуру цитозин-гуанозин динуклеотидных мотивов, присутствующих в ДНК. CpG известны в данной области в качестве адъюванта при введении как системным путем, так и через слизистые (WO 96/02555, ЕР 468520, Davis et al., J. Immunol, 1998, 160 (2): 870-876; McCluskie and Davis, J. Immunol., 1998, 161 (9): 4463-6). Исторически было замечено, что ДНК-фракция BCG (Bacillus Calmette-Guerin) может оказывать противоопухолевый эффект. В дальнейших исследованиях была показана способность синтетических олигонуклеотидов, полученных с генных последовательностей BCG, индуцировать иммуностимулирующие эффекты (как in vitro, так и in vivo). Авторы данного исследования сделали вывод о том, что некоторые палиндромические последовательности, включая центральный мотив CG, проявляют такую активность. Центральная роль CG-мотива в иммуностимуляции была впоследствии пояснена в публикации Krieg, Nature 374, р. 546, 1995. Детальный анализ показал, что CG-мотив должен находиться в контексте определенной последовательности, и что такие последовательности распространены в бактериальной ДНК, но редко встречаются в ДНК позвоночных. Иммуностимулирующая последовательность часто представляет собой: пурин, пурин, С, G, пиримидин, пиримидин; где CG-мотив не метилирован, однако известны другие неметилированные CpG-последовательности, которые являются иммуностимулирующими и которые можно применять в настоящем изобретении.
В некоторых комбинациях из шести нуклеотидов присутствует палиндромическая последовательность. Несколько таких мотивов, либо как повторы одного мотива, либо как комбинация разных мотивов, могут присутствовать в одном и том же олигонуклеотиде. Наличие одного или более таких олигонуклеотидов, содержащих иммуностимулирующие последовательности, может индуцировать различные уровни иммунитета, включая клетки - естественные киллеры (вырабатывающие интерферон γ и обладающие цитолитической активностью) и макрофаги (Wooldrige et al. Vol. 89 (№8), 1977). Также показано, что другие неметилированные CpG-содержащие последовательности, не имеющие такую консенсусную последовательность, являются иммуномодулирующими.
CpG, при использовании в вакцинах, обычно вводят в свободном растворе вместе со свободным антигеном (WO 96/02555; McCluskie and Davis, см. выше) или ковалентно связанным с антигеном (WO 98/16247), или готовят с носителем, таким как гидроксид алюминия ((Hepatitis surface antigen) Davis et al. смотри выше; Brazolot-Millan et al., Proc. Natl. Acad. Sci., USA, 1998, 95 (26), 15553-8).
Иммуностимуляторы, такие как описаны выше, могут быть объединены с носителями, такими как, например, липосомы, эмульсии "масло в воде" и/или соли металлов, включая соли алюминия (такие как гидроксид алюминия). Например, 3D-MPL может быть объединен с гидроксидом алюминия (ЕР 0689454) или эмульсиями "масло в воде" (WO 95/17210); QS21 может быть предпочтительно объединен с липосомами, содержащими холестерин (WO 96/33739), эмульсиями "масло в воде" (WO 95/17210) или квасцами (WO 98/15287); CpG может быть объединен с квасцами (Davis et al. см. выше; Brazolot-Millan, см. выше) или другими катионными носителями.
Также предпочтительными являются комбинации иммуностимуляторов, в частности комбинация монофосфориллипида А и производного сапонина (WO 94/00153; WO 95/17210; WO 96/33739; WO 98/56414; WO 99/12565; WO 99/11241), более конкретно комбинация QS21 и 3D-MPL, как раскрыто в WO 94/00153. Альтернативно комбинация CpG плюс сапонин, такой как QS21, также образуют сильнодействующий адъювант для применения в настоящем изобретении.
Таким образом, подходящая система адъювантов включает, например, комбинацию монофосфориллипида А, предпочтительно 3D-MPL, с солью алюминия.
Улучшенная система включает комбинацию монофосфориллипида А и производного сапонина, в частности комбинацию QS21 и 3D-MPL, раскрытую в WO 94/00153, или менее реактогенную композицию, где QS21 удерживается в липосомах, содержащих холестерин (DQ), как раскрыто в WO 96/33739.
Особенно сильнодействующая композиция адъювантов, включающая QS21, 3D-MPL & токоферол в водомасляной эмульсии, описана в WO 95/17210 и представляет собой другую предпочтительную композицию для применения по данному изобретению.
Другая предпочтительная композиция содержит CpG-олигонуклеотид, один, или вместе с QS21, 3D-MPL, или с солью алюминия.
Согласно одному воплощению настоящего изобретения предложено применение детоксифицированного липида А или нетоксичного производного липида А, более предпочтительно монофосфориллипида А или его производного, такого как 3D-MPL, в комбинации с малярийным антигеном, как описано в данной заявке, для изготовления вакцины для предупреждения тяжелой формы малярии.
Предпочтительно дополнительно используют сапонин, предпочтительно QS21.
Предпочтительно в изобретении также применяют эмульсию "вода в масле" или липосомы.
Предпочтительными комбинациями адъювантов для применения в настоящем изобретении являются:
1. 3D-MPL, QS21 и эмульсия "масло в воде";
2. 3D-MPL и QS21 в липосомном препарате;
3. 3D-MPL, QS21 и CpG в липосомном препарате.
Количество белка по настоящему изобретению, присутствующее в каждой дозе вакцины, выбирают как количество, которое индуцирует иммунозащитный ответ без значительных неблагоприятных побочных эффектов, присущих типичным вакцинам. Такое количество будет варьироваться в зависимости от того, какой специфический иммуноген применяют и присутствуют или нет в вакцине адъюванты. В общем случае предполагается, что каждая доза будет содержать 1-1000 мкг белка, предпочтительно 1-200 мкг, наиболее предпочтительно 10-100 мкг. Оптимальное количество для конкретной вакцины может быть установлено стандартными исследованиями, включающими измерение титров антител и других ответов у субъекта. После первичной вакцинации субъект предпочтительно будет получать бустерную дозу в течение 4 недель, после чего повторные бустерные дозы каждые шесть месяцев в течение времени, пока существует риск инфицирования. Предпочтительные количества RTS,S-белка также приведены в данной заявке выше.
Вакцины по изобретению могут быть доставлены любым из множества путей введения, например перорально, местно, подкожно, трансмукозально (обычно интравагинально), внутривенно, внутримышечно, интраназально, сублингвально, внутрикожно и посредством суппозитория.
Иммунизация может быть профилактической или терапевтической. Изобретение, описанное в данной заявке, в первую очередь, но не исключительно, относится к профилактической вакцинации против малярии, более конкретно к профилактической вакцинации для предупреждения или снижения вероятности тяжелой формы малярии.
Подходящие фармацевтически приемлемые носители или эксципиенты для применения по данному изобретению хорошо известны в данной области и включают, например, воду или буферы. Изготовление вакцины в общих чертах описано в Pharmaceutical Biotechnology, Vol.61, Vaccine Design - the subunit and adjuvant approach, edited by Powell and Newman, Plenum Press, New York, 1995. New Trends and Developments in Vaccines, edited by Voller et al., University Park Press, Baltimore, Maryland, USA, 1978. Инкапсулирование в липосомы описано, например, в Fullerton, патент США 4235877. Конъюгация белков в макромолекулы раскрыта, например, в Likhite, патент США 4372945 и в Armor et al., патент США 4474757.
Примеры
Материалы и способы
Область исследования
Испытание проводили в Centre de Investigaćäo em Saude da Manhića [CISM] в округе Manhića (провинция Мапуту) в южном Мозамбике с апреля 2003 по май 2004 года. Особенности данной области были подробно описаны в другой работе9. Климат субтропический с двумя четкими сезонами: теплый и дождливый сезон с ноября по апрель, и обычно прохладный и сухой сезон в течение остального года. В течение 2003 года годовое количество атмосферных осадков составило 1286 мм. Многолетнее распространение малярии с заметной сезонностью происходит преимущественно благодаря Р.falciparum. Главным переносчиком является Anopheles funestus, и примерный уровень энтомологического инфицирования (EIR) в 2002 году составлял 38. Комбинированная терапия на основе амодиахина и сульфадоксина-пириметамина (SP) является терапией первой линии для неосложненной малярии и легкодоступна в медицинских учреждениях. К CISM прилегает Центр здравоохранения Manhića, медицинское учреждение, рассчитанное на 110 коек. Окружная сеть здравоохранения состоит из еще 8 периферических постов здравоохранения и сельского госпиталя.
Дизайн исследования
Исследование представляло собой IIб фазу двойного слепого рандомизированного и контролируемого клинического исследования с целью оценки безопасности, иммуногенности и эффективности GSK Biologicals' RTS,S/AS02A малярийной вакцины. Главной целью являлась оценка эффективности в отношении клинических случаев малярии, вызванной Р.falciparum, у детей в возрасте от 1 до 4 лет при первой вакцинации в течение 6-месячного контрольного периода, начиная с 14 дня после дозы 3.
Исследование было задумано для проверки эффективности вакцины по двум пунктам жизненного цикла и патогенеза малярии: инфицированию и клиническому заболеванию. Эти два конечных момента оценивали одновременно в двух группах, располагающихся в двух разных местах (Фиг.1). Группа 1, набранная в радиусе 10 км вокруг Manhića, участвовала в оценке главного момента защиты против клинического заболевания, определяемого пассивным выявлением заболевания в Центре здравоохранения Manhića и на посту здравоохранения Maragra. Группу 2 набирали в IIha Josina, аграрной и болотистой низинной местности в 55 км к северу от Manhića, и следили за ней с целью определением новых случаев инфицирования посредством активного и пассивного наблюдения.
Для группы 1 требовалось 704 поддающихся оценке субъектов на группу для получения 80%-ной достоверности определения 15%-ной нижней границы доверительного интервала эффективности вакцины, принимая уровень клинической атаки Р.falciparum за контрольный период в контрольной группе за 11% и эффективность вакцины за 50%. Для группы 2 требовалось 116 поддающихся оценке детей на группу для получения достоверности 86% в определении 50%-ной эффективности вакцины для предупреждения новых случаев инфицирования с нижней границей доверительного интервала 20%, принимая уровень новых случаев инфицирования за контрольный период за 50%.
Протокол был утвержден Национальным наблюдательным комитетом по этике Мозамбика, Наблюдательным комитетом по этике стационарной клиники Барселоны и Программой за адекватные технологии в здравоохранении (PATH) Комитета по защите человека как объекта исследований. Испытание проводили согласно руководству по добросовестной клинической практике ICH, и оно находилось под контролем GlaxoSmithKline Biologicals. Местное управление по контролю безопасности и Управление по контролю данных и безопасности тщательно проверяли ход и результаты данного исследования.
Отбор и информированное согласие
CISM располагает системой демографического контроля в исследуемом регионе10. Списки потенциально подходящих постоянно проживающих детей были получены из этой переписи. Их посещали на дому, зачитывали информационные листки родителям или опекунам и проверяли критерии отбора. Они включали подтвержденное постоянное проживание в области исследования и полноценную иммунизацию вакцинами EPI. Заинтересованные родители/опекуны были приглашены в Центр здравоохранения Manhića или на пост здравоохранения IIha Josina. При первом посещении специально обученный персонал снова зачитывал и объяснял группам родителей/опекунов информационный лист. Индивидуальное согласие испрашивали только после того, как они проходили индивидуальный устный тест на понимание, предназначенный для проверки понимания данной информации. Им предлагали подписать (или поставить отпечаток большого пальца руки, если человек не грамотен) документ об информированном согласии. Член местной общины выполнял функции беспристрастного свидетеля и ставил вторую подпись на документ согласия. Отбор включал краткую историю болезни и осмотр, пробу крови из пальца на гематологические и биохимические тесты.
Детей исключали из участия, если у них в анамнезе были аллергические заболевания, гематокрит <25%, недостаточное питание (значение отношения массы к росту ≤3 Z), если они имели клинически значимое хроническое или острое заболевание или не соответствующие норме гематологические и биохимические параметры. Подходящих субъектов включали в исследование, начиная с первого дня вакцинации, и присваивали им уникальный номер для исследования и индивидуальную идентификационную фотографическую карточку.
Рандомизация и иммунизация
2022 ребенка в возрасте 1-4 года набрали и рандомизировали для получе