Бета-l-2' дезоксинуклеозиды для лечения гепатита в
Иллюстрации
Показать всеДанное изобретение относится к лекарственным средствам для лечения хозяина, инфицированного вирусом гепатита В, содержащим соединения указанных структурных формулы или к их фармацевтически приемлемым солям. Кроме того, изобретение относится к фармацевтическим композициям для лечения хозяина, инфицированного вирусом гепатита В, на основе каждого из данных соединений в отдельности (или их фармацевтически приемлемой соли), а также в их комбинации с эффективным количеством соединения, выбранного из группы, состоящей из β-L-2-гидроксиметил-5-(цитозин-1-ил)-1,3-оксатиолана (3ТС), цис-2-гидроксиметил-5-(5-фторцитозина-1-ил)-1,3-оксатиолана (FTC), β-L-2'-фтор-5-метил-арабинофуранозил-уридин (L-FMAU), β-D-2,6-диаминопуриндиоксолана (DAPD), фамцикловира, пенцикловира, 2-амино-1,9-дигидро-9-[4-гидрокси-3-(гидроксиметил)2-метиленциклопентил]-6Н-пурин-6-она (энтекавир, ВMS-200475), 9-[2-(фосфоно-метокси)этил]аденина (РМЕА, адефовир, дипивоксил), лобукавира, ганцикловира и рибавирина. 6 н. и 6 з.п. ф-лы, 6 табл., 4 ил.
Реферат
Это изобретение относится к способам лечения вируса гепатита В (также упоминаемого как “HBV”), которые включают в себя введение хозяину в случае необходимости - либо отдельно, либо в сочетании - эффективного количества одного или более активных соединений, описываемых в заявке, или фармацевтически приемлемого пролекарства, или соли одного из этих соединений.
HBV находится на втором месте после табака как причина рака человека. Механизм, посредством которого HBV вызывает рак, не известен, хотя предполагают, что он может непосредственно запускать развитие опухоли или косвенно запускать развитие опухоли через хроническое воспаление, цирроз и клеточную регенерацию, связанную с инфекцией.
Вирус гепатита В достигает эпидемических уровней по всему миру. После инкубационного периода от двух до шести месяцев, в течение которого хозяин ничего не знает об инфекции, инфекция HBV может привести к острому гепатиту и поражению печени, что вызывает боль в брюшной полости, желтуху и повышенные уровни определенных ферментов в крови. HBV может вызывать молниеносный гепатит, быстро прогрессирующую и летальную форму заболевания, при котором разрушаются массивные участки печени.
Обычно после острого гепатита пациенты выздоравливают. Однако у некоторых пациентов высокие уровни вирусного антигена сохраняются в крови в течение длительного или неограниченного периода времени, вызывая хроническое инфекционное заболевание. Хронические инфекции могут привести к хроническому персистирующему гепатиту. Пациенты, инфицированные хроническим персистирующим HBV, встречаются больше всего в развивающихся странах. К середине 1991 в одной Азии имелось приблизительно 225 миллионов хронических носителей HBV, а во всем мире почти 300 миллионов носителей. Хронический персистирующий гепатит может быть причиной утомляемости, цирроза печени и гепатоцеллюлярной карциномы, первичного рака печени.
У жителей индустриальных стран группы высокого риска инфицирования HBV включают в себя группы людей, находившихся в контакте с носителями HBV или образцами их крови. Эпидемиология HBV очень похожа на эпидемиологию синдрома приобретенного иммунодефицита (AIDS; СПИД), что объясняет, почему инфекция HBV распространена среди пациентов со СПИДом или родственным СПИДу комплексом. Однако HBV является более заразным, чем HIV (ВИЧ).
Однако позднее с помощью генной инженерии были получены вакцины, которые широко используются в настоящее время. К сожалению, вакцины не могут помочь пациентам, которые уже инфицированы HBV. Также показано, что ежедневное лечение α-интерфероном, генно-инженерным белком обнадеживает, но эта терапия оказывается успешной приблизительно только у одной трети леченых пациентов. Кроме того, интерферон нельзя назначать перорально.
Идентифицирован ряд синтетических нуклеозидов, которые проявляют активность в отношении HBV. (-)-Энантиомер ВСН-189, известный как 3ТС, заявленный Liotta, et al. в Патенте США 5 539 116, одобрен U.S. Food and Drug Administration для лечения гепатита В. Также см. Европейский Патент ЕРА 0 494 119 А1, поданный BioChem Pharma, Inc.
Цис-2-гидроксиметил-5-(5-фторцитозин-1-ил)-1,3-окса-тиолан (“FTC”) проявляет активность в отношении HBV. См. Международную Заявку WO 92/15308; Furman, et al., “The Anti-Hepatitis B Virus Activities, Cytotoxicities, and Anabolic Profiles of the (-) and (+) Enantiomers of cis-5-Fluoro-1-[2-(Hydroxymethyl)-1,3-oxathiolane-5-yl]-Cytosine” Antimicrobial Agents and Chemotherapy, декабрь 1992, page 2686-2692; и Cheng, et al., Journal of Biological Chemistry, Volume 267(20), 13938-13942 (1992).
Von Janta-Lipinski et al., описывает применение L-энантиомеров 5'-трифосфатов 3'-фтор-модифицированных β-2'-дезоксирибонуклеозидов для ингибирования гепатит В-полимеразы (J. Med. Chem., 1998, 41, 2040-2046). В частности, 5'-трифосфаты 3'-дезокси-3'-фтор-β-L-тимидина (β-L-FTTP), 2',3'-дидезокси-3'-фтор-β-L-цитидина (β-L-FdCTP) и 2',3'-дидезокси-3'-фтор-β-L-5-метилцитидина (β-L-FMethCTP) описаны как эффективные ингибиторы ДНК-полимеразы HBV.
В Международной Заявке WO 96/13512 Genencor International, Inc. и Lipitek, Inc. заявляют, что некоторые L-рибофуранозил нуклеозиды можно использовать для лечения рака и вирусов. В частности, описывается применение этого класса соединений для лечения рака и ВИЧ.
В Патентах США №№ 5565438, 5567688 и 5587362 (Chu, et al.) описывается применение 2'-фтор-5-метил-β-L-арабинофуранолилуридина (L-FMAU) для лечения гепатита В и вируса Эпштейна-Барр (Epstein-Barr).
В Международной Заявке WO 92/18517 Yale University and University of Georgia Research Foundation, Inc., описано применение L-FddC (β-L-5-фтор-2',3'-дидезоксицитидин) для лечения вируса гепатита В.
В данной области известны синтетические нуклеозиды β-L-2'-дезоксицитидин (β-L-2'-dC), β-L-2'-дезокситимидин (β-L-dT) и β-L-2'-дезоксиаденозин (β-L-2'-dA). Antonin Holy впервые описал β-L-dC и β-L-dT в 1972, “Nucleic Acid Components and Their Analogs. CLIII. Preparation of 2'-deoxy-L-Ribonucleosides of the Pyrimidine Series,” Collect. Czech. Chem. Commun. (1972), 37(12), 4072-87. Morris S. Zedeck et al., впервые предложил β-L-dA для ингибирования синтеза индуцированных ферментов у Pseudomonas testosteroni, Mol. Phys. (1967), 3(4), 386-95.
Известно, что определенные 2'-дезокси-β-L-эритро-пентофуранонуклеозиды проявляют антинеопластическую и избирательную противовирусную активность. Verri et al. описывает применение 2'-дезокси-β-L-эритропентофуранонуклеозидов в качестве антинеопластических агентов и противогерпетических агентов (Mol. Pharmacol. (1997), 51(1), 132-138 и Biochem. J. (1997), 328(1), 317-20). Saneyoshi et al. описывают применение 2'-дезокси-L-рибонуклеозидов в качестве ингибиторов обратной транскриптазы (I) для контроля ретровирусов и для лечения СПИДа Jpn. Kokai Tokkyo Koho JPO6293645 (1994).
Giovanni et al. исследовал 2'-дезокси-β-L-эритропентофуранонуклеозиды отчасти против вируса псевдобешенства (PRV), Biochem. J. (1993), 294(2), 381-5.
Химиотерапевтическое применение 2'-дезокси-β-L-эритропентофуранонуклеозидов изучалось Tyrsred et al. (Biochim. Biophys. Acta (1968), 155(2), 619-22) и Bloch, et al. (J. Med. Chem. (1967), 10(5), 908-12).
В данной области известно, что β-L-2'-дезокситимидин (β-L-dT) ингибирует тимидинкиназу (ТК) вируса герпеса I типа (HSV-I). Iotti et al. в Международной Заявке WO 92/08727 описано, что β-L-dT избирательно ингибирует фосфорилирование D-тимидина посредством TK HSV-I, но не посредством ТК человека. Spaldari et al. сообщил, что L-тимидин фосфорилируется тимидинкиназой вируса герпеса I типа и ингибирует рост вирусов, J. Med. Chem. (1992), 35(22), 4214-20.
В свете того факта, что вирус гепатита В достигает эпидемических уровней во всем мире и оказывает тяжелое и часто трагическое воздействие на инфицированного пациента, существует серьезная потребность в обеспечении новыми эффективными фармацевтическими веществами для лечения человека, инфицированного вирусом, которые характеризуются низкой токсичностью для хозяина.
Поэтому целью данного изобретения является предоставление новых способов и композиций для лечения человека или других хозяев, инфицированных вирусом гепатита В.
Краткое описание изобретения
Описан способ лечения инфекции гепатита В у человека и других животных хозяев, который включает в себя введение эффективного количества биологически активного 2'-дезокси-β-L-эритропентофуранонуклеозида (альтернативно упоминаемого в описании как β-L-d-нуклеозид или β-L-2'-d-нуклеозид) или его фармацевтически приемлемой соли или пролекарства, вводимого либо отдельно, либо в сочетании, возможно, в фармацевтически приемлемом носителе. Термин 2'-дезокси, который использован в описании, относится к нуклеозиду, не содержащему никакой замещающей группы в 2'-положении.
Описываемые 2'-дезокси-β-L-эритропентофуранонуклеозиды или фармацевтически приемлемые пролекарства или соли, или фармацевтически приемлемые композиции, содержащие эти соединения, используются для предупреждения и лечения инфекций гепатита В и других родственных состояний, таких как анти-HBV-антитело-позитивное и HBV-позитивное состояния, хроническое воспаление печени, вызванное HBV, цирроз, острый гепатит, молниеносный гепатит, хронический персистирующий гепатит и утомляемость. Эти соединения или композиции также можно использовать профилактически для предупреждения или замедления прогрессирования клинического заболевания у индивидуумов, которые являются анти-HBV-антитело-позитивными или HBV-антиген-позитивными или которые подвергались воздействию HBV.
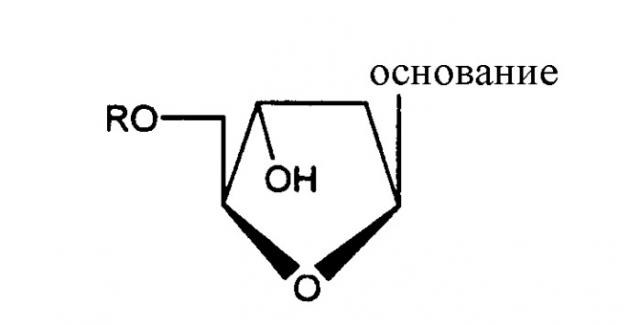
В одном из аспектов данного изобретения, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является соединением формулы:
в которой R выбирается из группы, состоящей из Н, прямого, разветвленного или циклического алкила, СО-алкила, СО-арила, СО-алкоксиалкила, СО-арилоксиалкила, СО-замещенного арила, алкилсульфонила, арилсульфонила, аралкилсульфонил, остатка аминокислоты, моно-, ди- или трифосфата, или производного фосфата; и основание представляет собой пуриновое или пиримидиновое основание, которое необязательно замещено.
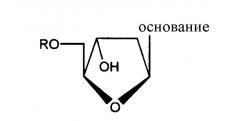
В другом аспекте производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида представляет собой β-L-2'-дезоксиаденозин или его фармацевтически приемлемую соль или пролекарство формулы:
в которой R представляет собой Н, моно-, ди- или трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства).
В еще одном аспекте, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является β-L-2'-дезоксицитидином или его фармацевтически приемлемой солью или пролекарством формулы:
в которой R представляет собой Н, моно-, ди- или трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства).
В следующем аспекте, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является β-L-2'-дезоксиуридином или его фармацевтически приемлемой солью или пролекарством, описываемом формулой:
в которой R представляет собой Н, моно-, ди- или трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для образования стабилизированного нуклеотидного пролекарства).
В другом аспекте, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является β-L-2'-дезоксигуанозином или его фармацевтически приемлемой солью или пролекарством, имеющим формулу:
в которой R представляет собой Н, моно-, ди- или трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для получения стабилизированного нуклеотидного пролекарства).
В следующем аспекте, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является β-L-2'-дезоксиинозином или его фармацевтически приемлемой солью или пролекарством, имеющим формулу:
в которой R представляет собой Н, моно-, ди- или трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для получения стабилизированного нуклеотидного пролекарства).
Еще в одном аспекте, производное 2'-дезокси-β-L-эритро-пентофуранонуклеозида является β-L-тимидином или его фармацевтически приемлемой солью или пролекарством формулы:
в которой R представляет собой Н, моно-, ди- трифосфат, ацил или алкил, или стабилизированное фосфатное производное (для получения стабилизированного нуклеотидного пролекарства).
В другом аспекте 2'-дезокси-β-L-эритро-пентофуранонуклеозид вводится в чередовании или в сочетании с одним или более 2'-дезокси-β-L-эритро-пентофуранонуклеозидами или с одним или более других соединений, которые проявляют активность в отношении вируса гепатита В. Вообще во время альтернирующей терапии эффективная доза каждого агента вводится по очереди, тогда как при сочетанной терапии эффективные дозы двух или более веществ вводятся вместе. Дозировки зависят от абсорбции, инактивации и скорости экскреции лекарственного вещества, а также других факторов, известных специалистам в данной области. Следует отметить, что величины доз также изменяют в зависимости от тяжести состояния для его облегчения. Кроме того, ясно, что для любого отдельного субъекта должны быть установлены специальные схемы и графики приема лекарственных средств, в зависимости от времени, согласно индивидуальной потребности и профессиональной оценке лицом, назначающим композиции и наблюдающим за их введением.
В следующем аспекте изобретение представляет способ лечения человека, инфицированного HBV, который включает в себя введение лечебной дозы пролекарства описанных производных 2'-дезокси-β-L-эритро-пентофуранонуклеозида. Пролекарство, которое используется в заявке, относится к соединению, которое превращается в нуклеозид при введении in vivo. Не ограничивающие примеры включают в себя фармацевтически приемлемую соль (альтернативно упоминаемую как «физиологически приемлемые соли»), 5' и N4 (цитидин)- или N6 (аденозин)-ацилированные или алкилированные производные активного соединения, или 5'-фосфолипид или 5'-эфиры липидов активного соединения.
Краткое описание чертежей
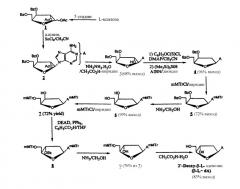
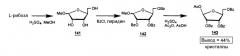
Фигура 1 иллюстрирует общий способ получения β-L-эритро-пентафуранонуклеозидов (β-L-dN), используя L-рибозу или L-ксилозу в качестве исходного материала.
Фигура 2 представляет собой график, который иллюстрирует метаболизм L-dA, L-dC и L-dT в клетках Hep G2 человека в зависимости от аккумуляции и распада. Клетки инкубировали в присутствии с 10 мкМ соединения.
Фигура 3 представляет собой график, который иллюстрирует противовирусное действие β-L-dA, β-L-dT и β-L-dC на модели хронического гепатита сурка.
Используемый в описании термин “по существу в форме ординарного изомера” или “в изолированной форме” относится к 2'-дезокси-β-L-эритро-пентофуранонуклеозиду, который существует по крайней мере приблизительно на 95% в установленной стереоконфигурации. В предпочтительном варианте, активное соединение, по крайней мере этой степени чистоты, вводят хозяину при необходимости терапии.
Используемый в описании термин “гепатит В и родственные состояния” относится к гепатиту В и родственным состояниям таким как анти-HBV-антитело-позитивное и HBV-позитивное состояния, хроническое воспаление печени, вызванное HBV, цирроз, острый гепатит, молниеносный гепатит, хронический персистирующий гепатит и утомляемость. Способ согласно изобретению включает в себя применение производных 2'-дезокси-β-L-эритро-пентофуранонуклеозида профилактически для предупреждения или замедления прогрессирования клинического заболевания у индивидуумов, которые являются анти-HBV-антитело-позитивными или HBV-антиген-позитивными или которые подверглись воздействию HBV.
Используемый в описании термин алкил, если не указано особо, относится к насыщенному прямому, разветвленному или циклическому, первичному, вторичному или третичному углеводороду, обычно С1 до С18, предпочтительно С1 до С6 и, в частности, не ограничиваясь этим, включает в себя метил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил, втор-бутил, трет-бутил, изопентил, амил, трет-пентил, циклопентил и циклогексил.
Используемый в описании термин «ацил» относится к фрагменту формулы -С(О)R', где R' представляет собой алкил; арил, алкарил, аралкил, гетероароматику, алкоксиалкил, включая метоксиметил; арилалкил, включая бензил; арилоксиалкил, такой как феноксиметил; арил, включая фенил, необязательно замещенный галогеном, С1-С4 алкил или С1-С4 алкокси, или остаток аминокислоты. Термин ацил, не ограничиваясь этим, в частности, включает в себя ацетил, пропионил, бутирил, пентаноил, 3-метилбутирил, кислый сукцинат, 3-хлорбензоат, бензоил, ацетил, пивалоил, мезилат, пропионил, валерил, остаток капроновой, каприловой, каприновой, лауриновой, миристиновой, пальмитиновой, стеариновой и олеиновой кислот.
Используемый в описании термин “пуриновое или пиримидиновое основание”, не ограничиваясь этим включает в себя 6-алкилпурин и N6-алкилпурины, N6-ацилпурины, N6-бензилпурин, 6-галопурин, N6-винилпурин, N6-ацетиленовый пурин, N6-ацилпурин, N6-гидроксиалкилпурин, N6-тиоалкилпурин, N2-алкилпурины, N4-алкилпиримидины, N4-ацилпиримидины, 4-бензилпиримидины, N4-галопиримидины, N4-ацетиленовые пиримидины, 4-ацил- и N4-ацилпиримидины, 4-гидроксиалкилпиримидины, 4-тиоалкилпиримидины, тимин, цитозин, 6-азапиримидин, включая 6-азацитозин, 2- и/или 4-меркаптопиримидин, урацил, С5-алкилпиримидины, С5-бензилпиримидины, С5-галопиримидины, С5-винилпиримидин, С5-ацетиленовый пиримидин, С5-ацилпиримидин, С5-гидроксиалкилпурин, С5-амидопиримидин, С5-цианопиримидин, С5-нитропиримидин, С5-аминопиримидин, N2-алкилпурины, N2-алкил-6-тиопурины, 5-азацитидинил, 5-азаурацилил, триазолопиридинил, имидазолпиридинил, пирролопиримидинил и пиразолопиримидинил. Функциональные группы кислорода и азота на основании могут быть защищены по мере необходимости или по желанию. Подходящие защищающие группы хорошо известны специалистам в данной области и включают в себя триметилсилил, диметил-гексилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил, тритил, алкильные группы, ацильные группы, такие как ацетил и пропионил, метансульфонил и п-толуолсульфонил.
Термин биологически активный нуклеозид, используемый в описании, относится к нуклеозиду, который характеризуется значением ЕС50, соответствующим 15 микромолям или менее при исследовании в клетках 2.2.15, трансфицированных вирионом гепатита.
Предпочтительные основания включают в себя цитозин, 5-фторцитозин, 5-бромцитозин, 5-иодцитозин, урацил, 5-фтор-урацил, 5-бромурацил, 5-иодурацил, 5-метилурацил, тимин, аденин, гуанин, инозин, ксантин, 2,6-диаминопурин, 6-аминопурин, 6-хлорпурин и 2,6-дихлорпурин, 6-бромпурин, 2,6-дибромпурин, 6-иодпурин, 2,6-дииодпурин, 5-бромвинилцитозин, 5-бромвинилурацил, 5-бромэтенилцитозин, 5-бромэтенилурацил, 5-трифторметилцитозин, 5-трифторметилурацил.
2'-дезокси-β-L-эритро-пентофуранонуклеозид может быть предоставлен в виде 5'-фосфолипида иои 5'-эфира липида, что описывается в следующих ссылках: Kucera, L.S., N. Lyer, E. Leake, A. Raben, Modest E.J., D.L.W., and C. Piantadosi. 1990. Novel membrane-interactive ether lipid analogs that inhibit infectious HIV-I production and induce defective virus formation. AIDS Res Hum Retroviruses. 6:491-501; Piantadosi, C., J.Marasco C.J., S.L. Morris-Natschke, K.L. Meyer, F. Gumus, J.R. Surles, K.S.Ishaq, L.S. Kusera, N. Iyer, C.A. Wallen, S.Piantadosi, and E.J. Modest. 1991-Synthesis and evaluation of novel ether lipid nucleoside conjugates for anti-HIV activity. J. Med. Chem. 34:1408-1414; Hostetler, K.Y., D.D. Richman, D.A. Carson, L.M. Stuhmiller, G.M.T. van Wijk, and H. van den Bosch. 1992. Greatly enhanced inhibition of human immunodeficiency virus type I replication in CEM and HT4-6C cells by 31-deoxythymidine dephosphate dimyristoylglycerol, a lipid prodrug of 31-deoxythymidine. Antimicrob Agents Chemother. 36:2025-2029; Hostetler, K.Y., L.M. Stuhmiller, H.B. Lenting, H. van den Bosch, and D.D.Richman. 1990. Synthesis and antiretroviral activity of phospholipid analogs of azidothymidine and other antiviral nucleosides. J. Biol. Chem. 265:6112-7.
2'-дезокси-β-L-эритро-пентофуранонуклеозид может быть превращен в фармацевтически приемлемый эфир посредством реакции с соответствующим эстерифицирующим агентом, например галогенангидридом или ангидридом. Нуклеозид или его фармацевтически приемлемое пролекарство может быть превращено в его фармацевтически приемлемую соль общепринятым способом, например с помощью обработки соответствующим основанием или кислотой. Эфир или соль может превращаться в исходный нуклеозид, например, в результате гидролиза.
Используемый в описании термин “фармацевтически приемлемые соли или комплексы” относится к солям или комплексам 2'-дезокси-β-L-эритро-пентофуранонуклозидов, которые сохраняют требуемую биологическую активность исходного соединения и проявляют минимальные, если вообще проявляют, нежелательные токсикологические воздействия. Не ограничивающими примерами таких солей являются (а) соли присоединения кислот, образованные неорганическими кислотами (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и тому подобные), и соли, образованные органическими кислотами такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, пальмовая кислоты, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновые кислоты, нафтaлиндисульфоновые кислоты и полигалактуроновая кислота; (b) соли присоединения основания, образованные катионами, такими как натрий, калий, цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий, натрий, калий и тому подобное, или органическим катионом, полученным из N,N-дибензилэтилендиамина, аммония или этилендиамина; или (с) комбинациями (а) и (b); например, таннат цинка или тому подобное.
Используемый в описании термин «пролекарство» относится к соединению, которое превращается в нуклеозид при введении in vivo. Не ограничивающими примерами являются фармацевтически приемлемые соли (альтернативно упоминаемые как «физиологически приемлемые соли»), 5'- и N4- или N6- ацилированные или алкилированные производные активного соединения и 5'-фосфолипидные и 5'-эфирлипидные производные активного соединения.
Модификации активных соединений, особенно в N4, N6 и 5'-O положениях, могут воздействовать на биологическую доступность и скорость метаболизма активных веществ, обеспечивая таким образом контроль за доставкой активных соединений.
Предпочтительным аспектом данного изобретения является способ лечения инфекций HBV у человека или других животных хозяев, который включает в себя введение эффективного количества одного или более 2'-дезокси-β-L-эритро-пентофу-ранонуклеозидных производных, выбранных из группы, состоящей из β-L-2'-дезоксиаденозина, β-L-2'-дезоксицитидина, β-L-2'-дезоксиуридина, β-L-2'-гуанозина, β-L-2'-дезоксиинозина и β-L-2'дезокситимидина или их физиологически приемлемого пролекарства, включая фосфат, 5'- и или N6- алкилированное или ацилированное производное или его физиологически приемлемую соль, необязательно в фармацевтически подходящем носителе. Соединения этого изобретения или обладают анти-HBV-активностью или преобразуются в соединение или соединения, которые проявляют анти-HBV-активность. В предпочтительном аспекте, 2'-дезокси-β-L-эритро-пентофуранонуклеозид вводится в основном в форме ординарного изомера, то есть по крайней мере приблизительно на 95% в установленной стереоконфигурации.
Нуклеотидные пролекарства
Любой из описанных в описании нуклеозидов может быть введен в виде стабилизированного нуклеодитного пролекарства, чтобы увеличить активность, биологическую доступность, стабильность или, иначе говоря, чтобы изменить свойства нуклеозида. Известен ряд лигандов нуклеотидных пролекарств. Вообще алкилирование, ацилирование или другая липофильная модификация моно-, ди- или трифосфата нуклеозида будет увеличивать стабильность нуклеотида. Примерами заместительных групп, которые могут замещать один или более водородов на фосфатном фрагменте, являются алкил, арил, стероиды, углеводы, включая сахара, 1,2-диацилглицерин и спирты. Большинство описывается в публикации R. Jones and N. Bischofberger, Antiviral Research, 27 (1995) 1-17. Любые из них могут применяться в комбинации с описанными нуклеозидами для достижения желаемого действия.
В одном аспекте 2'-дезокси-β-L-эритро-пентофуранонуклеозид обеспечивается в виде 5'-гидроксильного липофильного пролекарства. Не ограничивающие примеры патентов США, описывающие подходящие липофильные заместители, которые можно ковалентно включить в нуклеозид, предпочтительно в 5'-OH положении нуклеозида, или липофильные препараты, включают в себя патенты США № 5149794 (22 сентября, 1992, Yatvin et al.); 5 194 654 (16 мартаб 1993, Hostetler et al.); 5223263 (29 июня, 1993, Hostetler et al.); 5256641 (26 октября, 1993, Yatvin et al.); 5411947 (2 мая, 1995, Hostetler et al.); 5463092 (31 октября, 1995, Hostetler et al.); 5543389 (6 августа, 1996, Yatvin et al.); 5543390 (6 августа 1996, Yatvin et al.), 5543391 (6 августа, 1996, Yatvin et al.); и 5554728 (10 сентября, 1996, Basava et al.).
Иностранные патентные заявки, которые описывают липофильные заместители, которые могут быть присоеденены к 2'-дезокси-β-L-эритро-пентофуранонуклеозидному производному данного изобретения или к липофильным препаратам, включают в себя WO 89/02733, WO 90/00555, WO 91/16920, WO 91/18914, WO 93/00910, WO 94/ 26273, WO 96/15132, EP 0 350 287, EP 93917054,4 и WO 91/19721.
Дополнительными не ограничивающими примерами 2'-дезокси-β-L-эритро-пентофуранонуклеозидов являются нуклеозиды, которые содержат заместители, описанные в следующих публикациях. Эти преобразованные 2'-дезокси-β-L-эритро-пентофуранонуклеозиды могут использоваться для целей, описанных в тексте, или, иначе говоря, как противовирусные агенты, включая анти-HBV агенты. D.H.W. (1973) Distribution of kinase and deaminase of 1 β-D-arabinofuranosylcytosine in tissues of man and mouse. Cancer Res. 33, 2816-2820; Holy, A. (1993) Isopolar phosphorous-modified nucleotide analogues. In: De Clercq (Ed.), Advances in Antiviiral Drug Design, Vol. I, JAI Press, pp. 179-231; Hong, C.I., Nechaev A., and West, C.R. (1979a) Synthesis and antitumor activity of 1β-D-arabinofuranosylcytosine conjugates of cortisol and cortisone. Biochem. Biophys. Rs. Commun. 88, 1223-1229; Hong, C.I., Nechaev, A., Kirisits, A.J. Buchheit, D.J. and West C.R. (1980) Nucleoside conjugates as potential antitumor agents. 3.Synthsis and antitumor activity of 1-(β-D-arabinofuranosyl)cytosine conjugates of corticosteroids and selected lipophilic alcohols. J. Med. Chem. 28, 171-177; Hostetler, K.Y., Stuhmiller, L.M., Lenting, H.B.M., van den Bosch, H. and Richmann, D.D. (1990) Synthesis and antiretroviral activity of phospholipid analogs of azidothymidine and other antiviral nucleosides. J. Biol. Chem. 265, 6112-6117; Hostetler, K.Y., Carson, D.A. and Richman, D.D. (1991); Phosphatidylazidothymidine: mechanism of antiretroviral action in CEM cells. J. Biol. Chem. 266, 11714-11717; Hostetler, K.Y., Korba, B., Sridhar, C., Gardener, M. (1994a) Antiviral activity of phosphatidyl-dideoxycytidine in hepatitis B-infected cells and enhanced hepatic uptake in mice. Antiviral Res. 24, 59-67; Hostetler, K.Y., Richman, D.D., Sridhar, C.N., Felgner, P.L., Felgner, J., Ricci, J., Gardener, M.F., Selleseth, D.W. and Ellis, M.N. (1994b) Phosphatidylazidothymidine and phosphatidyl-ddC: Assessment of uptake in mouse lymphoid tissues and antiviral activities in human immunodeficiency virus-infected cells and in rauscher leukemia virus-infected mice. Antimicrobial Agents Chemother. 38, 2792-2797; Hunston, R.N., Jones, A.A. McGuigan, C., Walker, R.T., Balzarini,J. and De Clercq, E. (1984) Synthesis and biological properties of some cyclic phosphotriesters derived from 2'deoxy-5-fluorouridine. J.Med. Chem. 27, 440-444; Ji, Y.H., Moog, C., Schmitt, G., Bischoff, P. and Luu, B. (1990); Monophosphoric acid diesters of 7β-hydroxycholesterol and of pyrimidine nucleosides as potential antitumor agents: synthesis and preliminary evaluation of antitumor activity. J. Med. Chem. 33, 2264-2270; Jones, A.S., McGuigan, C., Walker, R.T., Balzarini, J. and DeClercq, E. (1984) Synthesis, properties, and biological activity of some nucleoside cyclic phosphoramidates. J. Chem. Soc. Perkin Trans. I, 1471-1474; Juodka, B.A. and Smart, J. (1974) Synthesis of ditribonucleoside a(P→N) amino acid derivatives. Coll. Czech. Chem. Comm. 39, 363-968; Kataoka, S., Imai, J., Yamaji, N., Kato, M., Saito, M., Kawada, T. And Imai, S. (1989) Alkylated cAMP derivatives; selective synthesis and biological activities. Nucleic Acids Res. Sym. Ser., 21, 1-2; Kataoka, S., Uchida, R. and Yamaji, N. (1991) A convenient synthesis of adenosine 3',5'cyclic phosphate (cAMP) benzyl and methyl triesters. Heterocycles 32, 1351-1356; Kinchington, D., Harvey, J.J., O'Connor, T.J., Jones, B.C.N.M., Devine, K.G., Taylor-Robinson, D., Jeffries, D.J. and McGuigan, C. (1992) Comparison of antiviral effects of zidovudine phosphoramidate and phosphorodiamidate derivatives against HIV and MuLV in vitro. Antiviral Chem. Chemother. 3, 107-112; Kodama, K., Morozumi, M., Saitoh, K.I., Kuninaka, H., Yoshino, H. and Saneyoshi, M. (1989) Antitumor activity activity and pharmacology of 1-β-D-arabinofuranosylcytosine-5'-stearylphosphate; an orally active derivative of 1-β-D-arabinofuranosylcytosine. Jpn. J. Cancer Res. 80, 679-685; Korty, M. and Engels, J. (1979) The effects of adenosine- and guanosine 3',5'-phosphoric and acid benzyl esters on guinea-pig ventricular myocardium. Naunyn-Schmiedeberg's Arch. Pharmacol. 310, 103-111; Kumar, A., Goe, P.L., Jones, A.S. Walker, R.T. Balzarini, J. and De Clercq, E. (1990) Synthesis and biological evaluation of some cyclic phosphoramidate nucleoside derivatives. J. Med. Chem. 33, 2368-2375; LeBec, C., and Huynh-Dinh, T. (1991) Synthesis of lipophilic phosphate triester derivatives of 5-fluouridine and arabinocytidine as anticancer prodrugs. Tetrahedron Lett. 32, 6553-6556; Lichtenstein, J., Barner, H.D. and Cohen, S.S. (1960) The metabolism of exogenously supplied nucleotides by Escherichia coli., J. Biol. Chem. 235, 457-465; Lucthy, J., Von Daeniken, A., Friederich, J. Manthey, B., Zweifel, J., Schlatter, C. And Benn, M.H. (1981) Synthesis and toxicological properties of three naturally occurring cyanoepithioalkanes. Mitt. Geg. Lebensmittelunters. Hyg. 72, 131-133 (Chem. Abstr. 95, 127093); McGuigan, C. Tollerfield, S.M. and Riley, P.A. (1989) Synthesis and biological evaluation of some phosphate triester derivatives of the anti-viral drug Ara. Nucleic Acids Res. 17. 6065-6075; McGuigan, C., Devine, K.G., O'Connor, T.J., Galpin, S.A., Jeffries, D.J. and Kinchington, D. (1990a) Synthesis and evaluation of some novel phosphoramidate derivatives of 3'-azido-3'-deoxythymidine (AZT) as anti-HIV compounds. Antiviral Chem. Chemother. 1, 107-113; McGuigan, C., O'Connor, T.J., Nicholls, S.R., Nickson, C. and Kinchington, D. (1990b) Synthesis and anti-HIV activity of some novel substituted dialkyl phosphate derivatives of AZT and ddCyd. Antiviral. Chem. Chemother. 1, 355-360; McGuigan, C., Nicholls, S.R., O'Connor, T.J., and Kinchington, D. (1990c) Synthesis of some novel dialkyl phosphate derivative of 3'-modified nucleosides as potential anti-AIDS drug. Antiviral Chem. Chemother. 1, 25-33; McGuigan, C., Devine, K.G., O'Connor, T.J., and Kinchington, D. (1991) Synthesis and anti-HIV activity of some haloalkyl phosphoramidate derivatives of 3'-azido-3'-deoxythymidine (AZT); potent activity of the trichloroethyl methoxyalaninyl compound. Antiviral Res. 15, 255-263; McGuigan, C., Pathirana, R.N., Mahmood, N., Devine, K.G. and Hay, A.J. (1992) Aryl phoaphate derivatives of AZT retain activity against HIV-1 in cell lines which are resistant to the action of AZT. Antiviral Res. 17, 311-321; McGuigan, C., Pathirana, R.N., Choi, S.M., Kinchington, D. and O'Connor, T.J. (1993a) Phosphoramidate derivatives of AZT as inhibitors of HIV; studies on the carboxyl terminus, Antiviral Chem. Chemother. 4, 97-101; McGuigan, C., Pathirana, R.N., Balzarini, J. and De Clercq, E. (1993b) Intracellulal delivery of bioactive AZT nucleotides by aryl phosphate derivatives of AZT. J. Med. Chem.36, 1048-1052.
The question of chair-twist equilibria for the phosphate rings of nucleoside cyclic 3',5'-monophosphates. 1НNMR and x-ray crystallographic study of the diasteromers of thymidine phenyl cyclic 3',5'-monophosphate. J. Am. Chem. Soc. 109, 4058-4064; Nerbonne, J.M., Richard, S., Nargeot, J. and Lester, H.A. (1984) New photoactivatable cyclic nucleotides produce intracellular jumps in cyclic AMP and GMP concentrations. Nature 301, 74-76; Neumann, J.M., Herve, M., Debouzy, J.C., Guerra, F.I., Gouyette, C., Dupraz, B. and Huynh-Dinh, T. (1989) Synthesis and transmembrane transport studies by NMR of a glucosyl phospholipid of thymidine. J. Am. Chem. Soc. 111, 4270-4277; Ohno, R., Tatsumi, N., Hirano, M., Imai, K., Mizoguchi, H., Nakamura, T., Kosaka, M., Takatuski, K., Yamaya,T., Toyama, K., Yoshida, T., Masaoka, T., Hashimoto, S., Ohshima, T., Kimura, I., Yamada, K. and Kimura, J. (1991) Treatment of myelodysplastic syndromes with orally administered 1-β-D-rabinofuranosylcytosine-5'-srearylphosphate. Oncology 48, 451-455.
Palomino, E., Kessle, D. and Horwitz, J.P. (1989) A dihydropyridine carrier system for sustained delivery of 2',3'-dideoxynuclesides to the brain. J. Med. Chem. 32, 622-625; Perkins, R.M., Barney, S., Wittrock, R., Clark, P.H., Levin, R. Lambert, D.M., Petteway, S.R., Serafinowska, H.T., Bailey, S.M., Jackson, S., Harnden, M.R. Ashton, R., Sutton, D., Harvey, J.J. and Brown, A.G. (1993) Activity of BRL47923 and its oral prodrug, SB203657A against a rauscher murine leukemia virus infection in mice. Antiviral Res. 20 (Suppl. I), 84; Piantadosi, C., Marasco, C.J.,Jr. Morris-Natschke, S.L., Meyer, K.L., Gumus, F., Surles, J.R., Ishaq, K.S., Kucera, L.S., Iyer, N., Wallen, C.A., Piantadosi, S. and Modest, E.J. (1991) Synthesis and evaluation of novel ether lipid nucleoside conjugates for anti-HIV-1 activity. J. Med. Chem. 34, 1408-1414; Pompon, A., Lefebvre, I., Imbach, J.L., Kahn, S. and Farquhar, D. (1994) Decomposition pathways of the mono- and bis(pivaloyloxymethyl) esters of azidothymidine-5'-monophosphate in cell extract and in tissue culture medium; an application of the on-line ISRP-cleaning' HPLC technique. Antiviral Chem. Chemother. 5, 91-98; Postemark, T. (1974) Cyclic AMP and GMP. Annu. Rev. Pharmacol. 14, 23-33; Prisbe, E.J., Martin, J.C.M., McGee, D.P.C., Barker, M.F., Smee, D.F., Duke, A.E., Matthews, T.R. and Verheyden, J.P.J. (1986) Synthesis and antiherpes virus activity of phosphate and phosphonate derivatives of 9-[(1,3-dihydroxy-2-propoxy)methyl]guanine. J. Med. Chem. 29, 671-675; Puech, F., Gosselin, G., Lefebvre, I., Pompon, A., Aubertin, A.M., Dirn, A. And Imbach, J.L. (1993) Intracellular delivery of nucleoside monophosphate through a reductase-mediated activation process. Antivral Res. 22, 155-174; Pugaeva, V.P., Klochkeva, S.I., Mashbits, F.D. and Eizengart, R.S. (1969). Robins, R.K. (1984) The potential of nucleotide analogs as inhibitors of retroviruses and tumors. Pharm. Res. 11-18; Posowsky, A., Kim, S.H., Ross and J. Wick, M.M. (1982) Lipophilic 5'-(alkylphosphate) esters of 1-β-D-arabinofuranosylcytosine and its N4-acyl and 2.2'-anhydro-3'-O-acyl derivatives as potential prodrugs. J.Med. Chem. 25, 171-178; Ross, W. (1961) Increased sensitivity of the walker turnout towards aromatic nitrogen mustards carrying basic side chains following glucose pretreatment. Biochem. Pharm. 8, 235-240; Ryu, E.K., Ross, R.J., Matsushita, T., MacCoss, M., Hong, C.I. and West, C.R. (1982). Phospholipid-nucleoside conjugates. 3. Synthesis and preliminary biological evaluation of 1-β-D-arabinofuranosylcytosine 5'diphosphate{-},2-diacylglycerols. J. Med. Chem. 25, 1322-1329; Saffhill, R. And Hume, W.J. (1986) The degradation of 5-iododeoxyuridine and 5-bromodeoxyuridine by serum from different sources and its consequences for the use of these compounds for incorporation into DNA. Chem. Biol. Interact. 57, 347-355; Saneyoshi, M., Morozumi, M., Kodama, K., Machida, J., Kuninaka, A. and Yoshino, H. (1980) Synthetic nucleosides and nucleotides. XVI. Synthesis and biological evaluations of a series of 1-β-D-arabinofyranosylcytosine 5'-alkyl or arylphosphates. Chem. Pharm. Bull. 28, 2915-2923; Sastry, J.K., Nehete, P.N., Khan, S., Nowak, B.J., Plunkett, W., Arlinghaus, R.B. and Farquhar, D. (1992) Membrane-permeable dideoxyuridine 5'-monophosphate analogue inhibits human immunodeficiency virus infection. Mol. Pharmacol. 41, 441-445; Shaw, J.P., Jones, R.J., Arimilli, M.N., Louie, M.S., Lee, W.A. and Cundy, K.C. (1994) Oral bioavailaability of PMEA from PMEA prodrugs in male Sprague-Dawley rats. 9th Annbal AAPS Meeting. San Diego, CA (Abstract). Shuto, S., Ueda, S., Imamura, S., Fukukawa, K. Matsuda, A. and Ueda, T. (1987) A facile one-step synthesis of 5'-phosphatidyl-nucleosides by an enzymatic two-phase reaction. Tetrahedron Lett. 28, 199-202; Shuto, S., Itoh, H., Ueda, S., Imamura, S., Kukukawa, K., Tsujino, M., Matsuda, A. And Ueda, T. (1988) A facile enzymatic synthesis of 5'-(3-sn-phosphatidyl)nucleosides and antileukemic activities. Chem. Pharm. Bull. 36, 209-217. Одна предпочтительная группа фосфатного пролекарства представляет собой группу S-ацил-2-тиоэтила, также упоминаемую как “SATE”.
Сочетанная или альтернирующая терапия
Установлено, что резистентные к лекарству формы HBV могут появляться после пролонгированного лечения противовирусным агентом. Наиболее типично устойчивость к лекарственному средству возникает в результате мутации гена, который кодирует фермент, используемый в цикле жизни вируса, и чаще всего в случае ДНК полимеразы HBV. Недавно было продемонстрировано, что эффективность лекарственного средства против инфекции HBV может быть пролонгирована, увеличена или восстановлена введением соединения в сочетании или чередовании со вторым и, возможно, третьим противовирусным соединением, которое вызывает мутацию, иную, чем вызванная исходным лекарственным средством. Альтернативно, фармакокинетика, биологическое распределение или другие параметры лекарственного вещества могут быть изменены с помощью такой сочетанной или чередующейся терапии. Вообще, обычно сочетанная терапия является предпочтительной по сравнению с чередующейся терапией, так как она вызывает множественные одновременные стрессы у вируса.
Активность против вируса гепатита соединений В β-L-2'-dA, β-L-2'-dC, β-L-2'dU, β-L-2'dG, β-L-2'-dT, β-L-dI или других β-L-2'-нуклеозидов, представленных в описании, или пролекарств, фосфатов или солей этих соединений может быть увеличена введением двух или более этих нуклеозидов в cочетании или в чередовании. Альтернативно например, один или более из β-L-2'-dA, β-L-2'-dC, β-L-2'-dU, β-L-2'-dG, β-L-2'-dT, β-L-dI или других β-L-2'-нуклеозидов, представленных в описании, можно вводить в сочетании или в чередовании с 3ТС, FTC, L-FMAU, DAPD, фамцикловиром, пенцикловиром, BMS-200475, бис пом РМЕА (адефовир, дипивоксил); лобукавиром, ганцикловиром или рибаварином.
В любом из аспектов, описанных в заявке, если β-L-2'-нуклеозид данного изобретения вводится в сочетании или в чередовании со вторым нуклеозидным или ненуклеозидным ингибитором обратной транскриптазы, который фосфорилируется до активной формы, то предпочтительно, чтобы второе соединение фосфорилировалось бы ферментом, который отличается от фермента, фосфорилирующего in vivo выбранный β-L-2'-нуклеозид данного изобретения. Примерами киназных ферментов являются тимидинкиназа, цитозинкиназа, гуанозинкиназа, аденозинкиназа, дезоксицитидинкиназа, 5'-нуклеотидаза и дезоксигуанозин-киназа.
Получение активных соединений
Производные 2'-дезокси-β-L-эритро-пентофуранонуклеозида согласно изобретению известны в данной области и могут быть получены в соответствии со способом, описанным Holy, Collect. Czech. Chem. Commun. (1972), 37(12), 4072-87 и Mol. Phys. (1967), 3(4), 386-95.
Обычный способ получения β-L-эритро-пентофуранонуклеозидов (β-L-dN) с использованием L-рибозы или L-ксилозы в качестве исходного вещества представлен на Фигуре 1.
Моно-, ди- или трифосфатные производные активных нуклеозидов можно получать, как описано, в соответствии с опубликованными способами. Монофосфат может быть получен согласно способу Imai et al., J. Org. Chem., 34(6), 1547-1550 (июнь, 1969). Дифосфат может быть получен согласно способу Davisson et al., J.Org. Chem. 52(9), 1794-1801 (1987). Трифосфат может быть получен в соответствии со способом Hoard et al., J. Am. Chem.Soc., 87(8), 1785-1788 (1965).
Протоколы экспериментов
Точки плавления были определены в открытых капиллярных пробирках на аппарате Gallenkamp MFB-595-010 M и являются нескорректированными. Спектр поглощения в УФ регистировали на спектрофотометре Uvikon 931 (KONTRON) в этаноле. Спектры 1Н ЯМР сняты при комнатной температуре в DMSO-d6 на спектрометре Bruker AC 250 или 400. Химический сдвиг представлен в миллионных долях (м.д.), DMSO-d5 устанавливали при 2,49 м.д., как рекомендовано. Дейтерообмен, эксперименты по нарушению взаимодействия или 2D-COSY проводили для того, чтобы установить расположение протонов. Разнообразие сигналов представлено посредством s (синглет), d (дублет), dd (двойной дублет), t (триплет), q (квадруплет), br (широкий), m (мультиплет). Все J-величины представлены в Hz (Гц). Масс-спектры FAB регистрировали в положительном (FAB>0) или отрицательном (FAB<0) ионном режиме на масс спектрометре JEOL DX 300. Матриксом был 3-нитробензиловый спирт (NBA) или смесь (50:50, об/об) глицерина и тиоглицерина (GT). Удельное вращение измеряли на спектрополяриметре Perkin-Elmer 241 (длина хода 1 см) и выражали в единицах 10-1 градус.см2.г-1. Элементный анализ проводили с помощью микроанализатора “Microanalyses du CNRS, Division de Vernaison” (France). Анализы, представленные символами элементов или выходом, оказывались в пределах +/- 0,4% теоретических величин. Тонкослойную хроматографию проводили на предварительно покрытых алюминием пластинах силикагеля 60 F254 (Merck, Art 5554), визуализация продуктов осуществлялась по поглощению в УФ с последующим обугливанием с 10% спиртовой серной кислотой и нагреванием. Колоночную хроматографию проводили на силикагеле 60 (Merck, Art. 9385) под атмосферным давлением.
Пример 1
Стереоспецифический синтез 2'-дезокси-β-L-аденозина
9-(3,5-Ди-О-бензоил-β-L-ксилофуранозил)аденин (3)
Раствор 9-(2-О-ацетил-3,5-ди-О-бензоил-β-L-ксилофуранозил) аденина 2 [ссылка: Gosselin, G., Bergogne, M.-C.; Imbach, J.-L., “Synthesis and Antiviral Evaluation of β-L-Xylofyranosyl Nucleosides of the Five Naturally Occuring Nucleic Acid B