Ингибиторы нейротрипсина
Иллюстрации
Показать всеВ изобретении описаны способ определения, является ли соединение ингибитором нейротрипсина, а также способ измерения каталитической активности нейротрипсина, где тестируемое соединение инкубируют вместе с человеческим или мышиным нейротрипсином или фрагментом человеческого или мышиного нейротрипсина, включающим домен протеазы нейротрипсина, и с полной длины или растворимым агрином, или агрином-С45, или флуоресцентным белком, или пептидом, включающим агрин, агрин-С45, в водном буферном растворе с рН 7,5 и измеряют количество расщепления агрина. 2 н. и 8 з.п. ф-лы, 24 ил., 1 табл.
Реферат
Область изобретения
Изобретение относится к способу определения, является ли соединение ингибитором нейротрипсина, к конкретным ингибиторам нейротрипсина, к применению данных ингибиторов для лечения и/или профилактики атрофии скелетных мышц и шизофрении и применению в качестве стимуляторов познавания.
Предшествующий изобретению уровень техники
Серинпротеазы принадлежат к группе протеолитических ферментов, которые совокупно имеют хорошо изученный каталитический механизм. Серинпротеазы обнаруживают в вирусах, бактериях и эукариотах. Они включают экзопептидазы, эндопетидазы и олигопептидазы. Имеется сходство механизмов реакции ряда пептидаз различного эволюционного происхождения. Геометрическая ориентация каталитических остатков очень близка, несмотря на тот факт, что в других случаях складки белка сильно отличаются. Каталитическая триада остатков серина, гистидина и аспартата в активном центре отвечает за эффективное гидролитическое расщепление пептидной связи. Примеры серинпротеаз включают тромбин, фактор XIIa, фактор IXa, фактор Ха, плазмин, tPA (тканевый активатор плазминогена), трипсин, химотрипсин и другие белки, такие как урокиназа, триптаза, эластаза, калликреин, комплемент С, протеаза А, серинкарбоксипептидаза II. Они участвуют в ряде важных процессов, таких как, например, свертывание крови и переваривание пищи. Показано, что ингибиторы серинпротеазы подавляют клеточные процессы, такие как адгезия, миграция, образование свободных радикалов и апоптоз. Введенные внутривенно, ингибиторы серинпротеазы обеспечивают защитный эффект в отношении повреждения ткани. Показано, что маленькие молекулы ингибиторов обладают высоким потенциалом в плане лечения различных заболеваний, связанных с гематологией, онкологией, астмой, воспалением, неврологией, пульмонологией и иммунологией. Подходящие ингибиторы серинпротеазы можно использовать при лечении дисфункций в области тромботических заболеваний, астмы, цирроза, артрита, карциномы, меланомы, рестеноза, атеромы, травмы, шока и реперфузионного повреждения.
Исследованный фермент нейротрипсин (WO 98/49322) принадлежит к семейству химотрипсина, члены которого почти полностью ограничены животными. Последовательность аминокислот нейротрипсина определяет мозаичный белок из 875 аминокислот, состоящий из Kringle домена, после которого следуют четыре богатых цистеином повтора фагоцитарного рецептора (у мыши три) и домен серинпротеазы (см. фиг.1, А и В). Нейротрипсин включает подобно тромбину, tPA, трипсину и ряду других ферментов остаток аспартата на дне своего кармана S1, демонстрируя вследствие этого специфичность в отношении основных аминокислот в данном центре связывания. Структурная близость нейротрипсина к протеазам каскада свертывания крови и фибринолитической системы, таким как фактор X, фактор IX, тромбин, тканевый активатор плазминогена и плазмин, предполагает, что он может представлять собой элемент направляемого протеазой внеклеточного механизма передачи сигнала в нервной системе (см. статьи Gschwend, Т.Р., et al., Molec. Cell Neurosci. 9: 207-219, 1997; Proba, К., et al., Biochim. Biophys. Acta 1396: 143-147, 1998).
Как будет показано ниже в данном контексте, нейротрипсин находится в пресинаптическом нервном окончании синапсов центральной нервной системы (ЦНС) и в нервно-мышечном соединении (НМС). Синапс представляет собой связь между нервными клетками (нейронами), в которых происходит передача информации в форме химических субстанций, называемых нейромедиаторами. Синапсы состоят из пресинаптического окончания, образованного генерирующей сигнал клеткой, и постсинаптической специализации принимающей сигнал клетки. Нейромедиаторы, высвобождаемые из пресинаптического окончания, пересекают синаптическую щель и связываются с рецепторами нейромедиаторов в постсинаптической специализации. При связывании нейромедиатора рецептор индуцирует генерацию электрического импульса в постсинаптической клетке. Передача сигнала между двумя нейронами является основой функции нейронов. Функции головного мозга являются результатом специфической сборки огромного числа нейронов в сети, обрабатывающие информацию.
Большинство синапсов находится в центральной нервной системе (ЦНС, головной мозг), где каждый синапс соединяет два нейрона. Посредством данных двухсторонних поточечных соединений каждый нейрон может связываться с тысячами других нейронов. Однако синапсы также связывают нейрон с железой или мышечной клеткой. Нервно-мышечное соединение (НМС, мышечная концевая пластинка (окончание двигательного нерва)) представляет собой синапс, который соединяет нервную клетку с клеткой поперечно-полосатой мышцы. Синапсы, находящиеся вне головного мозга, ствола головного мозга и спинного мозга, называют синапсами периферической нервной системы (ПНС). Синапсы ЦНС и синапсы ПНС проявляют много структурных и функциональных общих свойств и имеют много общего в плане молекулярных компонентов (синаптических молекул). Вследствие этого синаптические молекулы-мишени можно использовать для получения направленности на синаптические функции как ЦНС, так и ПНС.
Атрофия скелетных мышц (саркопения), определяемая как потеря мышечной массы и силы, играет главную роль в патогенезе хрупкости и функционального нарушения, которое происходит при старении. Она играет главную роль в потере мышечной силы, пониженной скорости метаболизма, постепенном уменьшении плотности костей и пониженной аэробной производительности (см. статью Doherty, T.J., J. Appl. Physiol. 95: 1717-1727, 2003). Потеря мышечной массы проявляется как уменьшение площади поперечного среза мышцы с возрастом, которое, как определяют, является результатом комбинированного эффекта уменьшения числа мышечных волокон и толщины отдельных оставшихся волокон.
В последние годы достигнут существенный прогресс в идентификации и характеризации факторов, делающих вклад в деградацию мышечной массы. Важные гены, ассоциированные с данными процессами, кодируют лигазы белка убиквитина, уровень которых, как обнаружено, повышен в атрофической мышце. Обнаружено, что среди факторов, которые обладают гипертрофической активностью, и, таким образом, блокируют атрофию, инсулиноподобный фактор роста 1 (IGF-1) играет основную роль. Интенсивно исследован данный и ряд других регуляторных путей, контролирующих массу скелетной мускулатуры (в качестве обзора см. статью Glass, D.J., Nature Cell Biol. 5: 87-90, 2003). Несмотря на значительный прогресс в характеризации как молекулярных механизмов, которые контролируют деградацию мышц, приводящую к атрофии, так и гипертрофических эффектов инсулиноподобного фактора роста, и, несмотря на тот факт, что ряд фирм работает над созданием лекарственных препаратов, способных стимулировать повышение мышечной массы, до настоящего времени не одобрены никакие лекарственные препараты.
Морфологическим признаком атрофии скелетных мышц, обнаруживаемой в старческом возрасте (саркопении), является существенное уменьшение числа мышечных волокон. Достаточно фактов, полученных в многочисленных независимых исследованиях, подтверждает, что вход нерва во фракцию мышечных волокон разрушается с возрастом, приводя к последующей атрофии и, в конечном счете, исчезновению денервированных волокон (см. статью Kamal, H.K., Nutrition Reviews 61: 157-167, 2003). Другим характерным признаком атрофии скелетной мышцы, обнаруживаемом в старческом возрасте, является одновременное появление мышечной атрофии, существенное уменьшение числа двигательных нейронов (см. статью Welle, S., Can. J. Appl. Physiol. 27: 19-41, 2002) и заметное структурное изменение нервно-мышечной связи (см. статью Tapia, J.C. et al., Abstract Viewer/Itinerary Planner, Washington DC: Society for Neuroscience). Данные характеристики показывают, что существенное, связанное с возрастом ухудшение структуры и функции нервно-мышечной связи является основным фактором, способствующим процессу, который, в конечном счете, приводит к структурной и функциональной денервации. Денервированные мышечные волокна, которые не получают компенсаторной реиннервации в течение нескольких недель, постепенно становятся атрофическими и со временем исчезают.
Шизофрения представляет собой хроническое тяжелое и инвалидизирующее головной мозг заболевание. У приблизительно 1% населения планеты на протяжении жизни развивается шизофрения. Люди, у которых развивается шизофрения, испытывают сильные страдания. Приблизительно 10% совершают самоубийство. Хотя шизофрения поражает мужчин и женщин с равной частотой, нарушение чаще раньше проявляется у мужчин, обычно в конце подросткового возраста или вскоре после двадцатилетия, чем у женщин, которые, как правило, заболевают в возрасте от двадцати лет до вскоре после тридцати. Больные шизофренией часто испытывают ужасные симптомы, например слышат внутренние голоса, которые не слышат другие, или считают, что другие люди читают их мысли, контролируют их мысли или замышляют причинить им вред. Данные симптомы могут пугать их и делать замкнутыми. Их речь и поведение могут быть настолько дезорганизованными, что они могут становиться непонятными или пугающими для окружающих. Доступные в настоящее время лекарственные препараты от шизофрении существенно уменьшают страдания, но приблизительно 2/3 больных шизофренией требуется государственная помощь в течение всего нескольких лет после начала заболевания. Большинство из них не способны вернуться к работе или учебе и имеют относительно низкий уровень или не имеют социальных взаимосвязей, и большинство больных шизофренией продолжают страдать от ряда симптомов на протяжении всей жизни. По приблизительной оценке не больше чем один из пяти больных выздоравливает полностью. Вследствие этого шизофрения является одной из наиболее важных проблем здравоохранения во всем мире, и затраты общества исчисляются в миллиардах долларов.
В настоящее время наиболее постоянным нейропатологическим событием в головном мозге пациентов с шизофренией является уменьшение числа синапсов в сером веществе центральной нервной системы, что отражается в снижении объема нейропилей (синаптической площади). Не наблюдают никаких доказательств дегенерации нейронов. Как правило, число подсчитываемых нейронов/площадь ткани сильно увеличено, факт объясняют избирательным уменьшением числа синапсов на площади нейропиля между нейронами, тогда как число тел нервных клеток остается постоянным. Феномен описан в течение двух последних десятилетий в ряде независимых исследований на посмертном материале и показано, что он наиболее обширен в предлобной коре. Литературное документирование данного наблюдения внимательно рассмотрено в обзоре Selemon, L.D. и Goldman-Rakic, P.S. (Psychiatry 45: 17-25, 1999). McGlashan, Т.Н. и Hoffman, R.E. (Arch. Gen. Psychiatry 57: 637-648, 2000), где подводят итоги основным морфологическим, связанным с развитием, электрофизиологическим и метаболическим наблюдениям при шизофрении в свете гипотезы "избыточного прунинга синапсов" и приходят к заключению о том, что "избыточный прунинг синапсов" или "сниженный в период развития уровень синаптических соединений" представляет собой все более привлекательную патофизиологическую модель шизофрении. Основываясь на данной модели, шизофрения возникает при критически пониженной связанности синапсов в результате связанных с развитием нарушений синаптогенеза во время беременности и раннего детства и/или избыточного прунинга синапсов в период полового созревания. В модели учитывают феноменологию нарушения, симптоматические состояния, начало, нейродефициты, связанные с развитием, окно ухудшения, половые различия в клиническом представлении, течение, определяемое возрастом начала, и сохранение шизофренического генотипа в популяции, несмотря на пониженную фенотипическую плодовитость.
Стимуляторы познавания представляют собой лекарственные препараты, направленные на предупреждение, улучшение или лечение когнитивных дефицитов на обоих, клиническом и субклиническом, уровнях. Данные лекарственные препараты дают положительный эффект при лечении нарушений памяти у пожилых людей, у которых не развивается болезни Альцгеймера (мягкое когнитивное нарушение). Однако данные лекарственные препараты, кроме того, дают положительный эффект в плане улучшения когнитивных функций у пациентов с установленным диагнозом болезни Альцгеймера или другими заболеваниями, ассоциированными с деменцией, или в плане улучшения когнитивных функций при посттравматической когнитивной дисфункции, а также для улучшения связанного со старением нарушения когнитивных функций, которое считают нормальным признаком процесса старения.
Мягкое когнитивное нарушение представляет собой широко приводимое представление в клиническом исследовании, связанном со старением когнитивных нарушений (см. статью Ritchie, K. и Touchon, J., The Lancet 355: 225-228, 2000). Оно в основном относится к субклиническим нарушениям функционирования памяти у пожилых людей, у которые, как считают, имеется большая вероятность развития болезни Альцгеймера. Выявление людей с возможным риском развития деменции в свете раннего терапевтического вмешательства важно, поскольку это может уменьшить страдания как для больного, так и для семьи, свести к минимуму риск несчастных случаев, увеличить период независимости и, возможно, даже, в конечном счете, предупреждает начало процесса, приводящего к самой деменции.
Нарушение когнитивных функций без деменции настолько обычно у пожилых людей, что многие рассматривают его как неизбежный признак процесса старения. Тем не менее, оно приобретает клиническую значимость вследствие трудностей, с которыми пациенты могут сталкиваться в повседневной деятельности. Хотя круг нарушений, наблюдаемых в популяциях, не имеющих деменции, чрезвычайно широк, предложен ряд клинических меток для описания данного последнего нормального когнитивного круга. Одним из наиболее ранних является доброкачественная старческая забывчивость. Ее клинические признаки включают неспособность вспомнить мелкие детали, забывание отдаленных событий в противоположность недавним и осознание проблем с памятью. Термин ассоциированное со старением снижение когнитивной способности относится к более широкому кругу когнитивных функций (внимание, память, обучение, мышление, речь и зрительно-пространственная функция) и диагностируется относительно норм для пожилых людей. Назначение стимуляторов познавания может продлить способность пораженных болезнью осуществлять повседневную деятельность и, таким образом, увеличивать период их независимости. Другие нарушения, ассоциированные по меньшей мере у части больных с когнитивными нарушениями, которые могут в конечном счете привести к деменции, включают болезнь Паркинсона, рассеянный склероз, инсульт и травма головы. Назначение лекарственных препаратов стимуляторов познавания может также улучшить когнитивные функции у данных пациентов.
Раскрытие изобретения
Изобретение относится к способу измерения каталитической активности нейротрипсина, отличающемуся тем, что нейротрипсин, его вариант или фрагмент, включающий домен протеазы нейротрипсина, и белок либо пептид, включающий агрин, его вариант или фрагмент, включающий α- или β-сайт расщепления агрина, совместно инкубируют в водном буферном растворе, и количественно измеряют расщепление агрина. Более того, изобретение относится к способу определения, является ли соединение ингибитором нейротрипсина, отличающемуся тем, что соединение инкубируют вместе с нейротрипсином, его вариантом или фрагментом, включающим домен протеазы нейротрипсина, и с белком либо пептидом, включающим агрин, его вариант или фрагмент, включающий α- или β-сайт расщепления агрина, в водном буферном растворе, и количественно измеряют расщепление агрина.
Кроме того, изобретение относится к ингибиторам нейротрипсина, обнаруженным с помощью данного способа, в частности к соединениям формулы
в которой Hal1 и Hal2 независимо друг от друга представляют собой фтор, хлор или бром и их фармацевтически приемлемым аддитивным солям.
Изобретение, кроме того, относится к применению данных ингибиторов как лекарственных средств, в частности, для лечения и/или профилактики заболеваний, вызываемых дефицитом синапсов, например атрофии скелетных мышц, шизофрении и когнитивного нарушения, и к применению данных ингибиторов для изготовления лекарственного средства для лечения и/или профилактики атрофии скелетных мышц, шизофрении и когнитивного нарушения.
Краткое описание чертежей
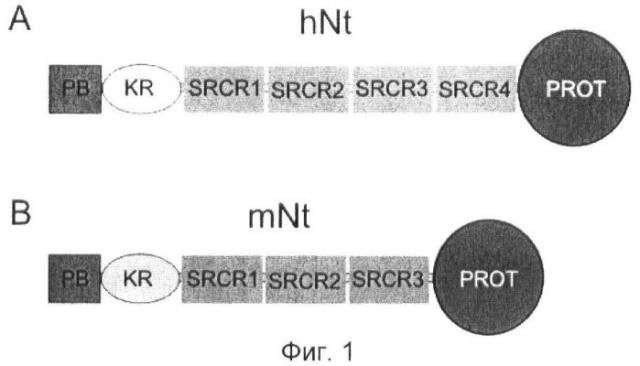
Фиг.1. Структура домена нейротрипсина.
(A) hNt: человеческий нейротрипсин.
(B) mNt: мышиный нейротрипсин.
Нейротрипсин состоит из богатого пролином основного домена (РВ), kringle-домена (KR), трех (mNt) или четырех (hNt) богатых цистеином доменов фагоцитарного рецептора (SRCR1, SRCR2, SRCR3 и SRCR4) и домена протеазы (PROT).
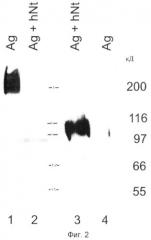
Фиг.2. Опосредованное нейротрипсином расщепление агрина: Анализ вестерн-блот агрина из клеток HEK293, сотрансфицированных агрином и нейротрипсином.
Полуконфлюэнтные клетки HEK293T временно трансфицируют либо pcDNA3.1-нейротрипсин либо pcDNA3.1-агрин либо обоими. Образцы разделяют SDS-PAGE (электрофорезом в полиакриламидном геле с использованием додецилсульфата натрия). Мембрану инкубируют с поликлональным антителом к агрину, направленным на С-концевую группу агрина, с последующим инкубированием с вторичным антителом, связанным с пероксидазой.
(Дорожка 1, Ag) Экстракт детергентом клеток, однократно трансфицированных агрином.
(Дорожка 2, Ag+hNt) Экстракт детергентом клеток, дважды трансфицированных агрином и нейротрипсином. Отмечают, что уровень агрина сильно понижен.
(Дорожка 3, Ag+hNt) Культуральная среда клеток, которые дважды трансфицированы агрином и нейротрипсином. Полосу 100-кД определяют с помощью антитела к агрину, направленного на С-концевую группу агрина.
(Дорожка 4, Ag) Культуральная среда клеток, которые однократно трансфицированы агрином.
Продукцию нейротрипсина во всех условиях подтверждают после повторного зондирования блота антителами к нейротрипсину. Анализ культуральной жидкости показывает, что иммунореактивность агрина, которая утрачена в клеточном экстракте дважды трансфицированных клеток, высвобождается в среду супернатанта. В среде супернатанта клеток HEK293T, трансфицированных агрином и каталитически неактивным нейротрипсином, не обнаруживают никакого сигнала.
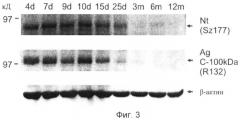
Фиг.3. Временный характер расщепления агрина in vivo соответствует временному характеру экспрессии нейротрипсина.
Гомогенаты спинного мозга мышей различного возраста подвергают SDS-PAGE и анализу вестерн-блот и затем зондируют в отношении нейротрипсина и С-концевого фрагмента агрина 100 кД, используя специфические антитела SZ 177 к нейротрипсину и R132 к С-концевому фрагменту агрина 100 кД. β-актин зондируют в качестве контроля в отношении равных количеств тканевого гомогената в различных образцах.
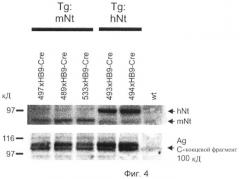
Фиг.4. Трансгенная сверхэкспрессия нейротрипсина в двигательных нейронах приводит в результате к повышенному уровню расщепления агрина.
Вестерн-блоты экстрактов спинного мозга зондируют антителами к человеческому (hNt) и мышиному (mNt) нейротрипсину, а также антителами к С-концевому фрагменту агрина 100 кД. Результаты демонстрируют повышенное распространение С-концевого фрагмента агрина 100 кД у мышей со сверхэкспрессией нейротрипсина.
Фиг.5. Нейротрипсин удаляет агрин из нервно-мышечного соединения (НМС).
НМС диафрагмы мышей, иммуноокрашенной на агрин в постнатальные дни 0 (Р0), 4 (Р4) и 8 (Р8). У трансгенных мышей со сверхэкспрессией нейротрипсина в двигательных нейронах аргин исчезает из НМС в период, исчисляемый часами-днями после начала сверхэкспрессии. Р4: переходное состояние. Частичная потеря агрина из НМС. Стрелки указывают на отдельные хорошо сформированные НМС. Звездочки указывают частично диспергированные НМС.Р8: почти полная потеря агрина из НМС. Стрелки указывают на отдельные хорошо сформированные НМС. Звездочки указывают частично диспергированные НМС.
Фиг.6. Нейротрипсин-зависимое удаление агрина из НМС осуществляется путем рассасывания постсинаптического аппарата.
НМС диафрагмы тех же мышей, что представлены на фиг.7, окрашивают на ацетилхолиновые рецепторы α-бунгаротоксином с флуоресцентной меткой (α-Btx). Ацетилхолиновые рецепторы исчезают за период, исчисляемый часами-днями после начала сверхэкспрессии. Р4: переходное состояние. Частичная потеря НМС. Стрелки указывают на отдельные хорошо сформированные НМС. Звездочки указывают частично диспергированные НМС.Р8: почти полная потеря НМС. Стрелки указывают на отдельные хорошо сформированные НМС. Звездочки указывают частично диспергированные НМС.
Фиг.7. Фрагментация НМС в камбаловидной мышце мышей со сверхэкспрессией Nt.
(А-С) Окрашивание α-бунгаротоксином (α-Btx) НМС мышей дикого типа показывает типичную Претцель-структуру.
(D-F) Окрашивание α-Btx НМС мышей со сверхэкспрессией Nt показывает выраженную фрагментацию постсинаптического аппарата.
(G-I) НМС трансгенных мышей со сверхэкспрессией каталитически неактивной формы Nt (Нейротрипсин Ser711Ala) не изменяются.
Фиг.8. Поперечные срезы через камбаловидную мышцу мышей дикого типа и со сверхэкспрессией нейротрипсина.
(A) Мышь дикого типа
(B) Мышь со сверхэкспрессией нейротрипсина.
По сравнению с мышами дикого типа мышцы мышей со сверхэкспрессией Nt включают меньше мышечных волокон. Стрелки в (А) и (В) указывают на одно мышечное волокно.
Фиг.9. Количественная оценка числа синапсов/объем ткани в нейропиле радиального слоя области СА1 гиппокампа.
У всех экспериментальных животных число синапсов/объем ткани определяют в электронно-микроскопических срезах, взятых из одного и того же участка радиального слоя участка СА1 гиппокампа.
wt: дикий тип;
ЦМВ-Cre: трансгенная линия, экспрессирующая рекомбиназу Cre под контролем промотора ЦМВ;
491(неакт.Nt): трансгенная линия 491, несущая неактивный трансген, включающий транскрипционный стоп-сегмент;
494(неакт.Nt): трансгенная линия 494, несущая неактивный трансген, включающий транскрипционный стоп-сегмент;
ДТГ(Nt491/cre): дважды трансгенная мышь, полученная из линии 491, у которой неактивный трансген нейротрипсина активирован скрещиванием с рекомбиназой Cre;
ДТГ(Nt494/cre): дважды трансгенная мышь, полученная из линии 494, у которой неактивный трансген нейротрипсина активирован скрещиванием с рекомбиназой Cre.
** p<0,01.
Фиг.10. Шипики на вторичных дендритных ответвлениях пирамидальных нейронов СА1.
Шипики на вторичных дендритных ответвлениях пирамидальных нейронов СА1 мышей дикого типа (А и В) и дважды трансгенных мышей со сверхэкспрессией нейротрипсин (С и D). Пирамидальные клетки СА1 ионтофоретически наполняют биоцитином во время электрофизиологических исследований in vitro и визуализируют, используя гистохимический метод с применением авидин-биотин-пероксидазы. Дендриты мышей дикого типа имеют много длинных хорошо развитых шипиков (большие стрелки); кроме того, обнаруживают также много коротких плотных шипиков (маленькие размерные стрелки). Среди дендритов мышей со сверхэкспрессией нейротрипсина (животные одного помета) преобладают короткие плотные шипики (маленькие размерные стрелки); длинные хорошо развитые шипики (большие стрелки) встречаются очень редко. Общая густота шипиков (число шипиков/единицу длины дендрита) заметно ниже у мышей со сверхэкспрессией нейротрипсина (С и D).
Фиг.11. Очищенный человеческий нейротрипсин полной длины.
SDS-PAGE с последующим окрашиванием серебром (А) и вестерн-блоттингом (В) показывает одну полосу человеческого нейротрипсина полной длины (указано стрелками), мигрирующую в положении, соответствующем приблизительно 75 кД в невосстанавливающих условиях. Иммунодетекцию (В) проводят, используя антитело к нейротрипсину. Молекулярные массы стандартов (кД) указаны на полях слева.
Фиг.12. Очищенный агрин-EGFP.
Очищенный инженерный агрин-EGFP (указано стрелками) показан на окрашенном серебром SDS-геле (А) и на вестерн-блоте, определенный с помощью антитела, образующегося к С-концевой части агрина (В). Молекулярные массы стандартов (кД) указаны на полях слева. Отмечают, что EGFP используют только в качестве указателя места в данной конструкции, которая разработана так, чтобы включала только центр расщепления α, но не центр расщепления β.
Фиг.13. Очищенный фрагмент агрин-С45.
(A) Окрашенный серебром гель SDS-PAGE, показывающий очищенный фрагмент агрин-С45 (указано стрелками), мигрирующий ниже 50 кД. Числа указывают молекулярные массы стандарта точности и белка (BIORAD).
(B) Вестерн-блот, определяющий очищенный фрагмент агрин-С45 (указано стрелками), с использованием StrepTactin для детекции С-концевой метки strep. Числа указывают молекулярные массы стандарта точности и белка (BIORAD).
Фиг.14. Анализ активности нейротрипсина с использованием агрин-EGFP в качестве субстрата.
Для тестирования активности очищенного нейротрипсина на центр расщепления α субстрат, включающий только центр расщепления а (агрин-EGFP), инкубируют в виде монокомпонента (-) и совместно с нейротрипсином (+) и затем подвергают SDS-PAGE с последующим вестерн-блоттингом с использованием антитела к С-концевому фрагменту расщепления агрина (см. пример 22). Дорожка 1 показывает агрин-EGFP (указано стрелкой, обозначенной Ag-EGFP) без обработки нейротрипсином в качестве контроля. Дорожка 2 показывает агрин-EGFP (указано стрелкой, обозначенной Ag-EGPF) и С-концевой фрагмент приблизительно 150 кД, генерированный активностью нейротрипсина (указано стрелкой, обозначенной Ag-CF). Маркер молекулярной массы в кД (килодальтонах).
Фиг.15. Анализ на активность нейротрипсина с использованием агрин-С45 в качестве субстрата.
Для тестирования активности очищенного нейротрипсина на центр расщепления β агрина субстрат, включающий только центр расщепления β (агрин-С45), инкубируют в виде монокомпонента (-) и совместно с нейротрипсином (+) и затем подвергают SDS-PAGE.
(A) Окрашенный серебром гель SDS-PAGE, показывающий 250 нг агрина-С45, инкубируют в буфере для анализа в течение 3 часов без нейротрипсина (-) и 250 нг агрина-С45 инкубируют в буфере для анализа в течение 3 часов с добавлением нейротрипсина (+). Стандарт точности и белка (BIORAD) показан слева, числа указывают молекулярные массы (кД). Агрин-С45 (указано стрелкой) можно видеть ниже 50 кД. Продукты расщепления агрина-С45 обнаруживают между 20 и 25 кД (указано стрелками). Ag-C45-NF: N-концевой фрагмент расщепления агрина-С45; Ag-C45-CF: С-концевой фрагмент расщепления агрина-С45.
(B) Вестерн-блот тех же образцов, что в (А), в котором нерасщепленный агрин-С45 и расщепленный С-концевой фрагмент агрина-С45 определяют с помощью их концевой Strep-метки, используя StrepTactin (IBA GmbH). Ag-C45-CF: С-концевой фрагмент расщепления агрина-С45 (указано стрелкой).
Фиг.16. Анализ на основе вестерн-блоттинга, направленный на скрининг ингибиторов нейротрипсина, с помощью детекции антителами субстрата агрина и С-концевого продукта.
Верхняя полоса показывает белок агрин-EGFP (стрелка, обозначенная Ag-EGFP) с молекулярной массой от 250 до 600 кД, используемый в качестве субстрата. Нижняя полоса показывает С-концевой фрагмент агрина-EGFP, генерированного нейротрипсином, с молекулярной массой приблизительно 150 кД (стрелка обозначена Ag-CF), который появляется с различной интенсивностью в соответствии с ингибирующей активностью тестируемых молекул ингибиторов No. 7, 47, 48, 49, 50 и 51. Гистограмма показывает относительные интенсивности (I) полосы 150 кД (Ag-CF), генерированной опосредованным нейротрипсином расщеплением агрина-EGFP, относительно набора положительного контроля до 100% и набора отрицательного контроля до 0%. Отрицательный контроль (-): только агрин-EGFP без нейротрипсина. Положительный контроль (+): агрин-EGFP с добавлением нейротрипсина.
No. 7: N1-амидино-N4-(3,5-дибромосалицилиден)-сульфаниламид
No. 47: 4-хлорциклогекс-4-ен-1,2-дикарбоновая кислота N1-амидиносульфаниламид
No. 48: N1-амидино-N4-(4-диметиламинобензилиден)-сульфаниламид
No. 49: N1-амидино-N4-бензилиден-сульфаниламид
No. 50: N1-амидино-N4-(2,4-дихлорбензилиден)-сульфаниламид
No. 51: N1-амидино-N4-(4-метоксибензилиден)-сульфаниламид
Фиг.17. Дозозависимое ингибирование активности нейротрипсина соединением No.7.
(A) Определение с помощью вестерн-блота С-концевого фрагмента агрина (Ag-CF) 150 кД, генерированного опосредованным нейротрипсином расщеплением агрина-EGFP в зависимости от концентрации соединения No. 7, N1-амидино-N4-(3,5-дибромосалицилиден)-сульфаниламида.
Дорожка 1: Агрин-EGFP
Дорожка 2: Агрин+мышиный нейротрипсин
Дорожка 3: Агрин+мышиный нейротрипсин + 25 мкМ соединения No. 7
Дорожка 4: Агрин+мышиный нейротрипсин + 37,5 мкМ соединения No. 7
Дорожка 5: Агрин+мышиный нейротрипсин + 50 мкМ соединения No. 7
Дорожка 6: Агрин+мышиный нейротрипсин + 75 мкМ соединения No. 7
Дорожка 7: Агрин+мышиный нейротрипсин + 100 мкМ соединения No. 7
(B) График данных интенсивности, полученных в (А) относительно концентрации ингибитора с I=100%, интенсивность агрина в сочетании с мышиным нейротрипсином без добавления соединения ингибитора No. 7.
Фиг.18-24. Тесты специфичности соединения No.7 (N1-амидино-N4-(3,5-дибромосалицилиден)-сульфаниламида): Отсутствие ингибирования тестируемых протеаз Ха, трипсина, tPA, тромбина, урокиназы, калликреина и плазмина.
Графики показывают исходные скорости реакции (Vini) тестируемых протеаз Ха (см. фиг.18), трипсина (см. фиг.19), tPA (см. фиг.20), тромбина (см. фиг.21), урокиназы (см. фиг.22), калликреина (см. фиг.23) и плазмина (см. фиг.24), построенных относительно концентраций субстрата (мкМ) в отсутствие (белые квадраты) и в присутствии (белые треугольники) соединения No. 7. В качестве положительного контроля конкурентного ингибирования в измерениях для tPA (см. фиг.20) и урокиназы (см. фиг.22) добавляют бензамидин (ВА) и в анализах Ха (см. фиг.18) и плазмина (см. фиг.24) добавляют пара-аминобензамидин (рАВА) в указанных концентрациях (белые ромбы).
Детальное описание изобретения
Изобретение основано на том факте, что ингибирование нейротрипсина позволяет усилить просинаптическую (синапс-формирующую, синапс-дифференцирующую, синапс-организующую, синапс-защищающую, синапс-усиливающую) активность. Ген нейротрипсина экспрессируется во многих нейронах центральной нервной системы (см. статьи Gschwend, T.P., et al., Molec. Cell Neurosci. 9: 207-219, 1997; Wolfer, D.P. et al., Molec. Cell. Neurosci. 18: 407-433, 2001), включая двигательные нейроны спинного мозга (см. пример 1), и белок нейротрипсина обнаруживают во многих синапсах ЦНС (см. статью Molinari, F. et al., Science 298: 1779-1781, 2002), а также в нейромышечном соединении. Нейротрипсин играет существенную роль в развитии и/или поддержании хорошо сбалансированной синаптической функции. Слишком большое количество нейротрипсина (сверхэкспрессия) коррелирует со слишком маленьким числом синаптических связей. Трансгенные мыши со сверхэкспрессией нейротрипсина в нейронах ЦНС демонстрируют уменьшенное число синапсов в коре головного мозга и гиппокампе, двух структурах головного мозга, которые очень важны для когнитивных функций, таких как память и обучение. Аналогичным образом трансгенные мыши со сверхэкспрессией нейротрипсина в спинальных двигательных нейронах показывают уменьшение нейромышечных соединений (НМС), синапсов, которые опосредуют нейроконтроль мышечной активности.
Изменения в нейромышечных соединениях диафрагмы трансгенных мышей, которые способны к сверхэкспрессии нейротрипсина в двигательных нейронах, напоминают обусловленные направленной инактивацией гена агрина. Протеогликан агрин представляет собой очень хорошо охарактеризованный просинаптический (синапс-формирующий, синапс-дифференцирующий, синапс-организующий, синапс-защищающий, синапс-усиливающий) агент (см. статью Sanes, J.R. и Lichtman, J., Nature Rev. Neurosci. 2: 791-805, 2001). Он имеет белок ядра массой приблизительно 220 кД. Агрин существует в нескольких изоформах. Они кодируют как секретируемые белки внеклеточного матрикса, так и трансмембранные белки типа II, которые несут очень короткий N-концевой цитоплазматический сегмент. Участок агрина, который несет просинаптическую активность, находится в С-концевой группе агрина, в частности в 3 домене ламинина G (см. статью Bezakova, G. и Ruegg, M.A., Nature Rev. Molec. Cell Biol. 4: 295-308, 2003). Агрин является субстратом нейротрипсина (см. пример 2). Нейротрипсин расщепляет агрин по двум центрам (см. пример 25). Один центр (называемый α-центром) находится между аргинином 995 (R995) и аланином 996 (А996). Другой центр (называемый β-центром) находится между лизином 1754 (K1754) и серином 1755 (S1755). Номера аминокислот относятся к заякоренному в мембране агрину (сплайс-вариант А4В0) крысы (NP_786930). Однако как центр расщепления α, так и центр расщепления β достаточно консервативны в агрине млекопитающих, включая агрин человека. Расщепление агрина нейротрипсином генерирует фрагмент приблизительно 100 кД (килодальтон), расположенный от А996 до K1754 и фрагмент приблизительно 22 кД, расположенный от S1755 до С-конца. Расщепление обоих, α- и β-центра, отделяет активность, организующую агриновый синапс, от N-концевой группы агрина. Расщепление агрина происходит также in vivo. Обнаружено, что у мышей дикого типа фрагмент агрина 100 кД наиболее часто встречается во время первых постнатальных недель, в период, когда связанная с развитием экспрессия нейротрипсина достигает максимума (см. пример 3). Преобладание фрагмента агрина 100 кД заметно повышено у трансгенных мышей со сверхэкспрессией нейротрипсина в двигательных нейронах (см. примеры 4 и 5).
Агрин является естественным субстратом нейротрипсина как в НМС (см. пример 6), так и в ЦНС (см. пример 14). Расщепляя агрин, нейротрипсин противодействует просинаптической активности агрина. Избыточный нейротрипсин в нейромышечном соединении трансгенных мышей контролирует исчезновение ранее образованных нейромышечных соединений в течение меньше чем трех дней (см. примеры 4-7). Данные наблюдения позволяют оценить нейротрипсин как дестабилизирующий синапс или антисинаптический агент.
Совместное существование про- и антисинаптических агентов поддерживает представление о том, что цепь нейронов нервной системы является динамичной, а не фиксировано связанной системой. Сбалансированное соответствие между просинаптическими и антисинаптическими факторами приводит в результате к гомеостазу. Адаптивные изменения, которые требуются, например, когда необходимо изменить синаптическое соединение с целью удовлетворения изменившихся потребностей, сдвигают баланс между просинаптическими и антисинаптическими силами контролируемым образом. Это тонкое жестко контролируемое взаимодействие между про- и антисинаптическими силами подвержено нарушению регуляции, приводящему к несоответствующему синаптическому гомеостазу или несоответствующей адаптации к функциональным требованиям. Синаптическое заболевание может произойти, когда степень нарушения регуляции превышает пороговое значение.
Фармацевтическое регулирование активности нейротрипсина обеспечивает беспрецедентный доступ к регуляторному механизму синаптической функции. Ингибирование протеолитической активности нейротрипсина будет сдвигать синаптическое равновесие в сторону усиления просинаптических активностей при сокращении антисинаптических активностей и, таким образом, в сторону увеличения числа и/или размера, и/или силы синапсов.
Эксперименты с трансгенными мышами, способными к сверхэкспрессии нейротрипсина в спинальных двигательных нейронах, показывают корреляцию между атрофией скелетных мышц (см. примеры 8 и 10) и нарушением синаптических связей (см. пример 9). Ингибиторы нейротрипсина будут уравновешивать результат избытка нейротрипсина и обеспечат возможность лечения и профилактики атрофии скелетных мышц, вызываемой потерей синаптических связей, например атрофии скелетных мышц у пожилых пациентов.
В линиях трансгенных мышей, способных к сверхэкспрессии нейротрипсина в двигательных нейронах, наблюдают сильную атрофию скелетных мышц, которая в основном обусловлена заметным уменьшением числа мышечных волокон (см. пример 10). Количественную оценку эффекта избыточной продукции нейротрипсина двигательными нейронами приводят в табл.1. Избыточные уровни нейротрипсина, продуцируемые двигательными нейронами, приводят в результате к уменьшению числа мышечных волокон камбаловидной мышцы взрослых мышей в интервале от 18 до 48% в зав