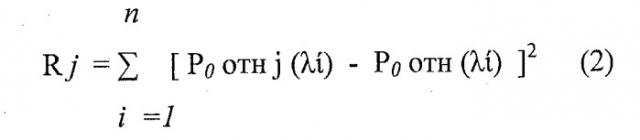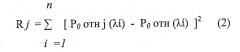Способ и автоматизированное устройство (два варианта) для диагностики заболеваний, вызванных вирусом a/h1n1 и его мутациями
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике. Способ состоит в флуоресцентной эндоскопической диагностике заболеваний, вызванных вирусом A/H1N1 и его мутациями. Устройство (два варианта), используемые для осуществления способа, содержит бронхоскоп (во втором варианте - трахеоскоп), две группы оптических волокон, источник излучения, спектрометр, персональную ЭВМ и сопряженную с ней через интерфейс цветную видеокамеру, а также имитатор патологии и имитатор нормы. Применение данной группы изобретений позволит проводить массовые экспресс-обследования населения, своевременно выявлять заболевания, уменьшить продолжительность лечения с экономией медикаментозных средств. 3 н.п. ф-лы, 1 ил.
Реферат
Изобретение относится к медицинской технике и может быть использовано в эндоскопической люминесцентной диагностике вируса A/H1N1 и его мутаций (подтипы A/H2N2, A/H3N3, H5N1, H7N7, H9N7 и др.).
Сложность борьбы с вновь появляющимися более патогенными штаммами возбудителей инфекционных заболеваний, в частности вируса A/H1N1, обусловлена произошедшими в мире значительными социально-экономическими изменениями. Тесная мировая экономическая интеграция привела к увеличению интенсивности грузовых и людских перевозок, что определяет возможность быстрого распространения возбудителя на территории разных стран и континентов. Кроме того, данные штаммы, как правило характеризуются большей устойчивостью к существующим средствам защиты и способностью к мутации. Поэтому возникла проблема ранней и моментальной диагностики поражения вирусом A/H1N1.
Известны сообщения мировой прессы о первичных признаках заболевания так называемым гриппом «Калифорния 04/2009». К ним относятся першение в горле и жесткий кашель.
Ближайшим аналогом для заявленного способа диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, является способ диагностики заболеваний, вызванных подтипом вируса A/H1N1 (US 7344722 B1, 18.03.2008), заключающийся в осмотре больного и проведении ряда лабораторных исследований. Однако результаты этих исследований получаются в течение около суток. Между тем, за 48 часов данный вирус активно внедряется в человеческие клетки и стремительно размножается. После двух суток заболевание может вступить в тяжелую фазу, и приходится использовать для лечения дорогостоящие импортные препараты типа "Тамифлю" (к тому же высокотоксичные, негативно влияющие на печень).
В качестве ближайшего аналога для заявленных двух вариантов автоматизированного устройства для диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, рассматривается автоматизированное устройство для определения вируса A/H1N1, раскрытое в (US 7262045 В2, 28.08.2007), выполненное с возможностью осуществления воздействия УФ-излучением на исследуемый образец, с последующим исследованием флуоресцентного свечения.
Ввиду экстраординарности мировой ситуации с распространением указанного высокопатогенного гриппа во многих странах на повестку дня ставится уникальная задача массовой моментальной диагностики наличия поражения вирусом данного типа (а в дальнейшем и его мутантами).
Целью настоящего изобретения является оперативное определение (в режиме реального времени) поражения вирусом A/H1N1 и его мутациями больного острым респираторным заболеванием.
Поставленная цель достигается предлагаемыми способом и устройством (два варианта). При этом заявляемый способ диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, включает воздействие УФ-зондирующего излучения на образцы штаммов вируса A/H1N1 и его мутаций и исследуемую трахею больного, последующий анализ вторичного флуоресцентного свечения, причем предварительно многократно измеряют совокупности значений уровней спектральных составляющих вторичного флуоресцентного свечения от калибровочных образцов штаммов вируса A/H1N1 и его мутаций (патология и ее виды), здоровой трахеи (норма), определяют совокупности полученных значений уровней спектральных составляющих по видам патологии и норме в качестве диагностических критериев, при каждом обследовании трахеи больного аналогично многократно измеряют совокупность значений уровней спектральных составляющих вторичного флуоресцентного свечения, полученную совокупность значений уровней спектральных составляющих вторичного флуоресцентного свечения в качестве спектрального образа поочередно сопоставляют с предварительно полученными диагностическими критериями нормы и видов патологии, находят наибольшее приближение к одному из диагностических критериев, которое и определяет диагноз.
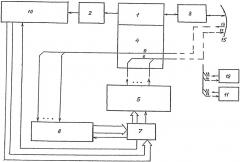
Для осуществления предлагаемого способа автоматизированное устройство для диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, содержит конструктивно объединенные канал освещения с окуляром и объективом и инструментальный канал бронхоскопа (или трахеоскопа - во втором варианте), две группы оптических волокон, группу управляемых источников оптических воздействий, цветную видеокамеру, спектрометр, имитатор патологии и имитатор нормы, персональную ЭВМ, информационный выход которой является информационным выходом устройства, один управляющий выход персональной ЭВМ подключен к входу запуска группы управляемых источников оптических воздействий, выходы которой оптически связаны с входами первой группы оптических волокон, выходы которых являются оптическими выходами устройства, входы второй группы оптических волокон являются оптическими входами устройства, причем имитатор патологии и имитатор нормы выполнены с возможностью показаний имитации соответственно различного вторичного флуоресцентного свечения от видов патологии и здоровой трахеи при подаче на них зондирующего излучения от источника излучения, а также с возможностью поочередного оптического подключения их к выходам оптических волокон первой группы и входам оптических волокон второй группы, выходы оптических волокон второй группы подключены к оптическому входу спектрометра, информационные выходы которого через USB-порт подключены к информационным входам персональной ЭВМ, второй и третий управляющие выходы которой подключены соответственно к входу запуска спектрометра и к входу запуска цветной видеокамеры, а на внешней боковой поверхности волокон второй группы нанесены металлизированные нанопокрытия (1 вариант).
На чертеже дана схема предлагаемого устройства.
Автоматизированное устройство для диагностики заболеваний, вызванных A/H1N1 и его мутациями, содержит конструктивно объединенные канал освещения 1 с окуляром 2 и объективом 3 и инструментальный канал 4 эндоскопа (бронхоскопа или трахеоскопа - во втором варианте), группу 5 управляемых источников оптических воздействий, персональную ЭВМ 7, две группы оптических волокон 6 и 9, спектрометр 8, цветную видеокамеру 10, имитатор патологии 11, имитатор нормы 12. Входы второй группы оптических волокон 9 являются оптическими входами 13 устройства. Для увеличения помехозащищенности устройства от изменения освещенности в медицинском кабинете на внешней боковой поверхности оптических волокон 9 второй группы нанесены металлизированные нанопокрытия Выходы второй группы оптических волокон 9 связаны с волоконным входом спектрометра 8, информационные выходы которого через USB-порт соединены с информационными входами персональной ЭВМ 7, первый управляющий выход которой соединен с входом запуска группы 5 управляемых источников оптических воздействий. Выходы группы 5 управляемых источников оптических воздействий оптически связаны с входами первой группы 6 оптических волокон, выходы которой являются оптическими выходами 14 устройства. Информационные выходы цветной видеокамеры 10 подключены к информационным входам персональной ЭВМ 7 по стандартному интерфейсу. Оптический вход цветной видеокамеры совмещен с окуляром 2. Второй и третий управляющие выходы персональной ЭВМ 7 подключены соответственно к входу запуска спектрометра 8 и к входу запуска цветной видеокамеры 10. Для оперативной проверки работоспособности устройства оно содержит имитатор патологии 11 и имитатор нормы 12, к которым во время режима проверки работоспособности обеспечивается оптическая связь с входами 13 и выходами 14 устройства.
На чертеже позицией 15 обозначена обследуемая поверхность трахеи.
Управляемые источники 5 оптических воздействий предназначены для формирования излучения в ультрафиолетовом, видимом, инфракрасном диапазоне длин волн, а параметры излучения (например, интенсивность излучения, спектр, доза облучения, продолжительность сеанса) задаются от персональной ЭВМ 7.
В группе управляемых источников 5 оптических воздействий могут быть использованы, например, ультрафиолетовый излучатель, инфракрасные полупроводниковые диоды, светодиоды красного, синего цвета и другие управляемые серийные источники излучения. Управление интенсивностью источников производится путем изменения управляющих воздействий (для лазерных диодов, светодиодов - изменение значения тока питания, для импульсных источников с нерегулируемой амплитудой - путем изменения частоты и скважности импульсов светового излучения).
Имитаторы патологии 11 и нормы 12 могут быть выполнены, например, в виде цилиндрических стаканов, на дне которых помещены разные оптические среды, дающие различное вторичное флуоресцентное свечение при подаче на них зондирующего излучения. Имитатор патологии 11 является моделью вторичного флуоресцентного свечения от патологической ткани (с максимумом обычно в середине видимого диапазона длин волн). Имитатор нормы 12 является моделью вторичного флуоресцентного свечения от здоровой ткани трахеи (с максимумом обычно в коротковолновой части видимого диапазона длин волн с интенсивностью сигналов отклика от зондирующего сигнала на порядок меньше по сравнению с имитатором патологии). Основное требование к моделям - обеспечение достаточно большого динамического диапазона уровней вторичного флуоресцентного свечения.
В режиме визуального наблюдения видимый свет от источника 5 через канал освещения 1 и объектив 3 освещает участок обследуемой поверхности 15 трахеи больного. Изображение освещенного участка трахеи через объектив 3, канал освещения 1 и окуляр 2 визуально наблюдают до обнаружения подозреваемого (покрасневшего) участка, требующего более точной диагностики.
В режиме диагностики объектив 3 остается ориентированным на подозреваемый участок обследуемой поверхности - трахеи. В инструментальный канал 4 эндоскопа (бронхоскопа или трахеоскопа - во втором варианте) вводится оптоволоконный жгут (в котором уложены волокна первой и второй групп). К волокнам первой группы 6 подключен выход группы источников 5 зондирующего излучения, а к волокнам второй группы 9 - волоконный вход спектрометра 8. Дистальный торец оптоволоконного жгута (с излучающими торцами первой группы волокон 6 и приемными торцами второй группы волокон 9) устанавливается в непосредственной близости от обследуемой поверхности 15 трахеи. Зондирующее излучение поступает на исследуемый участок поверхности 15 трахеи, где возникает вторичное флуоресцентное свечение.
Для проведения точечной диагностики выбранного подозреваемого участка обследуемой поверхности через инструментальный канал 4 бронхоскопа (или трахеоскопа - для второго варианта) к точкам этого участка обследуемой поверхности поочередно подводят выход 14 оптических волокон 6. Флуоресцентные сигналы, возбуждаемые на обследуемой поверхности 15 под воздействием зондирующего излучения из волокон 6, через волокна второй группы 9 поступают на входы спектрометра 8. Распределения интенсивностей (уровней) спектральных составляющих флуоресцентных сигналов от здоровой и патологической (зараженной вирусом A/H1N1 и его мутациями) тканей трахеи различаются. Коды уровней спектральных составляющих в привязке к кодам длин волн с информационных выходов спектрометра 8 поступают на информационные входы персональной ЭВМ 7.
Принцип формирования диагностических сигналов и алгоритм работы ЭВМ в этом режиме состоит в следующем.
Весь диапазон длин волн флуоресцентного свечения разбивается на дискретные участки, определяемые разрешающей способностью спектрометра 8.
Ранее в результате многократных облучений калибровочных образцов патологических (образцов штаммов вирусов, полученных Институтом гриппа от Всемирной Организации Здравоохранения (ВОЗ)) и нормальных тканей получают характерные устойчивые сочетания уровней сигналов флуоресцентного свечения (спектральные образы) для каждого вида патологии и для нормы - диагностические критерии. При этом ансамбли калибровочных спектральных образов для разных подтипов вируса гриппа и нормы различны и соответствуют выражению:
где j - вид состояния, которому соответствует диагностический критерий (1 - здоровая ткань трахеи (не пораженная вирусами), 2 - вирус A/H1N1, 3, …, n - его мутации).
В результате сравнения полученных спектральных образов от обследуемой трахеи больного Ротн (λi) со спектральными образами диагностических критериев Р0отн j (λi), например, по методу наименьших квадратов формируется оценка наиболее вероятностного состояния исследуемой поверхности трахеи 15 по соотношению
где n - число дискретных участков длин волн (определяемое разрешающей способностью спектрометра),
которая выдается на экран монитора.
По минимальному значению Rj принимается автоматически решение о состоянии исследуемой поверхности трахеи 15 (пораженной вирусом A/H1N1 и его мутациям (патология) или нет (норма).
Соотношения (1) и (2) являются алгоритмом работы персональной ЭВМ 7. При помощи персональной ЭВМ 7 также осуществляется управление запуском определенного излучателя источника 5, запуском спектрометра 8 на измерение и запуском цветной видеокамеры 10.
Для обеспечения измерения в информативный период времени после подачи зондирующего сигнала производится запуск цикла измерений по управляющим воздействиям от персональной ЭВМ 7.
Сигналы на первом, втором и третьем управляющих выходах персональной ЭВМ 7 представляют одну и ту же последовательность импульсов, задержанных относительно другой последовательности на величину срабатывания элементов, на которые подаются сигналы предыдущей последовательности.
Первым сигналом на третьем управляющем выходе ЭВМ 7 является сигнал запуска цветной видеокамеры 10. После этого на первом управляющем выходе персональной ЭВМ 7 с заданной задержкой появляется подобная импульсная последовательность на запуск выбранного источника 5. С заданной и программируемой задержкой (определяемой задержкой появления вторичной флуоресценции) по отношению к моменту запуска источника 5 эта же последовательность поступает на спектрометр 8 (с второго управляющего выхода персональной ЭВМ 7). Благодаря съемке пораженного вирусом участка исследуемой трахеи, на который воздействует зондирующее излучение от источника 5, осуществляемой цветной видеокамерой 10, производится фиксация места обследования в данном кадре видеосъемки. При обнаружении патологии или по команде врача кадр с изображением участка исследуемой ткани заносится в память персональной ЭВМ 7. Результаты диагноза выдаются на дисплей персональной ЭВМ и могут быть выведены на печать в виде диагностического заключения.
В качестве эндоскопа в данном устройстве может быть использован любой бронхоскоп. Более дешевой и массовой разновидностью предложенного устройства может стать вариант 2, в котором вместо бронхоскопа используется трахеоскоп. Трахеоскоп почти вдвое короче бронхоскопа (и соответственно - дешевле). К тому же, в этом случае ослабляются ограничения по внешнему диаметру волоконно-оптического жгута.
В качестве спектрометра 8 можно использовать, например, российский миниспектрометр FSD-03-08, монолитная конструкция которого включает волоконный вход, вогнутую дифракционную решетку, высокочувствительную фотодиодную линейку, 14-разрядный аналого-цифровой преобразователь. Миниспектрометр FSD-03-08 имеет спектральную разрешающую способность 10 нм (при самой высокой чувствительности) в диапазоне длин волн от 300 до 800 нм. Обмен информацией между спектрометром и персональной ЭВМ осуществляется через стандартный порт USB.
В качестве персональной ЭВМ 7 может быть использована любая IBM, совместимая персональная ЭВМ (или ноутбук) отечественного или зарубежного производства.
В тех случаях, когда мал уровень вторичного флуоресцентного свечения от обследуемой поверхности и есть вероятность, что имеет место дефект в оптоэлектронных трактах, поочередное помещение дистального торца волоконно-оптического жгута (в котором уложены приемные оптические волокна 9 второй группы и излучающие оптические волокна 6 первой группы) в имитатор патологии и в имитатор нормы позволяет (при исправной работе устройства) зафиксировать поочередно диагноз «патология» и «норма». Таким образом обеспечивается оперативная проверка работоспособности устройства в широком динамическом диапазоне.
Введение спектрометра позволило повысить разрешающую способность анализа сигналов вторичного флуоресцентного свечения во всем диапазоне длин волн.
Введение в устройство цветной видеокамеры позволяет накапливать в базе данных цветные видеоизображения патологических участков разных пациентов в различные моменты времени.
Введение металлизированных нанопокрытий на внешней поверхности волокон второй группы позволило повысить помехозащищенность устройства (устранить реагирование на изменения освещенности в медицинском кабинете). При этом удается уложиться в ограничения по внешнему диаметру волоконно-оптического жгута, обусловленные конечным внутренним диаметром (1,8 мм) инструментального канала бронхоскопа.
Диагностическое зондирующее ультрафиолетовое излучение угнетает вирусы и обладает некоторым терапевтическим воздействием.
Основным техническим результатом, достигаемым при использовании заявленной группы изобретений, является оперативное определение поражения вирусом A/H1N1 (а в дальнейшем и его мутациями) больного острым респираторным заболеванием. После введения эндоскопа (бронхоскопа или трахеоскопа) в трахею результаты диагностики автоматически получаются в течение нескольких миллисекунд.
Полученный мультипликативный эффект не является простой суммой эффектов от вновь введенных составных частей группы изобретений, а является результатом их совместной работы по единой методике, рассмотренной ранее.
Применение предложенных способа и автоматизированных устройств для диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, позволит проводить массовые экспресс-анализы населения в угрожаемые периоды, минимизировать размеры эпидемии, своевременно начать лечение этой высокопатогенной разновидности гриппа и сократить применение дорогостоящих медикаментозных средств.
1. Способ диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, отличающийся тем, что включает воздействие ультрафиолетовым зондирующим излучением на образцы штаммов вируса A/H1N1 и его мутаций и исследуемую трахею, последующий анализ вторичного флуоресцентного свечения, причем предварительно многократно измеряют совокупности значений уровней спектральных составляющих вторичного флуоресцентного свечения от калибровочных образцов штаммов вируса A/H1N1 и его мутаций, здоровой трахеи, определяют совокупности полученных значений уровней спектральных составляющих по видам патологии и норме в качестве диагностических критериев, при каждом обследовании трахеи больного в режиме реального времени аналогично многократно измеряют совокупность значений уровней спектральных составляющих вторичного флуоресцентного свечения, полученную совокупность значений уровней спектральных составляющих вторичного флуоресцентного свечения в качестве спектрального образа поочередно сопоставляют с предварительно полученными диагностическими критериями нормы и видов патологии, находят наибольшее приближение к одному из диагностических критериев, которое и определяет диагноз.
2. Автоматизированное устройство для диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, отличающееся тем, что содержит конструктивно объединенные канал освещения с окуляром и объективом и инструментальный канал бронхоскопа, две группы оптических волокон, группу управляемых источников оптических воздействий, цветную видеокамеру, спектрометр, имитатор патологии и имитатор нормы, персональную ЭВМ, информационный выход которой является информационным выходом устройства, один управляющий выход персональной ЭВМ подключен к входу запуска группы управляемых источников оптических воздействий, выходы которой оптически связаны с входами первой группы оптических волокон, выходы которых являются оптическими выходами устройства, входы второй группы оптических волокон являются оптическими входами устройства, причем имитатор патологии и имитатор нормы выполнены с возможностью показаний имитации соответственно различного вторичного флуоресцентного свечения от видов патологии и здоровой трахеи при подаче на них зондирующего излучения от источника излучения, а также с возможностью поочередного оптического подключения их к выходам оптических волокон первой группы и входам оптических волокон второй группы, выходы оптических волокон второй группы подключены к оптическому входу спектрометра, информационные выходы которого через USB-порт подключены к информационным входам персональной ЭВМ, второй и третий управляющие выходы которой подключены соответственно к входу запуска спектрометра и к входу запуска цветной видеокамеры, а на внешней боковой поверхности волокон второй группы нанесены металлизированные нанопокрытия.
3. Автоматизированное устройство для диагностики заболеваний, вызванных вирусом A/H1N1 и его мутациями, отличающееся тем, что содержит конструктивно объединенные канал освещения с окуляром и объективом и инструментальный канал трахеоскопа, две группы оптических волокон, группу управляемых источников оптических воздействий, цветную видеокамеру, спектрометр, имитатор патологии и имитатор нормы, персональную ЭВМ, информационный выход которой является информационным выходом устройства, один управляющий выход персональной ЭВМ подключен к входу запуска группы управляемых источников оптических воздействий, выходы которой оптически связаны с входами первой группы оптических волокон, выходы которых являются оптическими выходами устройства, входы второй группы оптических волокон являются оптическими входами устройства, причем имитатор патологии и имитатор нормы выполнены с возможностью показаний имитации соответственно различного вторичного флуоресцентного свечения от видов патологии и здоровой трахеи при подаче на них зондирующего излучения от источника излучения, а также с возможностью поочередного оптического подключения их к выходам оптических волокон первой группы и входам оптических волокон второй группы, выходы оптических волокон второй группы подключены к оптическому входу спектрометра, информационные выходы которого через USB-порт подключены к информационным входам персональной ЭВМ, второй и третий управляющие выходы которой подключены соответственно к входу запуска спектрометра и к входу запуска цветной видеокамеры, а на внешней боковой поверхности волокон второй группы нанесены металлизированные нанопокрытия.