Средство, оказывающее антиишемическое, антигипоксическое и антиамнестическое действие в остром периоде черепно-мозговой травмы
Иллюстрации
Показать всеПредложено применение известного снотворного средства золпидема в остром периоде черепно-мозговой травмы (ЧМТ) в качестве нейропротекторного средства, устраняющего гипоксические и амнестические нарушения. Показана профилактика вторичных осложнений, обусловленных черепно-мозговой травмой, и восстановление нервно-психического статуса, а также восстановление интегративных функций мозга под действием золпидема уже в остром периоде ЧМТ, что определяет исходы травматической болезни мозга. 4 табл.
Реферат
Изобретение относится к медицине, конкретно, к фармакологии и неврологии. Касается известного снотворного средства золпидем (др. название ивадал, амбиен), которое может быть использовано как нейропротектор для коррекции нарушений деятельности мозга, обусловленных черепно-мозговой травмой.
Общепринято считать, что исходы лечения острого периода черепно-мозговой травмы определяются, в основном, интенсивностью и частотой возникновения вторичных повреждений мозга, в качестве которых выступают эпизоды ишемии, гипоксии, гиперкапнии, судорог, повышенного внутричерепного давления, нарушений метаболизма нейронов. Для фармакотерапии этих синдромов используют средства, улучшающие микроциркуляцию или нормализующие метаболизм и возбудимость клеток нервной ткани, что ограничивает гибель нейронов мозга (Teadale G.M., Grabam D.I., 1998, Ф.Ю.Белозерцев и др., 2007). Наиболее назначают вазоактивные вещества (нимодипин, сермион, кавинтон, эуфиллин и др.), нейрометаболики (пирацетам, актовегин и др.), антиконвульсанты (фенобарбитал, фенитоин и др.), бензодиазепины (диазепам и др.), корректоры лактоацидоза (трометамин). Однако используемые в настоящее время препараты обладают, как правило, нейропротекторным действием в отношении расстройств, вызываемых одним из многих факторов вторичного повреждения мозга. Вазоактивные вещества предупреждают развитие или устраняют ангиоспазмы, ведущие к ишемии. Барбитураты уменьшают интенсивность последствий гипоксии с гиперкапнией, препятствуя истощению метаболических резервов и повышению внутричерепного давления. Бензодиазепины, фенитоин предупреждают возникновение вторичных судорожных эпизодов, усугубляющих влияние на травмированный мозг высокого внутричерепного давления, колебаний артериального давления, сниженной доставки кислорода, метаболического дефицита (Ф.Ю. Белозерцев и др., 2007, Т.А.Скоромец, 2002, A.I. Faden, 1996, Р.Мартуза, М. Проктор, 1997). Необходимо указать, что комбинированное применение этих лекарственных средств считается одним из вариантов «агрессии» по отношению к больному с черепно-мозговой травмой, способное снизить его функциональные возможности (И.А Качков и др., 1999, Касымов Р.Д., Кондратьев А.Н., 2001).
В настоящее время предлагается провести поиск препаратов, которые бы обладали многофакторным нейропротекторным действием на ишемию, гипоксию с гиперкапнией, судороги, когнитивные и др. вторичные повреждения мозга в посттравматический период.
Для расширения арсенала лекарственных средств, используемых в качестве нейропротекторов при черепно-мозговой травме, и для повышения эффективности фармакотерапии острого посттравматического периода предлагается использовать снотворное средство золпидем.
Золпидем (ивадал, амбиен) является производным имидазолина и относится к группе модуляторов ГАМКа-рецепторного комплекса, усиливающих гамкергические процессы в мозге. Препарат связывается с BZ1-подтипом рецепторов в α-субъединице ГАМКа-рецепторных комплексов и усиливает гамкергическое торможение нейронов мозга. В результате препарат уменьшает количество ночных пробуждений, увеличивает общую продолжительность сна и минимально изменяет его структуру. Кроме того, препарат обладает слабым анксиолитическим эффектом (Тревор Э.Д., Вэй У.Л., 2007).
Известно применение золпидема в неврологической практике при различных формах бессонницы как снотворного средства (Р.У.Хабриев, А.Г.Чучалин, 2006).
Применение золпидема по новому назначению стало возможным благодаря выявленным новым фармакологическим свойствам препарата.
Эксперименты проведены на белых, беспородных мышах массой 25-30 г и беспородных крысах массой 140-160 г. Животным наносили контактную черепно-мозговую травму (Ф.Ю.Белозерцев и др., 2004). Начиная со 2 дня, опытной группе животных вводили подкожно золпидем в дозе 5 и 10 мг/кг. Группе сравнения назначали прототипы: вазоактивный препарат сермион (5 мг/кг), антигипоксант натрия оксибутират (50 мг/кг), ноотроп пирацетам (50 мг/кг) и антиконвульсант сульфат магния (80 мг/кг), т.е. лекарственные средства, рекомендованные для применения при черепно-мозговой травме.
Нейропротекторную активность препаратов оценивали по устойчивости мозга к факторам его вторичного повреждения - ишемии, гипоксической гипоксии с гиперкапнией, судорожным явлениям, а также когнитивным нарушениям.
Для исследования антиишемической активности препаратов использовали декапитационную модель полной ишемии головного мозга (О.Н.Lowry et al., 1964, D.Gosal, J.E.Torres, 2001). С этой целью после декапитации на уровне 1 шейного позвонка определяли продолжительность и частоту агонального дыхания (гаспинга).
Антигипоксическую активность препаратов определяли по продолжительности резервного времени у мышей в условиях гермокамеры (Т.А.Воронина и др., 2005), что моделирует воздействие на животных двух факторов, повреждающих мозг при контактной травме головы (Качков И.А. и др., 1999).
Для оценки противосудорожной активности препаратов у крыс регистрировали продолжительность тонической экстензии при электрораздражении мозга через глазничные электроды и определяли защитный индекс - процент животных, у которых не возникали электрошоковые судороги (Воронина Т.А., Неробокова Л.Н., 2005).
Оценка состояния мнестических функций у животных, перенесших черепно-мозговую травму, выполнена с использованием методики выработки и отсроченного воспроизведения условной реакции пассивного избегания (Т.А.Воронина и др., 2005). Эффекты препаратов оценивали по достижению критерия обучения и количества выработанных условных ответов. Оценку состояния долговременной памяти производили по показателям отсроченного воспроизведения условной реакции пассивного избегания через 7 дней после сеанса обучения.
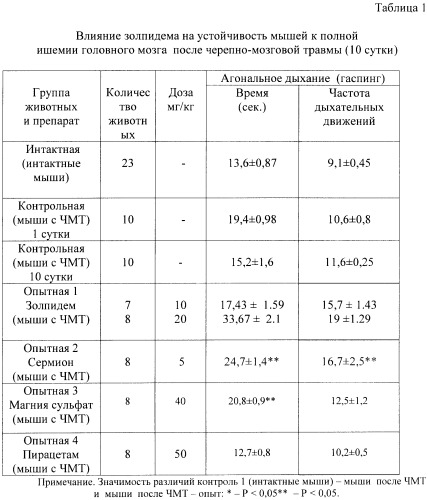
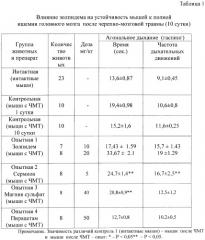
Проведенные исследования показали, что в первые три дня посттравматического периода наблюдается повышение на 24,9-42,6% устойчивости мозга к ведущим факторам его вторичного повреждения. Начиная с 3 суток, отмечается снижение показателей устойчивости головного мозга травмированных животных к ишемии, гипоксии, гиперкапнии и судорогам (табл.1, 2, 3), что указывает на уменьшение активности эндогенных протекторных механизмов и повышение вероятности вторичного повреждения мозга.
Золпидем оказывает выраженный протекторный эффект при ишемическом повреждении мозга. На 9 день введения золпидема в дозе 10 мг/кг/сутки мышам с черепно-мозговой травмой продолжительность агонального дыхания на фоне полной ишемии головного мозга возросла на 15%, а его частота - на 48%. Максимальное увеличение продолжительности агонального дыхания (на 121%) наблюдалось при курсовом применении золпидема в дозе 20 мг/кг/сутки. При этом частота агонального дыхания у травмированных мышей возросла на 79% в сравнении с контрольной группой. Эффективность препарата сравнения вазодилататора сермиона, используемого в качестве вазоактивного средства при черепно-мозговой травме, была ниже. В дозе 5 мг/кг/сутки сермион увеличивает продолжительность агонального дыхания при полной ишемии головного мозга травмированных животных на 62,5%, а частоту - на 57,5%. Введение травмированным животным сульфата магния и пирацетама не изменяет устойчивости головного мозга к глобальной ишемии (табл.1).
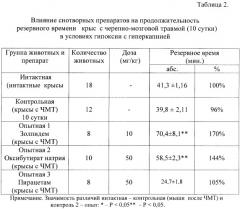
В следующей серии опытов установлено, что курсовое введение золпидема увеличивает резервное время у травмированных животных, помещенных в гермокамеру. В условиях черепно-мозговой травмы достоверное увеличение резервного времени у крыс отмечается после его назначения в дозировке 7,5 мг/кг/сутки (на 70%), что превышает эффект антигипоксического препарата сравнения натрия оксибутирата и ноотропа пирацетама (табл.2).
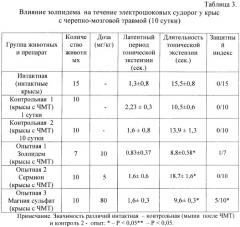
В сравнении с магния сульфатом золпидем в дозе 10 мг/кг/сутки не оказывает противосудорожное действие. Его курсовое введение не предупреждает возникновение электрошоковых судорог травмированных животных. Вместе с тем, отмечается уменьшение на 36,7% продолжительности тонической экстензии. Напротив, у вазодилататора сермиона выявлено просудорожное действие, которое проявляется увеличением продолжительности тонической экстензии у крыс. Эксперименты показали, что противосудорожный эффект золпидема уступает противосудорожному эффекту препарата сравнения магнию сульфата, входящего в стандарт лечения больных с черепно-мозговой травмой (табл.3).
Таким образом, в отличие от симптоматических средств с избирательно вазоактивным (сермион), антигипоксическим (натрия оксибутират), антиамнестическим (пирацетам), противосудорожным действием (магния сульфат) препарат с гамк-позитивной активностью золпидем обладает многофакторным протекторным эффектом. Его позитивное влияние на течение ишемии, гипоксии и гиперкапнии не уступает или превосходит по силе антиишемического и антигипоксического действия перечисленные выше препараты сравнения, которые входят в стандарт лечения в остром периоде черепно-мозговой травмы.
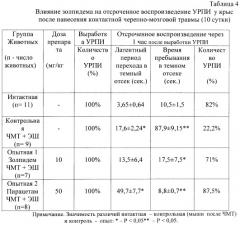
В серии исследований установлено, что наряду с многофакторным протекторным эффектом золпидем обладает свойством восстанавливать отсроченное воспроизведение адаптационных реакций. Как показали контрольные наблюдения, на 10 сутки острого периода черепно-мозговой травмы у животных отмечается полное отсутствие воспроизведения УРПИ через 1 час в случае нанесения электрошока сразу после сеанса его выработки. Курсовое применение золпидема (10 мг/кг) почти полностью восстанавливает воспроизведение адаптивных ответов у травмированных животных до уровня интактных животных. Введение препарата сравнения пирацетама, эталонного ноотропного средства, рекомендованного для использования для ускоренной нервно-психической реабилитации больных, также восстанавливает показатели обучения адаптивным ответам до уровня интактных животных (табл.4).
Таким образом, полученные данные убедительно свидетельствуют о наличии у средства с гамк-позитивной активностью золпидема многофакторного нейропротекторного эффекта при черепно-мозговой травме.
ЛИТЕРАТУРА
1. Белозерцев Ф.Ю., Белозерцев Ю.А. Значение нейропротекторов в лечении травматической энцефалопатии. - Чита, 2004. - 84 с.
2. Белозерцев Ф.Ю., Белозерцев Ю.А., Ширшов Ю.А. Нейропротекторы и черепно-мозговая травма. - Чита: ИИЦ ЧГМА, 2007. - 110 с.
3. Воронина Т.А., Неробокова Л.Н. Методические указания по изучению снотворных веществ / Руководство по эксперим. изучению новых фармакологических веществ/ Под редакцией Р.У.Хабриева. - Москва, 2005. - с.263-276.
4. Касымов Р.Д., Кондратьев А.Н. Основные принципы хирургического лечения и интенсивной терапии тяжелой черепно-мозговой травмы. - Санкт-Петербург.- 2001.
5. Качков И.А., Амчеславский В.Г., Филимонов Б.А. Алгоритмы лечения тяжелой черепно-мозговой травмы // Consilium medicum. - 1999. - t.1. - №2. - 85-90.
6. Лекарственные средства. Под ред. Р.У.Хабриева А.Г.Чучалина. - М.: Гэотар, 2006. - с.316-317.
7. Мартуза З., Проктор М. Травма. - Неврология. Под ред. Самуэльс М. - М.: Практика, 1997. - С.355-398.
8. Руководство по экспериментальному изучению новых фармакологических веществ/ Под редакцией Р.У.Хабриева. - Москва, 2005. - 785 с.
9. Скоромец Т.А. Вторичная ишемия головного мозга в остром периоде черепно-мозговой травме //Автореф диссер. докт.мед. наук. - Санкт-Петербург, 2002. - с.44.
10. Тревор Э.Д., Вэй У.Л. Седативные и снотворные средства. - Базисная и клиническая фармакология. - Санкт-Петербург: Невский диалект, 2007. - т.1. - С.429-448.
11. Faden A.I. Pharmacologic treatment of acute traumatic brain injury //JAMA 1996. - 276. - P.569-57.
12. Gostal D., J.E. Torres. Brainstem nitric oxide tissue levels correlate with anoxia-induced gasping activity in the developing rat.// Biol. Neonate. - 2001. - Vol.79. - №22. - Р.122-131.
13. Lowry O.H., J V.Passoneau, F.X. Hasselberger, D.W.Schuiz. Effect of ischemia on known substrates and cofactors of the glycolitic pathway in brain // J. Biol. Chem. - 1964. - Vol.239 - P 18-30.
14. Teadale G.M., Grabam D.I. Craniocerebral Trauma: protection and retrievale of the neural population after injury //Neurosurgery. - 1998. - p.43.
Применение золпидема в качестве нейропротекторного средства, устраняющего гипоксические и амнестические нарушения в остром периоде черепно-мозговой травмы.