Выделенный пептид, стимулирующий противоопухолевый иммунный ответ, фармацевтическая композиция на его основе, способ лечения млекопитающего и способ модуляции иммунного ответа
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине. Предлагается пептид структуры ProThrThrLysThrTyrPheProHisPhe, фармацевтическая композиция на его основе, которую используют для стимулирования противоопухолевого иммунного ответа, а также способы лечения млекопитающего и модуляции иммунного ответа. Предлагаемые изобретения расширяют арсенал средств для лечения раковых заболеваний. 4 н. и 15 з.п. ф-лы, 49 табл.
Реферат
Область изобретения
Изобретение относится к области иммунологии. В частности, настоящее изобретение относится к пептидам и их фармацевтическим композициям, способным модулировать иммунные ответы.
Предпосылки создания изобретения
Известно применение пептидов для лечения заболеваний и в качестве фармацевтических композиций. Например, в патенте США 6191113 описан пептид, который обладает ингибирующей активностью для роста клеток гладкой мускулатуры и, таким образом, может использоваться для профилактики и лечения патологических состояний, связанных с ростом клеток гладкой мускулатуры, таких как атеросклероз, рестеноз после ангиопластики, сужение просвета после трансплантации кровеносных сосудов и саркома гладкой мускулатуры. В патенте США 6184208 описан другой пептид, который, как установлено, модулирует физиологические процессы, такие как активность прироста веса зоны эпителиального роста и рост волос.
Краткое изложение сущности изобретения
Таким образом, объектом настоящего изобретения является идентификация биологически активных полипептидов. Стандартными химическими методами было синтезировано множество пептидов и проведен скрининг их биологической активности. Пептидам присвоены коды, имеющие буквы CMS с последующим номером. Всего было выявлено 30 пептидов, обладающих биологической активностью in vivo. Последовательности и соответствующие идентификационные номера (ID) таких биологически активных пептидов приведены в таблице А.
| Таблица А | ||
| SEQ ID No: | Название пептида | Пептидная последовательность |
| 1 | CMS001 | Pro Thr Thr Lys Thr Tyr Phe Pro His Phe |
| 2 | CMS002 | Val Val Tyr Pro Trp Thr Gln Arg Phe |
| 3 | CMS008 | Lys Ala Val Gly His Leu Asp Asp Leu Pro Gly Ala Leu |
| 4 | CMS010 | Val Ala Pro Glu Glu His Pro Thr Leu Leu Thr Glu Ala Pro Leu Asn Pro Lys |
| 5 | CMS012 | Leu Gly Met Glu Ala Cys Gly Ile His Glu Thr Thr Tyr |
| 6 | CMS013 | Leu Arg Val Ala Pro Glu Glu His Pro Val Leu |
| 7 | CMS014 | Ala Ala His His Pro Asp Asp Phe Asn Pro Ser Val |
| 8 | CMS015 | Pro Ser Ile Val Gly Arg Pro Arg His Gln Gly Val Met |
| 9 | CMS016 | Ile Gly Met Glu Ser Ala Gly Ile His Glu Thr Thr Tyr |
| 10 | CMS018 | Val Gly Met Gly Glu Lys Asp Ser Tyr |
| 11 | CMS019 | Val Gly Met Gly Gln Lys Asp Ser Tyr |
| 12 | CMS020 | Val Gly Met Gly Gln Lys Asp Ser Tyr Val |
| 13 | CMS021 | Met Ala Thr Ala Ala Ser Ser Ser Ser Leu |
| 14 | CMS022 | Tyr Ser Phe |
| 15 | CMS023 | Ala Ala Phe |
| 16 | CMS024 | Tyr Ser Leu |
| 17 | CMS026 | Thr Thr Tyr Asn Ser Ile Met |
| 18 | CMS027 | Phe Glu Glu Asn Met |
| 19 | CMS028 | Phe Glu Pro Ser Phe |
| 20 | CMS029 | Phe Asn Glu Glu |
| 21 | CMS030 | Phe Glu Glu Met |
| 22 | CMS032 | Phe Glu Glu Glu |
| 23 | CMS033 | Phe Glu Ser Phe |
| 24 | CMS034 | Pro Glu Asn Phe |
| 25 | CMS035 | Phe Val Asn Asp |
| 26 | CMS036 | Phe Gln Pro Ser Phe |
| 27 | CMS003 | Phe Asn Phe Val Pro Pro |
| 28 | CMS007 | Ala Gly Asp Asp Ala Pro Arg Ala Val Phe |
| 29 | CMS009 | Leu Arg Val Ala Pro Glu Glu His Pro Thr Leu |
| 30 | CMS011 | Arg Val Ala Pro Glu Glu His Pro Thr Leu |
Соответственно, один из аспектов настоящего изобретения относится к по существу чистым пептидам, имеющим последовательности, идентифицированные как последовательности SEQ ID No:1-30. Таким образом, настоящее изобретение также относится к по существу чистым пептидам, включающим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30. Оно также относится к по существу чистому пептиду, состоящему главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. В конкретном варианте осуществления пептиды могут модулировать, но не ограничиваются модулированием, одно или более из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
В другом аспекте настоящее изобретение относится к по существу чистым пептидам, которые являются функциональными производными пептидов, имеющим последовательности, идентифицированные как последовательности с ID No:1-30. Таким образом, настоящее изобретение также относится по существу к чистому пептиду, включающему аминокислотную последовательность, которая является функциональной производной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к по существу чистому пептиду, состоящему главным образом из аминокислотной последовательности, которая представляет собой функциональное производное аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. В конкретном варианте осуществления пептиды, которые являются функциональными производными, могут модулировать, но не ограничиваются модулированием, одно или несколько из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
В другом аспекте настоящее изобретение относится к нуклеиновым кислотам, которые имеют последовательности, кодирующие пептиды, идентифицированные выше как последовательности SEQ ID No:1-30. Дополнительный аспект настоящего изобретения относится к векторам экспрессии, которые содержат последовательности нуклеиновых кислот пептидов, показанные ниже как последовательности SEQ ID No:1-30. Таким образом, данный аспект настоящего изобретения также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, включающий аминокислотную последовательность, выбранную из группы, включающей SEQ ID No:1-30. Оно также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, состоящий главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Изобретение также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, включающий функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, состоящий главным образом из функциональной аминокислотной последовательности, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
Еще один аспект настоящего изобретения относится к гибридным пептидам, содержащим лидерный или сигнальный пептид, смежный с пептидом, при этом пептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30. Настоящее изобретение также относится к гибридным пептидам, содержащим лидерный пептид, смежный с пептидом, при этом пептид включает функциональное производное пептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30.
Настоящее изобретение также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, включающим функциональную аминокислотную последовательность, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, включающей SEQ ID No:1-30. Оно также относится к генетическому вектору, включающему нуклеотидную последовательность, кодирующую пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, состоящим главным образом из функциональной аминокислотной последовательности, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В конкретном варианте осуществления пептиды, продуцируемые в любом из вышеуказанных генетических векторов, могут модулировать, но не ограничиваются модулированием, одно или более из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
Еще в одном аспекте настоящее изобретение относится к микроорганизму, геном которого включает нуклеотидную последовательность, кодирующую пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к микроорганизму, геном которого включает нуклеотидную последовательность, кодирующую пептид, состоящий главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
Еще в одном аспекте настоящее изобретение относится к микроорганизму с генетическим материалом, который включает нуклеотидную последовательность, кодирующую экзогенный пептид, включающий функциональную аминокислотную последовательность, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к микроорганизму с генетическим составом, включающим нуклеотидную последовательность, которая кодирует экзогенный пептид, состоящий главным образом из функциональной аминокислотной последовательности, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Термин «экзогенный пептид», как использовано в данном описании, относится к пептиду, имеющему аминокислотную последовательность, которая отличается от любого другого пептида, обычно экспрессируемого микроорганизмом в своей природной немодифицированной форме.
Еще в одном аспекте настоящее изобретение относится к микроорганизму с генетическим составом, включающим нуклеотидную последовательность, которая кодирует экзогенный гибридный пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, пептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30. Оно также относится к микроорганизму, геном которого включает нуклеотидную последовательность, кодирующую гибридный пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, состоящим главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В другом аспекте настоящее изобретение относится к микроорганизму с генетическим составом, включающим нуклеотидную последовательность, которая кодирует экзогенный гибридный пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, при этом пептид включает функциональную аминокислотную последовательность, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к микроорганизму с генетическим составом, включающим нуклеотидную последовательность, которая кодирует экзогенный гибридный пептид, включающий лидерную аминокислотную последовательность, смежную с пептидом, состоящим главным образом из функциональной аминокислотной последовательности, которая представляет собой функциональное производное биологически активной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В конкретном варианте осуществления пептиды, продуцируемые любым из вышеуказанных микроорганизмов, могут модулировать, но не ограничиваются модулированием, одно или более из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, включающей по существу чистый пептид, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30. Изобретение также относится к фармацевтической композиции, включающей по существу чистый пептид, состоящий главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
Настоящее изобретение также относится к фармацевтической композиции, включающей по существу чистый пептид, включающий функциональное производное аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Оно также относится к фармацевтической композиции, включающей по существу чистый пептид, состоящий главным образом из функционального производного аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30. Кроме того, изобретение относится к фармацевтической композиции, состоящей из по существу чистого пептида, состоящего главным образом из функционального производного аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В конкретном варианте осуществления пептиды в составе любой из вышеуказанных фармацевтических композиций могут модулировать, но не ограничиваются модулированием, одно или более из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
В следующем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, включающему получение по существу чистого пептида, включающего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30, и смешивание указанного по существу чистого пептида с фармацевтически приемлемым носителем. Оно также относится к способу получения фармацевтической композиции, включающему получение по существу чистого пептида, состоящего главным образом из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В другом аспекте настоящее изобретение относится к способу получения фармацевтической композиции, включающему получение по существу чистого пептида, включающего аминокислотную последовательность, которая является функциональным производным аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30; и смешивание указанного по существу чистого пептида с фармацевтически приемлемым носителем.
Изобретение далее относится к способу получения фармацевтической композиции, включающему получение по существу чистого пептида, состоящего главным образом из аминокислотной последовательности, которая является функциональным производным аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В связи с любым из вышеуказанных способов пептид может модулировать, но не ограничиваются модулированием, одно или более из следующего: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
Еще в одном аспекте настоящее изобретение относится к способу лечения человека, включающему введение человеку фармацевтически эффективной дозы по существу чистого пептида, включающего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:1-30. Оно также относится к способу лечения человека, включающему введение человеку фармацевтически эффективной дозы по существу чистого пептида, включающего аминокислотную последовательность, которая представляет собой функциональное производное аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:1-30.
В конкретном варианте осуществления описанные выше пептиды, используемые для лечения человека, могут использоваться для модулирования, но не ограничиваются модулированием, одного или более из следующих состояний человека: иммунной активности; инфекции гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрита; роста раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и веса тела.
В связи с любыми вышеописанными последовательностями нуклеиновых кислот пептиды и/или гибридные пептиды, экспрессируемые из данных последовательностей нуклеиновых кислот, могут модулировать, но не ограничиваются модулированием, следующее: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
Другой аспект настоящего изобретения относится к способу лечения заболеваний, включающему введение фармацевтически эффективной дозы по существу чистого пептида, с последовательностью SEQ ID No:1 - SEQ ID No:30. В конкретном варианте осуществления вводимые таким образом пептиды могут модулировать, но не ограничиваются модулированием, следующее: иммунную активность; инфекцию гепатита, включая, но не ограничиваясь, инфекцию гепатита В; нефрит; рост раковой опухоли, включая, но не ограничиваясь этим, саркому, рак печени, лейкоз и меланому; и вес тела.
Как описано выше, другой вариант осуществления настоящего изобретения представляет собой пептид или полипептид, состоящий главным образом из пептидов по настоящему изобретению. Как использовано в данном описании, термин «состоящий главным образом из» относится к пептиду или полипептиду, который включает аминокислотную последовательность пептидов по настоящему изобретению наряду с дополнительными аминокислотами на карбоксильном и/или аминном концах и который поддерживает активность представленных здесь пептидов по настоящему изобретению. Таким образом, в качестве неограничивающего примера, когда активность пептида по настоящему изобретению заключается в модулировании иммунной активности, пептид или полипетид, «состоящий главным образом» из пептида по настоящему изобретению, будет обладать активностью модулирования иммунной активности, как представлено здесь относительно пептида, и не будет обладать какими-либо характеристиками, которые значительно снижают способность пептида или полипептида модулировать иммунную активность или которые вносят значимое изменение в основные и новые характеристики пептида в качестве модулятора иммунной активности. Таким образом, в приведенном выше примере полноразмерный природный полипептид, который обладает первичной активностью, отличающейся от модулирования иммунной активности, и который где-нибудь в себе содержит аминокислотную последовательность пептида по настоящему изобретению, не будет представлять собой пептид или полипетид, «состоящий главным образом» из пептида по настоящему изобретению. Аналогичным образом, в вышеуказанном примере генетически сконструированный пептид или полипептид, который обладает первичной активностью, отличающейся от модулирования иммунной активности, но включает где-нибудь в себе аминокислотную последовательность пептида по настоящему изобретению, не будет представлять собой пептид или полипептид, «состоящий главным образом» из пептида по настоящему изобретению.
Помимо использованного выше примера модулирования иммунной активности, приведенное выше определение также относится ко всем пептидам настоящего изобретения в отношении видов активности, которыми обладают такие пептиды. В частности, приведенное выше определение относится к пептидам изобретения, обладающим активностью модулирования степени вирусного инфицирования, модулирования степени инфекции гепатита, модулирования степени нефрита, модулирования роста раковой опухоли или модулирования веса тела, как указано ниже в подробном описании.
Специалисты в данной области легко смогут определить, состоит или не состоит пептид или полипептид главным образом из пептида по настоящему изобретению в рамках приведенных выше определений, с помощью измерения активности пептида или полипептида с использованием анализов модулирования иммунной активности, модулирования степени вирусного инфицирования, модулирования степени инфекции гепатита, модулирования степени нефрита, модулирования роста раковой опухоли или модулирования веса тела, которые обеспечиваются здесь для конкретных пептидов по настоящему изобретению.
В предпочтительном варианте осуществления термин «состоящий главным образом из» относится к пептидам или полипетидам, которые имеют меньше 20 аминокислотных остатков в дополнение к пептиду согласно настоящему изобретению. В более предпочтительном варианте осуществления та же терминология относится к пептидам, имеющим менее 15 аминокислотных остатков в дополнение к пептиду согласно настоящему изобретению. В еще более предпочтительном варианте осуществления та же терминология относится к пептидам, имеющим менее 10 аминокислотных остатков в дополнение к пептиду согласно настоящему изобретению. Еще в одном предпочтительном варианте осуществления та же терминология относится к пептидам или полипептидам, имеющим менее 6 аминокислотных остатков в дополнение к одному из пептидов согласно настоящему изобретению. В другом предпочтительном варианте осуществления та же терминология относится к пептидам или полипептидам, имеющим менее 4 аминокислотных остатков в дополнение к одному из пептидов согласно настоящему изобретению. В наиболее предпочтительном варианте осуществления та же терминология относится к пептидам или полипептидам, имеющим менее 2 аминокислотных остатков в дополнение к одному из пептидов согласно настоящему изобретению.
Подробное описание
Пептиды легко могут быть синтезированы стандартными синтетическими способами из L-аминокислот, а также могут быть синтезированы методами генной инженерии с использованием нуклеиновых кислот, имеющих последовательности, кодирующие конкретные пептиды.
I Биологическая активность
Для исследования возможной биологической активности пептидов изучали иммунологическое действие пептидов на животной модели с помощью методик, соответствующих «Принципам доклинического исследования новых лекарственных средств», выпущенным Министерством Здравоохранения Народной республики Китай [1].
Для обнаружения какого-либо возможного влияния пептидов на специфическую клеточную иммунную функцию использовали тест трансформации Т-лимфоцитов, тест цитотоксической активности NK клеток и тест секреции Т-лимфоцитами IL-2 и IFN-γ. Тест очистки частицами угля использовали для обнаружения какого-либо возможного влияния пептидов на неспецифическую клеточную иммунную функцию. Гемолиз овечьих эритроцитов (SRBC) использовали для обнаружения какого-либо возможного влияния пептидов на гуморальную иммунную функцию. Тест со взвешиванием иммунного органа использовали для обнаружения какого-либо возможного влияния пептидов на органном уровне.
В таком исследовании группу, получающую физиологический раствор, использовали в качестве отрицательного контроля, тогда как группы, получающие IL-2 и IFN-γ, использовали в качестве положительных контролей, поскольку IL-2 и IFN-γ представляют собой хорошо известные иммуностимуляторы[10]. В таком исследовании использовали четыре произвольных концентрации образцов пептидов для того, чтобы перекрыть 1000-кратный диапазон дозировки. Из-за внутренней сложности иммунологического ответа in vivo и отсутствия предшествующих данных по ответной реакции в зависимости от дозировки в качестве положительной биологической активности рассматривали любое статистически значимое различие относительно отрицательного контроля в любой из групп дозировки.
Результаты данного исследования были следующими:
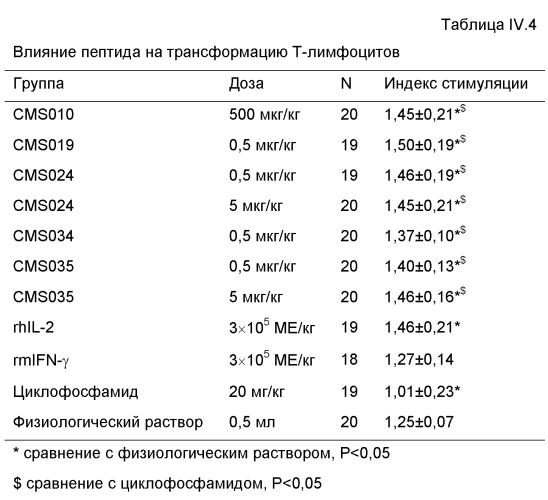
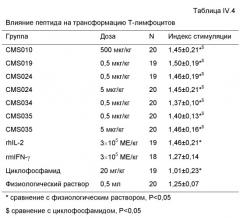
1. Установлено, что пептиды СМS001, СМS002, СМS003, СМS007, СМS008, СМS009, СМS010, СМS011, СМS012, СМS015, СМS019, СМS021, СМS029 и СМS034 способны усиливать трансформацию Т-лимфоцитов, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор. Также установлено, что пептиды СМS014 и СМS036 способны ингибировать трансформацию Т-лимфоцитов, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
2. Установлено, что пептиды СМS001, СМS002, СМS003, СМS008, СМS009, СМS010, СМS011, СМS012, СМS013, СМS015, СМS016, СМS020, СМS021, СМS022, СМS023, СМS024, СМS026, СМS027, СМS028, СМS029, СМS030, СМS032, СМS033, СМS034, СМS035 и СМS036 способны увеличивать цитотоксическую активность NK клеток, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор. Также установлено, что пептиды СМS008 и СМS012 в подходящей концентрации способны снижать цитотоксическую активность NK клеток, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
3. Установлено, что пептиды СМS001, СМS003, СМS007, СМS009, СМS010, СМS011, СМS012, СМS015, СМS020, СМS022 и СМS034 способны усиливать секрецию интерлейкина-2 (IL-2) Т-лимфоцитами, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
4. Установлено, что пептиды СМS001, СМS003, СМS009, СМS010, СМS011, СМS012, СМS013, СМS016, СМS021, СМS022 и СМS028 способны усиливать секрецию IFN Т-лимфоцитами, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
5. Установлено, что пептиды СМS001, СМS002, СМS003, СМS007, СМS008, СМS009, СМS010, СМS011, СМS012, СМS013, СМS014, СМS015, СМS016, СМS018, СМS019, СМS020, СМS021, СМS022, СМS023, СМS024, СМS026, СМS027, СМS028, СМS029, СМS030, СМS032, СМS033, СМS034, СМS035 и СМS036 способны усиливать синтез анти-SRBC антител при антигенной стимуляции, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор. Также установлено, что пептиды СМS002, СМS003, СМS009, СМS010, СМS011, СМS013, СМS014, СМS015, СМS018, СМS019, СМS020, СМS026, СМS028, СМS029, СМS030, СМS034 и СМS036 в подходящей концентрации способны ингибировать синтез анти-SRBC антител при антигенной стимуляции, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
6. Установлено, что пептиды СМS003, СМS008, СМS009, СМS010, СМS011, СМS013, СМS016, СМS018, СМS019, СМS020, СМS022, СМS024, СМS027, СМS030, СМS035, СМS036 способны усиливать фагоцитарную активность моноядерных фагоцитов, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
7. Установлено, что пептиды СМS001, СМS002, СМS008, СМS010, СМS012, СМS013, СМS014, СМS015, СМS016, СМS018, СМS019, СМS020, СМS021, СМS022, СМS023, СМS024, СМS026, СМS027, СМS028, СМS029, СМS030, СМS032, СМS033, СМS034, СМS035 и СМS036 способны увеличивать вес вилочковой железы, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
8. Установлено, что пептиды СМS019, СМS020 и СМS030 способны увеличивать вес селезенки, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор. Также было установлено, что пептиды СМS001, СМS003, СМS007, СМS008, СМS009, СМS010, СМS011, СМS013, СМS014, СМS015, СМS021, СМS023, СМS024, СМS027, СМS029 и СМS036 в подходящей концентрации способны снижать вес селезенки, проявляя статистически значимое различие при сравнении с нормальной контрольной группой, получающей физиологический раствор.
Ниже описаны материалы и методы, использованные для анализа влияния пептидов на мышах.
Материалы:
1. Экспериментальное животное
Мыши BALB/c, вес 18-22 г, 50% самок и 50% самцов, предоставлены Центром экспериментальных животных, Национальный Институт медицинских наук (National Institute of Medical Science), КНР.
2. Введение
Группа рекомбинантного мышиного IFN-γ (rmIFN-γ): 3×105 МЕ/кг/день
Группа рекомбинантного человеческого IL (rhIL)-2: 3×105 МЕ/кг/день
Группа физиологического раствора: 0,5 мл/каждый день
дозы пептида в I группе: 500 мкг/кг/день
дозы пептида во II группе: 50 мкг/кг/день
дозы пептида в III группе: 5 мкг/кг/день
дозы пептида в IV группе: 0,5 мкг/кг/день
Все вышеуказанные вещества растворяли в 0,5 мл физиологического раствора и вводили внутрибрюшинно (i.p.) непрерывно в течение 15 дней один раз в день.
3. Основные реагенты
Пептиды были произведены обычным образом American Peptide Company, Inc., США.
Фетальная телячья сыворотка и клеточная культуральная среда RPMI-1640 от Gibco, США.
MTT и ConA, Sigma, США
rmIFN-γ, Beijing Biotech Inc., Китай
rhIL-2, Shanghai Huaxin Biotech Inc., Китай
Раствор для отделения лимфоцитов, Научно-исследовательский институт Гематологических заболеваний, Национальный институт медицинских наук, КНР.
Вирус везикулярного стоматита (VSV), IFN-γ и IL-2 стандартные образцы, Национальный Институт контроля фармацевтических и биологических продуктов, КНР.
НТ-2 клетки и L929 клетки, дар Профессора WF Chen, факультет иммунологии Пекинского Университета, Beijing, КНР.
Метод
1. Влияние пептидов на клеточный иммунитет
1.1. Получение суспензии клеток селезенки [1, 2]
Мышей BALB/c случайным образом распределяли на группы пептида, IFN, IL-2 и физиологического раствора. Десять мышей на группу. Через день после последнего введения исследуемого вещества мышей убивали, смещая шейные позвонки. Селезенку удаляли в асептических условиях и вручную диспергировали в холодном растворе D-Hank с использованием иглы для инъекций. Диспергированную клеточную суспензию дополнительно пропускали через сито 100 калибра из нержавеющей стали диаметром 150 мкм. После центрифугирования при 200g в течение 10 минут супернатант (надосадочную жидкость) отбрасывали. Осадок клеток повторно суспендировали в 10 объемах буфера Tris-NH4Cl и затем оставляли на 10 минут при комнатной температуре. Суспендированные клетки собирали центрифугированием при 150g в течение 10 минут. Клетки промывали 2-4 раза холодным раствором D-Hank путем ресуспендирования и центрифугирования при описанных выше условиях. Промытые клетки затем разводили до желаемой плотности клеток с использованием культуральной среды RPMI-1640, содержащей 10% фетальной телячьей сыворотки.
1.2. Влияние пептидов на трансформацию Т-лимфоцитов
Клетки селезенки плотностью 1×106 мл помещали в 96-луночные планшеты для клеточных культур, 100 мкл/лунку, три параллельных лунки для каждого анализируемого образца и контрольный образец для каждой мыши. В анализируемые лунки добавляли 100 мкл/лунку ConA раствора 100 мкг/мл в RPMI-1640 и 100 мкл/лунку просто RPMI-1640 использовали для контроля. Клетки инкубировали в течение 66 часов при 37°С, 5% СО2. Клетки затем осаждали центрифугированием при 150g в течение 10 минут. Супернатант собирали и хранили при -20°С для определения цитокинов IL-2 и IFN.
50 мкл/лунку МТТ раствора 1 мг/мл в RPMI-1640 добавляли к осадку клеток и клетки повторно суспендировали встряхиванием в течение 2 минут. Инкубацию продолжали в течение 4 часов. Супернатант отбрасывали после центрифугирования при 150g в течение 10 минут. 120 мкл 40 мМ HCl в пропаноле-2 добавляли к осадку клеток и встряхивали в течение 3 минут для получения ОП570нм для каждой лунки, нормированной для 630 нм. Использовали ридер ELISA.
Расчеты
Для каждой мыши формировали три анализируемых лунки и три контрольных лунки. Индекс стимуляции (SI) для каждой мыши получали, первоначально получая среднюю ОП (оптическую плотность) для трех параллельных лунок, а затем деля значение для анализируемых лунок на значение для контрольных лунок.
1.3. Влияние пептидов на NK клеточную активность [3, 4]
Получали мышиные клетки селезенки плотностью 4×106 мл, как описано выше в разделе 1.1. Клетки-мишени YAC-1 брали в логарифмической фазе и доводили до 1×105 мл. С использованием 96-луночных планшетов для культур клеток 100 мкл клеток мышиной селезенки и 100 мкл культуральной среды добавляли в контрольную лунку, содержащую только клетки селезенки; 100 мкл клеток-мишеней и 100 мкл культуральной среды добавляли в контрольную лунку, содержащую только клетки-мишени; 100 мкл клеток мышиной селезенки и 100 мкл клеток-мишеней добавляли в лунки для анализа NK активности. Готовили три параллельных серии вышеуказанных лунок на мышь.
Образцы центрифугировали при 150g в течение 10 минут для того, чтобы собрать клетки. Супернатант отбрасывали и добавляли 50 мкл/лунку МТТ раствора 1 мг/мл. Реакционную смесь затем встряхивали в течение 2 минут и инкубировали при 37°С, 5% СО2 в течение 4 часов. Супернатант отбрасывали после центрифугирования при 150g в течение 10 минут. Добавляли 120 мкл 40 мМ HCl в пропаноле-2 и встряхивали в течение 3 минут. Ридер ЕLISA использовали для получения ОП570нм для каждой лунки, нормированной для 630 нм.
Расчеты
Для каждой мыши имелось 9 лунок: три лунки с клетками селезенки - только контроль, три с клетками-мишенями - только контроль, и три анализируемых лунки как с клетками селезенки, так и с клетками-мишенями. Индекс NK клеточной активности для каждой мыши получали, первоначально получая среднюю ОП для трех параллельных лунок каждой комбинации, затем используя такую среднюю ОП в следующей формуле:
Индекс активности NK клеток = [1-(средняя ОП лунки с клетками селезенки и клетками-мишенями - средняя ОП лунки только с клетками селезенки) + (средняя ОП лунки только с клетками-мишенями)]×100%.
1.4. Влияние пептидов на активность Т-лимфоцитов при секретировании IL-2 [5].
НТ-2 клетки в логарифмической фазе собирали центрифугированием при 150g в течение 10 минут и промывали три раза холодным раствором Хенка с помощью повторного суспендирования и центрифугирования. Собранные НТ-2 клетки повторно суспендировали в RPMI-1640 и инкубировали при 37°С, 5% СО2 в течение 30 минут. Клетки дополнительно промывали дважды RPMI-1640 с помощью повторного суспендирования и центрифугирования и ресуспендировали до конечной концентрации 2×105/мл в среде RPMI-1640.
Полученный в разделе 1.2 супернатант разводили средой RPMI-1640 до следующих процентных концентраций: 100%, 50%, 25%, 12,5%, 6,25% и 3,125%.
rIL-2 разводили средой RPMI-1640 до следующих концентраций: 500 МЕ/мл, 250 МЕ/мл, 125 МЕ/мл, 62,5 МЕ/мл, 31,25 МЕ/мл и 15,5 МЕ/мл.
В 96-луночном планшете для клеточных культур использовали три параллельные лунки для комбинации:
отрицательный контроль: 100 мкл RPMI-1640 + 100 мкл суспензии НТ-2 клеток;
rIL-2 стандарт: 100 мкл раствора rIL-2 + 100 мкл суспензии НТ-2 клеток;
анализируемая лунка: 100 мкл разведенного супернатанта + 100 мкл суспензии НТ-2 клеток.
Планшет инкубировали при 37°С, 5% СО2 в течение 68 часов, затем центрифугировали при 150g в течение 15 минут и супернатант удаляли. В каждую лунку добавляли 100 мкл 0,5 мг/мл МТТ в RPMI-1640 без фенолсульфонафталина. После встряхивания в течение 3-4 минут для ресуспендирования клеток продолжали инкубирование дополнительно в течение 4 часов. Затем образцы центрифугировали при 150g в течение 15 минут и супернатант удаляли. В каждую лунку добавляли 120 мкл 40 мМ HCl в 2-пропаноле, перемешивали в течение 3-4 минут и с использованием планшетного ридера ELISA анализировали ОП при 570 нм, нормированную для 630 нм.
Расчет
Брали среднее значение ОП для трех параллельных лунок для каждого разведения и строили график относительно концентрации на полулогарифмической шкале, откладывая концентрацию по оси х. Получали значение концентрации при 50% насыщении ОП как для тестируемого супернатанта, так и для rIL-2.
IL-2 активность образца = (разведение образца при 50% максимальной активности ÷стандартное разведение rIL-2 при 50% максимальной активности)× активность rIL-2 стандарта при 50% максимальной активности (МЕ/мл).
1.5. Влияние пептидов на активность Т-лимфоцитов при секретировании интерферона (IFN) [6]
Супернатант, полученный в разделе 1.2, разводили культуральной средой RPMI-1640 до следующих процентных концентраций: 100%, 50%, 25%, 12,5%, 6,25% и 3,125%.
Стандарт рекомбинантного интерферона (rIFN) разводили средой RPMI-1640 до следующих концентраций: 500 МЕ/мл, 250 МЕ/мл, 125 МЕ/мл, 62,5 МЕ/мл, 31,25 МЕ/мл и 15,5 МЕ/мл.
Клетки-мишени L929 в логарифмической фазе доводили до концентрации 2×105/мл средой RPMI-1640 при такой же обработке, как описано в разделе 1.4 для клеток НТ-2. Исходный VSV также доводили до 100 TCID50 средой RPMI-1640.
В 96-луночном планшете для клеточных культур использовали три параллельные лунки для комбинации:
отрицательный контроль: 150 мкл RPMI-1640 + 100 мкл L929;
лунка по