Амидоацетонитрильные производные, содержащие их фармацевтические композиции и их применение в изготовлении лекарственного средства
Иллюстрации
Показать всеНастоящее изобретение относится к соединениям формулы (I) или таутомеру или пролекарству, или фармацевтически приемлемой соли указанного соединения, таутомера или пролекарства, где каждый из R1, R2, R3, R4 и R5 независимо выбран из Н, галогено, CN, СF3 и CONH2; к композициям, содержащим такие соединения, и применениям таких соединений в качестве противопаразитарных агентов. 3 н. и 8 з.п. ф-лы.
Реферат
Предшествующий уровень техники
Настоящее изобретение относится к производным пентафтортиобензамидацетонитрила. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и к их применению для лечения паразитарных инвазий.
Существует постоянная потребность в обеспечении новых агентов для борьбы с паразитарными инвазиями, представляющими угрозу для здоровья людей и животных. В частности, необходимы новые агенты для борьбы с эндопаразитарными инвазиями у крупного рогатого скота вследствие увеличивающегося распространения паразитов и особенно нематод, которые устойчивы ко многим агентам, одобренным в настоящее время для этого показания.
В заявке на европейский патент ЕР-0953565-А2 (Ninon Nohyaku Co. Ltd.) описан класс производных амидоацетонитрила и сообщается, что эти соединения обладают инсектицидными свойствами. В международной заявке WO-2002/060257-A1 (Novartis AG) указано, что этот же класс активен против таких эндопаразитов, как гельминты. Родственные классы и подклассы обсуждаются в WO-2002/049641-A2 (Novartis), WO-2002/050052-A1 (Syngenta), WO-2005/044784-A1 (Novartis), WO-2005/121075-А1 (Novartis) и WO-2006/043654 (Nihon). Механизм действия этих агентов до сих пор полностью не объяснен.
Сохраняется потребность в дополнительных соединениях в качестве альтернативных или улучшенных терапевтических агентов. Предпочтительные соединения должны быть эффективными паразитицидными агентами, в то же время иметь небольшую токсичность или не иметь токсичности для животного-хозяина и должны находиться в физической форме, которая является стабильной, негигроскопичной и легко приготавливается в виде препарата. Они должны иметь высокую биодоступность, быть метаболически стабильными и иметь полезные фармакокинетические свойства. В случае предназначения для применения у домашнего скота данные соединения должны быть очищены таким образом, чтобы уменьшить время удерживания без риска для пищевой цепи.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте, в настоящем изобретении предложено соединение формулы или его таутомер или пролекарство, или фармацевтически приемлемая соль указанного соединения, таутомера или пролекарства, где:
каждый из R1, R2, R3, R4 и R5 независимо выбран из Н, галогено, CN, CF3 и CONH2.
В другом аспекте в настоящем изобретении предложено соединение формулы (I) или его таутомер или пролекарство, или фармацевтически приемлемая соль указанного соединения, таутомера или пролекарства для применения в качестве лекарственного средства.
В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его таутомера или пролекарства, или фармацевтически приемлемой соли указанного соединения, таутомера или пролекарства для изготовления лекарственного средства для лечения паразитарной инвазии животного-хозяина.
В другом аспекте в настоящем изобретении предложен способ лечения паразитарной инвазии у животного-хозяина, включающий лечение животного-хозяина эффективным количеством соединения формулы (I) или его таутомера или пролекарства, или фармацевтически приемлемой соли указанного соединения, таутомера или пролекарства.
В другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или его таутомер или пролекарство, или фармацевтически приемлемую соль указанного соединения, таутомера или пролекарства и фармацевтически приемлемый носитель.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для целей настоящего документа используют следующие определения:
"Галогено" включает фторо, хлоро, бромо или йодо.
Используемый в данном описании термин "фармацевтически приемлемый", например, в отношении солей и сольватов, включает "ветеринарно приемлемый" и "сельскохозяйственно приемлемый".
Соединения формулы (I) имеют ассиметрический атом углерода (хиральный центр), обозначенный 1* в структурной формуле, приведенной ниже. Соответственно, соединения формулы (I) могут существовать в виде оптических изомеров. Настоящее изобретение включает индивидуальные энантиомеры соединений формулы (I) и их смеси, включая рацематы.
Некоторые соединения формулы (I) могут существовать в виде геометрических изомеров. Настоящее изобретение охватывает такие соединения в цис(Z)- или транс(Е)-форме, а также смеси этих геометрических изомеров.
Некоторые соединения формулы (I) могут существовать более чем в одной таутомерной форме. Настоящее изобретение охватывает все такие таутомеры, а также их смеси.
Настоящее изобретение включает все фармацевтически приемлемые, меченные изотопами соединения формулы (I), где один или более атомов замещены атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, преобладающих в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, например 2H и 3H, углерода, например 11С, 13С и 14С, хлора, например 36Cl, фтора, например 18F, йода, например 123I и 125I, азота, например 13N и 15N, кислорода, например 15О, 17О и 18О, и серы, например 35S.
Некоторые меченные изотопами соединения формулы (I), например соединения, включающие радиоактивный изотоп, используются в исследованиях распределения в тканях лекарственного средства и/или субстрата. Радиоактивные изотопы тритий, т.е. 3H, и углерод-14, т.е. 14С, особенно полезны для этой цели с точки зрения легкости их включения и быстрого способа детекции.
Замещение более тяжелыми изотопами, таким как дейтерий, т.е. 2H, может дать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например увеличенный период полувыведения in vivo или уменьшенные требования к дозировкам, и поэтому может быть более предпочтительным в некоторых обстоятельствах.
Замещение позитрон-излучающими изотопами, например 11С, 18F, 15O и 13N, может быть полезным в исследованиях "оккупации" рецепторов субстратом с использованием позитронно-эмиссионной томографии (ПЭТ).
Меченые изотопами соединения формулы (I) могут быть получены, как правило, стандартными способами, известными специалистам в данной области, или способами, аналогичными способам, раскрытым в сопровождающих Примерах и Подготовительных примерах, с использованием соответствующего меченного изотопом реагента вместо немеченного реагента, используемого ранее.
Некоторые соединения формулы (I), которые имеют основную функциональную группу, способны образовывать соли присоединения кислот. Некоторые соединения формулы (I), имеющие кислотную функциональную группу, способны образовывать соли с подходящими основаниями. Такие соли включены в объем настоящего изобретения в той степени, в которой они являются приемлемыми для ветеринарного или фармацевтического применения.
Подходящие соли присоединения кислот образуются из кислот, которые образуют нетоксичные соли. Примеры включают соли ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, цикламат, эдизилат, формиат, фумарат, глуцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат.
Подходящие соли присоединения оснований образуются из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглюмина, оламина, калия, натрия, трометамина и цинка.
Также могут быть получены полусоли кислот и оснований, например гемисульфатные и гемикальциевые соли.
Обзор подходящих солей см. в Handbook of Pharmaceutical Salts: Properties. Selection, and Use (Stahl and Wermuth, Wiley-VCH, 2002).
Фармацевтически приемлемые соли соединений формулы (I) могут быть получены одним или более чем одним из трех способов:
(1) путем взаимодействия соединения формулы (I) с желаемой кислотой или основанием;
(2) путем удаления кислотной или основной подвижной защитной группы из подходящего предшественника соединения формулы (I) или путем раскрытия цикла подходящего циклического предшественника, например лактона или лактама, с использованием желаемой кислоты или основания; или
(3) путем превращения одной соли соединения формулы (I) в другую путем взаимодействия с подходящей кислотой или основанием или с помощью подходящей ионообменной колонки.
Все три реакции обычно проводят в растворе. Полученную соль можно осадить и собрать фильтрацией или можно извлечь при выпаривании растворителя.
Соединения формулы (I) и их соли могут существовать в различных твердых формах, варьирующих от полностью аморфных до полностью кристаллических. Термин "аморфный" относится к состоянию, в котором вещество не имеет дальнего порядка на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого тела или жидкости. Обычно такие вещества не дают характерных картин дифракции рентгеновских лучей и, хотя демонстрируют свойства твердого тела, более формально описываются как жидкость. При нагревании наблюдается изменение свойств от твердого тела к жидкости, которое характеризуется изменением состояния, обычно второго порядка ("стеклование"). Термин "кристаллический" относится к твердой фазе, в которой вещество имеет регулярную упорядоченную внутреннюю структуру на молекулярном уровне и дает характерную картину дифракции рентгеновских лучей с определенными пиками. Такие вещества при сильном нагревании будут демонстрировать также свойства жидкости, но изменение от твердого к жидкому состоянию характеризуется фазовым переходом, обычно первого порядка ("точка плавления").
Соединения формулы (I) и их соли могут существовать в несольватированной и сольватированной формах. Термин "сольват" используют в данной заявке для описания молекулярного комплекса, включающего соединение по изобретению и одну или более фармацевтически приемлемых молекул растворителя, например этанола. Термин "гидрат" используют, когда указанный растворитель представляет собой воду.
В настоящее время общепризнанной является система классификации органических гидратов, определяющая изолированные по месту, канальные или координированные ионами металлов гидраты - см. в Polymorphism in Pharmaceutical Solids (К.R.Morris; Ed. H.G.Brittain, Marcel Dekker, 1995). Изолированные по месту гидраты представляют собой гидраты, в которых молекулы воды изолированы от прямого контакта друг с другом с помощью промежуточных органических молекул. В канальных гидратах молекулы воды находятся в каналах пространственной решетки, где они граничат с другими молекулами воды. В гидратах, координированных ионами металлов, молекулы воды связаны с ионом металла.
Когда растворитель или вода прочно связаны, комплекс будет иметь хорошо определимую стехиометрию, не зависящую от влажности. Однако, когда растворитель или вода слабо связаны, как, например, в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от условий влажности или сухости. В таких случаях нормой будет нестехиометрия.
Фармацевтически приемлемые сольваты согласно изобретению включают сольваты, в которых растворитель кристаллизации может быть изотопно замещен, например D2O, d6-ацетон, d6-ДМСО.
В объем изобретения также включены многокомпонентные комплексы (отличные от солей и сольватов), в которых лекарственное средство и по меньшей мере один другой компонент присутствуют в стехиометрических или нестехиометрических количествах. Комплексы этого типа включают клатраты (соединения включения лекарственного средства в "хозяина") и сокристаллы. Последние обычно определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны друг с другом нековалентными взаимодействиями, но могут представлять собой также комплекс нейтральной молекулы с солью. Сокристаллы могут быть получены кристаллизацией из расплава или перекристаллизацией из растворителей или физическим измельчением компонентов друг с другом - см. в Chem Commun, 17, 1889-1896 (О.Almarsson и М.J.Zaworotko (2004). Общий обзор многокомпонентых комплексов см. в J Pharm Sci, 64 (8), 1269-1288, by Haleblian (August 1975).
Соединения формулы (I) и их соли также могут существовать в мезоморфном состоянии (мезофаза или жидкий кристалл), когда находятся в подходящих условиях. Мезоморфное состояние является промежуточным между истинным кристаллическим состоянием и истинным жидким состоянием (либо расплав, либо раствор). Мезоморфизм, возникающий в результате изменения температуры, описан как "термотропный", и мезоморфизм, происходящий в результате добавления второго компонента, такого как вода или другой растворитель, описан как "лиотропный". Соединения, которые способны образовывать лиотропные мезофазы, называются "амфифильными" и состоят из молекул, которые имеют ионную (например -COO-Na+, -COO-K+ или -SO3 -Na+) или неионную (например -N-N+(CH3)3) полярную концевую группу. Дополнительную информацию см. в Crystals and the Polarizing Microscope by N.H.Hartshorne and A.Stuart, 4th Edition (Edward Arnold, 1970).
В дальнейшем все ссылки на соединения формулы (I) включают ссылки на их соли, сольваты, многокомпонентные комплексы и жидкие кристаллы, и на сольваты, многокомпонентные комплексы и жидкие кристалы их солей.
В предпочтительном воплощении соединений формулы (I) каждый из R1, R2, R3, R4 и R5 независимо выбран из H, F, Cl, Br, CN и CF3. Более предпочтительно, по меньшей мере один из R1, R2, R3, R4 и R5 представляет собой CN и по меньшей мере два из R1, R2, R3, R4 и R5 представляют собой H. Еще более предпочтительно, R1 и R4 представляет собой H, один из R2 и R3 представляет собой H, а другой представляет собой CN, и R5 выбран из F, Cl, Br и CF3.
В другом предпочтительном воплощении соединений формулы (I) каждый из R1, R4 и R5 независимо выбран из H, галогено и CF3, и один из R2 и R3 представляет собой CN, а другой выбран из Н и CN.
В другом предпочтительном воплощении соединений формулы (I) каждый из R1 и R4 представляет собой Н, и R5 выбран из Cl, Br и CF3.
В другом предпочтительном воплощении соединений формулы (I) каждый из R1, R2, R3, R4 и R5 независимо выбран из Н, CN и CF3.
В другом предпочтительном воплощении соединений формулы (I) каждый из R1, R2 и R4 представляет собой Н.
В другом предпочтительном воплощении соединений формулы (I) R3 представляет собой CN.
В другом предпочтительном воплощении соединений формулы (I) R5 представляет собой CF3.
Особенно предпочтительные соединения формулы (I) включают:
N-{1-циано-2-[5-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-{(1R)-1-циано-2-[5-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-{(1S)-1-циано-2-[5-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-[2-(2-хлор-5-цианофенокси)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-[2-(2-хлор-5-цианофенокси)-(1R)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-[2-(2-хлор-5-цианофенокси)-(1S)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-{1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-{(1R)-1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-{(1S)-1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил}-4-пентафтортиобензамид,
N-{2-[2-хлор-5-циано-3-(трифторметил)фенокси]-1-циано-1-метилэтил}-4-пентафтортиобензамид,
N-{2-[2-хлор-5-циано-3-(трифторметил)фенокси]-(1R)-1-циано-1-метилэтил}-4-пентафтортиобензамид,
N-{2-[2-хлор-5-циано-3-(трифторметил)фенокси]-(1S)-1-циано-1-метилэтил}-4-пентафтортиобензамид,
N-[2-(2-хлор-4,5-дицианофенокси)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-[2-(2-хлор-4,5-дицианофенокси)-(1R)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-[2-(2-хлор-4,5-дицианофенокси)-(1S)-1-циано-1-метилэтил]-4-пентафтортиобензамид,
N-(1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил]-4-пентафтортиобензамид,
N-{(1R)-1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил]-4-пентафтортиобензамид, и
N-{(1S)-1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил]-4-пентафтортиобензамид,
и их фармацевтически приемлемые соли.
Еще одним предпочтительным соединением формулы (I) является:
N-{(1S)-1-циано-2-[4-циано-2-(трифторметил)фенокси]-1-метилэтил]-4-пентафтортиобензамид и его фармацевтически приемлемые соли.
В другом аспекте в настоящем изобретении предложены способы получения соединения формулы (I) или его фармацевтически, ветеринарно или сельскохозяйственно приемлемой соли, или фармацевтически, ветеринарно или сельскохозяйственно приемлемого сольвата (включая гидрат) любого объекта, как показано ниже.
Специалистам в данной области будет очевидно, что чувствительные функциональные группы следует защищать и снимать с них защиту во время синтеза соединения по изобретению. Этого можно достичь общепринятыми способами, например, как описано в "Protective Groups in Organic Synthesis" by TW Greene and PGM Wuts, John Wiley & Sons Inc (1999) и в приведенных в данной заявке ссылках.
Последующие способы являются иллюстрацией общих методик синтеза, которые могут быть адаптированы с целью получения соединений по изобретению.
Когда один или более из R1, R2, R3, R4 или R5 содержат реакционноспособные функциональные группы, тогда дополнительную защиту можно обеспечить согласно стандартным способам во время синтеза соединений формулы (I). В способах, описанных ниже, для всех синтетических предшественников, используемых в синтезе соединений формулы (I), определения R1, R2, R3, R4 и R5, где R1, R2, R3, R4 и R5 являются такими, как определено для формулы (I), предназначены для возможного включения подходящих защищенных вариантов Р1, Р2 Р3, Р4 и Р5. Такие подходящие защитные группы для этих функциональных групп описаны в ссылках, приведенных в данной заявке, и применение этих защитных групп, при необходимости, находится в пределах способов, описанных в настоящем изобретении для получения соединений формулы (I) и их предшественников. Когда используют соответствующие защитные группы, их необходимо затем удалить, чтобы получить соединения формулы (I). Снятие защиты можно осуществить согласно стандартным методикам, включая методики, описанные в ссылках, указанных в данной заявке.
1. Синтез соединений формулы (I)
1.1 Образование амидной связи
Соединения формулы (I), где R1, R2, R3, R4 и R5 являются такими, как определено для формулы (I), можно синтезировать путем сочетания аминонитрилов формулы (II), где R1, R2, R3, R4 и R5 являются такими, как определено для формулы (I), с кислотой формулы (III) или соответствующим образом активированными производными кислот, такими как ацилгалогениды, сложные эфиры или ангидриды.
Специалистам в данной области будет понятно, что многие стандартные условия реакций, известные в литературе, могут быть использованы для образования таких амидов, некоторые из них обсуждаются в "Amide bond formation and peptide coupling" C.A.G.N.Montalbetti and V.Falque, Tetrahedron, 2005, 61, 10827-10852.
Например, аминонитрилы формулы (II) могут быть подвергнуты взаимодействию с хлорангидридом формулы (IV) в диполярном апротонном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как диизопропилэтиламин, при пониженной температуре, обычно 0°С, в течение 2-24 часов. Альтернативно, кислота формулы (III) может быть подвергнута взаимодействию с аминонитрилами формулы (II) в полярном растворителе, таком как N,N-диметилформамид, в присутствии O-(этоксикарбонил)цианометиленамино)-N,N,N',N'-тетраметилурония тетрафторбората, и в присутствии основания, такого как диизопропилэтиламин, при пониженной температуре, обычно 0°С, в течение 2-24 часов, в инертной атмосфере.
1.2 Нуклеофильное замещение арилгалогенидов
Соединения формулы (I), где R1, R2, R3, R4 и R5 являются такими, как определено для формулы (I), также можно синтезировать путем взаимодействия спирта формулы (V) с арилгалогенидами формулы (VI), где R1, R2, R3, R4 и R5 являются такими, как определено для формулы (I), и Hal означает фторо или хлоро, предпочтительно фторо.
Например, трет-бутоксид калия добавляют при низкой температуре, обычно 0°С, к раствору соединения формулы (V) и соединений формулы (VI) в диполярном апротонном растворителе, таком как тетрагидрофуран, взаимодействием при комнатной температуре в течение длительного периода времени, обычно 16-24 часов, возможно в атмосфере азота. Альтернативно, трет-бутоксид калия добавляют при комнатной температуре к раствору соединений формулы (V) и соединениям формулы (VI) в диполярном апротонном растворителе, таком как тетрагидрофуран, с последующим взаимодействием при температуре в диапазане 55°С-75°С, обычно 65°С, в течение длительного периода времени, обычно 16-24 часов, возможно в атмосфере азота. Другие основания, такие как гидрид натрия, могут быть использованы в подходящих растворителях, обычно N,N-диметилформамиде, возможно в инертной атмосфере. Альтернативно, трет-бутоксид калия в тетрагидрофуране добавляют к раствору соединения формулы (V) и соединений формулы (VI) в диметилсульфоксиде с последующим взаимодействием при комнатной температуре в течение продолжительного периода времени, обычно 16-24 часов, возможно в атмосфере азота. Когда используют некоторые арилфториды формулы (VI), где Hal означает фторо, для этого взаимодействия требуется безводный диметилсульфоксид.
Индивидуальные энантиомеры спирта формулы (V) могут быть получены из рацематов с помощью хиральной ВЭЖХ с использованием известные из литературы стандартных условий хроматографии. Например, используя смеси метанол/этанол/гексан в качестве элюентов на 500 мм × 50 мм ID Chiralcel AD-H 5 мкм со скоростью потока 50 мл/мин. Эти энантиомеры формулы (V) также могут быть использованы в реакции нуклеофильного замещения с получением индивидуальных энантиомеров соединений формулы (I).
Для этой реакции, в случае использования соединений формулы (VI), где Hal означает фтор, и один или более из R1, R2, R3, R4 или R5 также представляют собой фтор, каждый индивидуальный атом фтора подвержен замещению с получением смеси региоизомеров.
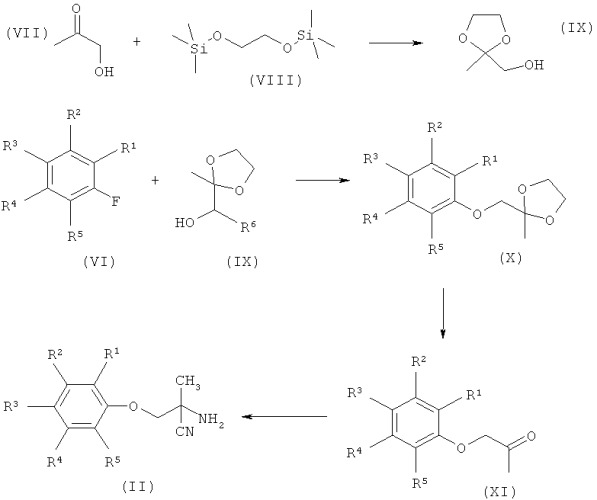
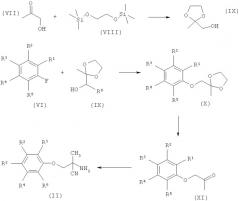
1.3 Синтез аминонитрилов формулы (II)
Схема А
Соединения формулы (II), где R1, R2, R3, R4 или R5 являются такими, как определено для формулы (I), можно синтезировать, как показано на Схеме А.
Гидроксиацетон формулы (VII) может быть защищен как этиленкеталь формулы (IX) путем взаимодействия с 1,2-бис(триметилсилилокси)этаном, соединением формулы (VIII), и триметилсилилтрифторметансульфонатом в безводном диполярном апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 10-30 часов, обычно 18 часов. Соединения формулы (X), где R1, R2, R3, R4 или R5 являются такими, как определено для формулы (I), можно синтезировать путем взаимодействия этиленкеталя формулы (IX) с арилфторидами формулы (VI). Например, трет-бутоксид калия добавляют при низкой температуре, обычно 0°С, к раствору соединений формулы (IX) и соединений формулы (VI) в диполярном апротонном растворе, таком как тетрагидрофуран, с последующим взаимодействием при комнатной температуре в течение длительного периода времени, обычно 16-24 часов, возможно в атмосфере азота. Можно снять защиту с кеталей формулы (X) с получением феноксикетонов формулы (XI) путем нагревания с обратным холодильником в ацетоне в присутствии кислотного катализатора, такого как 2 М соляная кислота, в течение периодов времени, варьирующих от 15 до 30 часов, обычно 20 часов. Аминонитрилы формулы (II) могут быть получены из кетонов формулы (XI) с использованием известных из литературы стандартных условий синтеза Штрекера. Например, кетоны формулы (XI) могут быть подвергнуты взаимодействию с хлоридом аммония в метанольном аммиаке при комнатной температуре в течение 15-45 минут с последующим добавлением цианида натрия и продолжением взаимодействия при комнатной температуре в течение 15-70 часов.
Аминонитрилы формулы (II), где R1, R2, R3, R4 или R5 являются такими, как определено для формулы (I), имеют один альфа-стереоцентр в нитриле, при условии что R1, R2, R3, R4 или R5 не имеют стереоцентров. Такие соединения могут быть получены стереохимически чистыми с использованием множества известных из литературы ассиметричных синтезов Штрекера. Некоторые из этих методик описаны в Org. Letters, 2000, 2, 6, 867-870; Tetrahedron - Asymmetry 2001, 12, 1147-1150; J. Amer. Chem. Soc. 2003,125,5634-5635; J. Amer. Chem. Soc, 1998, 120, 5315-5316; Tetrahedron Leters, 1996, 37, 33, 5839-5840; и Org. Letters, 2004, 5, 26, 5027-5029.
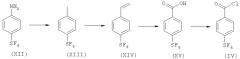
1.4 Хлоридангидрид формулы (IV)
4-Пентафтортиобензоилхлорид может быть получен согласно Схеме В.
Схема В
1-Йод-4-(пентафтортио)бензол, соединение формулы (XIII), может быть получено путем взаимодействия диазониевой соли, образованной путем взаимодействия 4-(пентафтортио)анилина с нитритом натрия в водной соляной кислоте, с йодидом калия. Диазониевая соль предпочтительно образуется при 0°С; последующее кодирование может происходить при комнатной температуре в течение периода времени 18-60 часов. Алкен формулы (XIV) может быть получен путем взаимодействия йодированного соединения формулы (XIII) с трибутил(винил)оловом с использованием катализатора тетракис(трифенилфосфин)палладия(0) в полярном растворителе, таком как N,N-диметилформамид, при 100°С, в атмосфере азота, в течение 1-5 часов, обычно 1,5 часа. Кислота формулы (XV) может быть получена путем окисления алкена формулы (XIV) с использованием, например, периодата натрия в смеси растворителей ацетонитрил/тетрахлорид углерода/вода в присутствии катализатора гидрата хлорида рутения(III), в инертной атмосфере, при комнатной температуре в течение 1-20 часов. Хлорангидрид формулы (IV) может быть получен из кислоты формулы (XV) с использованием способов, хорошо известных специалистам в данной области. Обычно нагреванием с избытком тионилхлорида при 65°С в течение 2-4 часов.
Кислота формулы (XV) может быть получена непосредственно из соединения формулы (XIII) путем взаимодействия двуокиси углерода с металлорганическими соединениями, образующимися из (XIII); например с использованием изопропилхлорида магния в безводном апротонном растворителе, таком кактетрагидрофуран.
Соединения формулы (XV) и (IV) могут быть также приобретены коммерческим путем.
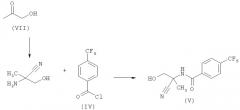
1.5 Синтез амидоспирта формулы (V)
Схема С
Амидоспирт формулы (V) может быть получен, как показано на Схеме С.
Аминонитрил формулы (XVI) может быть получен из гидроксилацетона формулы (VII) с использованием известных из литературы стандартных условий синтеза Штрекера. Например, гидроксилацетон может быть подвергнут взаимодействию с хлоридом аммония в метанольном аммиаке при комнатной температуре в течение 15-45 минут с последующим добавлением цианида натрия и продолжением взаимодействия при комнатной температуре в течение 15-25 часов. Амид формулы (V) может быть получен путем взаимодействия хлорангидрида формулы (IV) с аминонитрилом формулы (XVI). Например, аминонитрил формулы (XVI) может быть подвергнут взаимодействию с хлорангидридами формулы (IV), где R7, R8, R9, R10 и R11, в диполярном апротонном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как диизопропилэтиламин, при низкой температуре, обычно 0°С, в течение 2-24 часов.
1.6 Арилгалогениды формулы (VI)
Большинство арилгалогенидов формулы (VI) имеются в продаже или могут быть получены стандартными способами, известными специалистам в данной области из литературы. Следующие примеры демонстрируют некоторые успешные синтетические превращения и не представляют собой исчерпывающий перечень.
4-Циано-2-фторбензамид может быть получен путем аммонолиза 4-циано-2-фторбензойной кислоты с использованием водного гидроксида аммония (35%) в подходящем растворителе, таком как ацетонитрил, в присутствии 1,1'-дикарбонилдиимидазола. 2-Фтортерефталонитрил может быть получен из 4-циано-2-фторбензамида путем взаимодействия с хлоридом палладия(II) в подходящем растворителе, таком как ацетонитрил, при температурах в диапазоне 30°-60°С, обычно 50°С, в течение 15-30 часов, обычно 24 часов. 4-Фторизофталонитрил может быть получен из 2-фтор-5-формилбензонитрила путем взаимодействия с гидроксиламин-O-сульфокислотой в водном растворе при 50°С в течение нескольких часов, обычно 5 часов.
Схема D
На схеме D показано получение 4-хлор-3-фтор-5-(трифторметил)бензонитрила, соединения (XX). Соединение (XVIII) может быть получено путем бромирования 2-амино-3-фторбензотрифторида с использованием N-бромсукцинимида в подходящем растворителе, таком как ацетонитриле, в присутствии хлорида железа(III). Нитрил (XIX) может быть получен из соединения (XVIII) путем взаимодействия с цианидом натрия в подходящем растворителе, таком как 1-метил-2-пирролидинон, в присутствии бромида никеля(II) путем нагревания в микроволновой печи (типичная модель СЕМ 300W) при 160°С в течение нескольких часов, обычно 6 часов. Соединение (XIX) можно превратить в соединение (XX) в стандартных условиях Зандмейера с использованием трет-бутилнитрита и хлорида меди(I).
Метил-5-циано-2-фторбензоат может быть получен из 3-бром-4-фторбензонитрила путем нагревания в метаноле при 60°С, в атмосфере окиси углерода в присутствии основания, такого как триэтиламин, и подходящего катализатора, обычно [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II).
2. Взаимопревращения функциональных групп
Заместители R1, R2, R3, R4 и R5, которые являются такими, как определено для соединений формулы (I), в соединениях формулы (I) или соединениях формулы (V) можно превращать, где это возможно химически, в другие заместители R1, R2, R3, R4 и R5, как определено для соединений формулы (I).
Соединения формулы (I), где один из R1, R2, R3, R4 и R5 означает -C(O)NH2, могут быть получены из соответствующих соединений формулы (XXI), где один из R1, R2, R3, R4 и R5 означает -С(O)ОН, с использованием стандартных способов, известных из литературы. Специалистам в данной области будет понятно, что для осуществления такого образования амида можно использовать многие стандартные реакции, известные из литературы; некоторые из них обсуждаются в "Amide bond formation and peptide coupling" C.A.G.N.Montalbetti and V.Falque, Tetrahedron, 2005, 61, 10827-10852.
Кислоты формулы (XXI), где один из R1, R2, R3, R4, R5 означает С(O)ОН, а другие из R1, R2, R3, R4, и R5 являются такими, как определено для соединений формулы (I), могут быть получены из соответствующих сложных алкиловых эфиров путем взаимодействия с моногидратом гидроксида лития в смеси тетрагидрофуран:вода (1:1) при комнатной температуре в течение ночи. Кислоты могут быть превращены в сложные метиловые эфиры путем взаимодействия с диазометаном или (триметилсилил)диазометаном.
Сложные алкиловые эфиры формулы (XXI), где один из R1, R2, R3, R4 и R5 означает -С(O)O-алкил, могут быть получены из соответствующих бром-содержащих соединений путем Pd-катализируемого карбонилирования с использованием окиси углерода в присутствии спирта в растворителе, таком как N,N-диметилформамид. Эти сложные эфиры можно превращать непосредственно в амиды с использованием описанных в литературе способов, хорошо известных специалистам в данной области.
Эти бром-содержащие соединения также можно подвергать различным реакциям металлорганического сочетания. Для этих реакций другие чувствительные функциональные группы в другом месте молекулы нуждаются в соответствующей защите. Например, литирование с использованием бутиллития в апротонных растворителях, таких как тетрагидрофуран, в инертной атмосфере, дает промежуточные соединения ариллития, которые могут быть подвергнуты взаимодействию со сложными эфирами хлорформиатов, с получением соединений формулы (I) или соединений формулы (V), где один из R1, R2, R3, R4 и R5 означает -СООМе.
Также специалистам в данной области будет понятно, что в пределах некоторых описанных способов порядок выполнения стадий синтеза может различаться и будет зависеть, помимо прочего, от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, доступности ключевых промежуточных соединений и выбранной стратегии защиты групп (если она есть). Очевидно, что такие факторы также будут влиять на выбор реагента для использования на указанных стадиях синтеза.
Специалистам в данной области будет понятно, что соединения по изобретению могут быть получены способами, отличными от описанных в данной заявке, путем адаптации описанных в данной заявке способов и/или адаптации способов, известных в данной области, например, области техники, описанной в данной заявке, или с использованием стандартных руководств, таких как "Comprehensive Organic Transformations - A Guide to Functional Group Transformations", RC Larock, Wiley-VCH (1999 или более поздние издания).
Следует понимать, что упомянутые в данной заявке способы синтетической транформации являются только примерами и их можно осуществлять во многих различных последовательностях с целью эффективного получения желаемых соединений. Опытный химик будет использовать свои умения и навыки для наиболее эффективной последовательности реакций синтеза данного целевого соединения.
Соединения формулы (I) обладают противопаразитарной активностью и поэтому полезны для лечения паразитарной инвазии у животных-хозяев. Паразит может представлять собой эндопаразита, такого как гельминт, или эктопаразита, такого как членистоногое.
Примеры гельминтов включают паразитов типа Platyhelminthes (таких как ленточные черви и трематоды; например, Fasciola spp.; Fascioloides spp.; Paramphistomum spp.; Dicrocoelium spp.; Eurytrema spp.; Ophisthorchis spp.; Fasciolopsis spp.; Echinostoma spp.; Paragonimus spp.) и типа Nematoda (таких как филярийные, кишечные и тканевые нематоды; например, Haemonchus spp.; Ostertagia spp.; Cooperia spp.; Oesphagastomum spp.; Nematodirus spp.; Dictyocaulus spp.; Trichuris spp.; Toxocara spp.; Toxascaris spp.; Trichinella spp.; Dirofilarla spp.; Ancyclostoma spp.; Necator spp.; Strongyloides spp.; Capillaria spp.; Ascaris spp.; Enterobius spp.; и Trichostrongylus spp.).
Примеры членистоногих включают Acarina, включая иксодовых клещей (например, Ixodes spp., Boophilus spp., например, Boophilus microplus, Amblyomma spp., Hyalomma spp., Rhipicephalus spp., например Rhipicephalus appendiculatus, Haemaphysalis spp., Dermacentor spp., Omithodorus spp.(например, Omithodorus moubata)), клещей (например, Damalinia spp., Dermanyssus gallinae, Sarcoptes spp., например Sarcoptes scabiei, Psoroptes spp., Chorioptes spp., Demodex spp., Eutrombicula spp.); Diptera (например, Aedes spp., Anopheles spp., Muscidae spp., например, Stomoxys calcitrans и Haematobia irritans, Hypoderma spp., Gastrophilus spp., Simulium spp.); Hemiptera (например, Triatoma spp.); Phthiraptera (например, Damalinia spp., Linognathus spp.); Siphonaptera (например, Ctenocephalides spp.); Dictyoptera (например, Periplaneta spp., Blatella spp.) и Hymenoptera (например, Monomorium pharaonis).
Соединения формулы (I) особенно полезны для лечения гельминтных инвазий.
Животное-хозяин может представлять собой млекопитающее или животное, не являющееся млекопитающим, такое как птица или рыба. Когда животное-хозяин представляет собой млекопитающее, оно может быть человеком или млекопитающим, отличным от чел