Рекомбинантная бактерийная плазмида, экспрессирующая белок патогена и биологически активный фрагмент орнитиндекарбоксилазы в клетках млекопитающих, предназначенная для разработки средств профилактики вирусных инфекционных заболеваний (на примере вируса клещевого энцефалита)
Иллюстрации
Показать всеИзобретение относится к биотехнологии, иммунологии и молекулярной биологии. Предложенный способ модификации ДНК-вакцинного препарата основан на слиянии гена неструктурного белка NS 1 ВКЭ с фрагментом гена белка орнитиндекарбоксилазы мыши. Клонируют ген неструктурного белка NS1 в плазмиду, предназначенную для экспрессии белков в клетках эукариот. Осуществляют сайт-направленный мутагенез 5'-концевого фрагмента вирусного гена с целью удаления стоп-кодона. Клонируют фрагмент гена орнитиндекарбоксилазы, кодирующего 53 С-концевые аминокислоты и содержащего на 5'-конце стоп-кодон. Нарабатывают плазмиды в клетках E.coli и производят последующую очистку в условиях пониженного содержания эндотоксинов. Осуществляют трансфекцию плазмидным препаратом культуры клеток эукариот с последующим иммуноблот-анализом синтеза химерного белка в клетках. Проводят иммунизацию мышей и анализ протективных свойств модифицированного препарата. Предложенное изобретение позволяет повысить эффективность ДНК-вакцинных препаратов как средств профилактики заболеваний клещевым энцефалитом. 5 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности иммунологии, и молекулярной биологии и может быть использовано для разработки средств профилактики вирусных инфекционных заболеваний.
Уровень техники
Основным профилактическим средством против клещевого энцефалита (КЭ) является вакцинация цельновирионной инактивированной вакциной. Между тем как в культуре макрофагов мышей (Stephenson et al., 1984), так и макрофагов человека (Timofeev & Stephenson, 2006, Ожерелков и др., 2008) была показана способность как мышиных, так и человеческих донорских специфических иммуноглобулинов в определенных концентрациях усиливать вирусную инфекцию. Поскольку доноры получают в качестве вакцины ее традиционный цельновирионный инактивированный вариант, актуальным становится вопрос о создании альтернативной вакцины против КЭ, базирующейся на невирионных вирусных антигенах. Одним из главных претендентов на эту роль является неструктурный белок вируса NS1. Его эффективность в качестве вакцинирующего начала была неоднократно подтверждена (Jacobs et al., 1992; Timofeev et al., 1998, Тимофеев и др., 2001, Timofeev et al., 2004, Aleshin et al., 2005). Основным недостатком использования белка NS1 является отсутствие достаточно эффективной системы его доставки в организм вакцинируемого в форме, которая бы обеспечивала полную защиту от вирусного патогена.
Среди новых направлений в создании профилактических и терапевтических вакцин против вирусных заболеваний весьма перспективными считаются ДНК-вакцины. В самом простом варианте ДНК-вакцина представляет собой плазмидный вектор, содержащий ген белка патогена и элементы, необходимые для транскрипции этого гена. ДНК-вакцины применяются для индукции протективного иммунного ответа против различных инфекций как на мелких животных, например грызунах, так и на животных более крупных видов (Powell et al., 2004; Breathnach et al., 2006; Bahloul et al., 2006). Проводятся серии испытаний профилактических и терапевтических ДНК-вакцин против патогенов человека, таких как HIV-1 и HCV (Liu et al., 2006; Ulmer et al., 2006; Ahlen et al., 2007). Однако иммуногенность генетических вакцин требует улучшения, в особенности для применения на людях (Cui et al., 2005; Laddy et al., 2006; Duerr et al., 2006). Для увеличения эффективности ДНК-вакцин используют различные подходы (Donnelly et al., 2005; Kutzler et al., 2008; Barouch et al., 2006). Одним из перспективных подходов модификации иммуногена является изменение природного пути его процессинга и презентации (Leifert et al., 2004). Такое перенаправление может быть достигнуто за счет добавления специализированных сигнальных последовательностей белков. Одним из таких молекулярно-биологических подходов является модификация генов ДНК-вакцины, направляющая кодируемый этим геном белок в протеасому. Орнитиндекарбоксилаза мыши (ОДК) является белком, бысто деградирующим на протеасоме. Установлено, что участок связывания ODC с протеасомой состоит из 37 концевых аминокислот. Получение химерных белков путем присоединения деградационной последовательности дОДК может привести к ускорению деградации на протеасоме и, следовательно, к возможному увеличению презентации эпитопов и повышению уровня Т-клеточного ответа. До сих пор подобные исследования для неструктурного белка NS1 вируса клещевого энцефалита не проводились.
Из изложенного ясно, что в данной области существует настоятельная потребность в создании нового поколения вакцинных препаратов с высокой иммуногенностью и безопасностью для вакцинируемого.
Раскрытие изобретения
Данное изобретение стало возможным в результате разработки авторами способа, позволяющего направлять экспрессированный антиген в протеасомы клеток. Данный подход включает в себя создание конструкции, экспрессирующей неструктурный белок NS1, на карбоксильный конец которого добавлен С-концевой биологически активный фрагмент орнитиндекарбоксилазы (дОДК). Это обеспечило усиление клеточного Тx1 иммунного ответа за счет специфического протеолиза антигена протеасомой и преимущественной MHC-I презентации результирующих пептидов.
Настоящее изобретение в своем аспекте относится к созданию нового дизайна ДНК-вакцинной конструкции, кодирующей химерный белок, в котором на С-конец вирусного белка NS1 добавлен фрагмент белка орнитиндекарбоксилазы (С-концевые 53 а.к.).
Создание данной конструкции включает в себя следующие стадии:
а) клонирование целевого гена белка NS1 в плазмиду, предназначенную для экспрессии белков в клетках эукариот;
б) сайт-направленный мутагенез 5'-концевого фрагмента гена NS1 с целью удаления стоп-кодона;
в) клонирование фрагмента гена орнитиндекарбоксилазы, содержащего на 5'-конце стоп-кодон;
г) наработка плазмиды в клетках E.coli и последующая очистка в условиях пониженного содержания эндотоксинов.
Реализация назначения полученной ДНК-конструкции:
а) трансфекция плазмидным препаратом культуры клеток эукариот и последующий иммуноблот-анализ синтеза химерного белка в клетках для подтверждения экспрессии полученной конструкции;
б) анализ действия ингибиторов протеасомы на накопление химерного белка в клетках;
в) иммунизация мышей плазмидными препаратами и последующий анализ их протективных свойств.
Перечень чертежей
Далее изобретение будет более подробно раскрыто со ссылкой на чертежи.
Фиг.1 показывает фрагмент белка орнитиндекарбоксилазы (аминокислотная последовательность - 53 а.к.), ответственный за направление в протеасому.
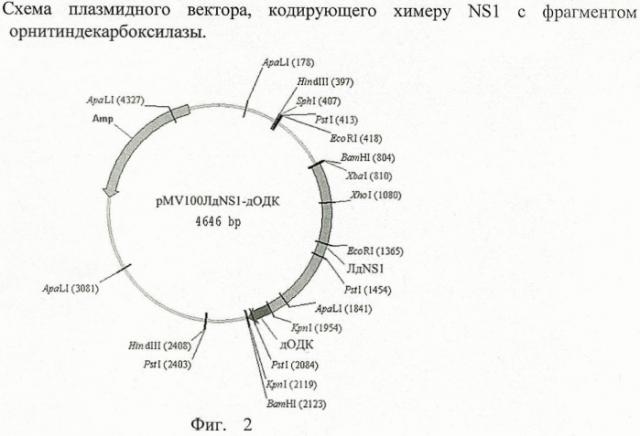
Фиг.2. представляет собой схему плазмиды, кодирующей неструктурный белок ВКЭ с повышенным сродством к протеасоме.
Фиг.3. демонстрирует экспрессию полученной конструкции в эукариотической системе.
Фиг.4. показывает накопление химерного белка в присутствии ингибиторов протеасомы.
Фиг.5. включает таблицу сравнения протективных свойств полученной конструкции.
Осуществление изобретения
Данное изобретение определяет способ получения ДНК-вакцинной конструкции, кодирующей неструктурный белок NS1 с повышенным сродством к протеасоме в результате слияния с фрагментом орнитиндекарбоксилазы мыши. В результате направления химерного белка в протеасомы усиливается клеточный иммунный ответ на вирусный антиген. Данная плазмидная конструкция может быть использована для создания средств профилактики вируса клещевого энцефалита.
Вирусный антиген
В качестве целевого вирусного антигена для создания профилактических препаратов против вируса клещевого энцефалита был использован неструктурный белок NS1.
Плазмида
В качестве плазмиды может быть использован любой вектор, содержащий элементы для экспрессии генов в клетках млекопитающих.
Клонирование генов
Создание химерной экспрессирующей конструкции, несущей ген неструктурного белка NS1 ВКЭ и орнитиндекарбоксилазу (дОДК), включает в себя:
1) клонирование гена белка NS1 в плазмиду, предназначенную для экспрессии белков в клетках эукариот;
2) сайт-направленный мутагенез 5'-концевого фрагмента гена NS1 с целью удаления стоп-кодона;
3) получение фрагмента дОДК и клонирование его в полученный вектор.
Способы молекулярного клонирования хорошо известны специалистам и, как правило, включают следующие стадии: ПЦР генов со специфическими праймерами, клонирование полученного фрагмента по выбранным сайтам рестрикции, трансформация клеток E.coil, выделение плазмиды методом щелочного лизиса и секвенирование полученных конструкций.
Препаративное выделение и очистка плазмиды
Выделение плазмидной ДНК в условиях пониженного содержания эндотоксинов можно проводить с использованием ряда коммерчески доступных наборов EndoFree Plasmid Kit (Qiagen).
Далее настоящее изобретение будет подробно проиллюстрировано со ссылкой на конкретный пример, представляющий собой наиболее предпочтительное воплощение данного изобретения. При этом должно быть понятно, что изобретение не ограничивается этим описанным воплощением. Напротив, предполагается, что оно включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Пример. pMV100ЛдNS1-дOДK
Клонирование химерной конструкции
На начальном этапе клонировали ген полноразмерного неструктурного белка NS1 ВКЭ (Западный субтип) в вектор pMV100, предназначенный для экспрессии белков в клетках эукариот. Данный ген клонировали по сайтам BamHI в аденовирусную экспрессирующую кассету, содержащую промотор и терминатор сверхраннего гена аденовируса 5 типа и сигнал полиаденилирования.
Для получения химерной конструкции с помощью ПЦР-мутагенеза на 3'-конце гена белка NS1 удаляли стоп-кодон и вводили сайт клонирования KpnI. Использовали смесь полимераз Taq и Pfu и праймеры Top NS1-XbaI-BamHI (5'-АСС GAT CCA GCC TGG GGA TCC TCT AGA ATG AGA AAC-3') и BotNS1-KpnI-BamHI (5'-TAG TGA CGT GGG АТС CTC GGT АСС CGC AAC CAC CAT TGA GCG AAC-3'), содержащие сайты рестрикции XbaI и KpnI соответственно. Праймер BotNS1-KpnI нес нуклеотидные замены, приводящие к изменению стоп-кодона гена NS1 на сайт KpnI. Оба праймера также содержали сайт рестрикции BamHI, по которому проводили следующие этапы клонирования. Полученный ПЦР-продукт обрабатывали рестриктазой BamHI и заменяли им соответствующий рестрикционный фрагмент плазмиды pMV100ЛдNS1. В результате получали плазмиду pMV100ЛдNS1-KpnI.
Далее для получения С-концевого биологически активного фрагмента гена дОДК, кодирующего 54 С - концевые а.к. (фиг.1), были использованы праймеры Top ODCsig-KpnI (5'-CAT CTT GGT АСС TCA CGG CCA ATG-3') и Bot ODC-KpnI (5'-TGC CTC GGT АСС TCA CAC ATT GAT CCT AGC AGA A-3'), содержащие сайт рестрикции KpnI, а праймер Bot ODC-KpnI также нес и стоп-кодон. Полученный ПЦР-фрагмент дОДК клонировали по сайту KpnI на 3'-конец в рамку считывания гена NS1 модифицированной плазмиды pMV100ЛдNS1-KpnI. В результате получили химерную плазмиду рМV100ЛдNS1-дОДК, содержащую NS1 с фрагментом гена орнитиндекарбоксилазы и стоп-кодоном (фиг.2). Наличие вставки определяли с помощью ПЦР с колоний, рестрикционным анализом и окончательно подтверждали секвенированием.
Гель-электрофорез и иммуноблоттинг
Для разделения белков электрофорезом в полиакриламидном геле в денатурирующих условиях образцы кипятили 10 мин в буфере нанесения (50 мМ Трис-HCl рН 6.8, 2% SDS, 10% глицерин, 2% β-меркаптоэтанол, 0.025% бромфеноловый синий) и наносили на гель. Электрофорез проводили в буфере TGE (25 мМ Трис-HCl, 250 мМ глицин, 0.1% SDS) в 5% концентрирующем геле (130 мМ Трис-HCl рН 6.8, 0.1% SDS) и 10% разделяющем геле (375 мМ Трис-HCl рН 8.8, 0.1% SDS) при постоянной силе тока 20 мА.
Белки, разделенные в 10% полиакриламидном геле в денатурирующих условиях, переносили на нитроцеллюлозную мембрану ("BioRad", США) с помощью электропереноса в буфере (48 мМ Трис, 39 мМ глицин, 0.037% SDS, 10% этанол) при силе тока 1-1.5 мА на см2 мембраны в течение 2 часов. Для блокирования неспецифического связывания блоты инкубировали в течение ночи при 4°С в блокирующем буфере (80 мМ Na2HPO4, 20 мМ NaH2PO4, 100 мМ NaCl, 0.1% Твин 20), содержащем 5% обезжиренное молоко. Связывание антител проводили в буфере для блокирования неспецифического связывания в течение часа при комнатной температуре и покачивании. Для выявления белка NS1 мембраны последовательно инкубировали с моноклональными антителами против белка NS1 («Биосан», Россия) в разведении 1:10000 и затем с вторичными антителами против IgG мыши, конъюгированными с пероксидазой хрена ("Jackson", США), в разведении 1:5000. Иммунные комплексы на мембране выявляли с помощью флюоресцентной системы детекции ECL™ ("Amersham Pharmacia Biotech", Великобритания) и регистрировали на рентгеновскую пленку ("FujiFilm", Япония). Пленку сканировали и данные обрабатывали в программе ImageJ fhttp://rsb.info.nih.gov/ij).
Препаративное выделение и очистка плазмиды pMV100ЛдNS1-nОДК из клеток Е.соil DH5α.
Выделение плазмидной ДНК проводили с использованием набора EndoFree Plasmid Mega Kit (Qiagen).
С помощью электрофореза ДНК в агарозном геле контролировали качество образца плазмидной ДНК.
Экспрессия химерной конструкции в клетках эукариот
Трансфекцию клеточной линии НЕК293 (клетки почки эмбрионов человека) проводили липосомным препаратом Lipofectamine LTX в сочитании с Plus реагентом (Invitrogen, США) в соответствии с рекомендациями фирмы изготовителя.
За день до трансфекции клетки рассевали на чашки Петри или планшеты из расчета - 3×105 клеток на мл среды. Так при использовании чашки Петри диаметром 3.5 см в 250 мкл среды OPTI-MEM (Invitrogen, США) растворяли 3 мкл липосомного реагента. Затем туда добавляли комплекс, состоящий из 1 мкг плазмидной ДНК и 1 мкл Plus реагента, разведенных в 250 мкл OPTI-MEM. Полученную смесь инкубировали 30 мин при комнатной температуре. Добавляли 500 мкл DMEM и наносили на клеточный слой, который предварительно дважды промывали буфером PBS. Клетки инкубировали в СO2-инкубаторе 4 часа, после чего трансфецирующую смесь заменяли на полную ростовую среду DMEM, содержащую 10%-ную эмбриональную телячью сыворотку и продолжали инкубацию клеток в стандартных условиях.
Влияние ингибиторов протеасомы на накопление химерного белка в клетках эукариот.
Для определения роли протеасомы в деградации полученного химерного белка ЛдNS1-дОДК в клетке использовали специфические ингибиторы. Наиболее широко используемые протеасомные ингибиторы - MG132 и эпоксомицин. Клетки HEK293, трансфицированные плазмидой рМV100ЛдNS1-дОДК или рМV100ЛдNS1, инкубировали с ингибиторами MG132 и эпоксомицином в течение 20 часов в конечных концентрациях 5 мкМ и 0,1 мкМ соответственно. Затем в лизатах клеток с помощью иммуноблоттинга определяли содержание белка в образцах, обработанных ингибиторами, и соотносили с содержанием белка в образце без ингибитора.
В результате было обнаружено, что добавление MG132 приводит к увеличению содержания белка ЛдNS1-дОДК в 3 раза по сравнению с неингибированным образцом. Эпоксомицин увеличивает содержание химерного белка в 5 раз (фиг.4). Тогда как добавление протеасомных ингибиторов не приводит к повышению накопления белка ЛдNS1. Таким образом, слияние неструктурного белка NS1 ВКЭ с фрагментом гена дОДК приводит к увеличению сродства и скорости деградации химерного белка на протеасоме.
Определение протективных свойств
Для определения протективных свойств плазмиды рМV100ЛдNS1-дОДК использовали иммунизацию самок мышей Bald/с массой 10-12 г. Проводили двукратную иммунизацию 50 мкг апирогенным раствором плазмиды. Интервал между введениями составлял 2 недели. Через 14 дней после последней инъекции мышей разрешали внутрибрюшинно 10ЛД50 вируса КЭ (шт. Абсеттаров). Падеж животных учитывали в течение 21 дня. Процент падежа вычисляли с использованием среднегеометрического отклонения. Результаты протективных испытаний полученной химерной конструкции рМV100ЛдNS1-дОДК после двухкратной вакцинации представлены в таблице (фиг.5).
Как видно из таблицы (фиг.5), полученная химерная конструкция рМV100ЛдNS1-дОДК обладает существенно большими протективными свойствами по отношению к исходному вектору рМV100ЛдNS1. Таким образом, направление гена неструктурного белка NS1 по протеасомному пути деградации путем создания конструкции, экспрессирующей неструктурный белок NS1, на карбоксильный конец которого добавлен С-концевой биологически активный фрагмент орнитиндекарбоксилазы (дОДК), приводит к усилению клеточного Тх1 иммунного ответа за счет специфического протеолиза антигена и преимущественной MHC-I презентации результирующих пептидов.
Представленное выше подробное описание изобретения и его конкретных воплощений, приведенных в примерах со ссылкой на чертежи, предназначено исключительно для более полного уяснения сущности заявленного изобретения, но не для его ограничения. Специалисту будет ясно, что могут быть сделаны различные изменения, которые тем не менее будут соответствовать сущности и объему настоящего изобретения, которые определяются прилагаемой формулой изобретения.
Способ модификации ДНК-конструкции, которая экспрессирует в клетках млекопитающих химерный белок, состоящий из неструктурного белка NS 1 ВКЭ и С-концевого фрагмента орнитиндекарбоксилазы (53 а.к.), включает следующие основные этапы:а) клонирование гена неструктурного белка NS1 в плазмиду, предназначенную для экспрессии белков в клетках эукариот;б) сайт-направленный мутагенез 5'-концевого фрагмента вирусного гена с целью удаления стоп-кодона;в) клонирование фрагмента гена орнитиндекарбоксилазы, кодирующего 53 С-концевые аминокислоты и содержащего на 5'-конце стоп-кодон;г) наработка плазмиды в клетках E.coli и последующая очистка в условиях пониженного содержания эндотоксинов;д) трансфекция плазмидным препаратом культуры клеток эукариот и последующий иммуноблот-анализ синтеза химерного белка в клетках;е) иммунизация мышей и анализ протективных свойств.