Способ дифференцированного назначения моксонидина у пациентов с артериальной гипертензией на фоне метаболического синдрома
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для лечения артериальной гипертензии на фоне метаболического синдрома. Измеряют уровень кортизола в крови и частоту сердечных сокращений (ЧСС). При кортизолемии более 800 нмоль/л и выше и ЧСС более 80 ударов в минуту в покое в дневные часы назначают моксонидин. Доза 0,2-0,6 мг в сутки. Способ позволяет корригировать артериальную гипертензию и инсулинорезистентность, повысить эффективность терапии артериальной гипертензии на фоне метаболического синдрома и снизить риск смертности от сердечно-сосудистых заболеваний. 2 ил., 7 табл.
Реферат
Изобретение относится к области медицины, конкретно к фармакологии, и касается способа повышения эффективности терапии артериальной гипертензии (АГ) на фоне метаболического синдрома (МС) за счет оптимизации использования агониста имидазолиновых рецепторов моксонидина.
Целью лечения пациентов с метаболическим синдромом, включающим в себя ожирение, артериальную гипертензию, дислипопротеидемии, нарушение углеводного обмена, является максимально возможное снижение общего риска возникновения сердечно-сосудистых заболеваний и смертности. Ключевой механизм в достижении такой установки терапии является поддержание артериального давления (АД) на целевом уровне [1]. Назначение антигипертензивных препаратов у пациентов с метаболическим синдромом должно быть патогенетически обоснованным и проводиться с учетом влияния используемых лекарственных средств на обменные процессы [2]. Учитывая, что ведущая роль в развитии цепи патологических реакций при метаболическом синдроме отводится гиперактивации симпатического отдела вегетативной нервной системы, один из механизмов регуляции тонуса которой опосредуется через имидазолиновые рецепторы ростральной вентролатеральной области продолговатого мозга, в связи с чем вариантом патогенетически обоснованной терапии представляется использование центральных симпатолитических средств, в частности моксонидина [3].
Известен способ назначения моксонидина в качестве антигипертензивного средства в дозе 0,2-0,6 мг (в дозе 0,2-0,4 мг 1 раз в сутки в утренние часы, в дозе 0,6 мг - 2 раза в сутки - 0,4 мг в утренние часы и 0,2 мг в вечерние) у всех пациентов с метаболическим синдромом при условии отсутствия у них общих для всех препаратов этой группы противопоказаний [4].
Данный способ является наиболее близким к заявленному и выбран в качестве прототипа.
Недостатком данного способа являются противоречивые на сегодняшний день данные о влиянии моксонидина на углеводный обмен у пациентов с АГ на фоне МС [1; 4-7]. Это привело к тому, что, несмотря на богатый клинический опыт применения моксонидина у пациентов с артериальной гипертензией и метаболическим синдромом, он не был включен в число препаратов первого выбора и остается средством резерва.
Задачей, решаемой данным изобретением, является определение критериев дифференцированного назначения моксонидина у пациентов с метаболическим синдромом для повышения эффективности лечения артериальной гипертензии.
Поставленная задача достигается техническим решением, представляющим собой способ дифференцированного применения моксонидина у пациентов с артериальной гипертензией на фоне метаболического синдрома, заключающийся в назначении препарата только лицам с исходной гиперсимпатикотонией, клиническим проявлением которой является кортизолемия более 800 нмоль/л и частота сердечных сокращений (ЧСС) более 80 уд./мин в покое в дневные часы.
Новым в предлагаемом изобретении является использование препарата моксонидин у лиц с артериальной гипертензией на фоне метаболического синдрома только при наличии у них исходной гиперсимпатикотонии, клиническим проявлением которой является кортизолемия более 800 нмоль/л и ЧСС более 80 уд/мин в покое в дневные часы.
Авторами в проанализированной литературе дифференцированного подхода в назначении моксонидина у пациентов с артериальной гипертензией на фоне метаболического синдрома, основанного на уровне кортизола в плазме и ЧСС не найдено, и предлагаемый способ соответствует критерию «Новизна».
Высокая распространенность МС, представляющего собой комплекс факторов, определяющих высокий риск сердечно-сосудистой заболеваемости и летальности, достигла к началу XXI века размаха пандемии [3]. Это определяет актуальность научных исследований, посвященных изучению возможностей повышения эффективности лечебных мероприятий в отношении столь многоплановой патологии. Эффективный контроль уровня артериального давления с помощью медикаментозной терапии позволяет вдвое уменьшить число основных сердечно-сосудистых осложнений [1]. Однако антигипертензивные препараты, применяемые у пациентов с МС, должны быть как минимум метаболически нейтральны, а их назначение должно быть патогенетически обосновано [2]. В последние десятилетия получены убедительные доказательства ведущей роли гиперактивности симпатического отдела вегетативной нервной системы в генезе метаболических нарушений [8]. И с этих позиций, особый интерес у обозначенной категории пациентов представляет применение антигипертензивных симпатолитических препаратов центрального действия и, в частности, селективных агонистов I1-имидазолиновых рецепторов, из которых наиболее широко на отечественном рынке представлен моксонидин [3]. Механизм действия препарата связан с активацией пресинаптических мембран нейронов ростральной вентролатеральной области продолговатого мозга, регулирующих активность симпатической нервной системы на центральном уровне. Предполагается, что дополнительные, наряду с антигипертензивным, эффекты, связанные со стимуляцией I1-имидазолиновых рецепторов в периферических тканях, - уменьшение реабсорбции натрия и воды в почках, торможение высвобождения катехоламинов из хромаффинных клеток надпочечников, нормализация секреции инсулина в поджелудочной железе - могут быть весьма полезны у пациентов с метаболическим синдромом [2].
Имеющиеся на сегодняшний день данные о влиянии моксонидина на обмен веществ у пациентов с артериальной гипертензией на фоне метаболического синдрома достаточно противоречивы. В ряде клинических работ было продемонстрировано достоверное улучшение показателей чувствительности к инсулину и статистически значимое снижение уровня глюкозы натощак у всех больных на фоне монотерапии моксонидином при отсутствии значимого влияния на уровни гликемии и инсулина после нагрузки глюкозой [1; 2]. При этом в работах других авторов показана нейтральность монотерапии моксонидином в отношении индекса инсулинрезистентности и базальных уровней инсулина и гликемии, а внимание акцентируется на достоверном снижении уровня инсулина через 2 часа после нагрузки глюкозой [6; 7].
В настоящее время имеются сведения о более выраженной положительной динамике метаболических показателей на фоне лечения моксонидином у пациентов с высокой активностью симпатической нервной системы с частотой сердечных сокращений >80 ударов в минуту [2], однако факт применения препарата только у пациентов с артериальной гипертензией и метаболическим синдромом с частотой сердечных сокращений >80 ударов в минуту в покое в дневные часы, а также кортизолемией более 800 нмоль/л, что является клиническим проявлением исходной гиперсимпатикотонии, для специалиста является не очевидным.
Совокупность отличительных признаков не является очевидной для специалиста и не вытекает явным образом из уровня техники данной области, что позволяет считать предлагаемое изобретение соответствующим критерию «Изобретательский уровень». Предлагаемое изобретение может быть использовано в практическом здравоохранении для повышения эффективности терапии АГ в рамках МС и соответствует критерию «Промышленная применимость».
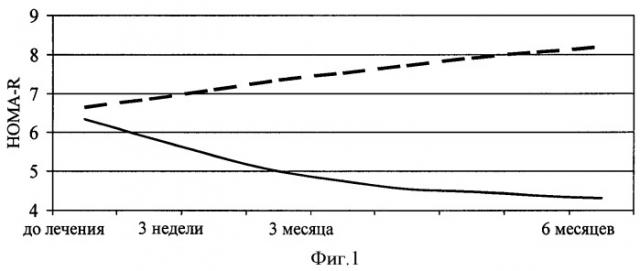
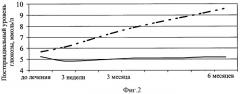
Изобретение будет понятно из следующего описания и приложенных к нему чертежей. На фиг.1 показана динамика индекса инсулинорезистентности HOMA-R у пациентов с артериальной гипертензией и метаболическим синдромом в зависимости от исходной кортизолемии на фоне терапии моксонидином. На фиг.2 представлена динамика постпрандиального уровня глюкозы крови пациентов с метаболическим синдромом в зависимости от исходной кортизолемии на фоне терапии моксонидином. (На фиг.1 и 2 сплошной линией отмечено изменение индекса HOMA-R у пациентов с исходной гиперкортизолемией, пунктирной - с уровнем кортизола в пределах «физиологической нормы»).
Способ осуществляют следующим образом.
Моксонидин назначается для постоянной гипотензивной терапии только пациентам с артериальной гипертензией I-II степени на фоне метаболического синдрома в средней терапевтической дозе 0,2-0,6 мг в сутки при условии наличия у них исходной гиперсимпатикотонии, клиническим проявлением которой является кортизолемия более 800 нмоль/л и частота сердечных сокращений более 80 уд/мин в покое в дневные часы.
Предлагаемый способ был изучен в клиническом исследовании, проведенным на базе клиники НИИ фармакологии СО РАМН с участием 30 пациентов с метаболическим синдромом и артериальной гипертензией I-II степени, характеризующейся стойким повышением артериального давления, требующей постоянной гипотензивной терапии. Исследование являлось открытым, рандомизированным, клинически контролируемым, сравнительным и было выполнено в соответствии с требованиями Хельсинкской декларации. Продолжительность исследования составила 6 месяцев активного лечебного вмешательства подборами доз антигипертензивных препаратов. Критерием включение являлось соответствие критериям International Diabetes Federation (IDF), 2005 г. для верификации метаболического синдрома, который диагностируется на основании обязательного критерия - центрального (абдоминального) ожирения (окружность талии более 94 см для мужчин и более 80 см для женщин) в сочетании как минимум с 2-мя из следующих 4-х факторов: повышение триглицеридов (ТГ) более 1,7 ммоль/л; снижение липопротеидов высокой плотности (ЛПВП) менее 0,9 ммоль/л у мужчин и менее 1,1 ммоль/л у женщин; повышение АД: систолического (САД) более 130 мм рт.ст. или диастолического (ДАД) более 85 мм рт.ст.; повышение глюкозы венозной плазмы натощак более 5,6 ммоль/л [1]. Обязательным критерием включения в исследование являлось наличие артериальной гипертензии, наличие которой верифицировали на основе рекомендаций ВНОК 2004 г. [9]. После первичного скрининга 32-х человек, 30 пациентов, подписавших информированное согласие, были включены в исследование. Пациенты получали селективный агонист имидазолиновых рецепторов моксонидин (физиотенз, "Solvay Pharma", Германия) в режиме монотерапии в стартовой дозе 0,2 мг однократно в сутки. В контрольные сроки (3 недели, 3 месяца от начала лечения) при недостаточном гипотензивном эффекте дозу препарата увеличивали последовательно максимально до 0,6 мг в сутки.
До лечения, через 3 недели, 3 месяца и 6 месяцев терапии пациентам проводилось обследование для оценки антигипертензивного, симпатолитического и метаболических эффектов препаратов. Для решения поставленных задач использовали общепринятые и специальные методы исследования. Антигипертензивный эффект изучали согласно международным рекомендациям путем суточного мониторирования АД (СМАД) с помощью системы "Meditech" АВРМ-04 (Венгрия). Активность центральных отделов симпатической нервной системы у пациентов в исследовании оценивалась косвенно по концентрации адренокортикотропного гормона (АКТГ) и кортизола плазмы крови - гормонов основной нейроэндокринной оси, определяемых иммуноферментным анализом. Для оценки параметров углеводного обмена исследовали натощак и через 2 часа после стандартного завтрака концентрацию глюкозы в сыворотке венозной крови по конечной точке и инсулина иммуноферментным анализом; инсулинорезистентность диагностировали по расчетному индексу HOMA-R.
Для обработки результатов использовали методы вариационной статистики. Для всех статистических тестов различия были достоверными при р<0,05. Для порядковых признаков внутри- и межгрупповые различия оценивали непараметрическими тестами: ранговым тестом Уилкоксона и U-тестом Манн-Уитни.
Пример 1.
Пациент Ч., 52 года. Обратился с жалобами на повышение артериального давления максимально до 160/110 мм рт.ст., сопровождающееся головной болью в затылочной области, колющими болями в области сердца, слабостью, тревожностью. Принимал нерегулярно эналаприл 10 мг, терапевтический эффект не отслеживал.
Объективный статус: рост 178 см, вес 98 кг. Объем талии 109 см, объем бедер 111 см, объем талии/объем бедер 0,98. АД 165/100 мм рт.ст., пульс 62 в минуту. Основные клинико-лабораторные характеристики пациента Ч. представлены в таблице 1.
| Таблица 1 | ||||
| Основные клинико-лабораторные характеристики пациента Ч. | ||||
| Показатель | Исходно | 3 недели | 3 месяца | 6 месяцев |
| Биохимический анализ крови | ||||
| Мочевина, ммоль/л | 6,1 | 6,3 | 9,9 | 11,5 |
| Креатинин мкмоль/л | 121 | 131 | 134 | 138 |
| Мочевая кислота, мкмоль/л | 410 | 412 | 414 | 405 |
| Липидный спектр | ||||
| Холестерин общий, ммоль/л | 5,1 | 5,7 | 6,1 | 6,3 |
| ЛПОНП, ммоль/л | 1,58 | 2,03 | 2,23 | 2,34 |
| ЛПНП, ммоль/л | 2,73 | 2,8 | 3,0 | 3,09 |
| ЛПВП, ммоль/л | 0,79 | 0,97 | 0,88 | 0,87 |
| ТГ, ммоль/л | 3,47 | 6,28 | 4,91 | 5,15 |
| Индекс атерогенности | 5,5 | 5,5 | 5,9 | 6,3 |
| Показатели суточного профиля АД и ЧСС | ||||
| САД24, мм рт.ст. | 174 | 159 | 146 | 138 |
| ДАД24, мм рт.ст. | 101 | 99 | 85 | 81 |
| САДд, мм рт.ст. | 179 | 164 | 152 | 144 |
| ДАДд, мм рт.ст. | 105 | 103 | 89 | 83 |
| В САДд, мм рт.ст. | 20 | 18 | 16 | 15 |
| В ДАДд, мм рт.ст. | 10 | 11 | 12 | 14 |
| САДн, мм рт.ст. | 170 | 156 | 134 | 131 |
| ДАДн, мм рт.ст. | 87 | 86 | 80 | 80 |
| В САДн, мм рт.ст. | 16 | 16 | 10 | 14 |
| В ДАДн, мм рт.ст. | 14 | 17 | 15 | 14 |
| СИ САД, % | 12 | 15 | 11 | 12 |
| СИ ДАД, % | 17 | 17 | 10 | 13 |
| Средняя дневная ЧСС, уд./мин | 70 | 72 | 73 | 73 |
| Средняя ночная ЧСС, уд./мин | 64 | 60 | 64 | 69 |
| Здесь и далее: САД - систолическое артериальное давление,ДАД - диастолическое артериальное давление,В - вариабельность,ЧСС - частота сердечных сокращений |
Клинический диагноз: Гипертоническая болезнь 2 степени, стадия II. Дислипопротеидемия. Ожирение 1 степени. Риск 4.
После первичного обследования назначен препарат моксонидин 0,2 мг 1 р/д утром. Через 3 недели, ввиду недостаточного снижения АД, доза увеличена до 0,4 мг 1 р/д утром, через 3 месяца назначен препарат в максимальной дозе - 0,6 мг/сут (0,4 мг утром и 0,2 мг вечером). На фоне терапии проводилась в первую очередь оценка параметров АД (по суточному мониторированию АД), безопасности приема препарата (табл.1). Через 6 месяцев терапии был достигнут целевой уровень параметров АД - 138/81 мм рт. ст., однако при этом впервые выявлено повышение постпрандиального уровня гликемии до 10,2 ммоль/л, сопровождающееся повышением постпрандиальной концентрации инсулина до 62,8 мкЕД/мл (табл.2), что является диагностически значимым для верификации сахарного диабета 2 типа. Пациент был направлен на консультацию эндокринолога для подбора сахароснижающей терапии и назначения лечения, улучшающего чувствительность тканей к инсулину.
| Таблица 2 | ||||
| Динамика показателей углеводного обмена и гормонального статуса пациента Ч. | ||||
| Показатель | Исходно | 3 недели | 3 месяца | 6 месяцев |
| Показатели углеводного обмена | ||||
| Глюкоза тощаковая, ммоль/л | 5,2 | 5,0 | 5,9 | 5,8 |
| Глюкоза поспрандиальная, ммоль/ | 5,2 | 5,5 | 5,4 | 10,2 |
| Гормональный статус | ||||
| Кортизол, нмоль/л | 455,8 | 370,7 | 416,1 | 392,9 |
| АКТГ, пг/мл | 31,8 | 31,4 | 28,6 | 25,0 |
| Инсулин тощаковый, мкЕД/мл | 18,1 | 15,3 | 17,9 | 20,1 |
| Инсулин постпрандиальный, мкЕД/мл | 24,8 | 28,1 | 24,0 | 62,8 |
Следует отметить, что частота сердечных сокращений, определяемая при суточном мониторировании АД, составила 70 ударов в минуту в дневные часы и 62 удара в минуту в покое при осмотре пациента; уровень кортизола - 455,8 нмоль/л и АКТГ - 31,8 пг/мл, что косвенно свидетельствует, об отсутствии гиперактивности симпатического отдела вегетативной нервной системы.
Пример 2.
Пациент П., 46 лет. Обратился с жалобами на повышение артериального давления максимально до 150/100 мм рт.ст., сопровождающееся головной болью в затылочной области, потливостью, слабостью. Длительность артериальной гипертензии 5 лет, принимал нерегулярно локрен 5 мг с удовлетворительным гипотензивным эффектом.
Рост 175 см, вес 110 кг. Объем талии 120 см, объем бедер 120 см, объем талии/объем бедер 1,0. АД 160/100 мм рт.ст., пульс 88 в минуту. Основные клинико-лабораторные характеристики пациента П. представлены в таблице 3.
| Таблица 3 | ||||
| Основные клинико-лабораторные характеристики пациента П. | ||||
| Показатель | Исходно | 3 недели | 3 месяца | 6 месяцев |
| Биохимический анализ крови | ||||
| Мочевина, ммоль/л | 5,5 | 3,8 | 4,7 | 4,4 |
| Креатинин мкмоль/л | 83 | 80 | 86 | 74 |
| Мочевая кислота, мкмоль/л | 426 | 341 | 412 | 419 |
| Липидный спектр | ||||
| Холестерин общий, ммоль/л | 6,5 | 5,4 | 6,2 | 6,2 |
| ЛПОНП, ммоль/л | 1,16 | 0,58 | 1,84 | 1,13 |
| ЛПНП, ммоль/л | 4,2 | 3,8 | 3,4 | 3,80 |
| ЛПВП, ммоль/л | 1,18 | 1,01 | 0,96 | 1,07 |
| ТГ, ммоль/л | 2,56 | 3,13 | 4,05 | 2,48 |
| Индекс атерогенности | 4,5 | 4,3 | 5,5 | 5,2 |
| Показатели суточного профиля АД и ЧСС | ||||
| САД24, мм рт.ст. | 165 | 152 | 144 | 132 |
| ДАД24, мм рт.ст. | 96 | 93 | 88 | 85 |
| САДд, мм рт.ст. | 169 | 157 | 142 | 137 |
| ДАДд, мм рт.ст. | 103 | 97 | 95 | 91 |
| В САДд, мм рт.ст. | 13 | 12 | 13 | 12 |
| В ДАДд, мм рт.ст. | 11 | 10 | 10 | 10 |
| САДн, мм рт.ст. | 137 | 132 | 128 | 124 |
| ДАДн, мм рт.ст. | 89 | 82 | 80 | 75 |
| В САДн, мм рт.ст. | 9 | 14 | 12 | 12 |
| В ДАДн, мм рт.ст. | 10 | 11 | 14 | 13 |
| СИ САД, % | 7 | 10 | 16 | 15 |
| СИ ДАД, % | 7 | 14 | 20 | 18 |
| Средняя дневная ЧСС, уд./мин | 86 | 80 | 78 | 75 |
| Средняя ночная ЧСС, уд./мин | 72 | 69 | 65 | 64 |
Клинический диагноз: Гипертоническая болезнь 2 степени, стадия II. Дислипопротеидемия. Ожирение 2 степени. Риск 4.
Назначен препарат моксонидин 0,2 мг 1 р/д утром. Через 3 недели ввиду недостаточного снижения АД доза увеличена до 0,4 мг 1 р/д утром, через 3 месяца назначен препарат в максимальной дозе - 0,6 мг/сут - 0,4 мг утром и 0,2 мг вечером. Через 6 месяцев терапии был достигнут целевой уровень параметров АД - 132/85 мм рт. ст. (табл.3), при этом отмечалась тенденция к снижению тощакового и постпрандиального уровней инсулина (табл.4), что привело к снижению инсулинорезистентности с 3,9 до 2,5, что свидетельствует об улучшении чувствительности тканей к инсулину и в сочетании со стабильным гипотензивным действием определяет успех профилактики сердечно-сосудистых осложнений при лечении пациентов с МС [10].
| Таблица 4 | ||||
| Динамика показателей углеводного обмена и гормонального статуса пациента П. | ||||
| Показатель | Исходно | 3 недели | 3 месяца | 6 месяцев |
| Показатели углеводного обмена | ||||
| Глюкоза тощаковая, ммоль/л | 5,9 | 5,1 | 5,7 | 5,6 |
| Глюкоза поспрандиальная, ммоль/ | 7,2 | 7,0 | 5,9 | 5,4 |
| Гормональный статус | ||||
| Кортизол, нмоль/л | 907,0 | 739,0 | 852,0 | 621,0 |
| АКТГ, пг/мл | 49,4 | 42,8 | 37,5 | 30,3 |
| Инсулин тощаковый, мкЕД/мл | 15,0 | 11,3 | 10,6 | 10,1 |
| Инсулин постпрандиальный, мкЕД/мл | 27,1 | 24,8 | 12,9 | 11,4 |
Следует отметить, что изначально средняя частота сердечных сокращений у пациента П. составила 86 ударов в минуту в дневные часы по данным суточного мониторирования АД и 88 ударов в минуту в покое при осмотре пациента врачом; уровень кортизола - 907,0 нмоль/л, а АКТГ - 49,4 пг/мл, что свидетельствует о выраженной гиперактивности симпатического отдела вегетативной нервной системы.
Таким образом, моксонидин может назначаться для постоянной гипотензивной терапии только пациентам с артериальной гипертензией I-II степени на фоне метаболического синдрома в средней терапевтическойдозе 0,2-0,6 мг в сутки (в дозе 0,2-0,4 мг 1 раз в сутки в утренние часы, в дозе 0,6 мг - 2 раза в сутки - 0,4 мг в утренние часы и 0,2 мг в вечерние) при условии наличия у них исходной гиперсимпатикотонии, клиническим проявлением которой является кортизолемия более 800 нмоль/л и частота сердечных сокращений более 80 уд/мин в покое в дневные часы.
Предлагаемый способ применен у 30 пациентов и позволяет повысить эффективность терапии артериальной гипертензии у лиц с метаболическим синдромом за счет оптимизации использования агониста имидазолиновых рецепторов моксонидина.
Клиническое исследование было проведено с участием 30 пациентов с артериальной гипертензией, наличие которой верифицировали на основе рекомендаций ВНОК 2004 г., и метаболическим синдромом, диагностируемым согласно критериям International Diabetes Federation (IDF), 2005. Среди них 18 мужчин и 12 женщин в возрасте от 28 до 67 лет (средний возраст 48,89±2,07 года) с длительностью АГ от 2 до 13 лет (в среднем 6,93±1,98 года).
После проведения предусмотренных протоколом исследований всем пациентам назначался моксонидин в стартовой дозе 0,2 мг в сутки, при недостаточном гипотензивном действии дозу препарата увеличивали последовательно максимально до 0,6 мг в сутки. При назначении 0,6 мг моксонидина, дозу разбивали на 2 приема - 0,4 мг утром и 0,2 мг вечером. В ходе исследования у пациентов в первую очередь оценивался уровень артериального давления по результатам ежедневного каузального его измерения и суточного мониторирования. Через 6 месяцев терапии моксонидином отмечалось достоверное снижение суточных показателей систолического и диастолического давления (р<0,05, табл.5) при этом частота достижения целевого артериального давления превысила 70%. Также зафиксировано достоверное снижение дневных и ночных показателей систолического и диастолического артериального давления, а также индекса вариабельности, что свидетельствует о значительной выраженности антигипертензивного эффекта препарата. Моксонидин не нарушал нормальные циркадные колебания артериального давления. На основании исследования динамики показателей суточного профиля артериального давления при мониторировании установлено стабильное, равномерное его снижение в течение суток. Терапия моксонидином у пациентов с артериальной гипертензией на фоне метаболического синдрома не влияла на значение частоты сердечных сокращений в дневные и ночные часы.
| Таблица 5 | ||
| Динамика показателей суточного профиля артериального давления и частоты сердечных сокращений на фоне терапии моксонидином (М±m) | ||
| Показатель | до лечения | 6 месяцев лечения |
| САД суточное, мм рт.ст. | 145,33±4,38 | 133,17±2,05* |
| ДАД суточное, мм рт.ст. | 86,08±2,68 | 79,00±1,99* |
| САД дневное, мм рт.ст. | 148,83±4,55 | 137,58±2,12* |
| ДАД дневное, мм рт.ст. | 90,75±3,15 | 83,83±2,42* |
| В САДд, мм рт.ст. | 13 | 12 |
| В ДАДд, мм рт.ст. | 11 | 10 |
| САД ночное, мм рт.ст. | 136,25±4,33 | 124,42±2,97* |
| ДАД ночное, мм рт.ст. | 77,33±2,58 | 72,17±2,98 |
| В САДн, мм рт.ст. | 9 | 12 |
| В ДАДн, мм рт.ст. | 10 | 13 |
| суточный индекс САД, % | 8,55±1,82 | 10,08±1,66 |
| суточный индекс ДАД, % | 17,50±2,46 | 14,83±3,38 |
| средняя дневная ЧСС, уд./мин | 76,00±2,88 | 77,25±3,19 |
| средняя ночная ЧСС, уд./мин | 61,83±2,36 | 66,83±2,90 |
| Примечание: * - достоверно при р<0,05 по сравнению с исходными значениями | ||
При оценке симпатолитических эффектов препарата, оцениваемых по динамике уровня АКТГ и кортизола, было выявлено, что исходно симпатикотония наблюдалась у четверти пациентов. Через 6 месяцев терапии моксонидином отмечалось достоверное снижение АКТГ венозной крови (табл.6) и тенденция к уменьшению кортизолемии. Изменение кортизола крови пациентов, включенных в исследование, была статистически незначимой, возможно в силу значительных биоритмологических колебаний этого гормона, однако зарегистрированная динамика исследуемых гормонов основной нейроэндокринной оси подтверждает оцениваемое действие моксонидина на гиперактивность симпатической нервной системы.
| Таблица 6 | ||||
| Концентрация кортизола и АКТГ у пациентов с артериальной гипертензией и метаболическим синдромом на фоне терапии моксонидином (М±m) | ||||
| Показатель | До лечения | Через 3 недели | Через 3 месяца | Через 6 месяцев |
| Кортизол, нмоль/л | 638,57±85,12 | 577,15±73,50 | 644,30±93,70 | 578,97±47,16 |
| АКТГ, пг/мл | 43,52±6,92 | 37,46±5,36 | 30,66±4,19 | 27,76±3,09* |
| Примечание: * - достоверно при р<0,05 по сравнению с исходными значениями | ||||
Большинство клинических проявлений метаболического синдрома обусловлено инсулинорезистентностью - нарушением биологического действия инсулина с уменьшением утилизации глюкозы клетками периферических тканей, а также гиперинсулинемией [6; 8]. Именно поэтому важным фактором оценки эффективности антигипертензивных препаратов при метаболическом синдроме является характеристика их влияния на инсулинорезистентность и показатели углеводного обмена.
До начала терапии у 11,1% пациентов, включенных в исследование, диагностировалась гипергликемия натощак в сочетании с повышением постпрандиального уровня глюкозы. Через 6 месяцев терапии моксонидином нарушения регуляции углеводного обмена регистрировались у 27,8%: гипергликемия натощак у 5,6%, повышение постпрандиального уровня глюкозы - у 11,1%, гипергликемия натощак в сочетании с повышением постпрандиального уровня гликемии у 11,1%.
Концентрационные характеристики уровня тощаковой глюкозы на фоне терапии моксонидином существенно не изменялись (табл.7), при этом через 6 месяцев наблюдения было зарегистрировано некоторое уменьшение концентрации базального инсулина на 22,8% (р>0,05). Снижение базального уровня инсулина на фоне применения моксонидина выразилось в уменьшении показателя инсулинорезистентности - индекса HOMA-R. И, хотя инсулинорезистентность имела место в 100% случаев исходно и частота ее выявления не менялась на этапах лечения моксонидином, индекс HOMA-R, представляющий собой количественную характеристику чувствительности тканей к инсулину, снизился в среднем на 18,74% (р>0,05). На фоне 6-ти месячной терапии моксонидином значимой динамики постпрандиальной инсулинемии у пациентов с артериальной гипертензией и метаболическим синдромом зафиксировано не было, при этом отмечалось значимое повышение концентрации постпрандиальной глюкозы через 6 месяцев лечения на 16,5% (р<0,05) относительно исходного уровня.
| Таблица 7 | ||||
| Параметры углеводного обмена у пациентов с артериальной гипертензией и метаболическим синдромом на этапах терапии моксонидином (М±m) | ||||
| Показатель | До лечения | Через 3 недели | Через 3 месяца | Через 6 месяцев |
| Глюкоза натощак (ммоль/л) | 5,72±0,22 | 5,56±0,19 | 5,69±0,25 | 5,98±0,24 |
| Инсулин натощак (мкЕД/мл) | 25,23±5,46 | 22,78±5,78 | 20,15±2,88 | 19,48±2,83 |
| Модель HOMA-R | 6,51±1,48 | 5,54±1,48 | 5,37±0,99 | 5,29±0,91 |
| Постпрандиальный уровень глюкозы (ммоль/л) | 5,77±0,41 | 5,50±0,47 | 6,19±0,68 | 6,91±0,58* |
| Постпрандиальный уровень инсулина (мкЕД/мл) | 44,59±7,29 | 46,18±11,17 | 56,60±9,75 | 59,03±11,00 |
| Примечание: * - достоверно при р<0,05 по сравнению с исходными значениями |
Неоднозначность изменения параметров углеводного обмена на фоне терапии моксонидином может быть объяснена исходно различным уровнем активности симпатической нервной системы у пациентов этой группы. Так, при использовании в антигипертензивной терапии моксонидина у пациентов с исходным содержанием кортизола выше среднего уровня, индекс инсулинорезистентности снизился более значительно, чем в целом у лиц, включенных в исследование - на 32% (фиг.1., р>0,05). В то же время, при исходно более низкой, чем в среднем по группе, концентрации кортизола крови, индекс инсулинорезистентности увеличился на 14,6% по сравнению с исходными данными (р>0,05). Следовательно, эффективность препарата в коррекции инсулинорезистентности напрямую зависит от выраженности гиперсимпатикотонии. Кроме того, проведение углубленного анализа показало, что постпрандиальный уровень глюкозы имеет отрицательную корреляционную зависимость с концентрацией кортизола в крови у лиц, получающих терапию моксонидином. У пациентов с исходной концентрацией гормона ниже среднегруппового значения, в динамике наблюдения концентрация постпрандиальной глюкозы увеличилась в среднем на 57,7% (фиг.2). Следует отметить, четкую зависимость частоты сердечных сокращений от уровня кортизолемии. Исходно у лиц, принимавших моксонидин, частота сердечных сокращений в дневные часы в покое составила 76,00±2,88 уд./мин, в то время как у пациентов с исходно высокой кортизолемией частота сердечных сокращений была равна 87,12±4,38 уд./мин. При этом у пациентов с низким содержанием кортизола не отмечалось динамики этого показателя на этапах лечения моксонидином, тогда как у лиц с выраженной кортизолемией частота сердечных сокращений через 6 месяцев терапии снизилась более значимо, чем в целом по группе - на 10,9%, что составило 77,63±2,11 уд./мин. Таким образом, повышение частоты сердечных сокращений более 80 уд./мин может служить дифференциальным признаком гиперкортизолемии и, следовательно, повышенной активности симпатической нервной системы у пациентов с артериальной гипертензией на фоне метаболического синдрома и являться критерием назначения моксонидина у пациентов с артериальной гипертензией и метаболическим синдромом.
Полученные результаты свидетельствуют о позитивных эффектах терапии моксонидином в отношении инсулинорезистентности, без существенного влияния на уровень постпрандиального инсулина и гликемии у пациентов с кортизолемией свыше 800 нмоль/л и частотой сердечных сокращений более 80 уд./мин в покое. Применение моксонидина нежелательно у лиц с более низким содержанием кортизола крови и частотой сердечных сокращений менее 80 ударов в минуту в покое, так как на фоне терапии агонистом имидазолиновых рецепторов имеет место повышение уровня постпрандиальной гликемии, а индекс инсулинорезистентности имеет тенденцию к увеличению, что отражает планомерное развитие нарушений углеводного обмена у данной категории пациентов.
Таким образом, применение моксонидина, позволяющего достичь целевого уровня артериального давления и тем самым, вероятно, снизить частоту сердечно-сосудистых осложнений, летальность и улучшить прогноз, показано только у пациентов с исходной гиперсимпатикотонией, клиническим проявлением которой является кортизолемия более 800 нмоль/л и частота сердечных сокращений более 80 ударов в минуту в покое, ввиду доказанного его благоприятного влияния в отношении инсулинорезистентности у данной категории больных. Применение моксонидина у пациентов с низкой активностью симпатической нервной системой, клиническим проявлением которой является кортизолемия менее 800 нмоль/л и частота сердечных сокращений менее 80 ударов в минуту в покое, не желательно ввиду возможного усугубления нарушений углеводного обмена.
Предлагаемый способ дифференцированного подхода к назначению моксонидина у пациентов с артериальной гипертензией на фоне метаболического синдрома, основанный на уровне кортизола плазмы и частоте сердечных сокращений, позволит избежать назначения препарата у лиц без симпатической гиперактивности и, как следствие, снизить вероятность усугубления углеводных нарушений.
Предлагаемый способ позволяет проводить оптимальную коррекцию основных патогенетических компонентов метаболического синдрома - симпатической гиперактивности, артериальной гипертензии, инсулинорезистентности, тем самым способствуя снижению кардиоваскулярного риска, уменьшению полипрагмазии и повышая эффективность терапии артериальной гипертензии на фоне метаболического синдрома за счет оптимизации использования агониста имидазолиновых рецепторов моксонидина у пациентов с метаболическим синдромом при условии исходной кортизолемии более 800 нмоль/л и частоты сердечных сокращений более 80 ударов в дневные часы в минуту в покое.
Цитируемая литература.
1. Zimmet, P. New International Diabetes Federation (IDF) Worldwide Definition of the Metabolic Syndrome: the Rationale and the Results / P.Zimmet, K.G.Alberti, M.S.Rios // Rev. Esp. Cardiol. - 2005. - Vol.58, №12. - P.1371-1375.
2. Grundy, S.M. Drug therapy of the metabolic syndrome: minimizing the emerging crisis in polypharmacy / S.M.Grundy // Nat. Rev. Drug. Discov. - 2006. - Vol.5. - P.295-309.
3. Шилов, A.M. Ожирение и артериальная гипертония [Текст] / А.М.Шилов, А.С.Авшалумов, А.С.Галанова [и др.] // Лечащий врач. - 2008. - №2. - С.8-12.
4. Fenton, С.Moxonidine: A Review of its Use in Essential Hypertension / C.Fenton, G.M.Keating, K.A.Lyseng-Williamson // Drugs. - 2006. - Vol.66 (4). - P.477-496.
5. Демидова, Т.Ю. Моксонидин в коррекции метаболических нарушений и эндотелиальной дисфункции у больных сахарным диабетом типа 2, ассоциированным с артериальной гипертензией / Т.Ю.Демидова, А.С.Аметов, Л.В.Смагина // Обзоры клин. кардиол. - 2006. - №4. - С.21-30.
6. Abellan, J. Efficacy of moxonidine in the treatment of hypertension in obese, noncontrolled hypertensive patients / J.Abellan, M.Leal, F.Hernandez-Menarguez et al. // Kidney Int. Suppl. - 2005, Jan. - Vol.93. - P.20-24.
7. Sanjuliani, A. F. Effects of moxonidine on the sympathetic nervous system, blood pressure, plasma renin activity, plasma aldosterone, leptin, and metabolic profile in obese hypertensive patients / A.F.Sanjuliani, V.Genelhu de Abreu, J.Ueleres Braga et al. // J. Clin. Basic. Cardiol. - 2004. - №7. - P.19-25.
8. Eikelis, N. The neurobiology of human obesity [Текст] / N. Eikelis, M.Esler // Exp. Physiol. - 2005. - №90 (5). - P.673-682.
9. Чазова, И.Е. Основные положения проекта второго пересмотра рекомендаций ВНОК по профилактике, диагностике и лечению артериальной гипертензии / И.Е.Чазова, С.А.Бойцов, Д.В.Небиеридзе // Кардиоваскулярная терапия и профилактика. - 2004. - №4. - С.90-98.
10. Дзидзария, М.И. Роль инсулинорезистентности в формировании метаболического синдрома и пути ее коррекции / М.И.Дзидзария // Рус. мед. журн. - 2007. - Т.15, №11. - С.948-953.
Способ дифференцированного назначения моксонидина у пациентов с артериальной гипертензией на фоне метаболического синдрома, заключающийся в назначении препарата в дозе 0,2-0,6 мг в сутки, отличающийся тем, что моксонидин назначают только лицам с исходной гиперсимпатикотонией, клиническим проявлением которой является кортизолемия более 800 нмоль/л и частота сердечных сокращений в покое более 80 уд./мин в дневные часы.