Лечение нарушений цнс
Иллюстрации
Показать всеИзобретение относится к области медицины. Настоящее изобретение относится к способу и композиции для лечения нарушения центральной нервной системы (ЦНС) путем интраназального применения соединений, которые вызывают РНК-интерференцию. Композиция согласно изобретению содержит молекулы коротких интерферирующих нуклеиновых кислот (siPHK). При этом нарушение выбрано из деменции, болезни Альцгеймера, болезни Гентингтона и/или болезни Паркинсона, а также врожденных заболеваний, ассоциированных с мутациями в генах ЦНС. Способ включает в себя введение пациенту в случае необходимости эффективного количества одной или более siPHK согласно изобретению. Изобретение обеспечивает подавление экспрессии генов-мишеней, связанных с измененными состояниями ЦНС. 3 н. и 17 з.п. ф-лы, 8 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам и композициям для лечения патологических состояний центральной нервной системы (ЦНС) посредством интраназального введения композиций, которые изменяют экспрессию и/или активность генов, вовлеченных в проявление вышеуказанных состояний, с помощью РНК-интерференции. Композиции согласно изобретению содержат короткие интерферирующие молекулы нуклеиновых кислот (siНК) и связанных с ними соединений. В предпочтительных вариантах осуществлений интраназальную доставку молекул siНК, нацеленных на гены тау, гентингтина, ацетилхолинэстеразы, а также на мутантные аллели указанных или иных генов ЦНС, используют для лекарственных средств, производимых для лечения заболеваний ЦНС, таких как слабоумие, болезни Альцгеймера, Гентингтона и/или Паркинсона, а также врожденных заболеваний, связанных с мутациями в других генах ЦНС.
УРОВЕНЬ ТЕХНИКИ
РНКi является инструментом для изменения экспрессии гена
РНК-интерференция относится к посттранскрипционному процессу последовательность-специфического сайленсинга, опосредованного двухцепочечными РНК (дцРНК). После открытия данного феномена у растений в начале 1990-х годов Andy Fire и Craig Mello показали, что дцРНК специфически и селективно подавляют экспрессию генов крайне эффективным способом у Caenorhabditis elegans (Fire et ah, 1998). Последовательность первой цепи (смысловая РНК) совпадала с таковой соответствующего участка матричной РНК-мишени (мРНК). Вторая нить (антисмысловая РНК) была комплементарна мРНК. Образовавшаяся дцРНК выключала ген на несколько порядков более эффективно, чем соответствующие одноцепочечные молекулы РНК (в частности, антисмысловая РНК).
Процесс РНКi начинается, когда фермент DICER встречается с дцРНК и расщепляет ее на фрагменты, называемые короткими интерфирирующими РНК, или siРНК. Этот белок принадлежит семейству нуклеаз РНКазы III. Комплекс белков включает в себя эти фрагменты РНК и использует эти коды для нахождения и разрушения любых РНК в клетке с совпадающей последовательностью, таких как мРНК-мишени (см. Bosher & Labouesse, 2000; и Akashi et al., 2001).
При попытках применить РНКi для нокдауна гена было выяснено, что клетки млекопитающих развили различные способы защиты против вирусных инфекций, которые могут препятствовать использованию данного подхода. Действительно, присутствие крайне малых уровней вирусных дцРНК усиливает ответ, опосредуемый интерфероном, что приводит к общему неспецифическому подавлению трансляции, которая, в свою очередь, запускает апоптоз (Williams, 1997, Gil & Esteban, 2000).
В 2000 году сообщалось, что дцРНК специфически ингибируют три гена в ооците мыши и раннем эмбрионе. Арест трансляции и, таким образом, PKR-ответ не наблюдался, так как эмбрионы продолжали развиваться (Wianny & Zernicka-Goetz, 2000). Исследования в Ribopharma AG (Kulmbach, Germany) показали, что функционирование РНКi в клетках млекопитающих с использованием коротких (20-24 пар оснований) дцРНК для выключения генов в человеческих клетках не приводит к инициации ответа с острой фазой. Подобные эксперименты были проведены другими исследовательскими группами и подтвердили эти результаты (Elbashir et al., 2001; Caplen et al., 2001). При проверке на разнообразных нормальных и опухолевых клеточных линиях человека и мыши было определено, что короткие шпилечные РНК (shРНК) могут заставить молчать гены так же эффективно, как и их siРНК-копии (Paddison et al., 2002). Недавно для другой группы коротких РНК (21-25 пар оснований) было показано, что они опосредуют даун-регуляцию экспрессии гена. Такие РНК, короткие временно регулирующие РНК (stРНК), регулируют экспрессию гена в процессе развития Caenorhabditis elegans (см. обзор Banerjee & Slack, 2002 и Grosshans & Slack, 2002).
Исследователи использовали РНКi в нескольких системах, включая Caenorhabditis elegans, дрозофилу, трипаносомы и других беспозвоночных. Несколько групп недавно представили результаты по специфическому подавлению биосинтеза белка в различных клеточных линиях млекопитающих (особенно в клетках HeLa), показав, что РНКi может быть широко используемым методом для генного сайленсинга in vitro. На основе этих результатов РНКi быстро стала общепризнанным инструментом для проверки (идентификация и определение) функций гена. В РНКi используются короткие олигонуклеотиды дцРНК, что обеспечит понимание функций генов, чья последовательность определена частично.
Недавно Krutzfeldt и коллеги показали, что особенным образом сконструированные соединения, названные «антагомирами», могут эффективно подавлять действие микроРНК (miРНК), не кодирующих кусочков РНК, которые регулируют экспрессию гена (Krutzfeldt et al., 2005).
Интраназальная доставка продуктов siНК
Аэрозольная доставка нуклеиновых кислот к легким с использованием вирусных векторов, полимеров, поверхностно-активных веществ или инертных наполнителей была описана для лечения заболеваний легких. Были предложены подходящие нуклеиновые кислоты для интраназальной доставки, включая дцДНК, дцРНК, оцДНК, оцРНК, короткие интерферирующие РНК, микроРНК и антисмысловые РНК (см. US2005/0265927 и WO2005/115358).
Предпочтительные вещества для доставки соединений, инициирующих РНКi, в легкие содержат катионные полимеры, модифицированные катионные полимеры, липиды и подходящие для введения поверхностно-активные вещества (см. US20050008617).
Доставка в ЦНС
Интраназальная доставка для лечения заболеваний ЦНС была только достигнута с помощью ингибиторов ацетилхолинэстеразы, таких как галантамин и различные соли и производные галантамина (для примера см. US2006003989, WO2004/002402, WO2005/102275), в то время как лечение нейродегенеративных заболеваний под действием незаряженных малых интерферирующих РНК в ЦНС было получено путем хирургической имплантации катетера (см. для примера WO2005/116212). В WO02/086105 описан способ доставки олигонуклеотидов в ЦНС посредством нейронных путей, берущих начало в носовой полости. Обсуждается использование антисмысловых олигонуклеотидов, но при этом не приведено ни одной ссылки на РНК-интерференцию. В данной публикации отсутствует также описание физиологической активности доставляемых олигонуклеотдов. При внутривенном введении siРНК было показано также, что они проходят через барьер кровь-сетчатка и изменяют экспрессию генов в глазе (WO03/087367, US2005/0222061). Изменение экспрессии определенных генов, участвующих в болезни Альцгеймера, таких как β-секретаза (BACE), амилоидный белок-предшественник (APP), PIN-1, пресенилин 1 (PS-1) и/или пресенилин 2 (PS-2), а также генов, вовлеченных в болезнь Гентингтона, таких как гентингтин или атаксин-1, было достигнуто с помощью siНК как в культуре клеток, так и in vivo посредством интратекального и интрацеребровентрикулярного введения, имплантации катетеров и помп, химическим или осмотическим открытием барьера кровь-мозг или путем прямой инъекции или перфузии в артериальную систему мозга (например, в полосатое тело, кору головного мозга, - см. для примера WO2005/003350, US2005/042646, and GB2415961).
Нацеливание на ген тау посредством РНКi
[Ген] Тау играет центральную роль в наследственных и приобретенных формах возрастных деменций, включая болезнь Альцгеймера (БА) (Hardy & Selkoe, 2002; Lee et al., 2001; Mullan et al., 1992; Poorkaj et al., 1998; Hutton et al., 1998). БА характеризуется двумя главными отличительными патологическими признаками: старческими бляшками, которые содержат бета-амилоид (AP), полученный после расщепления амилоидного белка-предшественника (APP), и нейрофибриллярные узлы, которые содержат нитчатый белок тау. Редкая наследственная форма БА раскрыла существенную роль продуцирования AP в патогенезе всех форм БА, как спорадической, так и наследственной (Hardy & Selkoe, 2002). Известно, что мутации в трех генах являются причиной наследственной БА - эти гены кодируют APP, пресенилин 1 и пресенилин 2, - обладают доминантным действием в усилении продукции нейротоксического бета-амилоида (Hardy & Selkoe, 2002).
Тау, главный компонент нейрофибриллярных узлов, также играет существенную роль в патогенезе БА (Lee et al., 2001). Мутации в тау вызывают подобные наследственные доминантные нейродегенеративные заболевания, лобно-височную деменцию с паркинсонизмом, связанным с 17 хромосомой (FTDP-17). В FTDP-17 мутации тау либо изменяет последовательность белка тау, либо ведут к ошибочному сплайсингу (Lee et al., 2001; Lewis et al., 2001; Oddo et al., 2003). Нарушения в экспрессии тау также вносят вклад в некоторые другие важные нейродегенеративные расстройства, включая прогрессирующий надъядерный паралич и кортикальную-базальную ганглионарную дегенерацию (Houlden et al., 2001). Таким образом, усилия по уменьшению экспрессии тау либо в целом, либо аллель-специфическим способом могут оказаться терапевтически полезными при FTDP-17, БА или других тау-связанных заболеваниях.
Аллель-специфический сайленсинг мутаций в тау и/или связанных однонуклеотидных полиморфизмах (SNP) посредством РНКi был уже достигнут на клеточных культурах (Miller et al. 2003, 2004). Кроме того, представляющие интерес siРНК были успешно доставлены на мышиной модели посредством инъекции в хвостовую вену (US2004/0241854).
Предшествующее описание приведено для пояснения специалистам из смежных областей понятий, относящихся к РНКi, а также к подходам для доставки в ЦНС. Пояснения представлены только для понимания последующего изобретения и не является признанием того, что любая из описанных публикаций относится к известному уровню техники по отношению к заявленному изобретению. В данной области есть большая потребность в удобных способах, посредством которых молекулы siНК могут быть доставлены в ЦНС, и в результате подобная доставка приводит к РНК-интерферирующей активности. Авторы изобретения разработали технологии для изменения экспрессии генов in vivo для лечения заболеваний ЦНС интраназальным путем посредством нацеливания молекул siРНК на ЦНС.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способы и композиции для лечения патологий центральной нервной системы (ЦНС) путем интраназального применения соединений, которые вызывают РНК-интерференцию.
Композиции согласно изобретению содержат молекулы коротких интерферирующих нуклеиновых кислот (siНК) и связанных соединений, включая, но не ограничиваясь ими, короткие интерферирующие РНК (siРНК), двухцепочечные РНК (дцРНК), короткие шпилечные РНК (shРНК), микроРНК (miРНК), антагомиры и молекулы, способные опосредовать РНК-интерференцию.
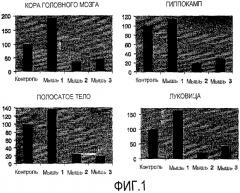
Способы согласно изобретению включают в себя введение пациенту, в случае необходимости, эффективного количества одной или более siНК для лечения патологических состояний ЦНС. В предпочтительных вариантах осуществлений способы согласно изобретению включают в себя интраназальное применение терапевтических siРНК. Заслуживает большого внимания то, что композиции согласно изобретению могут быть использованы при получении лекарственного средства для лечения патологий ЦНС, включая деменцию, болезни Альцгеймера, Гентингтона и/или Паркинсона, а также врожденных заболеваний, связанных, помимо прочего, с мутациями генов ЦНС. Патологии и заболевания, которые могут быть подвержены лечению в соответствии со способами изобретения, предпочтительно включают те, которые действуют на гиппокамп, кору головного мозга и/или полосатое тело.
При одном варианте осуществления настоящее изобретение относится к siНК или к подобным химически синтезированным веществам, которые направленно препятствуют экспрессии мРНК с генов тау, гентингтина или ацетилхолинэстеразы, а также других мутантных аллелей указанных или других генов ЦНС, которые в конечном счете модулируют количество продуцируемого белка. В предпочтительном варианте осуществления композиции согласно настоящему изобретению применяют интраназально для специфического нацеливания на аномальный вариант представляющего интерес гена в ЦНС.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение будет описано только на примере, со ссылкой на соответствующие чертежи.
Фигура 1. Уровень экспрессии GFP после интраназального введения мыши 0,9% NaCl (контроль), 1 нмоль/мкл siРНК-GFP (мышь 1), 2 нмоль/мкл siРНК-GFP (мышь 2) и 2 нмоль/мкл siРНК-GFP + TransIT-TKO (мышь 3). Данные проведенного анализа коры головного мозга, гиппокампа, полосатого тела и луковицы ЦНС.
Фигура 2. siРНК уменьшает уровни белка GFP. siРНК, предназначенная против GFP, была интраназально введена трансгенным GFP-мышам. Животных умерщвляли в разное время, а ткани собирали и анализировали методом Вестерн-блотинга. Контрольный солевой раствор вводили мышам CI, CII и CIII в качестве контроля. Значения показывают уровни экспрессии белка GFP, нормализованные на белок GFP у контрольных мышей.
Фигура 3. siРНК уменьшает уровни мРНК GFP. siРНК, предназначенная против мРНК GFP, была интраназально введена трансгенным GFP-мышам. Животных умерщвляли в разное время, и собирали мРНК из разных тканей. На фигуре 3 показана экспрессия мРНК GFP в полосатом теле и коре головного мозга, анализ которой осуществляли методом количественной ПЦР.
Фигура 4. siРНК уменьшает уровни транскриптов гена MAPT с различными мутациями. siРНК, сконструированные против различных мутаций, были проанализированы, SEQ ID NO:159 (мутация P301L) и SEQ ID NO:160 (мутация R406W). РНК получали из клеток, обработанных специфическими siРНК в течение 48 ч. Образцы анализировали методом количественной ПЦР, используя специфические праймеры для MAPT (описаны в тексте). Значения соответствуют среднему уровню экспрессии различных транскриптов, нормализованных на 18S, относительно трансфекции клеток пустым вектором в качестве контроля.
Фигура 5. siРНК уменьшает уровни транскриптов гена MAPT. РНК получали из клеток MDA-MB-435, обработанных различными siРНК в течение 24, 48 ч и 72 ч. Образцы анализировали методом ПЦР в режиме реального времени, используя специфические праймеры, описанные в тексте. Значения соответствуют среднему уровню экспрессии различных транскриптов, нормализованных на 18S, относительно трансфекции клеток пустым вектором в качестве контроля.
Фигура 6. siРНК SEQ ID NO:160, сконструированная против мутации R406W, уменьшает уровни белка MAPT in vivo. siРНК SEQ ID NO:160 интраназально вводили трансгенным мышам MAPT. Животных умерщвляли через семь дней после введения siРНК, а ткани гиппокампа собирали и анализировали методом Вестерн-блоттинга.
Фигура 7. Список мутаций и номера доступов последовательности гена MAPT.
Фигура 8. Список последовательностей участков MAPT, на которые нацелены siНК согласно изобретению, а также дуплексов siНК, нацеленных на данные участки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для лечения патологий центральной нервной системы (ЦНС) путем интраназального применения соединений, которые вызывают РНКi. Композиции согласно изобретению содержат молекулы коротких интерферирующих нуклеиновых кислот (siНК), которые модулируют экспрессию генов-мишеней, связанных с измененными состояниями ЦНС.
Способы согласно изобретению включают в себя введение пациенту, в случае необходимости, эффективного количества одной или более siНК согласно изобретению.
Конструирование siРНК
Ген «таргетируют» с помощью siНК согласно изобретению [или siНК согласно изобретению направляют на ген-мишень], при этом siНК селективно уменьшает или ингибирует экспрессию гена или аллеля гена, вовлеченного в патологическое состояние. Альтернативно siНК таргетирует ген, когда siНК гибридизуется с транскриптом при условии точного соответствия. siНК могут быть протестированы на способность к таргетингу гена либо in vitro, либо in vivo.
В 1999 г. Tuschl et al. раскрыл эффект сайленсинга с помощью siРНК, показав, что их эффективность есть функция от длины дуплекса, длины 3'-выступающих концов и последовательностей данных выступающих концов.
Правильный выбор гомологичной области внутри гена-мишени имеет большую значимость для точного сайленсинга. Короткие фрагменты последовательности гена-мишени (например, 19-40 нуклеотидов в длину) выбраны как последовательность siНК согласно изобретению. Альтернативно, вариабельный участок представляющего интерес аллеля выбирают в качестве мишеней для соединений siНК. При одном варианте осуществления siНК представляет собой siРНК. При данном варианте осуществления короткий фрагмент последовательности гена-мишени представляет собой фрагмент мРНК гена-мишени. В предпочтительных вариантах осуществлений критерии для выбора фрагмента последовательности из мРНК гена-мишени в качестве молекулы siРНК-кандидата включают в себя следующее: 1) последовательность мРНК из гена-мишени должна по меньшей мере на 50-100 нуклеотидов отстоять от 5'- или 3'-конца природной молекулы мРНК; 2) последовательность из мРНК гена-мишени должна иметь G/C-состав между 30% и 70%, более предпочтительно около 50%; 3) последовательность из мРНК гена-мишени не должна содержать повторяющихся последовательностей (например, AAA, CCC, GGG, TTT, AAAA, CCCC, GGGG, TTTT); 4) последовательность из мРНК гена-мишени должна быть доступна в мРНК; и 5) последовательность из мРНК гена-мишени должна быть уникальна для гена-мишени. Последовательность фрагмента из мРНК гена-мишени может соответствовать одному или более вышеуказанным установленным критериям. В предпочтительных вариантах осуществлений siРНК имеет G/C-состав менее 60% и/или в ней отсутствуют повторяющиеся последовательности.
Практически представляющий интерес ген вводят в виде нуклеотидной последовательности в программу для предсказания, в которой учитываются все переменные, описанные выше для конструирования оптимальных олигонуклеотидов. Данная программа сканирует любую нуклеотидную последовательность мРНК для выявления участков, пригодных для нацеливания siРНК. Результатом данного анализа является оценка возможного олигонуклеотида siРНК. Наиболее подходящие используют для конструирования олигонуклеотидов двухцепочечной РНК (обычно длиной в 21 п.н., хотя другие длины также возможны), которые обычно получают путем химического синтеза. Несколько химических модификаций, которые известны в данной области, направленные на увеличение стабильности или доступности олигонуклеотидов дцРНК, также возможны.
Олигонуклеотиды-кандидаты могут быть далее отобраны на основе межвидового консерватизма с тем, чтобы облегчить переход клинических исследований от животных к человеку.
Дополнительно к siНК, которые полностью комплементарны области-мишени, вырожденные последовательности siНК могут быть использованы также для нацеливания на гомологичные участки. В WO2005/045037 описано конструирование молекул siНК для нацеливания на такие гомологичные последовательности, например, путем введения неканонических пар оснований, для примера, мисматчей и/или болтающихся пар оснований, которые могут обеспечить дополнительные таргетируемые последовательности. В примерах, где определены мисматчи, неканонические пары оснований (например, мисматчи и/или вырожденные основания) могут быть использованы для синтеза молекул siНК, которые нацелены более чем на одну последовательность. В неограничивающем примере неканонические пары оснований, такие как UU- или CC-пары оснований, используют для образования молекул siНК, способных к нацеливанию на последовательности, у которых наблюдается гомология последовательностей. По существу, одним из преимуществ использования siНК согласно изобретению является то, что одна и та же siНК может содержать последовательность нуклеиновой кислоты, которая консервативна между гомологичными генами. В данном подходе одна siНК может быть использована для ингибирования экспрессии более чем одного гена, вместо того, чтобы использовать более чем одну молекулу siНК для нацеливания на разные гены.
Идентичность последовательности может быть подсчитана путем сравнения последовательностей и алгоритмов выравнивания, известных в данной области (см. Gribskov and Devereux, Sequence Analysis Primer, Stockton Press, 1991, и цитируемые здесь ссылки), и подсчета процента различий между нуклеотидными последовательностями, например, с помощью алгоритма Smith-Waterman, внедренного в программное обеспечение BESTFIT, используя значения по умолчанию (например, University of Wisconsin Genetic Computing Group). Предпочтительна более чем 90%, 95% или 99% идентичность последовательностей между siНК и областью гена-мишени. Альтернативно комплементарность между siНК и природной РНК может быть определена функционально путем гибридизации, а также по способности уменьшать или ингибировать экспрессию гена-мишени. Способность siНК воздействовать на экспрессию гена может быть определена опытным путем либо in vivo, либо in vitro.
В соответствии с изобретением предпочтительными молекулами siНК являются двухцепочечные. В одном из вариантов осуществления двухцепочечная молекула siНК содержит затупленные концы. В другом варианте осуществления двухцепочечная молекула siНК содержит выступающие нуклеотиды (например, 1-5 выступающих нуклеотидов, предпочтительно, 2 выступающих нуклеотида). В конкретном варианте осуществления выступающими нуклеотидами являются 3'-выступающие концы. В другом конкретном варианте осуществления выступающими нуклеотидами являются 5'-выступающие нуклеотиды. Любые типы нуклеотидов могут быть частью выступающего конца. В одном из вариантов осуществления выступающий нуклеотид или нуклеотиды являются рибонуклеиновыми кислотами. В другом варианте осуществления в качестве выступающего нуклеотида или нуклеотидов могут выступать дезоксирибонуклеиновые кислоты. В предпочтительном варианте осуществления в качестве выступающего нуклеотида или нуклеотидов могут выступать тимидиновые нуклеотиды. В другом варианте осуществления в качестве выступающего нуклеотида или нуклеотидов могут выступать модифицированные или неклассические нуклеотиды. Выступающие нуклеотид или нуклеотиды могут иметь неклассические внутринуклеотидные связи (например, отличные от фосфодиэфирных связей).
Синтез дуплексов siНК
siНК могут быть синтезированы любым из известных способов, известных в данной области. Предпочтительно РНК синтезируют химически, используя соответствующим образом защищенные фосфорамидаты рибонуклеозидов и серийный ДНК/РНК-синтезатор. Кроме того, siРНК могут быть получены от коммерческих поставщиков, включая, но не ограничиваясь ими, Proligo (Гамбург, Германия), Dharmacon Research (Лафейетт, CO, США), Glen Research (Sterling, VA, США), ChemGenes (Ашленд, MA, США), и Cruachem (Glasgow, UK), Qiagen (Германия) Ambion (США) и Invitrogen (Шотландия). Альтернативно, молекулы siНК в соответствии с изобретением могут быть экспрессированы в клетках в результате трансфекции клеток векторами, содержащими обратно комплементарную последовательность siНК под контролем промотора. После экспрессии siНК можно выделить из клеток, используя хорошо известные в данной области технологии.
Этап отжига необходим при работе с одноцепочечными молекулами РНК. Для отжига РНК 30 мкл 50 мкМ раствора каждого РНК-олигонуклеотида объединяют с 100 мМ ацетатом калия, 30 мМ HEPES-KOH с pH 7,4, с 2 мМ ацетатом магния. Растворы затем инкубируют в течение 1 минуты при 90°C, центрифугируют в течение 15 секунд и инкубируют в течение 1 часа при 37°С.
В вариантах осуществления, когда siРНК представляет собой короткую шпилечную РНК (shРНК), две нити молекулы siРНК могут быть связаны линкерным участком (например, нуклеотидным линкером или ненуклеотидным линкером).
Химические модификации siНК.
В соответствии с изобретением siНК могут включать в себя один или более модифицированных нуклеотидов и/или нефосфодиэфирные связи. Химические модификации, известные в данной области, могут увеличивать стабильность, доступность и/или клеточное поглощение siНК. Специалист может знать другие типы химических модификаций, которые могут быть введены в молекулы РНК (см. международные публикации WO03/070744 и WO2005/045037 для общего представления о типах модификаций).
В одном варианте осуществления модификации могут быть использованы для обеспечения повышенной стойкости к деградации или улучшенному поглощению. Примеры подобных модификаций включают фосфоротиоатные межнуклеотидные связи, 2'-O-метилрибонуклеотиды (в особенности на смысловой цепи двухцепочечной siРНК), 2'-дезокси-фторрибонуклеотиды, 2'- дезоксирибонуклеотиды, "универсальные основания" нуклеотидов, 5-C-метил нуклеотиды, а также введение обращенных остатков дезоксиоснований (см. в целом GB2406568).
В другом варианте осуществления модификации могут быть использованы для усиления стабильности siРНК или для увеличения эффективности нацеливания. Модификации включают в себя химическую сшивку между двумя комплементарными нитями siРНК, химическую модификацию 3'- или 5'-конца цепи siРНК, модификации сахара, модификации оснований нуклеотида и/или модификации боковых связей, 2'-фтор-модифицированные рибонуклеотиды и 2'-дезоксирибонуклеотиды (см. в целом международную публикацию WO2004/029212).
В другом варианте осуществления модификации могут быть использованы для увеличения или уменьшения аффинности для комплементарных нуклеотидов в мРНК-мишени и/или в комплементарной цепи siНК (см., в целом, международную публикацию WO2005/044976). Например, немодифицированный пиримидиновый нуклеотид может быть замещен на 2-тио-, 5-алкинил-, 5-метил- или 5-пропинилпиримидин. Кроме того, немодифицированный пурин может быть замещен на 7-деза-, 7-алкил- или 7-алкенилпурин.
В другом варианте осуществления, в котором siНК представляет собой двухцепочечную siРНК, 3'-концевые выступающие нуклеотиды замещены на дезоксирибонуклеотиды (см., в целом, Elbashir et al., 2001).
В одном варианте осуществления изобретение характеризуется двухцепочечной молекулой короткой интерферирующей нуклеиновой кислоты (siНК), которая снижает экспрессию гена-мишени, предпочтительно, экспрессию гена в ЦНС, более предпочтительно, гена MAPT, где сборка молекулы siНК происходит из двух отдельных олигонуклеотидных фрагментов, где один фрагмент содержит смысловой участок, а второй фрагмент содержит антисмысловой участок молекулы siНК. В другом варианте осуществления приблизительно 19 нуклеотидов каждого фрагмента молекулы siНК представляют собой пары оснований, комплементарных нуклеотидам другого фрагмента молекулы siНК, и где два 3'-концевых нуклеотида каждого фрагмента молекулы siНК не представляют собой пары оснований нуклеотидов другого фрагмента молекулы siНК (то есть молекула siНК содержит выступающие концы по меньшей мере с 2 нуклеотидами на каждой цепи). В одном варианте осуществления каждый из двух 3'-концевых нуклеотидов каждого фрагмента молекулы siНК представляет собой 2'-дезоксипиримидиновый нуклеотид, такой как 2'-дезокситимидин. В другом варианте осуществления все нуклеотиды в количестве 21 нуклеотида каждого фрагмента молекулы siНК являются парами оснований, комплементарных нуклеотидам другого фрагмента молекулы siНК. В другом варианте осуществления приблизительно 19 нуклеотидов антисмысловой области представляют собой парные основания для нуклеотидной последовательности или части РНК, кодируемой геном-мишенью. В другом варианте осуществления около 21 нуклеотида антисмысловой области спарены с нуклеотидной последовательностью или частью РНК, кодируемой геном-мишенью. В любом из вышеописанных вариантов осуществления 5'-конец фрагмента, включающий в себя указанный антисмысловой участок, может дополнительно содержать фосфатную группу.
В одном варианте осуществления изобретение характеризуется молекулой siНК, в которой либо одна, либо обе - и смысловая, и антисмысловая - цепи содержат одну или более, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, предпочтительно, от 1 до 5, фосфоротиоатных межнуклеотидных связей, и/или одну или более (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более), предпочтительно, от 1 до 5, 2'-дезокси, 2'-O-метил, 2'-дезокси-2'-фтор, и/или приблизительно один или более (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более), предпочтительно, от 1 до 5 нуклеотидов, модифицированных универсальных оснований и дополнительно концевую молекулу кэпа на 3'-конце, 5'-конце или на обоих, 3'- и 5'-концах одной или обеих смысловой или антисмыловой цепей. В другом варианте осуществления один или более, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, предпочтительно, от 1 до 5 пиримидиновых нуклеотидов смысловой и/или антисмыловой цепи siНК являются химическими модифицированными 2'-дезокси-, 2'-O-метил-, 2'-дезокси-2'-фтор-нуклеотидами, дополнительно одним или более, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более, предпочтительно, от 1 до 5, фосфоротиоатных межнуклеотидных связей, и/или концевых молекул кэпа на 3'-конце, на 5'-конце или на обоих, 3'- и 5'-концах, которые присутствуют на одной или на разных цепях.
В одном варианте осуществления для изобретения характерно то, что химически модифицированная молекула короткой интерферирующей нуклеиновой кислоты (siНК) содержит приблизительно от 1 и приблизительно до 5 или более (в частности, приблизительно от 1, 2, 3, 4, 5 или более) фосфоротиоатных межнуклеотидных связей в каждой цепи молекулы siНК.
В другом варианте осуществления для изобретения характерно то, что молекула siНК содержит 2'-5'-межнуклеотидные связи. 2'-5' межнуклеотидная(ые) связь(и) может находиться на 3'-конце, на 5'-конце или на обоих, 3'- и 5'-концах, одной или обеих нитей последовательности siНК. Кроме того, 2'-5'-межнуклеотидная(ые) связь(и) может находиться в различных других положениях внутри одной или обеих цепей последовательности siНК, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, включая каждую межнуклеотидную связь пиримидинового нуклеотида на одной или обеих цепях последовательности молекулы siНК; в различных положениях внутри одной или обеих цепей последовательности siНК может содержаться 2'-5'-межнуклеотидная(ые) связь(и), например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, может содержаться 2'-5'-межнуклеотидная(ые) связь(и).
В одном варианте осуществления молекула siНК согласно изобретению может содержать один или более (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) блокирующих нуклеиновую кислоту (LNA) нуклеотидов, например, на 5'-конце, на 3'-конце, на обоих, 5'- и 3'-концах, или их комбинациях, молекулы siНК.
В другом варианте осуществления молекула siРНК согласно изобретению содержит один или более (например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) ациклических нуклеотидов, например, на 5'-конце, на 3'-конце, на обоих, 5'- и 3'-концах, или их комбинациях, молекулы siНК.
В одном варианте осуществления для изобретения характерно то, что согласно изобретению химически модифицированная молекула короткой интерферирующей нуклеиновой кислоты (siНК), в которой любые (например, один или более, или все) пиримидиновые нуклеотиды, присутствующие либо на одном, либо на обоих, смысловом или антисмысловом, участках, являются 2'-дезокси-2'-фторпиримидиновыми нуклеотидами, и в которой любые (например, один или более, или все) пуриновые нуклеотиды, присутствующие либо на одном, либо на обоих, смысловом или антисмысловом, участках, являются 2'-дезоксипуриновыми нуклеотидами. Кроме того, любые нуклеотиды, содержащие 3'-концевой выступающий нуклеотид, которые присутствует на указанном смысловом или антисмысловом участке, представляет собой 2'-дезоксинуклеотиды.
В одном варианте осуществления для изобретения характерно то, что согласно изобретению химически модифицированная молекула короткой интерферирующей нуклеиновой кислоты (siНК), в которой любые (например, один или более, или все) пиримидиновые нуклеотиды, присутствующие либо на одном, либо на обоих, смысловом или антисмысловом, участках, являются 2'-дезокси-2'-фторпиримидиновыми нуклеотидами, и в которой любые (например, один или более, или все) пуриновые нуклеотиды, присутствующие либо на одном, либо на обоих, смысловом или антисмысловом, участках, являются 2'-O-метилпуриновыми нуклеотидами. Кроме того, любые нуклеотиды, содержащие 3'-концевой выступающий нуклеотид, которые присутствует на указанном смысловом или антисмысловом участке, представляет собой 2'-дезоксинуклеотиды.
В одном варианте осуществления для изобретения характерно то, что химически синтезированная двухцепочечная молекула РНК, которая направляет расщепление РНК-мишени, предпочтительно, РНК, которая экспрессируется в ЦНС, более предпочтительно, РНК MAPT, посредством РНК интерференции, в которой каждая нить указанной молекулы РНК имеет длину приблизительно от 21 до 23 нуклеотидов; одна нить молекулы РНК содержит нуклеотидную последовательность, обладающую достаточной комплементарностью к РНК-мишени, с тем, чтобы направить расщепление РНК-мишени посредством РНК интерференции; и в которой по меньшей мере одна нить молекулы РНК содержит один или более описанных здесь химически модифицированных нуклеотидов, таких как дезоксинуклеотиды, 2'-O-метил-нуклеотиды, 2'-дезокси-2'-фтор-нуклеотиды, 2'-O-метоксиэтил-нуклеотиды и т.д.
В одном варианте осуществления для изобретения характерно то, что лекарственный препарат содержит молекулу siНК согласно изобретению.
В одном варианте осуществления для изобретения характерно то, что активный ингредиент содержит молекулу siНК согласно изобретению.
В одном варианте осуществления для изобретения характерно то, что двухцепочечная молекула короткой интерферирующей нуклеиновой кислоты (siНК) осуществляет понижающую регуляцию экспрессии гена-мишени, предпочтительно, экспрессию гена в ЦНС, более предпочтительно, гена MAPT, и в котором молекула siНК содержит одну или более химических модификаций, и каждая нить двухцепочечной siНК имеет длину приблизительно от 18 до 28 или более (например, приблизительно 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 или более) нуклеотидов.
В одном варианте осуществления для изобретения характерно то, что двухцепочечная молекула короткой интерферирующей нуклеиновой кислоты (siНК), которая снижает экспрессию гена-мишени, предпочтительно, экспрессию гена в ЦНС, более предпочтительно, гена MAPT, в которой одна из нитей двухцепочечной молекулы siНК представляет собой антисмысловую нить, которая содержит нуклеотидную последовательность, комплементарную нуклеотидной последовательности РНК-мишени или части ее, а другая нить представляет собой смысловую нить, которая содержит нуклеотидную последовательность, комплементарную нуклеотидной последовательности антисмысловой нити и в которой большинство пиримидиновых нуклеотидов, присутствующих в двухцепочечной молекуле siНК, содержит модификацию сахарного остатка. Предпочтительно, чтобы РНК-мишень или часть ее кодировала белок или часть его. Кроме того, 5'- конец антисмысловой цепи включает в себя фосфатную группу. Нуклеотидная последовательность антисмысловой цепи или ее части может быть комплементарна нуклеотидной последовательности нетранслируемой области РНК-мишени или ее части.
В одном варианте осуществления каждая нить молекулы siНК содержит приблизительно от 18 до 29 или более (например, приблизительно 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 или более) нуклеотидов, и каждая нить содержит по меньшей мере приблизительно 18 нуклеотидов, которые комплементарны нуклеотидам другой цепи. В одном варианте осуществления сборка молекулы siНК происходит из двух отдельных олигонуклеотидных фрагментов, где один фрагмент содержит нуклеотидную последовательность антисмысловой нити молекулы siНК, а второй фрагмент содержит нуклеотидную последовательность смыслового участка молекулы siНК. В одном варианте осуществления смысловая цепь соединена с антисмысловой цепью через линкерную молекулу, такую как полинуклеотидный линкер или ненуклеотидный линкер. В дальнейшем варианте осуществления пиримидиновые нуклеотиды, присутствующие в смысловой нити, представляют собой 2'-дезокси-2'-фтор-пиримидиновые нуклеотиды, а пуриновые нуклеотиды, присутствующие в смысловой области, представляют собой 2'-дезокси-пуриновые нуклеотиды. В другом варианте осуществления пиримидиновые нуклеотиды, присутствующие в смысловой нити, представляют собой 2'-дезокси-2'-фтор-пиримидиновые нуклеотиды, а пуриновые нуклеотиды, присутствующие в смысловой области, представляют собой 2'-О-метилпуриновые нуклеотиды. В еще одном варианте осуществления пиримидиновые нуклеотиды, присутствующие в антисмысловой нити, представляют собой 2'-дезокси-2'-фтор-пиримидиновые нуклеотиды, а любые пуриновые нуклеотиды, присутствующие в антисмысловой нити, представляют собой 2'-дезокси-пуриновые нуклеотиды. В другом варианте осуществления антисмысловая нить содержит один или более 2'-д