Полимерный комплекс хитозана с тетрахлоридом платины
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к полимерному комплексу хитозана с тетрахлоридом платины, содержащему в своей структуре 6,18-6,5 мас.% платины, который обладает противоопухолевой активностью. Технический результат изобретения заключается в снижении побочных реакций, повышении эффективности лечения, ускорении снятия тяжелых симптомов, расширении спектра действия. 5 ил.
Реферат
Изобретение относится к медицине, а именно к фармации, и связанно с проблемой использования препаратов на основе платины, в химиотерапевтических методах лечения онкологических заболеваний.
Современные исследования свидетельствуют об эффективности и целесообразности использования гомологов и аналогов хитозана (ХТЗ), для совершенствования лечения и профилактики онкологических заболеваний.
В качестве противоопухолевого препарата используют ХТЗ выделенный из гриба Actinomucorgenus с ММ - 5-14·104 с высокой СДА [Wan Li qing, Hu Fu -qiang, Yuan Hong. Изучение захвата клетками A 549 наночастич на основе олигосахарида хитозана // Yaoxue xuebao. 2004. #3. Р.227-231. РЖХ 07.01-04Т.136]. Конъюгаты водорастворимых низкомолекулярных хитозанов и его аналогов с противоопухолевыми препаратами дают эффект преимущественной транспортировки субстанций непосредственно в опухоль, с последующим контролируемым их высвобождением; при этом значительно снижаются побочные эффекты. Сукцинат, полученный на основе низкомолекулярного ХТЗ, обладает сродством по отношению к клеткам лейкемии, что определяет возможность использования его в качестве носителя противоопухолевых препаратов [Wang Yinqong, Li Yinqxia a.o. // Gaofenzi xuebao. 2004. #3. Р.378-382. РЖХ 05.23-190, 49. Wang Li, Wang Qin a.o // Yingqong huaaue. 2005. V.22 #6. P.688-690. РЖХ 06.09-19Б.2.484].
Установлена противоопухолевая активность водорастворимых и гидрофобных форм N-сукцинатов ХТЗ [Kato Yoshinori, Onishi Hiraku, Machida Yoshiharu. N-succinyl-chitosan as a drug carrier: Water-insoluble and water-soluble conjugutes / Biomaterials. 2004 #5. P.907-915].
В процессе лечения лейкозов Р-378 отмечена высокая эффективность фтордезоксиуридина и циторабина, используемых в виде конъюгатов с ХТЗ. Конъюгат митомицина с гликозилированным ХТЗ обладает активностью, идентичной исходной субстанции при значительном снижении побочных эффектов. Конъюгат митомицина С с карбоксиметилхитином при химиотерапевтическом воздействии на организм вызывает полную регрессию меланомы В-16, для конъюгата митомицина С с N сукцинил ХТЗ характерна особая эффективность, направленность транспортировки субстанции к мишени опухолевой ткани, что обеспечивает селективную деструктивную активность препарата [Kato Yoshinori, Onishi Hiraku, Machida Yoshiharu. Contribution of chitosan and its derivatives to cancer chemotherapy // In vivo. 2005. #1. P.301-310].
Предложены модифицированные формы 5-фторурацила, где в качестве носителя использованы аналоги ХТЗ, отмечено селективное сорбирование таких препаратов вокруг раковых клеток и ингибирование их роста. Конъюгат 5-фторурацила и бромацетилированного ХТЗ с ММ 1,98-106, содержащий 16,4% связанной субстанции, использован в качестве эффективного противоопухолевого препарата, определена скорость ее высвобождения [Li He-ping. // Changsha ligong daxue xuebao. Ziran kexue ban. 2005. V.2. #4. Р.84-88. РЖХ 07.12-190.169].
Микросферы на основе ХТЗ пространственно структурированные формальдегидом, загруженные 5-фторурацилом (38,5%), применялись в условиях интроназального введения. Отмечено быстрое высвобождение активного компонента в начальном периоде и с медленной последующей его диффузией [Zhehg Ai-ping. // Journal of China Pharmaceutical University. 2004. V.35. #4. P.318-323. РЖХ 05.22-190.37]. Противоопухолевый препарат эпирубицин в виде конъюгата с хитозаном использован при лечении лейкоза Р-388, для конъюгата отмечено возрастание онкостатической активности, выживаемости животных и снижение побочных эффектов [Тодорова Н. Исследования противоопухолевого действия оригинального конъюгата антрациклинового противоопухолевого антибиотика эпирубицина с хитозаном. // Мед. прекл. онкол. и радиол. 2004, №1. С.3-7]. В ряде исследований отмечено определяющие значение ХТЗ и его аналогов в качестве модуляторов в условиях воздействия на опухоль платиносодержащих компонентов, на примере при перорального и интроперитонеального последовательном введении ХТЗ и цисплатина. Отмечается сохранение противоопухолевой активности при снижении побочных эффектов угнетения иммунных свойств, эритро- и лецкопоэза, снижение токсического действия на печень и почки на примере саркомы 180 [Yoshiyuki Kimura, Mitsuko Onoyama, Toshiki Sera and Hiromichi Okuda. Antitumour Activity and Side Effects of Combined Treatment with Chitosan and Cisplatin in Sarcoma 180 - Bearing Mice. // J.Pharm. Pharmacol. 2000. #4. 52: 883-890].
В качестве противоопухолевого препарата предложено синтезированные комплексы цисплатина с гликольхитозаном, инкорпорированные в гидрогели, микрочастицы и наночастицы на основе этого полимераналога; исследованы условия высвобождения субстанции и структуры указанных матриц [Jueun Cha, Won Bum Lee and Chong Rae Park. Preparation and Characterization of Cisplatin - Incorporated Chitosan Hydrogels, Microparticles and Nanoparticles. // Macromolecular Research, Vol.14, N.5, pp.573-578 (2006)].
Из числа наиболее близких к заявленному объекту производных, содержащих в своем составе платину, выбран цисплатин.
Известен противоопухолевой препарат цисплатин, относящийся к группе алкилирующих противоопухолевых средств, который применяют для лечения: герминогенные опухоли женщин и мужчин - рак яичников и яичка, мелкоклеточный и немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, рак мочевого пузыря, рак шейки матки, остеосаркома, меланома, нейробластома, рак пищевода.
Применение цисплатина может вызывать нефротоксичность, гипомагниемию, гипокальцинемию, гипонатриемию, гипокалиемию, гипофосфатемию, тошноту, рвоту, боль в области живота, диарею, запор, миелосупресию, анемию. Также наблюдается одно- и двухсторонний шум в ушах с потерей или без потери слуха, вестибулотоксические свойства, периферические нейропатии, судороги, невнятная речь, потеря памяти и вкуса, симптом Лермитта, аллергические реакции, неврит зрительного нерва, отек соска зрительного нерва, корковая слепота, изменения в восприятии цвета, гепатотоксичность, аритмии, увеличение риска возникновения инфарктов миокарда, ишемической болезни, аритмий, ортостатической гипотонии, аллопеции, лихорадка, икота, нарушение сперматогенеза. При попадании под кожу препарата возможно развитие флебита, целлюлита, некроза кожи [Аннотация к препарату].
Задачей изобретения является - улучшения качества жизни и удлинение ее продолжительности.
Техническим результатом является снижение побочных действий, повышение эффективности лечения, ускорение снятия тяжелых симптомов, расширение спектра действия.
Указанный технический результат достигается применением полимерного комплекса хитозана с тетрахлоридом платины, содержащего в своей структуре 6,18-6,5% (мас.) платины, обладающего противоопухолевой активностью.
Приведенные данные позволяют определить возможность получения комплексного соединения платины с ХТЗ, в частности с олигомерным ХТЗ, проявляющим противоопухолевую активность, и отмечающимся снижением побочных эффектов в сравнении с применяющимся в химиотерапии онкозаболеваний комплекса на основе PlCl4, цисплатина.
Комплекс ХТЗ с PlCl4, синтезирован при использовании полимерного компонента олигохитозана со степенью полимеризации (СП) в диапазоне 7-15 глюкозных единиц, которые получали путем селективного окисления товарного хитозана ММ>400 КДА известным пероксидным методом. В качестве платиносодержащего препарата применяли тетрахлорид платины (ТУ 2625 -060-00205067-2004). Синтез полимерного комплекса платины с хитозаном осуществляли методом соосаждения с последующим выведением и очисткой целевого водорастворимого продукта способами фазового разделения и селективной экстракции. Концентрация металлоионов в синтезированном комплексе на основе ХТЗ определялась после удаления органической его части («мокрого сжигания») и количественного определения конечного в этом варианте окисления продукта - PlCl4.
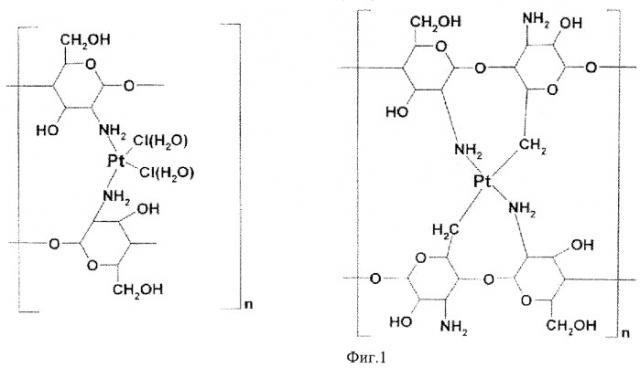
Структура полученного полимерного комплекса изучалась с использованием ИК-спектра, спектров ЯМР, данных рентгеноструктурного и элементарного анализа. Для полученного комплекса представлены две наиболее вероятные структурные модели (фиг.1).
Для проведения биологических испытаний на мелких лабораторных животных, были приготовлены жидкие лекарственные формы, предназначенные для перорального введения.
Данный препарат был использован в монотерапии лимфосаркомы Плисса, на мелких лабораторных животных при пероральном введении. В условиях биологических испытаний оценивалась онкостатичность, а также корреляция побочных эффектов - нефротоксичность, гепатотоксичность, степень интоксикации.
Пример №1
Комплекс ХТЗ с PlCl4.
Материалы: PlCl4 с массовой долей 54%; категория - чистая, температура разложения 370°C, растворимая в воде и этаноле 95%; хитозан низкомолекулярный [η] 1,3-1,6 дцл/г или олигохитозан (степень полимеризации 7-15 глюкозных единиц).
А. 0,4 ХТЗ (0,0024 моль; [η] 1,3 дцл/г, 10 мл 1% AcOH поместили в плоскодонную колбу объемом 200 мл, снабженную обратным холодильником, перемешивали при 45°C до получения однородного раствора. 0,05 г (0,00015 моль) тетрахлорида платины растворили в 100 мл дистиллированной воды. Полученный раствор объеденили с раствором ХТЗ в 1% AcOH при перемешивании, которое продолжали при термостатировании 70-75°C в течение 120 мин. Соотношение ХТЗ:PlCl4 16:1 моль; 8:1 масс образовалась гомогенная жидкая система, окрашенная в желтый цвет, которую выдержали в течение 24 часов при температуре окружающей среды. Фильтрат смеси вакуумировали при 60-70°C (-0,9 атм) до образования сухого остатка коричневого цвета. Остаток обработали двукратно 50% и 90% этанола (экстракция остатка PlCl4). Твердую фазу образовавшейся суспензии отделили фильтрацией. Вакуумирование фильтрата (70°C и -0,4 атм) показало практически полное отсутствие экстрагировавшегося реагента (PlCl4), твердую фазу на фильтре высушили при 50-60°C и -0,8 атм. Выделен твердый слабоокрашенный аморфный продукт - полимерный комплекс PlCl4 с ХТЗ. Выход 0,441 г, 96,9% от теоретического.
0,26 г полученного платиносодержащего комплекса ХТЗ поместили в колбу Къельдаля, емкостью 50 мл и добавили 20 мл смеси концентрированных азотной и хлорной кислот (5:3). Образовавшуюся смесь термостатировали при 300°C в течение 40 мин. Получали практически прозрачный раствор, который охолождали до 20-22°C и ввели в ее состав несколько капель 30% пероксида водорода. Образовавшийся осадок коричневого цвета выделяли из реакционной смеси фильтрацией на фильтре из пористого стекла. Остаток на фильтре экстрагировали 90% этанолом и высушили в вакууме (-0,8 атм). Выделен твердый продукт коричневого цвета, нерастворим в воде - дихлоридплатины (PlCl4) - (t разл - 570°C) выход 0,25 гр; содержание платины 0,018 г; (73,3%). Содержание платины в составе синтезированного металлокомплекса для испытуемого образца 0,018 г (6,18%).
Б. 1,0 г (0,006 моль) олигохитозана СП 7-15, 75 мл дистиллированной воды перемешивали в плоскодонной колбе емкостью 700 мл, при 20-25°C до образования гомогенной системы. 0,14 г 0,0004 моль PlCl4 растворяли в 25 мл дистиллированной воды. Растворы ХТЗ и PlCl4 объединяли в условиях перемешивания при 65-70°C в течение 120 минут. Образовалась однородная окрашенная в желтый цвет жидкая система. Фильтрат раствора обработали по методике указанной в A. Выделен растворимый в воде твердый - аморфный слабоокрашенный продукт - комплекс PlCl4 с олигохитозаном. Выход 1,07 г - 94,1% от теоретического. Концентрация металлокомпонентов в полученном комплексе определяли по методике, указанной в А.
Содержание платины в составе синтезированного комплекса 6,5%
B. Подготовка растворов комплексов ХТЗ с PlCl4 для биологических исследований - противоопухолевой активности и побочных действий на организм производили при использовании металлоионкомплексов полученных хитозана [η] 1,2-1,5 дцл/г и олигохитозана с СП 7-15 глюкозных единиц и тетрахлорида платины (опыт А, Б). В качестве растворителей соответственно использовали 0,5% водную AcOH или дистиллированную воду. В соответствии с программой биологических объектов (крысы; m ср - 0,2 кг) готовили серию растворов, отличающихся по массообъемной концентрации комплекса. В расчете на вводимую перорально в животный объект разовую дозу 10 мл. Концентрация комплекса 0,114% и 0,115%.
Биологические исследования.
Объекты исследования: крысы: беспородные и линии Wistar количество 60 животных (средняя масса животных 150-200 г) обоего пола, получены из питомника ВГМА им Н.Н.Бурденко.
Методика:
Животные были разделены на 3 группы (без учета пола).
1-я группа: интактные крысы.
2-я группа: получала цисплатин в дозе 4 мг/кг, per os.
3-я группа: получала комплекс низкомолекулярного хитозана и PlCl4 per os опыт A.
4-я группа: получала комплекс олигохитозана и PlCl4 per os опыт Б.
Животных декапитировали под эфирным наркозом. Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (приложение к приказу МЗ СССР от 12.08.1977 г., №755).
Производили забор гистологического материала: внутренние органы фиксировали в 10%-м формалине с добавлением фосфатного буфера. Гистологические препараты внутренних органов животных приготовляли стандартными методами с применением целлоидин парафиновой проводки. Парафиновые срезы окрашивали гематоксилином и эозином.
Морфологические исследования тканей паренхиматозных органов (печени, почек), проводились для выявления морфологических изменений, формирующихся вследствие воздействия на организм подопытных крыс препаратов: цисплатина, комплекса низкомолекулярного хитозана с PlCl4, комплекс олигохитозана с PlCl4.
На этапе скрининговых исследований оценивали действие изучаемых средств как на развитие опухолевого узла и выраженность процесса метастазирования лимфосаркомы Плисса у крыс, так и на эффективность цитостатического лечения и проведение оценки степени интоксикации. При проведении химиотерапии использовали цисплатин, комплекс низкомолекулярного хитозана с PlCl4 и комплекс олигохитозана с PlCl4, которые вводили per os на 10-14 сутки после трансплантации опухолевых клеток в режиме, вызывающем умеренное торможение опухолевого процесса с интервалом между введениями 24 ч.
Характеристика опухолевых штаммов: Лимфосаркома Плисса (LS-Плисса) Опухоль индуцирована у крысы-самки введением 3,3-дихлорбензидина в 1958 г. Г.Б.Плиссом. Перевивается подкожно 20% взвесью опухолевых клеток на 14-16 сут после перевивки, метастазирует по лимфогенному типу. Продолжительность жизни животных - 12-95 дней. Опухоль состоит из лимфоидных клеток разного размера неправильной формы.
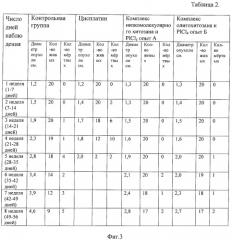
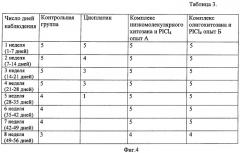
Производилась балльная оценка качества жизни, стандартные значения приведены в таблице 1 (фиг.2). Диаметр опухоли и количество крыс, продолжающих участие в эксперименте, приведены в таблице 2 (фиг.3). Средняя оценка качества жизни крыс представлена в таблице 3 (фиг.4). Патоморфологические изменения внутренних органов представлены в таблице 4 (фиг.5).
Выводы: по сравнению с контрольной группой и группой, получающей цисплатин, группа, получающая комплексы низкомолекулярного хитозана и олигохитозана с PlCl4, показала снижение побочных действий препарата платины (нет изменения в гистоархитектоники печени и почек), без изменения степени цитостатического действия (снижение прогресированного роста опухолевого узла и степени метастазирования), увеличение продолжительности и качества жизни животных (минимальное снижение качества жизни животных).
Полимерный комплекс хитозана с тетрахлоридом платины, содержащий в своей структуре 6,18-6,5 мас.% платины, обладающий противоопухолевой активностью.