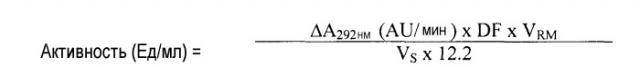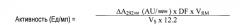Очистка белков с помощью катионного поверхностно-активного вещества
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Способы очистки целевого белка предусматривают получение раствора, содержащего смесь растворенного целевого белка и один или несколько растворенных белков-примесей, контактирование указанного раствора с одним или более катионными поверхностно-активными веществами с увеличением содержания целевого белка относительно оставшихся в растворе белков и выделение растворенного целевого белка. В качестве катионного поверхностно-активного вещества может быть использовано амфипатическое соединение аммония в количестве, эффективном для предпочтительного осаждения одного или более белков-примесей. Изобретение позволяет повысить эффективность выделения и чистоту целевых белков, увеличить содержание целевого белка относительно оставшихся в растворе белков. 3 н. и 38 з.п. ф-лы, 12 ил., 5 табл.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка претендует на приоритет и преимущества по предварительной заявке US 60/670520, поданной 11 апреля 2005 года, содержание которой включено сюда посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к области очистки белков с использованием поверхностно-активных веществ.
Уровень техники
Получение биологических макромолекул, особенно белков, часто включает стадии повышения чистоты продукта на основе физических и физико-химических свойств. Трудности, встречающиеся на данных стадиях обработки, включают, но не ограничиваются, определение условий, позволяющих разделять растворимые и нерастворимые молекулы, сравнительно низкий выход желаемой молекулы после стадии обработки, потеря биологической активности в процессе обработки и чувствительность белков к условиям технологического процесса, таким как рН.
Поверхностно-активные вещества использовали в процессе получения биологических макромолекул. Катионные поверхностно-активные вещества являются известным подклассом поверхностно-активных веществ и включают амфипатические соединения аммония. К амфипатическим соединениям аммония относят четвертичные аммониевые соединения общей формулы QN+ и первичные аммониевые соединения с парафиновой цепью общей формулы RNH3 +. Оба типа амфипатических соединений аммония включают длинноцепочечные аммониевые поверхностно-активные вещества, имеющие длинную алифатическую цепь, предпочтительно по меньшей мере из шести атомов углерода (Scott (1960) Methods Biochem. Anal. 8:145-197). Известно, что длинноцепочечные четвертичные аммониевые поверхностно-активные вещества взаимодействуют с биологическими макромолекулами. Длинноцепочечные четвертичные аммониевые соединения имеют по меньшей мере один заместитель при азоте, который состоит из линейной алкильной цепи с 6-20 атомами углерода. Наиболее известными представителями этого класса соединений являются соли бензалкония (хлориды и бромиды), хлорид гексадецилпиридиния, ацетат деквалиния, бромид цетилдиметиламмония (CTAB), хлорид гексадецилпиридиния (CPCl) и хлорид бензетония. К четвертичным аммониевым поверхностно-активным веществам относятся такие соли цетилпиридиния, как хлорид цетилпиридиния (CPC), соли стеарамидметилпиридиния, соли лаурилпиридиния, соли цетилхинолиния, соли метилового эфира лауриламинопропионовой кислоты, соли лауриламинопропионовой кислоты с металлами, лаурилдиметилбетаин, стеарилдиметилбетаин, лаурилдигидроскиэтилбетаин и соли бензетония. К солям алкилпиридиния относятся соли стеарилтриметиламмония, хлорид алкилдиметилбензиламмония и хлорид дихлорбензилдиметилалкиламмония.
К известным областям применения катионных поверхностно-активных веществ для очистки биологических макромолекул относятся: 1) растворение агрегатов, включая белковые агрегаты; 2) элюирование биологических макромолекул, связанных на хроматографической колонке; и 3) осаждение полианионов, таких как гиалуроновая кислота (HA), нуклеиновые кислоты и гепарин (и молекул, которые осаждаются совместно с полианионами).
Катионные поверхностно-активные вещества использовали для растворения белковых агрегатов. Otta и Bertini ((1975) Acta Physiol. Latinoam. 25:451-457) показали, что активная уриказа может быть экстрагирована из пероксисом печени грызунов с помощью четвертичного аммониевого поверхностно-активного вещества, Гиамина 2389. Было установлено, что повышение концентрации аммониевого поверхностно-активного вещества приводит к увеличению растворения как уриказы (на основе ферментативной активности), так и общего белка, так что нет никакого увеличения относительного количества белка уриказы по отношению к количеству общего белка. Другими словами, не было избирательной экстракции белка уриказы по отношению к общему белку, и процентное содержание белка уриказы от общего белка не увеличивалось после экстракции катионным поверхностно-активным веществом. Соответственно при такой обработке чистота уриказы в отношении содержания общего белка, по-видимому, не повышается в результате экстракции четвертичным аммониевым поверхностно-активным веществом.
В другой работе Truscoe ((1967) Enzymologia 33:1 19-32 исследовал ряд катионных, анионных и нейтральных детергентов на предмет эффективности экстракции уратоксидазы (уриказы) из порошка почек быка. В то время как нейтральные и анионные детергенты увеличивали активность растворенной уратоксидазы, катионные детергенты, например четвертичные аммониевые соли, снижали общую ферментативную активность при увеличении концентрации. Авторы сделали вывод, что катионные детергенты непригодны для очистки уратоксидазы из почек быка.
Экстракция рекомбинантных белков, свиного гормона роста, свиного метионил-гормона роста, белка вируса, вызывающего инфекционный бурсит, белков, сшитых с бета-галактозидазой, из телец включения или клеток E.coli с помощью катионных поверхностно-активных веществ описана в патенте US 4797474, патенте US 4992531, патенте US 4966963 и патенте US 5008377, включенных сюда путем ссылки. Экстракцию в щелочных условиях с применением четвертичных аммониевых соединений, включая хлорид цетилтриметиламмония, хлорид (смешанный н-алкил)диметилбензиламмония, CPC, хлорид N,N-диметил-N-[2-[2-[4-(1,1,3,3,-тетраметилбутил)фенокси]этокси]этил]бензолметанаммония, бромид тетрадецилтриметиламмония, бромид додецилтриметиламмония, бромид цетилтриметиламмония. В этих публикациях отмечено, что после каждой стадии экстрагирования растворы центрифугируют, и осадок либо не появляется, либо появляется в небольшом количестве. Данное наблюдение заставляет предположить, что большинство или все белки растворяются вне зависимости от избирательности экстракции целевого белка. Чистота выделенных белков не обсуждается. В патенте US 5929231, включенном сюда путем ссылки, описан способ разделения гранул и агрегатов, содержащих крахмал, с помощью хлорида цетилпиридиния (CPC). Таким образом, в уровне техники катионные поверхностно-активные вещества использовали для общей, неспецифической экстракции определенных биологических макромолекул. В данных методах из уровня техники не описано повышение чистоты целевых белков в сравнении с общим белком с помощью катионного поверхностно-активного вещества.
Катионные поверхностно-активные вещества также использовали для элюирования биологических макромолекул, адсорбированных на катионообменной смоле или адъювантах, содержащих алюминий (Antonopoulos et al. (1961) Biochim. Biophys. Acta 54:213-226; Embery (1976) J. Biol. Buccale 4:229-236; и Rinella et al. (1998) J. Colloid Interface Sci. 197:48-56, включенные сюда путем ссылки). В патенте US 4169764, включенном сюда путем ссылки, описан способ элюирования урокиназы из карбоксиметилцеллюлозной колонки с использованием широкого разнообразия растворов катионных поверхностно-активных веществ. Авторы высказывают предпочтение в использовании четвертичных солей аммония, в которых одна алкильная группа является высшей алкильной группой, содержащей до 20 атомов углерода, а другие алкильные группы являются низшими алкильными группами, содержащими до 6 атомов углерода. Использование таких катионных поверхностно-активных веществ позволяет отделить биологические макромолекулы от твердой основы.
И наоборот, пропитывание фильтров, таких как фильтры из нейлона, катионными поверхностно-активными веществами, позволяет осуществлять иммобилизацию полисахаридов или нуклеиновых кислот (Maccari and Volpi (2002) Electrophoresis 23:3270-3277; Benitz et al. (1990) патент US 4945086; Macfarlane (1991) патент US 5010183, включенные сюда путем ссылки). Этот процесс происходит, очевидно, за счет взаимодействия полианионов с катионными поверхностно-активными веществами, которое дает возможность осуществлять осаждение полианионов.
Четко установлено, что амфипатические аммониевые соединения, к которым относятся четвертичные аммониевые соединения общей формулы QN+ и первичные аммониевые соединения с парафиновой цепью общей формулы RNH3 +, в определенных условиях могут осаждать полианионы (в обзоре Scott (1955) Biochim. Biophys. Acta 18:428-429; Scott (1960) Methods Biochem. Anal. 8:145-197; Laurent, et al., (1960) Biochim. Biophys. Acta 42:476-485; Scott (1961) Biochem. J. 81:418-424; Pearce and Mathieson (1967) Can. J. Biochemistry 45:1565-1576; Lee (1973) Fukushima J. Med. Sci. 19:33-39; Balazs, (1979) патент US 4141973; Takemoto, et al., (1982) патент US 4312979; Rosenberg (1981) патент US 4301153; Takemoto, et al., (1984) патент US 4425431; d'Hinterland, et al., (1984) патент US 4460575; Kozma, et al. (2000) Mol. Cell. Biochem. 203:103-112, включенных сюда путем ссылки). На это осаждение влияет вид осажденных молекул, имеющих высокую плотность полианионного заряда и высокий молекулярный вес (Saito (1955) Kolloid-Z 143:66, включенный сюда путем ссылки). Присутствие солей может помешать или ослабить осаждение полианиона с катионным поверхностно-активным веществом.
В дополнение, в условиях щелочного рН полианионы могут по-разному осаждаться из растворов, содержащих белковые примеси. В таких случаях не связанные химически с полианионами белки будут оставаться в растворе, в то время как полианионы и другие молекулы, связанными с полианионами, будут осаждаться. Например, осаждение полианионов, таких как полисахариды и нуклеиновые кислоты, сопровождается совместным осаждением таких молекул, как протеогликаны и белки, которые взаимодействуют с полианионами (Blumberg and Ogston (1958) Biochem. J. 68:183-188; Matsumura, et al., (1963) Biochim. Biophys. Acta 69:574-576; Serafini-Fracassini, et al. (1967) Biochem. J. 105:569-575; Smith, et al. (1984) J. Biol. Chem. 259:11046-11051; Fuks and Vlodavsky (1994) патент US 5362641; Hascall and Heinegard (1974) J. Biol. Chem. 249:4232-4241, 4242-4249, and 4250-4256; Heinegard and Hascall (1974) Arch. Biochem. Biophys. 165:427-441; Moreno, et al. (1988) патент US 4753796; Lee, et al. (1992) J. Cell Biol. 116:545-557; Varelas, et al. (1995) Arch. Biochem. Biophys. 321:21-30, включенные сюда путем ссылки).
Изоэлектрической точкой (или pI) белка является значение рН, при котором молекула белка имеет одинаковое количество положительных и отрицательных зарядов. В растворах со значениями рН, близкими (особенно ниже) к изоэлектрической точке белка, белки могут образовывать стабильные соли с сильнокислыми полианионами, такими как гепарин. В условиях, которые способствуют осаждению таких полианионов, комплексы белков с этими полианионами также будут осаждаться (LB Jaques (1943) Biochem. J. 37:189-195; AS Jones (1953) Biochim. Biophys. Acta 10:607-612; JE Scott (1955) Chem and Ind 168-169; патент US 3931399 (Bohn, et al., 1976) и патент US 4297344 (Schwinn, et al., 1981), включенные сюда путем ссылки).
В патенте US 4421650, патенте US 5633227 и статье Smith et al. ((1984) J. Biol. Chem. 259:11046-11051, включенных сюда путем ссылки) описываются способы очистки полианионов путем последовательной обработки катионным поверхностно-активным веществом и сульфатом аммония (который способствует диссоциации комплексов полианион-катионное поверхностно-активное вещество) и последующего разделения с использованием хроматографии с гидрофобными взаимодействиями. В опубликованной европейской заявке ЕР055188, включенной сюда путем ссылки, описано выделение RTX-токсина из липополисахарида при использовании катионного поверхностно-активного вещества. Однако не приводится материальный баланс количества липополисахарида, который оценивают по активности эндотоксина. Нейтрализация активности эндотоксина за счет сильного взаимодействия с катионными соединениями была показана (Cooper JF (1990) J Parenter Sci Technol 44:13-5, включенной сюда путем ссылки). Таким образом, в ЕР055188 отсутствие активности эндотоксина у осадка, полученного обработкой возрастающими количествами катионного поверхностно-активного вещества, возможно происходит из-за нейтрализации активности по причине образования комплекса поверхностно-активное вещество-липополисахарид.
Способы, представленные выше, требуют присутствия промежуточных полианионов, твердого носителя или агрегатов, включающих белки с избирательной растворимостью в катионных поверхностно-активных веществах для осуществления очистки растворимых белков, используя катионные поверхностно-активные вещества. Следовательно, в уровне техники не предлагается способ очистки целевых белков посредством контакта белка с катионным поверхностно-активным веществом в количестве, эффективном для предпочтительного осаждения всех белков, иных, чем целевой белок, т.е. белков-примесей, особенно, когда такой контакт происходит в отсутствие промежуточных полианионов, твердого носителя или белковых агрегатов. Очень часто специалисты в данной области сталкиваются с тем, что, когда им нужно выделить целевой белок из смеси белков, у них нет для этого эффективных методик. Новый способ очистки белков, который описан здесь, позволяет эффективно очищать целевые белки, используя катионные поверхностно-активные вещества для того, чтобы предпочтительно осаждались белки, иные, чем целевой белок. Предпочтительно такое осаждение белков-примесей происходит напрямую и не зависит от присутствия полианионов, твердых носителей или белковых агрегатов, включающих белки-примеси и другие молекулы.
Сущность изобретения
Объектом изобретения является способ очистки целевого белка из смеси, содержащей целевой белок и белки-примеси, включающий стадии воздействия на данную смесь эффективного количества катионного поверхностно-активного вещества, так что белки-примеси предпочтительно осаждаются, и выделения целевого белка.
Краткое описание чертежей
На фиг.1 представлена зависимость активности и чистоты уриказы от концентрации СРС.
Концентрацию белка (А) и ферментативную активность (В) уриказы млекопитающего из раствора телец включения E.coli измеряли после указанной обработки CPC и разделения путем центрифугирования. Удельную активность (С) каждого изолята вычисляли как отношение этих значений (активность/концентрация белка).
На фиг.2 представлен анализ методом эксклюзионной высокоэффективной жидкостной хроматографии (ВЭЖХ) неочищенной уриказы млекопитающего, полученной из телец включения после обработки 0,075% CPC.
На А представлены профили эксклюзионной ВЭЖХ растворенных телец включения E.coli без обработки CPC, а на В - супернатанта после осаждения в 0,075% CPC и фильтрования. Площади каждого пика и % от общей площади приведены в сопутствующих таблицах.
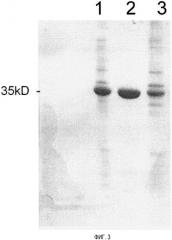
На фиг.3 изображен отпечаток электрофореза уриказы после обработки CPC в полиакриламидном геле (15%) в присутствии додецилсульфата натрия.
Образцы, содержащие уриказу, получали, как описано в примере 1. Образцы с каждой стадии были представлены в следующем порядке: дорожка 1 - растворенные тельца включения; дорожка 2 -супернатант после обработки CPC; дорожка 3 - осадок после обработки CPC.
На фиг.4 изображен результат анализа методом эксклюзионной ВЭЖХ неочищенного scFv антитела после обработки 0,02% CPC.
На А представлен профиль эксклюзионной ВЭЖХ стандартного sc Fv антитела BTG-271, а на В - растворенных телец включения, и на С - супернатанта после рефолдинга и обработки CPC (0,02%) и фильтрования. Площадь каждого пика и его процент от общей площади приведены в сопутствующих таблицах.
На фиг.5 изображен электрофорез обработанного CPC scFv антитела в полиакриламидном геле (15%) в присутствии додецилсульфата натрия.
Содержащие scFv антитела образцы после разных стадий и маркеры представлены в следующем порядке: дорожка 1 - маркеры молекулярного веса; дорожка 2 - растворенные тельца включения; дорожка 3 - свернутый белок; дорожка 4 - осадок CPC; дорожка 5 - супернатант после обработки CPC.
На фиг.6 представлены данные гель-фильтрационной ВЭЖХ интерферона-бета до и после обработки CPC.
А. До обработки CPC.
В. После обработки CPC.
На колонку наносили 200 мкл раствора интерферона-бета с концентрацией 0,1 мг/мл.
Подробное описание изобретения
Белки являются амфолитами, несущими как положительные, так и отрицательные заряды. Значение рН раствора и заряженные молекулы, которые взаимодействуют с белком, влияют на суммарный заряд этого белка. Если суммарный заряд молекулы белка нейтральный (в изоэлектрической точке), то молекулы белка могут сильно взаимодействовать друг с другом. Если значение рН раствора ниже изоэлектрической точки белка, то суммарный заряд белка положительный, и поэтому между катионными молекулами может происходить электростатическое отталкивание, включая другие белки.
Объектом изобретения является разработка способа очистки растворимых целевых белков из растворов, содержащих смесь целевого белка и белков-примесей, путем контактирования раствора смеси белков с эффективным количеством катионного поверхностно-активного вещества и выделения целевого белка. Катионные поверхностно-активные вещества представляют собой поверхностно-активные молекулы с положительным зарядом. Как правило, эти соединения также имеют по меньшей мере одну неполярную алифатическую группу. Предпочтительно, чтобы значение изоэлектрической точки целевого белка было больше 7. В определенном варианте осуществления значение рН раствора приблизительно совпадает со значением изоэлектрической точки целевого белка. В предпочтительном варианте осуществления значение рН раствора меньше значения изоэлектрической точки целевого белка. В определенном варианте осуществления, если значение рН раствора выше значения изоэлектрической точки целевого белка, то значение рН раствора составляет 1-2 единицы рН от значения изоэлектрической точки целевого белка. В определенном варианте осуществления, когда значение рН раствора больше значения изоэлектрической точки целевого белка, то значение рН раствора находится в пределах 1 единицы рН от значения изоэлектрической точки целевого белка.
В определенном варианте осуществления белок- или белки-примеси предпочтительно осаждаются, таким образом, среди оставшихся в растворе белков возрастает процентное содержание целевого белка. Например, исходя из раствора целевого белка и белков-примесей, в котором количество целевого белка составляет 20% от общего количества белков в растворе, можно, используя предложенные способы, очистить целевой белок и получить раствор, в котором количество целевого белка составляет 30% или более, 40% или более, 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 95% или более от общего количества белка, находящегося в растворе.
Как используется в данном описании, термин «предпочтительно осаждается» означает, что белок или группа белков осаждаются в большей степени, чем другой белок или группа белков. Например, в случае смеси целевого белка и белков-примесей, белки-примеси осаждаются более предпочтительно, чем целевой белок, если количество белков-примесей, выпавших в осадок, составляет 20% или более, а количество целевого белка, выпавшего в осадок, составляет менее 20%. Более предпочтительно, когда процент белков-примесей, выпавших в осадок, высокий, а процент целевого белка, выпавшего в осадок, низкий. В предпочтительном варианте осуществления осаждается 30% или более белков-примесей, в то время как осаждается менее 30% целевого белка; осаждается 40% или более белков-примесей, в то время как осаждается менее 40% целевого белка; осаждается 50% или более белков-примесей, в то время как осаждается менее 50% целевого белка; осаждается 60% или более белков-примесей, в то время как осаждается менее 60% целевого белка; осаждается 70% или более белков-примесей, в то время как осаждается менее 70% целевого белка; осаждается 80% или более белков-примесей, в то время как осаждается менее 80% целевого белка; осаждается 90% или более белков-примесей, в то время как осаждается менее 90% целевого белка; осаждается 95% или более белков-примесей, в то время как осаждается менее 95% целевого белка. Предпочтительно, осаждается небольшой процент целевого белка. Например, осаждается менее 60%, менее 50%, менее 40%, менее 30%, менее 20%, менее 10%, менее 5% или менее 1% целевого белка.
В определенном варианте осуществления общее количество белка в растворе (целевой белок плюс белки-примеси) до осуществления способа очистки по изобретению составляет от 0,1 до 10 мг/мл. В определенном варианте осуществления общее количество белка в растворе до осуществления способа очистки по изобретению составляет от 0,1 до 3 мг/мл, от 0,3 до 2 мг/мл, от 0,5 до 2 мг/мл, от 0,5 до 1 мг/мл, от 1 до 2 мг/мл или около 1 мг/мл.
В определенном варианте осуществления предпочтительное осаждение белков-примесей происходит напрямую и не зависит, или по существу не зависит, от присутствия полианионов. В другом варианте осуществления предпочтительное осаждение белков-примесей происходит напрямую и не зависит, или по существу не зависит, от присутствия твердого носителя. В другом варианте осуществления предпочтительное осаждение белков-примесей не зависит, или по существу не зависит, от присутствия агрегатов между белками-примесями и другими молекулами. Предпочтительное осаждение белков-примесей не зависит, или по существу не зависит, от компонентов (например, полианионов, твердого носителя или агрегатов белков-примесей и других молекул), если, например, удаление этих компонентов не влияет или по существу не влияет, соответственно, на предпочтительное осаждение белков-примесей. Примером несущественного влияния удаления компонента могло бы быть то, что белки-примеси предпочтительно осаждаются как в присутствии, так и в отсутствие данного компонента. Дополнительным примером были бы белки-примеси, осажденные в равной степени в присутствии и в отсутствие данного компонента. Предпочтительно, если одинаковое или по существу одинаковое количество белков-примесей осаждается в отсутствие или по существу в отсутствие компонента, как и в присутствии компонента.
В другом варианте осуществления способ осуществляют в отсутствие полианионов или по существу в отсутствие полианионов. В другом варианте осуществления способ осуществляют в отсутствие твердого носителя или по существу в отсутствие твердого носителя. В другом варианте осуществления способ осуществляют в отсутствие агрегатов между белками-примесями и другими молекулами, или по существу в отсутствие агрегатов между белками-примесями и другими молекулами. Предпочтительно, если способ осуществляют в отсутствие или по существу в отсутствие двух или трех членов группы, включающей полианионы; твердый носитель; и агрегаты между белками-примесями и другими молекулами.
После ознакомления со способом, изложенным в данном изобретении, для специалиста в данной области техники не представляет сложности подобрать конкретные поверхностно-активные вещества и условия, например рН, температуру, концентрацию солей, концентрацию катионного поверхностно-активного вещества, общую концентрацию белка, при которых можно улучшить показатели качества очистки конкретного целевого белка. Например, способы очистки, осуществляемые при разных значениях рН и разных концентрациях поверхностно-активного вещества, можно сравнить для определения оптимальных условий очистки. Примеры таких способов представлены ниже в разделе Примеры. В определенном варианте осуществления рН раствора выбирают как можно более высокий, но еще не приводящий к существенному снижению количества извлекаемого целевого белка.
Следующим объектом данного изобретения является предложение способа определения условий, которые способствуют эффективной очистке целевых белков на основе их растворимости, на которую влияют катионные поверхностно-активные вещества.
Эффективным количеством катионного поверхностно-активного вещества является такое количество поверхностно-активного вещества, которое способствует предпочтительному осаждению белков-примесей. В определенном варианте осуществления эффективное количество поверхностно-активного вещества осаждает 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99% белков-примесей.
В одном из вариантов осуществления концентрация добавленного катионного поверхностно-активного вещества составляет от 0,001% до 5,0%, предпочтительно, если концентрация добавленного катионного поверхностно-активного вещества составляет от 0,01% до 0,5%, и более предпочтительно, если концентрация добавленного катионного поверхностно-активного вещества составляет от 0,03% до 0,2%. В определенном варианте осуществления концентрация добавленного катионного поверхностно-активного вещества составляет от 0,01% до 0,1%, от 0,01% до 0,075%, от 0,01% до 0,05% или от 0,01% до 0,03%.
В одном из вариантов осуществления вышеприведенный способ осуществляют в условиях, где катионным поверхностно-активным веществом является амфипатическое аммониевое соединение.
В предпочтительном варианте осуществления растворенный целевой белок подвергают дополнительной обработке после осаждения белков-примесей. Такая дополнительная обработка может включать дополнительные стадии очистки, анализы для определения активности или концентрации, диализ, хроматографию (например, ВЭЖХ, эксклюзионная хроматография), электрофорез, диализ и т.д.
Как используется в данном описании, амфипатические аммониевые соединения включают соединения, содержащие как катионные, так и неполярные компоненты общей формулы либо QN+, либо RNH3 +. Q означает, что азот входит в состав четвертичного аммония (ковалентно связан с четырьмя органическими группами, которые могут быть, а могут и не быть связаны между собой). Если органические группы связаны между собой, то они могут образовывать циклические алифатические или ароматические соединения, в зависимости от электронной конфигурации связей между компонентами, которые образуют циклическую структуру. Если выбранное амфипатическое аммониевое соединение имеет общую формулу RNH3 +, то это соединение является первичным амином, где R означает алифатическую группу. Алифатические группы представляют собой органические группы с открытыми цепями.
В одном из вариантов осуществления изобретения выбранное соединение аммония может образовывать галогениды. Обычно под галогенидами понимают соли, включающие фторидные, хлоридные, бромидные и йодидные ионы.
В одном из вариантов осуществления изобретения амфипатическое аммониевое соединение имеет по меньшей мере одну алифатическую цепь, содержащую 6-20 атомов углерода, предпочтительно, амфипатическое аммониевое соединение имеет по меньшей мере одну алифатическую цепь, содержащую 8-18 атомов углерода.
В одном из вариантов осуществления изобретения выбранное амфипатическое аммониевое соединение выбрано из группы, состоящей из солей цетилпиридиния, солей стеарамидметилпиридиния, солей лаурилпиридиния, солей цетилхинолиния, солей метилового эфира лауриламинопропионовой кислоты, солей лауриламинопропионовой кислоты с металлами, лаурилдиметилбетаина, стеарилдиметилбетаина, лаурилдигидроксиэтилбетаина и солей бензетония.
Амфипатические аммониевые соединения, которые могут быть использованы, включают, но не ограничиваются ими, хлорид гексадецилпиридиния, ацетат деквалиния, хлорид гексадецилпиридиния, хлорид цетилтриметиламмония, хлорид (смешанный н-алкил)диметилбензиламмония, хлорид цетилпиридиния (CPC), хлорид N,N-диметил-N-[2-[2-[4-(1,1,3,3-тетраметилбутил)фенокси]этокси]этил]бензолметанаммония, хлорид алкилдиметилбензиламмония, хлорид дихлорбензилдиметилалкиламмония, бромид тетрадецилтриметиламмония, бромид додецилтриметиламмония, бромид цетилтриметиламмония, лаурилдиметилбетаин, стеарилдиметилбетаин и лаурилдигидроксиэтилбетаин.
В одном из вариантов осуществления изобретения амфипатическим аммониевым соединением является соль цетилпиридиния, такая как хлорид цетилпиридиния.
В одном из вариантов осуществления изобретения смесь, содержащая целевой белок, дополнительно включает клеточные компоненты, такие как клеточные компоненты, происходящие от микроорганизмов, например бактерии, такой как E.coli.
В одном из вариантов осуществления изобретения клеточными компонентами являются один белок или несколько белков.
В одном из вариантов осуществления изобретения целевым белком может быть рекомбинантный белок, например фермент.
Способ по изобретению может быть использован для очистки разнообразных белков. Эти белки могут включать, но не ограничиваются ими, антитела, уриказу, интерферон-бета, ингибитор Х фактора пиявки, кислую дезоксирибонуклеазу II, эластазу, лизоцим, папаин, пероксидазу, панкреатическую рибонуклеазу, трипсиноген, трипсин, цитохром с, эрабутоксин, энтеротоксин С1 золотистого стафилококка, моноаминоксидазу А и другие белки, которые являются положительно заряженными в щелочных условиях.
В одном из вариантов осуществления изобретения целевым белком может быть антитело, рецептор, фермент, транспортный белок, гормон или их фрагмент или конъюгат, например конъюгат с вторичным белком или химическим соединением, или токсином.
Антитела включают, но не ограничиваются ими, моноклональные, «гуманизированные», химерные, одноцепочечные, биспецифичные, Fab фрагменты, F(ab')2 фрагменты, фрагменты, полученные путем экспрессии библиотеки Fab, антиидиотипические антитела (анти-Id), эпитоп-связывающие фрагменты любых из вышеперечисленных, но при условии, что в условиях способа очистки антитело будет заряжено положительно.
Для получения моноклональных антител может быть использована любая методика, которая подразумевает получение молекул антитела из постоянных культур клеточных линий. Это включает, но не ограничивается ими, гибридомную технологию Kohler и Milstein, (1975, Nature 256, 495-497; и патент US 4376110), технологию человеческих В-клеточных гибридом (Kozbor et al., 1983, Immunology Today 4, 72; Cole et al., 1983, Proc. Natl. Acad. Sci. USA 80, 2026-2030) и технологию EBV-гибридомы для получения человеческих моноклональных антител (Cole et al., 1985, Monoclonal Anibodies And Cancer Therapy, Alan R. Liss, Inc., pp.77-96).
Такие антитела могут быть использованы в качестве исходного материала для клонирования и последующей экспрессии рекомбинантных индивидуальных тяжелых и легких цепей. Обе цепи могут быть экспрессированы рекомбинантным путем в одной и той же клетке или объединены in vitro после индивидуальной экспрессии и очистки. Нуклеиновые кислоты (например, плазмидные векторы), кодирующие определенную тяжелую или легкую цепь, или кодирующие молекулу, содержащую вариабельный домен определенной тяжелой или легкой цепи, могут быть трансфицированы в клетки, экспрессирующие определенную тяжелую или легкую цепь антитела или молекулу, включающую в себя тяжелую или легкую цепь антитела, для экспрессии многомерного белка. Альтернативно тяжелые цепи или молекулы, включающие их вариабельные домены или их CDR, могут быть экспрессированы и использованы без присутствия комплементарной легкой цепи или вариабельного домена легкой цепи. В другом варианте осуществления такие антитела и белки могут быть модифицированы с N- или С-конца, например амидированы с С-конца или ацетилированы с N-конца.
Химерное антитело представляет собой молекулу, у которой разные части происходят от разных видов животных, такое как антитело, имеющее вариабельный домен мышиного mAb и константную область иммуноглобулина человека (см., например, Cabilly et al., патент US 4816567; и Boss et al., патент US 5816397). Технология получения химерных антител включает сплайсирование гена молекулы мышиного антитела, имеющей соответствующую антигенную специфичность, вместе с генами соответствующей биологически активной молекулы человеческого антитела (см., например, Morrison et al., 1984, Proc. Natl. Acad. Sci., 81, 6851-6855; Neuberger et al., 1984, Nature 312, 604-608; Takeda et al., 1985, Nature 314, 452-454).
«Гуманизированные» антитела представляют собой молекулы антител, происходящих не от человека, и имеющие одну или более областей, определяющих комплементарность (CDR), от видов, исключая человека, а также каркасные области молекулы иммуноглобулина человека. Методики получения «гуманизированных» антител описаны, например, у Queen, патент US 5585089, и Winter, патент US 5225539. Протяженность каркасных областей и CDR была строго определена (см. “Sequence of Proteins of Immunological Interest”, Kabat, E. et al., U.S. Department of Health and Human Services (1983)).
Одноцепочечные антитела образуются путем связывания фрагментов тяжелой и легкой цепи Fv области посредством аминокислотного мостика, в результате чего получается одноцепочечный полипептид. Методики получения одноцепочечных антител описаны, например, в патенте US 4946778; Bird, 1988, Science 242, 423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85, 5879-5883; Ward et al., 1989, Nature 334, 544-546)).
Биспецифичные антитела являются генноинженерными антителами, которые распознают два типа мишеней, например (1) специфический эпитоп и (2) «триггерную» молекулу, например Fc-рецепторы на миелоидных клетках. Такие биспецифичные антитела могут быть получены либо химической конъюгацией, от гибридомы, или рекомбинантными молекулярно-биологическими методами.
Фрагменты антител включают, но не ограничиваются ими, F(ab')2 фрагменты, которые могут быть получены путем расщепления молекулы антитела пепсином, и F(ab') фрагменты, которые могут быть получены путем восстановления дисульфидных мостиков F(ab')2 фрагментов. Альтернативно, можно сконструировать экспрессионную библиотеку Fab фрагментов (Huse, et al., 1989, Science 246, 1275-1281) для быстрой и простой идентификации моноклональных Fab фрагментов с заданной специфичностью.
В одном из вариантов осуществления изобретения белок представляет собой уриказу.
В другом варианте осуществления изобретения уриказа представляет собой уриказу млекопитающего.
В другом варианте осуществления изобретения уриказа млекопитающего представляет собой вариант уриказы млекопитающего.
В другом варианте осуществления изобретения уриказа млекопитающего представляет собой уриказу свиньи.
В другом варианте осуществления изобретения вариант уриказы свиньи обозначается как PKSΔN уриказа.
В другом варианте осуществления изобретения белок представляет собой антитело.
В другом варианте осуществления изобретения антитело представляет собой одноцепочечное антитело.
В другом варианте осуществления изобретения белок представляет собой интерферон.
В другом варианте осуществления изобретения интерферон представляет собой интерферон-бета. В определенном варианте осуществления интерферон представляет собой интерферон-бета 1b. Nagola, S. et al., Nature, 284:316 (1980); Goeddel, D. V. et al., Nature, 287:411 (1980); Yelverton, E. et al., Nuc. Acid Res., 9:731 (1981); Streuli, M. et al., Proc. Nat'l Acad. Sci. (U.S.), 78:2848 (1981); заявка EP № 28033, опубл. 6 мая 1981; № 321134, опубл. 15 июля 1981; № 34307, опубл. 26 августа 1981; бельгийский патент № 837379, поданный 1 июля 1981, описывают различные способы получения бета-интерферона, используя методику рекомбинантной ДНК. Методика получения и очистки интерферонов, продуцируемых бактериями, описана в патентах US 4450103; 4315852; 4343735 и 4343736; и Derynck et al., Nature (1980) 287:193-197 и Scandella and Kronenberg, Biochemistry, 10:4447 (1971).
В определенном варианте осуществления целевым белком является фактор Ха пиявки. Фактор Ха пиявки может быть получен любым способом, известным специалисту в данной области, таким как способ, описанный в патенте US 6211341 и в WO94/23735.
В одном из вариантов осуществления изобретения контактирование длится примерно от 1 минуты до примерно 48 часов, более предпочтительно примерно от 10 минут до примерно 24 часов, примерно от 30 минут до примерно 12 часов, примерно от 30 минут до примерно 8 часов, примерно от 30 минут до примерно 6 часов, примерно от 30 минут до 4 часов, примерно от 30 минут до примерно 2 часов, примерно от 30 минут до примерно 1 часа или примерно от 1 часа до примерно 2 часов.
В одном из вариантов осуществления изобретения контактирование происходит при температуре примерно от 4°C до примерно 36°C; более предпочтительно примерно от 4°C до примерно 26°C.
Объектом изобретения также является применение катионного поверхностно-активного вещества в качестве единственного агента для очистки белков, имеющих значение изоэлектрической точки выше 7 в щелочных условиях.
Объектом изобретения также является уриказа, очищенная в щелочных условиях из смеси путем добавления к смеси хлорида цетилпипридиния.
В одном из вариантов осуществления изобретения уриказу получают из бактериальных клеток, содержащих ДНК, кодирующую уриказу, способом, включающим обработку бактериальных клеток с целью экспрессии ДНК и получения уриказы и выделение уриказы.
В одном из вариантов осуществления изобретения уриказу выделяют из осадка бактериальных клеток.
Объектом изобретения также является очищенная уриказа для применения при получении конъюгатов уриказы с полимерами.
Изобретение также предоставляет очищенный белок, имеющий значение изоэлектрической точки выше 7, получаемый способом, включающим контактирование смеси, содержащей белок, с эффективным количеством катионного поверхностно-активного вещества в условиях, при которых б