Рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена и содержащая его фармацевтическая композиция
Иллюстрации
Показать всеНастоящее изобретение относится к рекомбинантному химерному белку, содержащему фактор ингибирования нейтрофилов, пептид FPRP, специфически узнающий активный сайт тромбина, и гируген. Данный белок способен направленно ингибировать активность тромбина. Кроме того, предлагается нуклеиновая кислота, кодирующая химерный белок, вектор, содержащий эту нуклеиновую кислоту, и клетка-хозяин, несущая вектор. Настоящее изобретение также относится к фармацевтической композиции, включающей рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена. Эффект от применения данной композиции заключается в ингибировании агрегации тромбоцитов или ингибировании активации периферических лейкоцитов. Данная композиция может быть использована для лечения кардио-цереброваскулярного заболевания или профилактики ишемического повреждения головного мозга или гематомы головного мозга. 6 н. и 7 з.п. ф-лы, 11 ил., 16 табл.
Реферат
Область изобретения, к которой относится изобретение
Изобретение относится к рекомбинантному химерному белку фактора ингибирования нейтрофилов и гиругена (TNHH), кодирующей его полинуклеотидной последовательности, рекомбинантному вектору, содержащему указанную полинуклеотидную последовательность, микроорганизму, трансформированному указанным вектором, и фармацевтической композиции, содержащей указанный рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена.
Уровень техники
В настоящее время кардио-цереброваскулярные заболевания являются одним из основных заболеваний, угрожающих здоровью человека, среди которых инсульт головного мозга приводит к чрезвычайно высокому коэффициенту смертности. Основные патологические симптомы таких заболеваний включают: (1) образование гематомы головного мозга, (2) тромбоз головного мозга, (3) ишемию головного мозга и (4) отек головного мозга. На настоящий момент считается, что приведенные выше симптомы следует рассматривать как связанные с лейкоцитарной инфильтрацией, активацией тромбина и нарушениями микроциркуляции. Известно, что фактор ингибирования нейтрофилов и гирудин могут ингибировать лейкоцитарную инфильтрацию и активацию тромбина соответственно (Moyle M. et al.: US 5789175; Madden Ketal, Inflamm Res 1997, 46(6):216-223; Masadda T. et al., Brain Res, 2000, 867(2):173-179). Фактор ингибирования нейтрофилов (NIF) состоит из 257 аминокислот и содержит семь сайтов гликозилирования. Было доказано, что рекомбинантный дегликозилированный NIF сохраняет эти биологические свойства. NIF может эффективно ингибировать активность нейтрофилов, в том числе адгезию к эндотелиальным клеткам, высвобождение перекиси водорода и ионов супероксидов, а также хемотаксис, агрегацию и фагоцитоз нейтрофилов, и тому подобное (Moyle M. et al.: J Biol chem 1994, 269(13):10008-10015). В связи с вышеуказанной активностью NIF на модели животного было продемонстрировано, что рекомбинантный NIF имеет клиническую значимость для профилактики и лечения ишемического нейронального повреждения (модель МСАО крысы), улучшения циркуляции крови во время поражения головного мозга и уменьшения зоны поражения ткани головного мозга (Zhang L. et al.:stroke. 2003, 34(7):1790-1795).
Было обнаружено, что С-концевой додекапептид (т.е. 53-64 аминокислоты) гирудина обладают всеми этими функциями, такими как антитромбиновая активность гирудина, согласно исследованию структуры и функции гирудина (Naski MC. et al.: J Biochem. 1990, 265(23):13484-13489; Maraganore J metal: Biochemistry. 1990, 29(30):7095-7101). На основании вышеприведенных результатов был синтезирован искусственный додекапептид, названный гиругеном. Оказалось, что гируген может связываться с анионсвязывающей областью тромбина, но не может связываться с областью каталитического сайта и фибрином. Тромбин может связываться с фибрином, то есть гируген не может специфически связываться с тромбином, то есть гируген не может действовать на тромбин. Однако гируген может ингибировать как in vivo, так и in vitro превращение фибриногена в фибрин тромбином и удлинять APTT (активированное частичное тромбопластиновое время), PT (протромбиновое время) и TT (тромбиновое время), осуществляя таким образом антикоагуляционный эффект.
На основании вышеуказанных патологических исследований и исследований биологической активности NIF и гиругена в Китайской заявке на патент (№ 031011551) описан бифункциональный химерный белок (гибрид NIF-гирудина, или кратко - NHH), полученный из NIF и гиругена способами генетической рекомбинации. Этот химерный белок представляет собой NIF-(Gly)5-гируген. NHH состоит из 274 аминокислот и способен ингибировать адгезию и активацию нейтрофилов, а также ингибировать активности тромбина и, таким образом, может использоваться при лечении острых цереброваскулярных заболеваний. К сожалению, поскольку гируген, содержащийся в NHH, не может связываться с областью каталитического сайта, то NHH не может действовать на тромбин, что в значительной степени уменьшает терапевтическую эффективность NHH для кардио-цереброваскулярных заболеваний.
Сущность изобретения
Для устранения недостатков уровня техники настоящее изобретение направлено на получение нового рекомбинантного химерного белка фактора ингибирования нейтрофилов и гиругена, способного направленно ингибировать активность тромбина, улучшая таким образом терапевтическую эффективность при лечении кардио-цереброваскулярных заболеваний, например инсульта головного мозга.
Для достижения вышеуказанных целей настоящее изобретение в первом аспекте относится к рекомбинантному химерному белку фактора ингибирования нейтрофилов и гиругена (TNHH) со следующей структурой: Met-NIF-линкер 1-FPRP-линкер 2-гируген или NIF-линкер 1-FPRP-линкер 2-гируген. Предпочтительно, линкер 1 является 5-15 глицинами и, более предпочтительно, является 5-10 глицинами, а линкер 2 является (GSGG)n, n=1-3.
Во втором аспекте изобретение относится к полинуклеотидной последовательности, кодирующей рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена.
В третьем аспекте изобретение относится к вектору экспрессии, содержащему полинуклеотидную последовательность.
В четвертом аспекте изобретение относится к микроорганизму, содержащему вектор экспрессии.
В пятом аспекте изобретение относится к фармацевтической композиции, содержащей рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена.
TNHH в соответствии с изобретением имеет структуру: Met-NIF-линкер 1-FPRP-линкер 2-гируген или NIF-линкер 1-FPRP-линкер 2-гируген. Предпочтительно, линкер 1 является 5-15 глицинами, более предпочтительно, является 5-10 глицинами; линкер 2 является (GSGG)n, где n=1-3, более предпочтительно, n=1. В FPRP фенилаланин (F) находится, предпочтительно, в L-форме, и Met обозначает метионин. Предпочтительно, химерный белок представляет собой Met-NIF(257)-(Gly)5-FPRPGSGG-гируген, где фенилаланин (F) в FPRP находится в L-форме.
TNHH по изобретению также включает аминокислотную последовательность, которая приблизительно на 80% или больше, предпочтительно, на 90% или больше, идентична аминокислотной последовательности Met-NIF-линкер 1-FPRP-линкер 2-гиругена или NIF-линкер 1-FPRP-линкер 2-гиругена, имеющую терапевтическую значимость в отношении кардио-цереброваскулярных заболеваний, например инсульта головного мозга. Обычно указанная величина идентичности предпочтительно является более высокой. Идентичность аминокислотных последовательностей может быть определена при помощи алгоритма BLAST (Algorithm of Karlin and Altschul (Proc. Natl. Acad. Sci. USA 87:2264-2268, 1990; Proc. Natl. Acad. Sci. USA 90:5873, 1993).
Структура FPRP в TNHH может специфически связываться с фибрином, обеспечивая TNHH направленное ингибирование активности тромбина и лечение кардио-цереброваскулярного заболевания.
Кроме того, TNHH по изобретению необычайно эффективен для лечения или профилактики кардио-цереброваскулярных заболеваний, например для лечения или профилактики ишемического повреждения головного мозга или гематомы головного мозга, и обеспечивает значительное ингибирование агрегации тромбоцитов или ингибировании активации периферических лейкоцитов. Кардио-цереброваскулярным заболеванием является, предпочтительно, инсульт головного мозга.
Для получения TNHH по изобретению используют следующие стадии: (1) конструирование последовательности кДНК, соответствующей искусственно синтезируемому NHH, основанной на кДНК NIF из GenBank и последовательности кодонов, расшифрованной из додекапептида гиругена, в комбинации с предпочтительными кодонами Escherichia coli, дрожжей или СНО, (2) конструирование множественных пар комплементарных перекрывающихся праймеров на основе сконструированной, как описано выше, кДНК-последовательности, амплификацию этой кДНК-последовательности при помощи рекурсивной ПЦР, встраивание продукта амплификации в секвенирующую плазмиду pUC57 и секвенирование автоматическим ДНК-секвенатором (ABI) для обеспечения идентичности сконструированной последовательности кДНК и искусственно синтезированной последовательности кДНК, (3) конструирование праймеров с использованием pUC57, содержащей последовательность оснований, сконструированную в стадии (2), в качестве матрицы для амплификации гена TNHH, и в этом амплифицированном гене начальная область и область в конце последовательности содержат сайты расщепления соответственно, а область в конце последовательности, кроме того, содержит терминатор, предпочтительно, терминатор TAATGA, перед этим сайтом расщепления, для удобства введения амплифицированного гена в вектор экспрессии и экспрессии вектора в клетках-хозяевах; сайты расщепления NdeI и BamHI являются соответственно предпочтительными для начальной области и области в конце последовательности для удобства введения амплифицированного гена в прокариотический вектор экспрессии pET-3c, (4) использование секвенирующей плазмиды с теми же самыми сайтами расщепления, что и сайты расщепления гена TNHH, если амплифицированный ген содержит сайты расщепления в начальной области и в конце последовательности, с последующим расщеплением секвенирующей плазмиды, содержащей правильный ген TNHH и вектор экспрессии, и лигирование правильного гена TNHH с этим вектором экспрессии с получением вектора экспрессии, содержащего ген TNHH, и (5) трансформацию клетки-хозяина вектором экспрессии, содержащим ген TNHH, проведение анализа секвенирования на трансформированной клетке-хозяине для подтверждения правильного введения гена TNHH и идентичности сконструированной последовательности и последовательности гена-мишени, экспрессию белка TNHH в клетке-хозяине, а также экстракцию и очистку белка TNHH из клетки-хозяина. Последовательность белка TNHH состоит из NIF, линкеров и гиругена, где последовательность NIF расположена на N-конце и состоит из 274 аминокислот. Согласно примерам 1-7 вектор экспрессии для получения рекомбинантного TNHH представляет собой pET-систему, экспрессирующуюся в E. coli. При экспрессии в прокариотических организмах стартовый кодон ATG на 5'-конце рекомбинантного TNHH транслируется в метионин (Met). Таким образом, рекомбинантным продуктом TNHH, экспрессируемым в E. coli, является met-TNHH. При экспрессии той же самой полинуклеотидной последовательности TNHH в эукариотических системах экспрессии, таких как дрожжи, клетки млекопитающего (СНО) и тому подобное, рекомбинантный продукт TNHH не содержит Met на N-конце. В этом изобретении биологическая активность и фаромакодинамические эффекты TNHH не зависят от Met на N-конце рекомбинантного продукта TNHH, полученного экспрессией аминокислотной последовательности TNHH по изобретению в прокариотических или эукариотических организмах.
Изобретение также относится к полинуклеотидным последовательностям, кодирующим рекомбинантный химерный белок фактора ингибирования нейтрофилов и гиругена, среди которых предпочтительным является полинуклеотид SEQ ID NO:2.
Предпочтительно, вектор экспрессии, содержащий полинуклеотид по изобретению, является системой pET.
Клетки-хозяева, содержащие вектор экспрессии по изобретению, включают E. coli, клетки дрожжей и клетки СНО и так далее, среди которых предпочтительной является E. coli.
Фармацевтическая композиция по изобретению может быть в любой общепринятой лекарственной форме, вводимой любым общепринятым способом доставки, среди которых предпочтительным является парентеральное введение. Предпочтительной лекарственной формой является инъекционный препарат, в том числе раствор для инъекции, лиофилизированный порошок для инъекции и так далее. При получении препарата для инъекции TNHH по изобретению добавляют к определенному количеству буфера, содержащему неорганическую соль, или аминокислотному буферу, такому как фосфатный, ацетатный, карбонатный, цитратный, глициновый, гистидиновый буфер, где солью является, предпочтительно, соль натрия, и ионная сила буфера находится в диапазоне 5-100 ммоль/л. Величина рН фармацевтической композиции находится в диапазоне 5,0-9,0. Белковый протектор, такой как альбумин, желатин, полисахарид, крахмал, глицерин и тому подобное, также может быть добавлен в композицию, где полисахарид выбран из одного или нескольких компонентов, таких как маннит, сахароза и трегалоза, до концентрации (г/мл) 2,0-6,0%.
Фармацевтическая композиция, содержащая TNHH, по изобретению может быть использована для лечения кардио-цереброваскулярного заболевания, в частности инсульта головного мозга.
Краткое описание фигур
Фиг.1 - ДНК-фрагменты, амплифицированные при помощи ПЦР, где M: маркер-лэддер 100 п.н. ДНК; 1: ген Hirulog (70 п.н.); 2: ген NIF (810 п.н.); 3: ген TNHH (870 п.н.).
Фиг.2 - Идентификация плазмид pLEX-TNHH, pLEX и pET3c ферментативным расщеплением, где M1: продукт расщепления λDNA/Hind III+EcoR I; 1: pLEX-TNHH/Nde I+BamH I; 2: pLEX/Nde I+BamH I; 3: pET3c/Nde I+BamH I; M2: маркер-лэддер 100 п.н. ДНК.
Фиг.3 - Конструирование рекомбинантной экспрессионной плазмиды pET3-TNHH.
Фиг.4 - Идентификация рекомбинантной плазмиды pET3-TNHH, где M: продукт расщепления λDNA/HindIII+EcoRI; 1: pET3c/Nde I+BamH I; 2-3: pET3-TNHH/Nde I+BamH I; 4: ПЦР-фрагмент гена TNHH.
Фиг.5 - Иммуноблоттинг-идентификация TNHH, где M: маркер молекулярной массы белка; 1: очищенный TNHH; 2: Гирудин; 1': иммуноблоттинг TNHH; 2': иммуноблоттинг гирудина.
Фиг.6 - В группе нормального контроля, нервные клетки в коре головного мозга имели правильное расположение, хорошо окрашенное ядро, сморщивание или исчезновение цитоплазмы.
Фиг.7 - В модельной группе, нервные клетки в коре головного мозга имели неправильное расположение, хорошо окрашенные ядра и сморщивание или исчезновение цитоплазмы.
Фиг.8 - В группе NIF, нервные клетки в коре головного мозга имели не совсем правильное расположение, часть хорошо окрашенного ядра и некоторое сморщивание или исчезновение цитоплазмы.
Фиг.9 - В NHH-группе, нервные клетки в коре головного мозга имели не совсем правильное расположение, часть хорошо окрашенного ядра и некоторое сморщивание или исчезновение цитоплазмы.
Фиг.10 - В TNHH-группе, нервные клетки в коре головного мозга имели более правильное расположение, часть хорошо окрашенного ядра и некоторое сморщивание или исчезновение цитоплазмы (HE 10×10).
Фиг.11 - В TNHH-группе, нервные клетки в коре головного мозга имели более правильное структурные расположение, часть хорошо окрашенного ядра и некоторое сморщивание или исчезновение цитоплазмы (HE 40×40).
Подробное описание изобретения
Настоящее изобретение иллюстрируется следующими конкретными примерами. Однако объем данного изобретения не ограничивается этими примерами.
Пример 1: Получение гена NHH
Полный ген был искусственно синтезирован Shanghai Sangon Biological Engineering Technology & Services Co., Ltd., и схема этого конструирования была следующей:
14 олигонуклеотидных фрагментов длиной от 80 до 130 п.н. синтезировали на основе полноразмерной последовательности гена NHH (SEQ ID NO:1). Фрагменты с номерами 1, 3, 5, 7, 9, 11 и 13 были прямыми фрагментами, а фрагменты с номерами 2, 4, 6, 8, 10, 12 и 14 были обратными фрагментами. Между двумя смежными фрагментами был сконструирован комплементарный район из приблизительно 20 п.н. Вышеописанные фрагменты синтезировали, очищали и смешивали в эквивалентных количествах в качестве субстрата для повторяющейся (рекурсивной) ПЦР. Затем ген NHH 822 п.н. получали при помощи ПЦР.
Сайт Kex2 добавляли перед геном NHH и в первых 6 п.н. сайта Kex2 находился сайт XhoI; за геном NHH следовали два стоп-кодона, и за этими стоп-кодонами следовал сайт Xba I.
Полноразмерная последовательность синтезированного гена NHH показана как следующая последовательность (SEQ ID NO: 1):
CTC GAG AAA AGA AAC GAA CAC AAC TTG AGA TGT CCA CAA
Kex2
XhoI
AAC GGT ACT GAA ATG CCA GGT TTC AAC GAC TCC ATC AGA TTG CAA TTC TTG GCT ATG CAC AAC GGT TAC AGA TCC AAG TTG GCT TTG GGT CAC ATC TCC ATC ACT GAA GAA TCC GAA TCC GAC GAC GAC GAC GAC TTC GGT TTC TTG CCA GAC TTC GCT CCA AGA GCT TCC AAG ATG AGA TAC TTG GAA TAC GAC TGT GAA GCT GAA AAG TCC GCT TAC ATG TCC GCT AGA AAC TGT TCC GAC TCC TCC TCC CCA CCA GAA GGT TAC GAC GAA AAC AAG TAC ATC TTC GAA AAC TCC AAC AAC ATC TCC GAA GCT GCT TTG AAG GCT ATG ATC TCC TGG GCT AAG GAA GCT TTC AAC TTG AAC AAG ACT AAG GAA GGT GAA GGT GTT TTG TAC AGA TCC AAC CAC GAC ATC TCC AAC TTC GCT AAC TTG GCT TGG GAC GCT AGA GAA AAG TTC GGT TGT GCT GTT GTT AAC TGT CCA TTG GGT GAA ATC GAC GAC GAA ACT AAC CAC GAC GGT GAA ACT TAC GCT ACT ACT ATC CAC GTT GTT TGT CAC TAC CCA AAG ATC AAC AAG ACT GAA GGT CAA CCA ATC TAC AAG GTT GGT ACT CCA TGT GAC GAC TGT TCC GAA TAC ACT AAG AAG GCT GAC AAC ACT ACT TCC GCT GAC CCA GTT TGT ATC CCA GAC GAC GGT GTT TGT TTC ATC GGT TCC AAG GCT GAC TAC GAC TCC AAG GAG TTC TAC AGA TTC AGA GAA TTG GGC GGT GGC GGT GGC AAC GGT GAC TTC GAA GAA ATC CCA GAA GAA TAC TTG TAA TGA TCT AGA
терминатор Xba I
Синтезированный ген вводили в плазмиду pUC57, которая была обозначена как pUC57-NHH. Ген NHH рекомбинировали с pPIC9K для конструирования рекомбинантной плазмиды, которую затем линеаризовали и трансформировали в Pichia pastoris. Индуцируемую экспрессию выполняли для получения рекомбинантного NHH в качестве контрольного белка для модели животного.
Пример 2: Получение гена TNHH
В этом примере сконструированный TNHH имел структуру Met-NIF-GGGGG-FPRP-GSGG-гируген, которая соответствовала следующей полинуклеотидной последовательности (SEQ ID NO:2):
AAC GAA CAC AAC TTG AGA TGT CCA CAA AAC GGT ACT GAA ATG CCA GGT TTC AAC GAC TCC ATC AGA TTG CAA TTC TTG GCT ATG CAC AAC GGT TAC AGA TCC AAG TTG GCT TTG GGT CAC ATC TCC ATC ACT GAA GAA TCC GAA TCC GAC GAC GAC GAC GAC TTC GGT TTC TTG CCA GAC TTC GCT CCA AGA GCT TCC AAG ATG AGA TAC TTG GAA TAC GAC TGT GAA GCT GAA AAG TCC GCT TAC ATG TCC GCT AGA AAC TGT TCC GAC TCC TCC TCC CCA CCA GAA GGT TAC GAC GAA AAC AAG TAC ATC TTC GAA AAC TCC AAC AAC ATC TCC GAA GCT GCT TTG AAG GCT ATG ATC TCC TGG GCT AAG GAA GCT TTC AAC TTG AAC AAG ACT AAG GAA GGT GAA GGT GTT TTG TAC AGA TCC AAC CAC GAC ATC TCC AAC TTC GCT AAC TTG GCT TGG GAC GCT AGA GAA AAG TTC GGT TGT GCT GTT GTT AAC TGT CCA TTG GGT GAA ATC GAC GAC GAA ACT AAC CAC GAC GGT GAA ACT TAC GCT ACT ACT ATC CAC GTT GTT TGT CAC TAC CCA AAG ATC AAC AAG ACT GAA GGT CAA CCA ATC TAC AAG GTT GGT ACT CCA TGT GAC GAC TGT TCC GAA TAC ACT AAG AAG GCT GAC AAC ACT ACT TCC GCT GAC CCA GTT TGT ATC CCA GAC GAC GGT GTT TGT TTC ATC GGT TCC AAG GCT GAC TAC GAC TCC AAG GAG TTC TAC AGA TTC AGA GAA TTG GGC GGT GGC GGT GGC TTC CCA AGA CCA GGT AGC GGT GGC AAC GGT GAC TTC GAA GAA ATC CCA GAA GAA TAC TTG
Ген TNHH получают с использованием следующих стадий:
синтеза 4 праймеров P1, P2, P3 и P4 с использованием рекомбинантной плазмиды pUC57-NHH в качестве матрицы, амплификации гена NIF (содержащего последовательность оснований в области в конце последовательности для кодирования FPRP) с праймерами P1 и P2 и амплификации гена Hirulog (содержащего последовательность оснований в начальной области для кодирования FPRP) с праймерами P3 и P4; затем использования гена NIF и гена Hirulog в качестве матриц и амплификации гена TNHH с праймерами P3 и P4. Сайты Nde I и BamH I добавляли к начальной области и области в конце последовательности гена TNHH соответственно для удобного инсертирования гена TNHH в прокариотический вектор экспрессии pET-3c. Эти праймерные последовательности показаны как следующие (P1, P2, P3 и P4 показаны в виде SEQ ID NO: 4, 5, 6 и 7 соответственно):
P1 (прямой): 5'-CG CAT ATG AAC GAA CAC AAC TTG AGA TGT CCA -3'
P2 (обратный): 5'-ACC TGG TCT TGG GAA GCC ACC GCC ACC GCC CAA TTC TCT GAA-3'
P3 (прямой): 5'-GGC TTC CCA AGA CCA GGT AGC GGT GGC AAC GGT GAC TTC-3'
P4 (обратный): 5'-TG GGA TCC TTA CAA GTA TTC TTC TGG GAT TTC-3'
CATATG: сайт Nde I; GGA TCC: сайт BamH I; аминокислотная последовательность, кодируемая вставленными в рамку парами оснований, была FPRP; и аминокислотная последовательность, кодируемая подчеркнутыми парами оснований, была GGGGG или GSGG.
Реакционная система, используемая для амплификации гена-мишени TNHH, посредством ПЦР с перекрывающимся удлинением показана следующим образом: каждую реакционную систему ПЦР устанавливали в соответствии с инструкцией изготовителя Набора для реакции ПЦР (TaKaRa, Dalian) (таблица 1).
Ген NIF 810 п.н. (показанный в дорожке 2, фиг.1) амплифицировали с использованием рекомбинантной плазмиды pUC57-NHH в качестве матрицы и P1 и P2 в качестве праймеров. Ген гиругена 70 п.н. (показанный в дорожке 1, фиг.1) амплифицировали с использованием рекомбинантной плазмиды pUC57-NHH в качестве матрицы и P3 и P4 в качестве праймеров. Ген TNHH 870 п.н. (показанный в дорожке 3, фиг.1) в конечном счете амплифицировали с использованием гель-очищенного гена NIF и гена гиругена в качестве матриц и P1 и P4 в качестве праймеров.
| Таблица 1Реакционная система ПЦР | |
| Матрица | 1 мкл |
| Прямой праймер (25 пмоль/л) | 2 мкл |
| Обратный праймер (25 пмоль/л) | 2 мкл |
| dNTPs (2,5 ммоль/л для каждого основания) | 8 мкл |
| Буфер для 10×ПЦР | 10 мкл |
| MgCl2 (25 ммоль/л) | 10 мкл |
| Taq ДНК-полимераза | 1 мкл |
| ddH2O | 66 мкл |
| Общий объем | 100 мкл |
Эту реакционную систему тщательно смешивали и центрифугировали и затем в эту реакционную систему добавляли 40 мл парафинового масла.
Используемые параметры реакции были следующими:
94°С предварительная денатурация 3 мин,
Далее 35 циклов:
| 94°С 1 мин55°С 1 мин72°С 1,5 ми72°С 10 мин |
После этой реакции 3 мкл продукта реакции извлекали для детектирования результата ПЦР с использованием электрофореза на 1,0% агарозном геле (фиг.1).
Результат ПЦР показал, что фрагменты ДНК-мишени амплифицировались в каждой стадии ПЦР, и был получен ген TNHH. Последовательность гена TNHH идентифицировали: ферментативным расщеплением гена TNHH и вектора pLEX (Invitrogen) рестриктазами Nde I и BamH I, извлечением фрагментов-мишеней, лигированием ДНК-лигазой Т4 с образованием рекомбинантной плазмиды pLEX-TNHH и секвенированием (TaKaRa, Dalian). Результат секвенирования продемонстрировал полную идентичность между амплифицированным геном TNHH и сконструированной последовательностью.
Пример 3: Конструирование рекомбинантной плазмиды
1. Основные материалы
Бактерии-хозяева E. coli BL21(DE3)pLysS, E. coli DH5α, плазмида pET3c (Novagen), Набор для экстракции и очистки ДНК (Shanghai Huashun Bioengineering Co., Ltd.), маркер λDNA/Hind III+EcoRI (Huamei), рабочие ферменты: Nde I, BamH I, Hind III, маркер-лэддер ДНК, набор для выделения ДНК и набор для лигирования ДНК Ver.2.1 (TaKaRa, Dalian), антибиотики ампициллин, стрептомицин, тетрациклин, канамицин (AMRESCO).
2. Способы
pLEX-TNHH ферментативно расщепляли Nde I и BamH I и получали фрагменты-мишени. Набор для лигирования ДНК использовали для лигирования гена TNHH с большим фрагментом плазмиды pET3c, полученным ферментативным расщеплением с использованием Nde I и BamH I. Компетентную E. coli DH5α получали в соответствии с CaCl2-способом и трансформировали. Эту трансформированную E. coli DH5α распределяли на LB-чашке, содержащей 100 мг/л ампицилина. LB-планшет инкубировали в термостате при 37°С в течение 12 часов с получением опалесцирующей полупрозрачной единственной колонии. Эту единственную колонию выскребали стерильными зубочистками и культивировали в жидкой LB-среде, содержащей 100 мг/л ампициллина для экстракции плазмид. Экспрессирующую плазмиду pET3-TNHH, содержащую химерный фрагмент 860 п.н., подвергали скринингу ферментативным расщеплением с использованием Nde I и BamH I.
① Экстракция плазмид
Процедуры экстракции выполняли в соответствии с инструкцией изготовителя набора для экстракции и очистки ДНК.
② Ферментативное расщепление
Плазмиду pLEX-TNHH и плазмиду pET3c расщепляли в указанном порядке. Реакционной системой была ДНК-плазмида 0,5 мкг, BamH I 1,0 Е, NdeI 1,0 Е, 10×буферный раствор для ферментативной реакции 2,0 мкл с добавлением деионизованной воды (DDW) до 20 мкл. Ферментативное расщепление выполняли в термостате при 37°С в течение 2 часов. 1 мкл расщепленной плазмиды брали из каждой реакции и детектировали электрофорезом в 1% агарозном геле. Расщепленная плазмида pLEX-TNHH показала полосу 860 п.н. и полосу 2900 п.н., а расщепленная плазмида pET3c показала полосу 4600 п.н. (фиг.2).
③ Лигирование pET-3c и гена TNHH
Все расщепленные пробы извлекали гель-электрофорезом и фрагмент-мишень из расщепленной плазмиды pLEX-TNHH и линеаризованную плазмиду pET-3c выделяли в соответствии с инструкцией изготовителя набора для выделения ДНК. Выделенную линеаризованную плазмиду pET-3c и этот фрагмент-мишень лигировали при 16°С в течение 30 минут в соответствии с инструкцией изготовителя набора для лигирования ДНК с получением pET3-TNHH (фиг.3).
④ Получение и трансформация компетентных клеток
Получение компетентных E. coli DH5α и E. coli BL21(DE3)pLysS и трансформацию pET3-TNHH выполняли в соответствии с общепринятым кальций-хлоридным способом (Molecular Cloning, Second edition, P55).
Пример 4
1. Лигирование и трансформация
E. coli DH5α трансформировали pET3-TNHH-положительным раствором для лигирования и pET3-TNHH-негативным раствором для лигирования соответственно. E. coli DH5α отдельно распределяли на двух чашках LB, содержащих 100 мг/л ампициллина в каждом случае, и инкубировали при постоянной температуре 37°С в течение 12 часов. 5 отдельных колоний наблюдали на негативной чашке и приблизительно 100 отдельных колоний наблюдали на позитивной чашке, что демонстрировало успешные лигирование и трансформацию. Эти колонии обнаруживали типичную морфологию E. coli.
2. Идентификация рекомбинантной экспрессионной плазмиды pET3-TNHH ферментативным расщеплением
Две отдельные колонии выскребали стерильными зубочистками из позитивной чашки и затем культивировали в жидкой LB-среде, содержащей 100 мг/л ампициллина, при 37°С в течение 12 часов. Затем рекомбинантную экспрессионную плазмиду pET3-TNHH экстрагировали и расщепляли Nde I и BamH I. Результаты показывали полосу 4600 п.н. и полосу 860 п.н. (с использованием ПЦР-продукта TNHH в качестве контроля), как и ожидалось (фиг.4).
3. Идентификация рекомбинантной экспрессионной плазмиды pET3-TNHH секвенированием
Выполняли экстракцию плазмиды pET3-TNHH из pET3-TNHH/E. coli DH5α и выполняли анализ последовательности после идентификации ферментативным расщеплением. Результаты секвенирования (полученные TaKaRa, Dalian) показали, что последовательность TNHH, содержащаяся в этой плазмиде, была такой, какая и ожидалась.
Пример 5: Экстракция и очистка TNHH
Сконструированные бактерии pET3-TNHH/BL21(DE3)pLysS инокулировали в LB-среду (содержащую 100 мкг/мл ампициллина) и культивировали при 30°С и 250 об/мин в течение 1,5-3 часов. При достижении величины OD 0,4-0,6 добавляли 0,5 мМ IPTG (конечная концентрация) для 3-4-часовой индукции. Сконструированные бактерии собирали и лизировали и TNHH экстрагировали и очищали.
Подробные процедуры были следующими:
Бактерии
↓
| Лизис бактерий гомогенизацией под давлением: 1 л раствора лизирующего буфера (50 ммоль/л Трис, 10 ммоль/л ЭДТА, 1% Тритон Х-100, pH 10,0, 4°С) добавляли в 100 г бактерий и эти бактерии подвергали гомогенизации под давлением 2-3 раза при давлении 40 МПа |
↓
| Центрифугирование: 4°С, 12000 об/мин, 15 мин, сохранение осадка |
↓
| Промывание содержащихся включений: промывочный буферный раствор (50 ммоль/л Трис, 5 ммоль/л ЭДТА, 2 моль/л мочевина, 1% Тритон Х-100 pH 8,0) с тем же самым объемом, какой добавляли выше, и достаточным перемешиванием для растворения |
↓
| Центрифугирование: 4°С, 12000 об/мин, 15 мин, с сохранением осадка |
↓
| Растворение содержащихся включений: раствор буфера для растворения (50 ммоль/л Трис, 0,5/1000 Я-ME, 6 моль/л мочевина, pH 9,0) с тем же самым объемом, какой добавляли выше, и достаточным перемешиванием для растворения |
↓
| Ренатурация: градиентное разведение с использованием 50 ммоль/л Трис-Cl, 6 моль/л мочевина, 1/2000 Я-ME, концентрация белка 2,5~3,0 мг/мл, 0,3 ммоль/л цистин при рН 9,0, 15~20°С и ренатурация раствором для ренатурации: 25 ммоль/л Tris-Cl, 0,3 ммоль/л L-цистин, pH 9,0 |
↓
| Ультрафильтрационное концентрирование: около 10°С, отсечение молекулярной массы 3KD, ультрафильтрация до 20-30-кратного увеличения концентрации |
↓
| Грубая очистка TNHH: среда Бутил-Сефароза F.F., буферный раствор для уравновешивания: 25 ммоль/л Трис, 0,3 M (NH4)2SO4, 0,5 моль/ NaCl, pH 8,0, сбор белка-мишени из проходящего через колонку пика, элюция этого белка в виде примесей 25 ммоль/л Трисом 25 pH 8,0 |
↓
| Белок-мишень из проходящего через колонку пика очищали бутил-колонкой и осаждали при рН 3,0~4,0 (доведенном с использованием HCl) |
↓
| Центрифугирование: 4°С, 12000 об/мин, 15 мин, с сохранением осадка |
↓
| Растворение этого осадка в 20 ммоль/л буферного раствора PB pH 8,0 с получением прозрачного раствора и фильтрование с использованием мембраны 0,45 мкм |
↓
| Тонкая очистка TNHH: среда Source 30 Q., буфер А для уравновешивания: 20 ммоль/л PB, 0,2 моль/л NaCl, pH 8,0, условия элюции В (20 ммоль/л PB 0,5 моль/л NaCl pH 8,0), элюция линейным градиентом, сбор представляющего интерес белкового пика (приблизительно 35% раствор В) |
↓
| Представляющий интерес белок очищали с использованием колонки Source 30 Q и осаждали при pH 3,0~4,0 (доведенном фосфорной кислотой) |
↓
| Центрифугирование: 4°С, 12000 об/мин, 15 мин, с сохранением осадка |
↓
| Полное растворение осадка 10 ммоль/л буферного раствора PB, pH 7,4 и фильтрование с использованием пленки 0,45 мкм |
↓
| Удаление источника тепла и некоторого количества высокомолекулярного белка: среда Супердекс 75, буфер для уравновешивания: 10 ммоль/л PB pH 6,5, условие элюции для представляющего интерес белка: 10 ммоль/л PB pH 6,5 |
↓
Маточный раствор TNHH
Полученный таким образом маточный раствор TNHH разбавляли 10 ммоль/л PB (pH 7,5), пока не достигалась концентрация TNHH 3,0 мг/мл, и затем лиофилизировали с получением продукта после добавления 4,0% маннита.
Пример 6: Идентификация маточной жидкости TNHH иммуноблоттингом и секвенированием
Очищенный TNHH анализировали гель-электрофорезом в ДСН-ПААГ с тем же самым количеством нанесенной пробы и затем переносили на нитроцеллюлозную пленку с использованием электропереносящего прибора для связывания сначала с мышиным антителом против гирудина (первичным антителом) и затем связывания с козьим HRP-антителом против мышиного IgG (вторичным антителом). Результаты иммуноблоттинга получали с использованием развивающих окраску реакций с субстратами (фиг.5).
Из фиг.5 можно видеть, что в TNHH имелся компонент, специфически связывающий анти-гирудин-антитело, что позволяет предположить, что сконструированный эпитоп антигена HV2 был достаточно экспонирован (выставлен) и мог специфически связываться с этим антителом.
Результаты секвенирования показали, что N-концевой аминокислотной последовательностью TNHH была MNEHNLRCPQNGTEM, а С-концевой аминокислотной последовательностью TNHH была EYL, обе из которых согласуются с последовательностями сконструированной последовательности: MNEHNLRCPQNGTEMPGFNDSIRLQFLAMHNGYRSKLALGHISITEESESDDDDDFGFLPDFAPRASKMRYLEYDCEAEKSAYMSARNCSDSSSPPEGYDENKYIFENSNNISEAALKAMISWAKEAFNLNKTKEGEGVLYRSNHDISNFANLAWDAREKFGCAVVNCPLGEIDDETNHDGETYATTIHVVCHYPKINKTEGQPIYKVGTPCDDCSEYTKKADNTTSADPVCIPDDGVCFIGSKADYDSKEFYRFRELGGGGGFPRPGSGGNGDFEEIPEEYL (SEQ ID NO:3). Идентичность между аминокислотной последовательностью TNHH и этой сконструированной последовательностью дополнительно определяли в свете результатов секвенирования ДНК.
Аминокислотной последовательностью перед (Gly)5 был NIF, а аминокислотной последовательностью гирудина была NGDFEEIPEEYL.
Из приведенных выше результатов можно видеть, что полученный TNHH имел структуру Met-NIF-GGGGG-FPRP-GSGG-гируген.
Пример 7: Получение TNHH, содержащего линкер 1 (Gly)15 и линкер 2 (GSGG)3
Линкер 1 и линкер 2 в гене TNHH заменяли при помощи ПЦР с получением NIF-(Gly)15-FPRP-(GSGG)3-гиругена.
Синтезировали две пары праймеров:
P5 (прямой): тот же самый, что и Р1 в примере 2
P6 (обратный): 5'-ACCTGG TCT TGG GAA GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC CAA TTC TCT GAA-3' (SEQ ID NO:8)
P7 (прямой): 5'-GGCTTC CCA AGA CCA-GGT AGC-GGT GGC GGT AGC GGT GGC GGT AGC GGT GGC AAC GGT GAC TTC-3' (SEQ ID NO:9)
P8 (обратный): тот же самый, что и P4 в примере 2,
где аминокислотной последовательностью, кодируемой парами оснований, представленными в рамке, был FPRP; аминокислотной последовательностью, кодируемой подчеркнутыми парами оснований в P6, был (Gly)15 и аминокислотной последовательностью, кодируемой подчеркнутыми основаниями в P7, был (GSGG)3.
Представляющий интерес ген получали с использованием полинуклеотида TNHH в качестве матрицы и выполнением ПЦР в соответствии со способом, используемым в примерах 2, 3, 4 и 5. Затем выполняли конструирование рекомбинантной плазмиды, лигирование, трансформацию, экстракцию и очистку.
Полученный рекомбинантный TNHH был назван TNHH-G15/n3.
In vitro сравнительный анализ показал, что TNHH-G15/n3 и TNHH имели одну и ту же антитромбиновую активность и адгезионную в отношении лейкоцитов активность.
Синтезировали две пары праймеров:
P5 (прямой): тот же самый, что и P1 в примере 2
P6 (обратный): 5'-ACCTGG TCT TGG GAA GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC ACC GCC CAA TTC TCT GAA-3'
P7 (прямой): 5'-GGCTTC CCA AGA CCA-GGT AGC-GGT GGC GGT AGC GGT GGC GGT AGC GGT GGC AAC GGT GAC TTC-3'
P8 (обратный): тот же самый, что и P4 в примере 2,
где аминокислотной последовательностью, кодируемой парами оснований, представленными в рамке, был FPRP; аминокислотной последовательностью, кодируемой подчеркнутыми парами оснований в P6, был (Gly)15 и аминокислотной последовательностью, кодируемой подчеркнутыми основаниями в P7, был (GSGG)3.
| антитромбиновая активность(ATU/мг) | активность против адгезии лейкоцитов(ЕД/мг) | |
| TNHH | 1200 | 750 |
| TNHH-G15/n3 | 1200 | 740 |
| NHH | 800 | 650 |
| NIF | отсутствует | 750 |
| Гируген | 1000 | отсутствует |
Пример 8: фармацевтическая композиция, содержащая TNHH
8.1 Инъекционные растворы
Маточный раствор рекомбинантного белка TNHH из примера 5 готовили в соответствии со следующим рецептом для приготовления инъекционного раствора, где указанная концентрация TNHH была конечной концентрацией.
Рецепт A:
| TNHH | 3,0 мг/мл |
| Na2HPO4/NaH2PO4 | 10 ммоль/л |
| pH | 7,0-8,0 |
Рецепт В:
| TNHH | 6,0 мг/мл |
| ацетат натрия/уксусная кислота | 20 ммоль/л |
| глицерин | 20 мг |
| pH | 5,5 - 7,0 |
8.2 Лиофилизированный порошок
Маточный раствор рекомбинантного белка TNHH из примера 5 готовили в соответствии со следующим рецептом для получения лиофилизированного порошка, где концентрация TNHH была конечной концентрацией.
Рецепт С:
| TNHH | 3,0 мг/мл |
| Na2HPO4/NaH2PO4 | 10 ммоль/л |
| глицин | 40 мг |
| pH | 6,0-8,0 |
Рецепт D:
| TNHH | 6,0 мг |
| ацетат натрия/уксусная кислота | 10 ммоль/л |
| сахароза | 60 мг |
| pH | 5,0-6,0 |
Рецепт E:
| TNHH | 9,0 мг |
| бикарбонат натрия/карбонат натрия | 20 ммоль/л |
| трегалоза | 40 мг |
| pH | 8,0-9,0 |
Способы приготовления в примере 8, все, соответствовали общепринятым способам для приготовления инъекционных растворов и лиофилизированных порошков.
Следующие примеры были экспериментами на TNHH данного изобретения для определения его биологических активностей. Все пробы TNHH в этих экспериментах были TNHH-продуктами из примера 5; NIF и NHH готовили FAGEN BIOMEDICAL INC. CHONGQING в соответствии с Китайской заявкой на патент № 031011551.
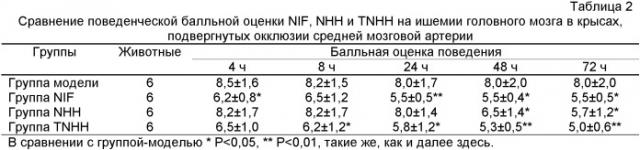
Пример 9: Сравнение терапевтических действий NIF, NHH и TNHH на ишемическом повреждении головного мозга в крысах, подвергнутых окклюзии (закупорке) средней мозговой артерии
1. Материалы
Лекарственные средства: испытуемыми лекарственными средствами были NIF, NHH и TNHH.
Агенты: хлорид трифенилтетразолия (TTC), приобретенный из China National Medicine Group, Shanghai Chemical Reagent Company, Lot № F20020610; APTT kit, приобретенный из Shanghai Sunbiote Company, Lot № Medical Device Registration Record JIN(2002) № 3401632.
Животные: 24 крыс Wistar, самцов, 180~230 г, обеспеченных Animal Center, Chongqing Medical University.
2. Способы
Крыс Wistar случайным образом делили на 4 группы (6 животных на группу), включающие в себя группу-модель, группу NHH, группу NIF и группу TNHH. Затем выполняли анестезию каждой из крыс Wistar с использованием 10% хлоральгидрата (350 мг/кг, i.p.). Крысу фиксировали в положении на спине и кожу рассекали вдоль срединного надреза шеи для поиска правой общей сонной артерии, который затем зашивали 2 швами для более позднего применения. Наружную сонную артерию затем отделяли и лигировали (перевязывали). Внутреннюю сонную артерию и крылонебную артерию ниже наружной сонной артерии выделяли и последнюю также лигировали. Выделенные проксимальный конец и дистальный конец выделенной общей сонной артерии клиппировали и затем небольшой разрез открывали на наружной сонной артерии, в который вставляли найлоновую нить (Φ=0,22~0,30 мм). Затем эту нить проталкивали в переднюю мозговую артерию (приблизительно на 20 мм) медленно и вытягивали обратно приблизительно 2 мм для по