Способ селекции кардиомиоцитов (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способам селекции кардиомиоцитов. Данный способ включает культивирование клеточной смеси, содержащей кардиомиоциты и некардиомиоциты, образованные из стволовых клеток, кроме эмбриональных клеток человека, в культуральной среде. Клеточную смесь культивируют в следующих условиях: (i) условия низкой подпитки глюкозой, (ii) одно или несколько условий, выбранных из группы, состоящей из: условия низкого содержания кальция; условия низкого содержания питательных веществ; условия подпитки молочной кислотой; условия подпитки аспарагиновой кислотой/глутаминовой кислотой и условия подпитки пировиноградной кислотой. Предложенное изобретение позволяет повысить степень чистоты и уровень выхода кардиомиоцитов из клеточной смеси, содержащей кардиомиоциты и некардиомиоциты, образованные из стволовых клеток, кроме эмбриональных клеток человека. 2 н. и 9 з.п. ф-лы, 23 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу очистки кардиомиоцитов из клеточной популяции, образованной из стволовых клеток и эмбрионов, а также к способу их применения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Поскольку кардиомиоцит теряет пролиферативную способность во взрослом организме, то при лечении тяжелых заболеваний сердца, таких как инфаркт миокарда или кардиомиопатия, необходимо проводить трансплантацию сердца. Однако в настоящее время, поскольку доступно недостаточное количество донорских сердец, существует срочная необходимость в разработке способа лечения, отличного от трансплантации сердца.
С другой стороны, привлечение полученных ex vivo кардиомиоцитов, как ожидают, является наиболее перспективным способом обеспечения облегчения у пациентов, нуждающихся в трансплантации сердца. Были исследованы различные способы получения кардиомиоцитов, такие как способ дифференцировки стволовых клеток (эмбриональных стволовых клеток или различных взрослых стволовых клеток) в кардиомиоциты или способ выделения кардиомиоцитов из эмбрионов.
Дифференцировку кардиомиоцитов из эмбриональных стволовых клеток положительно индуцируют посредством образования клеточной массы (эмбриоидного тельца) с помощью устранения из культуральной среды подавляющих дифференцировку факторов (таких как фидерные клетки, лейкозингибирующий фактор: LIF) в случае эмбриональных стволовых клеток мыши или подавляющих дифференцировку факторов (таких как фидерные клетки, основной фибробластный фактор роста: bFGF, трансформирующий фактор роста: TGF) в случае эмбриональных стволовых клеток человека.
Способ дифференцировки in vitro частично соответствует процессу физиологического развития. В частности, в отношении процессов раннего развития существует много общего между способом физиологического развития оплодотворенных яйцеклеток и способом дифференцировки in vitro. В ходе дифференцировки кардиомиоцитов in vitro, так же как и при физиологическом развитии, сначала получают недифференцированные мезобластные клетки, часть которых изменяется до запрограммированных кардиомиоцитов (прекардиальных мезобластных клеток), а затем дифференцируется в кардиомиоциты. Однако поскольку эмбриональные стволовые клетки могут дифференцироваться в клетки любого типа, которые образуют органы в организме, технически трудно дифференцировать эмбриональные стволовые клетки только в один тип клеток.
Кроме того, поскольку не в физиологических условиях (in vitro) также является трудным индуцировать дифференцировку эмбриональных стволовых клеток во все типы клеток, частично остаются недифференцированные клетки. Более того, мезенхимные стволовые клетки, находящиеся в костном мозге или пуповине, и тканевые стволовые клетки, находящиеся в различных типах тканей (такие как нейрональные стволовые клетки, стволовые клетки жировой ткани и стволовые клетки скелетных мышц), рассматривают как взрослые стволовые клетки, которые, как считают, обладают способностью дифференцироваться в кардиомиоциты. Полагают, что эти клетки дифференцируются не только в кардиомиоциты, но также в клетки различных типов. Хотя детали механизмов дифференцировки из каких-либо взрослых стволовых клеток в кардиомиоциты не выяснены полностью, известно, что в течение определенного периода после прохождения переходной фазы эти клетки образуют кардиомиоциты, другие дифференцированные клетки и клеточную популяцию, содержащую недифференцированные клетки.
В общих словах, все стволовые клетки приводят к некоторым общим неблагоприятным для клинического применения особенностям, состоящим в том, что существуют клетки, отличные от кардиомиоцитов, которые образуются из стволовых клеток в качестве побочных продуктов, или недифференцированные клетки. Поскольку недифференцированные клетки обладают пролиферативной активностью и способностью дифференцироваться во многие типы клеток, клеточную популяцию, содержащую кардиомиоциты, полученные индукцией дифференцировки, нельзя трансплантировать в живой организм при лечении.
Таким образом, для безопасного проведения лечения с использованием стволовых клеток и достижения идеального эффекта лечения необходимо разработать способ очистки кардиомиоцитов из клеточной популяции.
До настоящего времени кардиомиоциты очищали способом очистки кардиомиоцитов посредством специфичной экспрессии флуоресцентного маркера, такого как GFP, в кардиомиоцитах и селекцией клеток, экспрессирующих флуоресцентный маркер с использованием клеточного сортера (Непатентный документ 1), или способом очистки кардиомиоцитов посредством специфичной экспрессии устойчивого к антибиотику белка в кардиомиоцитах и селекцией клеток с использованием антибиотика (Непатентный документ 2). Однако поскольку эти способы должны вовлекать генетическое изменение, которое приводит к связанным с безопасностью проблемам, эти способы нельзя применять для получения кардиомиоцитов в целях трансплантации в клинике. Кроме того, поскольку эти способы вовлекают генетическое изменение, то с геномным изменением ассоциированы этические вопросы и некоторый непредсказуемый серьезный риск, такой как изменение скорости трансформации (Непатентный документ 3).
В данной области известно, что сердце может использовать молочную кислоту, образованную тканью, отличной от сердца (такой как скелетная мышца), в качестве источника энергии (Непатентный документ 4). Однако в предшествующем уровне техники не пытались очищать кардиомиоциты с использованием этого признака.
Кроме того, в сердце, печени и почке используются аспарагиновая кислота и глутаминовая кислота для транспорта NADH в митохондрии, механизм которого отличается от механизма в других тканях (Непатентный документ 5). Транспорт NADH в митохондрии необходим для выработки энергии в митохондриях. Однако в предшествующем уровне техники не пытались очищать кардиомиоциты с использованием этого отличия в данном механизме.
Непатентный документ 1: Muller M, et al., FASEB J. 2000; 14: 2540-2548
Непатентный документ 2: Klug M.G., et al., J. Clin. Invest. 1996; 98: 216-224
Непатентный документ 3: Schroder AR, et al., Cell. 2002; 110: 521-529
Непатентный документ 4: Khairallah M, et al., Am J Physiol Heart Circ Physiol 2004; 286, H1461-1470
Непатентный документ 5: Chatham JC, et al., J Biol Chem 1995; 270: 7999-8008
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ ЭТИМ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является разработка способа очистки кардиомиоцитов с высокой степенью очистки и с высоким выходом из клеточной смеси, содержащей кардиомиоциты, полученные из эмбриона, и стволовые клетки, с использованием различных признаков, которые ранее не предполагали применять для очистки кардиомиоцитов или которые являются вновь выявленными, при этом указанный способ проводят без какого-либо генетического изменения или без добавления каких-либо специальных белков или биологически активных веществ.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМЫ
В целях создания системы для эффективной продукции кардиомиоцитов, образованных из эмбриональных стволовых клеток, авторы настоящего изобретения провели исчерпывающее исследование различных типов композиций культуральных сред. Исходя из результатов, касающихся исследования концентрации каждого из компонентов различных культуральных сред или исследования распределения во времени изменений концентраций каждого из компонентов различных культуральных сред, полученных изменением составов компонентов различных культуральных сред, авторы настоящего изобретения выявили следующие события:
(1) событие, при котором происходит ингибирование дифференцировки/роста клеток и индукция направленной не на кардиомиоциты гибели клеток, когда клеточную среду, содержащую кардиомиоциты и некардиомиоциты, культивируют в условиях низкой подпитки сывороткой или в бессывороточных условиях;
(2) событие, при котором происходит индукция направленной не на кардиомиоциты гибели клеток, когда клеточную среду, содержащую кардиомиоциты и некардиомиоциты, культивируют в культуральной среде со средней кислотностью;
(3) событие, при котором происходит ингибирование дифференцировки/роста клеток и индукция направленной не на кардиомиоциты гибели клеток, когда клеточную смесь, содержащую кардиомиоциты и некардиомиоциты, культивируют в культуральной среде с низким содержанием кальция;
(4) событие, при котором некардиомиоциты селективно подвергаются клеточной гибели, когда кардиомиоциты культивируют в культуральной среде с низким содержанием питательных веществ;
(5) событие, при котором потребление энергии ингибируется ослаблением автономной пульсации кардиомиоцитов, когда кардиомиоциты культивируют в условиях низкого содержания кальция;
(6) событие, при котором спонтанное образование клеточной массы кардиомиоцитов усиливается в условиях низкой подпитки сывороткой или в бессывороточных условиях; и
(7) событие, при котором жизнеспособность кардиомиоцитов значительно снижается, когда кардиомиоциты культивируют после разделения клеточной массы кардиомиоцитов.
Авторы настоящего изобретения обнаружили, что кардиомиоциты, образованные из эмбриональных стволовых клеток, можно подвергать селекции или очищать эффективно и в высокой степени посредством оптимизированного способа с использованием одного или нескольких процессов, соответствующих этим событиям. Кроме того, авторы изобретения также обнаружили, что способы, разработанные, исходя из свойств эмбриональных стволовых клеток, также являются применимыми для селекции и очистки кардиомиоцитов, образованных из эмбриона, или для селекции или очистки кардиомиоцитов, образованных из взрослых стволовых клеток. Исходя из этих открытий авторы изобретения осуществили настоящее изобретение.
Более конкретно, в одном варианте осуществления настоящее изобретение относится к способу селекции кардиомиоцитов из клеточной смеси, содержащей кардиомиоциты и некардиомиоциты, образованной из эмбриональных стволовых клеток, взрослых стволовых клеток или эмбрионов, где указанную клеточную смесь культивируют в культуральной среде в следующих условиях: (i) условия низкой подпитки глюкозой; и (ii) одно или несколько условий, выбранных из группы, состоящей из условий низкого содержания кальция, условий низкого содержания питательных веществ, условий подпитки молочной кислотой, условий подпитки аспарагиновой кислотой/глутаминовой кислотой и условий подпитки пировиноградной кислотой. В этом варианте осуществления клеточную смесь можно получать индукцией дифференцировки эмбриональных стволовых клеток, образованием эмбриоидных телец, содержащих запрограммированные кардиомиоциты (недифференцированные мезобластные клетки), культивированием эмбриоидных телец в культуральной среде в условиях низкой подпитки сывороткой и/или в условиях среднекислых значений pH.
В другом варианте осуществления настоящее изобретение относится к способу селекции кардиомиоцитов, образованных из эмбриональных стволовых клеток, где селекцию кардиомиоцитов проводят посредством следующих стадий: индукция дифференцировки эмбриональных стволовых клеток с образованием эмбриоидных телец, содержащих недифференцированные мезобластные клетки; затем культивирование эмбриоидных телец в культуральной среде в условиях низкой подпитки сывороткой и/или условиях среднекислого значения pH с получением клеточной смеси, содержащей запрограммированные кардиомиоциты; и продолжение культивирования клеточной смеси в указанной культуральной среде с получением кардиомиоцитов.
КРАТКОЕ ОПИСАНИЕ ФИГУР
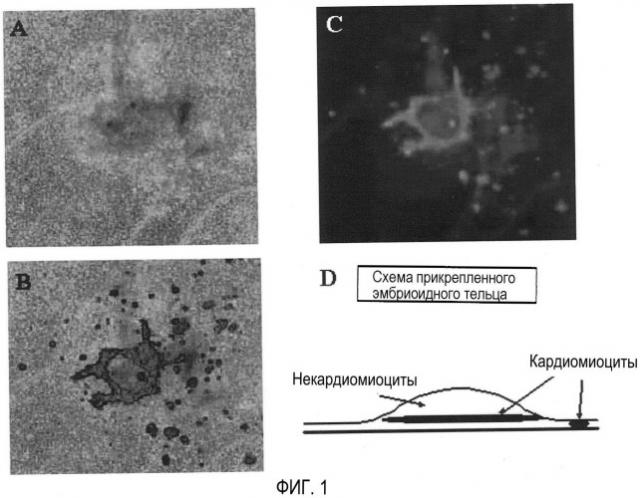
Фиг. 1. На фиг. 1 представлено изображение кардиомиоцитов в эмбриоидном тельце после культивирования в прикрепляющейся культуре.
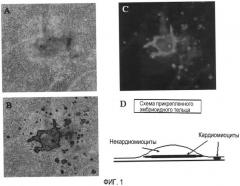
Фиг. 2. На фиг. 2 представлено изображение кардиомиоцитов в прикрепленных эмбриоидных тельцах, которые культивировали в бессывороточных условиях.
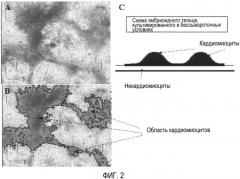
Фиг. 3. На фиг. 3 представлена успешная селекция запрограммированных кардиомиоцитов в бессывороточных условиях.
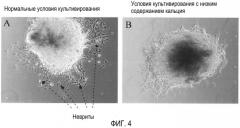
Фиг. 4. На фиг. 4 представлен эффект условий низкого содержания кальция.
Фиг. 5. На фиг. 5 представлена успешная селекция запрограммированных кардиомиоцитов из массы эмбриональных стволовых клеток в бессывороточных условиях/условиях среднекислого значения pH.
Фиг. 6-1. На фиг. 6-1 представлен анализ запрограммированных кардиомиоцитов в массе эмбриональных стволовых клеток в бессывороточных условиях/условиях среднекислого значения pH.
Фиг. 6-2. На фиг. 6-2 представлен анализ запрограммированных кардиомиоцитов в массе эмбриональных стволовых клеток в бессывороточных условиях/условиях среднекислого значения pH.
Фиг. 7. На фиг. 7 представлена масса кардиомиоцитов, которые отобрали посредством культивирования эмбриональных стволовых клеток в бессывороточных условиях/условиях среднекислого значения pH.
Фиг. 8. На фиг. 8 представлена селекция кардиомиоцитов посредством культивирования клеток в условиях без сахаров, без сыворотки и с подпиткой молочной кислотой.
Фиг. 9. На фиг. 9 представлены изображения кардиомиоцитспецифичного окрашивания для клеток, которые подвергали селекции и собирали посредством культивирования клеток в условиях без сахаров/без сыворотки и с подпиткой молочной кислотой.
Фиг. 10. На фиг. 10 представлены массы кардиомиоцитов и массы погибших клеток сразу после селекции культивированием клеток в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой молочной кислотой.
Фиг. 11. На фиг. 11 показан результат способа элиминации агрегатов с высокой плотностью, состоящих из масс погибших клеток, с использованием центрифугирования в градиенте плотности.
Фиг. 12-1. На фиг. 12-1 представлены массы кардиомиоцитов, подвергнутые селекции культивированием клеток в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой молочной кислотой.
Фиг. 12-2. На фиг. 12-2 представлены массы кардиомиоцитов, подвергнутых селекции посредством культивирования клеток в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой молочной кислотой.
Фиг. 13. На фиг. 13 показаны кардиомиоциты, очищенные посредством культивирования клеток в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой аспарагиновой кислотой/глутаминовой кислотой.
Фиг. 14. На фиг. 14 показаны результаты очистки кардиомиоцитов из стволовых клеток костного мозга.
Фиг. 15. На фиг. 15 показаны результаты очистки кардиомиоцитов из эмбрионов.
Фиг. 16. На фиг. 16 показаны области, содержащие автономно пульсирующие клетки в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой пировиноградной кислотой.
Фиг. 17. На фиг. 17 показаны массы кардиомиоцитов мартышки, подвергнутые селекции культивированием клеток в течение 15 суток в условиях без сахаров/без сыворотки и с подпиткой молочной кислотой.
Фиг. 18. На фиг. 18 показаны изображения кардиомиоцитспецифичного окрашивания клеток мартышки, которые подвергают селекции и собирают культивированием клеток в условиях без сыворотки/со средней кислотностью/с низким содержанием кальция/без сахаров и с подпиткой молочной кислотой.
Фиг. 19. На фиг. 19 показано, что клетки мартышки, которые подвергают селекции и собирают культивированием в условиях без сахаров/без сыворотки и с подпиткой молочной кислотой, успешно пересаживают в сердце реципиента.
Фиг. 20. На фиг. 20 показаны картина клеточных масс, образованных из эмбриональных стволовых клеток человека, которые получали культивированием в условиях присутствия сахара (контроль) (т.е. в контрольных условиях), и картина клеточных масс, образованных из эмбриональных стволовых клеток человека, которые были получены с помощью селективного для кардиомиоцитов культивирования в условиях без сахаров (селекция кардиомиоцитов) в течение 15 суток (то есть в условиях селекции кардиомиоцитов).
Фиг. 21. На фиг. 21 показаны изображения иммунного окрашивания клеточных масс, образованных из эмбриональных стволовых клеток человека с использованием антитела против актинина и антитела против Nkx2.5, где клеточные массы были образованы кардиомиоцитами с продолжающейся автономной пульсацией. Клеточные массы получали культивированием эмбриональных стволовых клеток человека в условиях без сахаров (селекция кардиомиоцитов) в течение 1 суток с последующей сменой условий культуральной среды.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ЭТОГО ИЗОБРЕТЕНИЯ
Пригодный способ обработки для индукции дифференцировки кардиомиоцитов, как правило, приводит к дифференцировке стволовых клеток, обладающих способностью дифференцироваться в кардиомиоциты (то есть эмбриональных стволовых клеток и взрослых стволовых клеток, таких как стволовые клетки костного мозга). Возможной является индукция дифференцировки эмбриональных стволовых клеток в кардиомиоциты с использованием способа "висячей капли", в котором, например, эмбриональные стволовые клетки мыши инкубируют в суспензионной культуре в условиях отсутствия лейкозингибирующего фактора (LIF) с образованием клеточной массы (эмбриоидного тельца). Также, аналогично, для индукции дифференцировки эмбриональных стволовых клеток в кардиомиоциты можно использовать эмбриональные стволовые клетки мартышки или эмбриональные стволовые клетки человека.
Данный способ можно применять в случае стволовых клеток, полученных из млекопитающих любых видов. Например, примеры видов млекопитающих, из которых получают стволовые клетки, используемые в данном способе, включают, но не ограничиваются ими, мышь, корову, козу, собаку, кошку, мартышку, макаку резус, человека и т.д. Примеры стволовых клеток, используемых для настоящего изобретения, включают клетки ES млекопитающих, которые широко используют в данной области, такие как клетки ES мыши, клетки ES обезьяны и клетки ES человека.
Конкретные примеры клеток ES мыши включают клетки EB3, клетки E14, клетки D3, клетки CCE, клетки R1, клетки 129SV, клетки J1 и т.д. Клетки ES мыши, используемые для настоящего изобретения, доступны от Американской коллекции типовых культур (ATCC), Chemicon and Cell & Molecular Technologies и т.д.
Примеры клеток ES обезьяны включают клетки ES, полученные от макаки резус (Macaca mulatta) (Thomson et al., Proc. Natl. Acad. Sci. USA 1995; 92:7844), клетки ES, полученные от яванской макаки (Macaca fascicularis) (Suemori et al., Dev. Dyn. 2001; 222: 273-279), и клетки ES, полученные от обыкновенной игрунки (Callithrix jacchus) (Sasaki et al., Stem cells. 2005; 23: 1304-1313), все из которых доступны в данной области. Например, клетки ES мартышки доступны от Central Institute for Experimental Animals (Kawasaki, Japan).
К настоящему времени в мире получено несколько дюжин типов клеток ES человека, и множество клеточных линий ES зарегистрировано в перечне United States National Institute of Health (http://stemcells.nih.gov/registry/index.asp) и являются доступными. В США некоторые клеточные линии ES человека также коммерчески доступны от Cellartis, ES Cell International, Wisconsin Alumni Research Foundation, и т.д. Также в Японии некоторые клеточные линии ES человека доступны от Stem Cell Research Center (Institute for Frontier medical Sciences, Kyoto University) (Suemori et al., Biochem. Biophys. Res. Commun., 2006; 345: 926-932).
Кроме того, также были получены клетки ES коровы (Mitalipova et al., Cloning 2001; 3: 59-67), клетки ES курицы (Petitte et al., Mech. Dev. 2004; 121: 1159-1168) и клетки ES данио-рерио (Fishman, M. C., Science 2001; 294: 1290-1291).
Главным образом, клетки ES получают культивированием раннего эмбриона. В дополнение к этому способу можно получать клетки ES из раннего эмбриона, который подвергают ядерной трансплантации ядрами соматических клеток (Munsie et al., Curr. Biol. 10:989, 2000; Wakayama et al., Science 292:740, 2001; Hwang et al., Science 303: 1669, 2004). Также существует несколько сообщений о попытках выделения стволовых клеток следующим образом: способ получения клеток ES из партеногенетических эмбриональных клеток, развитых до стадии, эквивалентной стадии бластоцисты (публикация патента США №02/168763; Vrana K et al., Proc. Natl. Acad. Sci. USA 100:11911-6, 2003), и способ получения клеток ES, обладающих генетической информацией, исходно содержащейся в ядре соматических клеток, посредством слияния клеток ES и соматических клеток (WO 00/49137; Tada et al., Curr. Biol. 11:1553, 2001). Примеры клеток ES, используемых в настоящем изобретении, включают клетки ES, полученные способом, описанным выше, или клетки, в которых один или несколько генов на хромосоме клеток ES изменены способами генетической инженерии.
Кроме того, примеры стволовых клеток, используемых в способе по настоящему изобретению, включают не только клетки ES, но также любые стволовые клетки, обладающие характеристиками, сходными с характеристиками клеток ES, которые образованы из клеток взрослых органов или тканей млекопитающих, клеток костного мозга, клеток крови и клеток эмбрионов или плодов. В этом контексте выражение "характеристики, сходные с характеристиками клеток ES" можно определить клеточными биологическими характеристиками, специфичными для клеток ES (такими как наличие поверхностного (антигенного) маркера, специфичного к клеткам ES, специфичная для клеток ES экспрессия генов, или способность образовывать тератому или химерную мышь). Конкретные примеры стволовых клеток, имеющих характеристики, сходные с характеристиками клеток ES, включают клетки EG, образующиеся из первичных зародышевых клеток, клетки GS, образующиеся из тестикулярных зародышевых клеток, и индуцированные плюрипотентные стволовые клетки (клетки iPS), образующиеся из соматических клеток, таких как фибробласт, с использованием специального способа генетической инженерии. Считают, что в этом способе эмбриоидные тельца через 3-6 суток после начала индукции дифференцировки, проводимой культивированием стволовых клеток с помощью суспензионной культуры в отсутствие LIF, включают недифференцированные мезобластные клетки и запрограммированные кардиомиоциты, которые в будущем дифференцируются в кардиомиоциты. В данной области известно, что в случае индукции эмбриональных стволовых клеток кардиомиоцит появляется через 7 суток после начала индукции дифференцировки (в случае эмбриональных стволовых клеток человека через 10 суток после начала индукции дифференцировки). Однако полученные таким способом эмбриоидные тельца с использованием эмбриональных стволовых клеток включают не только кардиомиоциты, описанные выше, а также клетки, которые не обладают способностью дифференцироваться в кардиомиоциты (такие как недифференцированные клетки, эндотелий-эпителийподобные клетки и нейрональные клетки). В настоящем изобретении любые клетки, отличные от кардиомиоцитов, или клетки, которые в будущем дифференцируются в кардиомиоциты (такие как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты), обозначают как "некардиомиоциты".
Авторы настоящего изобретения исследовали эффекты условий культивирования, таких как условия низкой подпитки сывороткой, условия низкой подпитки глюкозой, условия низкого содержания питательных веществ, условия низкого содержания кальция и условия среднекислого значения pH, на селекцию кардиомиоцитов, в целях специфичного отделения кардиомиоцитов или клеток, которые в будущем дифференцируются в кардиомиоциты, от некардиомиоцитов, находящихся в полученных таким образом эмбриоидных тельцах.
В результате авторы настоящего изобретения выявили, что когда клеточную смесь, содержащую недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты, культивируют в одном или нескольких условиях, выбранных из группы, состоящей из условий низкой подпитки сывороткой, условий низкой подпитки глюкозой, условий низкого содержания питательных веществ, условий низкого содержания кальция, условий среднекислого значения pH, отдельно или в любом сочетании, кардиомиоциты или клетки, которые в будущем дифференцируются в кардиомиоциты, являются менее чувствительными в таких условиях к цитотоксическому эффекту по сравнению с некардиомиоцитами.
Исходя из этого открытия в настоящем изобретении клетки, которые являются жизнеспособными даже в указанных выше условиях, были способны проходить селекцию в качестве запрограммированных кардиомиоцитов и кардиомиоцитов из клеточной смеси, содержащей недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты, посредством культивирования клеточной смеси в условиях низкой подпитки глюкозой в сочетании с любым одним или любыми сочетаниями из условий низкой подпитки сывороткой, условий низкого содержания питательных веществ, условий низкого содержания кальция и условий среднекислого значения pH.
Описанный выше способ селекции представляет собой селекцию представляющих интерес клеток культивированием клеточной смеси в условиях, к которым кардиомиоциты являются физиологически устойчивыми, и, таким образом, его называют "способом основанной на физиологической устойчивости селекции". Способ основанной на физиологической устойчивости селекции по настоящему изобретению характеризуется культивированием клеточной смеси, содержащей кардиомиоциты, в культуральной среде в условиях, выбранных из условий низкой подпитки глюкозой, условий низкой подпитки сывороткой, условий низкого содержания питательных веществ, условий низкого содержания кальция или условий среднекислого значения pH.
В настоящем изобретении термин "условия низкой подпитки глюкозой" определяют как условия, при которых клеточную смесь культивируют в культуральной среде со сниженным уровнем сахаров (то есть группы веществ, включающей полисахариды и моносахариды (такие как глюкоза, галактоза, фруктоза, манноза), которые являются биохимически растворимыми и превращаются in vivo или внутриклеточно для конечного катаболизма гликолитической системой). В предпочтительном варианте осуществления термин "условия низкой подпитки глюкозой" означает, что клеточную смесь культивируют в культуральной среде в отсутствие указанных выше сахаров или в культуральной среде, в которой уровень сахаров ограничен до менее 1% по сравнению с уровнем сахаров в культуральной среде, используемой для индукции дифференцировки. В настоящем изобретении является желательным устранение из культуральной среды глюкозы, среди прочих, насколько это возможно. Например, коммерчески доступные культуральные среды, которые, как правило, используют в данной области (такие как α-MEM, MEM [BSS Хэнка], DMEM), содержат 1 г/л D-глюкозы (5,56 мМ), RPMI 1640 содержит 2,0 г/л D-глюкозы (11,12 мМ), и F-12 Хэма содержит 1,82 г/л D-глюкозы (10,12 мМ) соответственно. Таким образом, культуральная среда с уровнем сахаров, сниженным до 1%, означает культуральную среду, содержащую 55,60-111,20 мкМ сахаров.
Авторы настоящего изобретения обнаружили, что когда клеточную смесь культивируют в культуральной среде с ограниченным уровнем сахаров до менее 1% по сравнению с уровнем сахаров, обычно используемым в данной области, некардиомиоциты подвергаются клеточной гибели, в то время как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты могут выживать в культуральной среде в таких условиях. В настоящем изобретении условия низкой подпитки глюкозой могут быть достигнуты с использованием, например, культуральной среды RPMI (без сахаров) и культуральной среды DMEM (без сахаров) (обе от GIBCO).
Как используют в настоящем документе, термин "компонент сыворотки" включает саму сыворотку, компоненты биологически активных веществ, содержащиеся в сыворотке животных или человека, и рекомбинантно или искусственно полученные компоненты биологически активного вещества. В настоящем описании термин "условия низкой подпитки сывороткой" относится к условиям, где уровень сыворотки или компонента сыворотки, или рекомбинантно или искусственно продуцированных компонентов биологически активного вещества ограничен до 0-10% по сравнению с уровнем сыворотки, которой дополняют культуральную среду, используемую для получения недифференцированных мезобластных клеток, который рассматривают как 100%, и включают, например, "бессывороточные условия". Таким образом, примером "условий низкой подпитки сывороткой" является случай, когда для получения недифференцированных мезобластных клеток культуральную среду дополняют 10% сывороткой, и тогда концентрация сыворотки в культуральной среде для селекции запрограммированных кардиомиоцитов или кардиомиоцитов ограничена до менее 1%. Авторы настоящего изобретения открыли, что, когда уровни компонентов сыворотки, содержащихся в культуральной среде, ограничены до менее 10% по сравнению с уровнями компонентов сыворотки в культуральной среде, обычно используемой в данной области, некардиомиоциты подвергаются клеточной гибели, в то время как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты могут выживать в культуральной среде.
В настоящем изобретении термин "условия низкого содержания питательных веществ" относится к условиям, где уровни всех питательных компонентов, находящихся в культуральных средах, которые обычно используют в данной области (такие как культуральная среда RPMI, культуральная среда DMEM, культуральная среда MEM, культуральная среда F12 и культуральная среда α-MEM) ограничены до уровня менее 10% по сравнению с уровнями питательных компонентов в культуральной среде, обычно используемой в данной области. В настоящем изобретении является желательным ограничение уровней питательных компонентов до 10%. Авторы настоящего изобретения открыли, что, когда уровни питательных компонентов в культуральной среде ограничены до 10% по сравнению с уровнями питательных компонентов в культуральной среде, обычно используемыми в данной области, некардиомиоциты подвергаются клеточной гибели, в то время как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты могут выживать в культуральной среде. Такие "условия низкого содержания питательных веществ" в культуральной среде могут быть достигнуты разбавлением 1 объема культуральной среды, обычно используемой в данной области (культуральной среды RPMI, культуральной среды DMEM, культуральной среды MEM, культуральной среды F12 и культуральной среды α-MEM), с использованием 9 объемов физиологического раствора (такого как BSS Хэнка (без сахаров) или PBS).
В настоящем изобретении термин "условия низкого содержания кальция" относится к условиям, где концентрация кальция, находящегося в культуральной среде, варьирует между 0,3-1,3 мМ. Культуральные среды, обычно используемые для дифференцировки в кардиомиоциты (такие как культуральная среда DMEM, культуральная среда MEM и культуральная среда α-MEM), содержат 1,8 мМ концентрацию кальция в культуральной среде. В данной области известно, что для дифференцировки в кардиомиоциты на протяжении периода культивирования концентрацию кальция поддерживают на уровне приблизительно 1,8 мМ. Авторы настоящего изобретения открыли, что когда концентрация кальция в культуральной среде ограничена до концентрации кальция 0,3-1,3 мМ до величин, значительно меньших, чем концентрация кальция в культуральной среде, обычно используемой в данной области, некардиомиоциты подвергаются клеточной гибели, в то время как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты могут выживать в культуральной среде. Культуральную среду RPMI и культуральную среду F12 (обе от GIBCO) можно использовать в качестве примеров культуральных сред с "условиями низкого содержания кальция" по настоящему изобретению.
В настоящем изобретении термин "условия среднекислого значения pH" относится к условиям, где значение pH культуральной среды варьирует между pH 6-7. В данной области известно, что условия pH культуральной среды, обычно используемой для индукции дифференцировки кардиомиоцитов (такой как культуральная среда RPMI, культуральная среда DMEM, культуральная среда MEM, культуральная среда F12 и культуральная среда α-MEM), обычно необходимо поддерживать на уровне приблизительно pH 7,5, который является таким же, как и физиологические условия. Значение pH основной BSS доводят приблизительно до pH 6,5 в инкубаторе с 5% CO2. Авторы настоящего изобретения открыли, что когда значение pH культуральной среды снижают до значения pH 6,5, которое является более кислым, чем значение pH культуральной среды, обычно используемой в данной области, некардиомиоциты подвергаются клеточной гибели, в то время как недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты могут выживать в культуральной среде. Культуральную среду с "условиями среднекислого значения pH" по настоящему изобретению можно получать коррекцией pH культуральной среды с использованием сбалансированного солевого раствора Хэнка (BSS Хэнка).
В настоящем изобретении кардиомиоциты можно очищать более эффективно, воздействуя на упомянутую выше клеточную смесь любым сочетанием двух или более пригодных условий культуральной среды (то есть способом основанной на физиологической устойчивости селекции).
Авторы настоящего изобретения открыли, что, когда культуральную среду лишают сахаров, некардиомиоциты подвергаются клеточной гибли в эмбриоидных тельцах, образованных из эмбриональных стволовых клеток. Авторы настоящего изобретения далее исследовали альтернативный субстрат, который может предпочтительно обеспечивать кардиомиоциты энергией, отличный от сахаров, в целях дальнейшего улучшения селективности недифференцированных мезобластных клеток, запрограммированных кардиомиоцитов и кардиомиоцитов, находящихся в эмбриоидных тельцах.
В результате авторы настоящего изобретения обнаружили, что является эффективным дополнение культуральной среды молочной кислотой (лактат, 0,1-5 мМ), сочетанием аспарагиновой кислоты (20-100 мг/л) и глутаминовой кислоты (20-100 мг/л), или пировиноградной кислотой (0,5-5 мМ), или любым их сочетанием вместо сахаров. Исходя из этих открытий, полагают, что такие заместители сахаров могут специфично обеспечить кардиомиоциты необходимыми питательными веществами.
Описанный выше способ селекции обозначают в настоящем описании как "способ, основанный на метаболизме селекции", поскольку в способе селекции кардиомиоцитов используется метаболическая способность кардиомиоцитов. Способ, основанный на метаболизме селекции, по настоящему изобретению характеризуется культивированием клеточной смеси, содержащей кардиомиоциты, в условиях подпитки молочной кислотой, условиях подпитки аспарагиновой кислотой/глутаминовой кислотой или в условиях подпитки пировиноградной кислотой.
В настоящем изобретении можно использовать два типа способов селекции кардиомиоцитов (то есть способ основанной на физиологической устойчивости селекции и способ основанной на метаболизме селекции) в сочетании для очистки кардиомиоцитов с высокой степенью чистоты. Также указанные выше способы проводят неоднократно для достижения последующей высокой степени очистки.
Клеточную смесь, содержащую недифференцированные мезобластные клетки, запрограммированные кардиомиоциты и кардиомиоциты, которые используют в настоящем изобретении в качестве источника кардиомиоцитов, также можно получать из стволовых клеток или эмбрионов. В этом контексте термин "стволовые клетки" включает, но не ограничивается ими, тотипотентные клетки, которые могут дифференцироваться в любые типы клеток (такие как эмбриональные стволовые клетки) и плюрипотентные клетки, которые могут дифференцироваться во множество конкретных типов клеток (такие как взрослые стволовые клетки, образованные в костном мозге).
Полагают, что в ходе получения кардиомиоцитов из эмбриональных стволовых клеток, по мере прохождения дифференцировки, эмбриональные стволовые клетки дифференцируются в недифференцированные мезобласты и затем последовательно переходят в запрограммированные кардиомиоциты и в конце образуют кардиомиоциты. В настоящем документе "недифференцированные мезобластные клетки" относятся к клеткам, которые экспрессируют белок Brachyury (специфичный маркер недифференцированных мезобластных клеток). При этом "запрограммированные кардиомиоциты" относятся к клеткам, которые экспрессируют специфичные для недифференцированных мезобластных клеток бел