Способ направленного транспорта биологически активных веществ и применение стволовых клеток для их направленного транспорта
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для направленного транспорта биологически активных веществ (БАВ). Проводят добавление БАВ к эмульсии перфторуглеродов (ПФУ), включающей по крайней мере: перфтордекалин и/или перфторметилциклогексилпиперидин, и/или перфтортрибутиламин, и/или перфтороктилбромид, стабилизированных раствором проксанола и/или фосфолипидами. Добавляют эмульсию ПФУ с БАВ к стволовым клеткам (СК) и проводят их совместное культивирование. После культивирования СК вводят субъекту, нуждающемуся во введении БАВ. Изобретение позволяет осуществлять направленный транспорт БАВ в организме. 2 н. и 14 з.п. ф-лы, 7 ил., 1 табл.
Реферат
Изобретения относятся к медицине, ветеринарии, биотехнологии и предназначено для направленного транспорта биологически активных веществ (БАВ).
Направленный транспорт БАВ веществ является актуальной проблемой современной биологии и медицины. Многие лаборатории во всем мире стремятся создать транспортные системы, которые обеспечат локальное резкое увеличение концентрации активного вещества в патологической ткани, не затрагивая здоровые органы организма.
Было предложено множество идей для реализации данного подхода.
Во-первых, создание липосомальных форм, которые, взаимодействуя с мембраной клетки, доставляют внутрь последней лекарственные вещества, при этом гидрофильные лекарственные формы располагаются внутри липосомы, а липофильные формы в липидном слое (1). Такие лекарства защищены от воздействия гидролитических ферментов плазмы крови и сохраняют свою биологическую активность длительное время. Доказано, что такие липосомы высвобождают лекарства постепенно, создавая длительно высокую концентрацию в организме больного (2).
Однако одно из главных недостатков липосомальных форм сложность с проникновением в воспаленные ткани, в которых нарушена микроциркуляция.
Во-вторых, создание транспортных систем на основе экзогенных полимерных макромолекул (3). При этом антибиотики культивировались с макромолекулами (полиглюкин, реополиглюкин), которые сорбировали лекарственное вещество на своей поверхности. Однако такая форма доставки вызывает нарушение функционирования ретикуло-эндотелиальной системы и препятствие к проникновению в патологически измененные ткани (4).
Наиболее перспективным, по нашему мнению, является создание транспортных систем на использовании клеточных носителей, полученных из форменных элементов крови, не покрытых соответствующими антителами к органу мишени. Такими клетками являются аутологичные или донорские эритроциты, тромбоциты и лейкоциты.
В работе (5) считают, что их органоспецифичность будет определяться в первую очередь следующими свойствами: способностью лейкоцитов мигрировать в очаг воспаления, эритроцитов - фиксироваться эритрофагоцитирующими клетками (в основном печени и селезенки), тромбоцитов - адгезировать на поврежденных участках интимы сосуда.
Первым этапом реализации направленного транспорта лекарственных средств на аутоклетках крови было применение так называемых "теней эритроцитов", получаемых при помощи гипотонического гемолиза (6, 7). Авторы сообщают, что внутримышечное введение аминогликозидных антибиотиков (гентамицина и амикацина) оказывает иммуносупрессивное действие на организм здоровых животных, в то время как антибиотики, заключенные в тени эритроцитов, наоборот, усиливают развитие иммунного ответа (8).
Возможность транспорта различных лекарственных веществ с применением "теней эритроцитов" обсуждается в литературе в течение 10 лет. Несмотря на сложную технологию подготовки аутологичных эритроцитов при помощи гипотонического гемолиза, многие авторы отмечают высокую эффективность метода для гормонов, антигипоксантов, ингибиторов протеаз и др. в качестве объекта транспорта.
Таким образом, использование "эритроцитарных теней" с целью транспорта лекарственных средств различных классов является эффективным с точки зрения реализации клинического эффекта относительно других путей введения.
Однако широкому применению данного метода в клинике препятствует технические трудности его воспроизведения. С другой стороны существенным недостатком предложенного метода является то, что проникновение лекарственного вещества происходит после повреждения клетки, что существенно снижает ее время жизни в организме больного.
Другим направлением в развитии технологий направленного транспорта лекарств является использование аутоцитовзвеси, полученной в результате цитафереза, которую инкубируют с лекарственными веществами при различных условиях. Однако остается неясным, какие именно клетки участвуют в реализации фиксации и транспорта лекарственных средств.
В работе (9) описывают применение метода реинфузии клеточной массы крови с реланиумом при лечении эпилепсии у детей, отмечая общую позитивную модель введения препарата на клеточной массе детям с эпилептическими пароксизмами.
Еще одним этапом в изучении направленного транспорта является использование тромбоцитов в качестве контейнеров-переносчиков лекарственных средств. Данный выбор основывался на органе-мишени, к которому кровяные пластинки обладают повышенной тропностью к эндотелию, поврежденному в результате распространенного атеросклероза.
В работе (10) предлагают для терапии облитерирующих заболеваний нижних конечностей с высоким адгезивно-агрегационным состоянием тромбоцитов и лейкоцитов метод экстракорпоральной тромболейкомодификации в сочетании с плазмаферезом. Экстракорпоральная тромболейкомодификация проводилась методом цитафереза с последующей супрессией тромбоцитарно-лейкоцитарного слоя кортикостероидами, антагонистами кальция, ингибиторами тромбоксанситетазы и фосфодиэстеразы, а эксфузируемая эритроцитарная масса обрабатывалась раствором трентала. В результате применения данной методики удалось снизить активность липопероксидации, уровень ферментемии, напряжения pCO2 в ишемизированной ткани, агрегацию и адгезию тромбоцитов и лейкоцитов, повысить антиоксидантную защиту.
Однако данная методика предусматривает действие многокомпонентной системы: несколько лекарственных препаратов разнонаправленного действия, плазмаферез, отсутствие отделения тромбоцитарной массы от лейкоцитов, что определялось техническим обеспечением экстракорпоральных операций. В силу этих обстоятельств, при несомненном положительном клиническом эффекте трудно выделить конкретный механизм его достижения.
Идея транспорта антибактериальных химиопрепаратов непосредственно к очагу инфекции была высказана Лохвицким С.В. и Гуляевым А.В с соавт. (11), которые впервые использовали для этих целей лейкоциты. Авторы считают, что в качестве носителей наиболее обосновано использование клеток белой крови, учитывая их способность быстро накапливаться в области очага острого воспаления. Однако при этом возникает задача создания комплекса "препарат - носитель", обеспечивающего связывание антибиотиков клетками. В качестве варианта включения антибиотиков в лейкоциты и другие клетки крови для дальнейшей доставки их в очаг воспаления авторами предложено использование цитафереза.
Имеются данные об использовании донорских лейкоцитсодержащих сред с целью осуществления направленного транспорта антибактериальных химиопрепаратов в лечении пациентов с панкреонекрозом. Однако донорская цитовзвесь обладает всеми отрицательными свойствами аллогенного трансплантата и имеет строгие показания к применению.
Таким образом, использование аутоклеток для реализации метода направленного транспорта лекарственных веществ у пациентов обладает рядом недостатков:
1) множественная обработка клеток лекарственными препаратами снижает метаболическую активность и продолжительность жизни клеток;
2) данный вид клеток, имеет ограниченные сроки жизни в организме (средняя продолжительность жизни лимфоцитов до 120 дней);
3) данный вид клеток преимущественно мигрирует в зону воспаления, что снижает варианты использования данного подхода для лечения, например пролиферативных процессов.
На сегодняшний день большое распространение получили методы, основанные на использовании стволовых клеток.
Стволовые клетки обладают целым рядом характерных особенностей:
они способны к самовозобновлению и к мультилинейной дифференцировке. Между стволовой клеткой и ее терминальным потомством обычно имеется несколько промежуточных клеток с возрастающей способностью к дифференцировке. Стволовые клетки недифференцированы, и в большинстве тканей не способны выполнять специальные функции.
Первоначальные исследования концентрировались на гемопоэтических стволовых клетках костного мозга, и они сегодня достаточно хорошо изучены. Сейчас известно, что стволовые клетки существуют в большинстве органов. В органах они составляют незначительную популяцию, обычно 1-2% от общего числа клеток. До недавнего времени считали, что органоспецифичные стволовые клетки в дифференцировке ограничиваются своим происхождением. В последнее время доказано, что стволовые клетки могут обладать намного более широкими возможностями дифференцировки. Стволовые клетки стромы костного мозга могут дифференцироваться в мышечную, костную ткань, клетки печени, почки, кардиомиоциты и т.д. Это послужило толчком для лечения ряда заболеваний с использованием стволовых клеток, в частности клеток костного мозга (12).
Также имеет место использование и другого свойства стволовых клеток - как метчиков процессов, связанных с активной пролиферацией. К стволовой клетке «цепляется» маркер и после этого отслеживается судьба данной клетки.
Данные клетки обладают целым рядом преимуществ по сравнению с лейкоцитами, полученными из периферической крови.
1) Эти клетки активно мигрируют в зоны повышенной пролиферации (опухоли, неоангиогенез, регенерация, регенерация в зоне воспаления), т.к. эти зоны выделяют ростовые факторы, которые являются хемоатрактантами для стволовых клеток.
2) Стволовые клетки активно включаются в пролиферирующую (регенерирующую) ткань, создавая новые сосуды, формируя паренхиму внутренних органов.
3) Стволовые клетки относятся к популяции, которая длительно циркулирует в организме, являясь самоподдерживающейся.
В качестве носителя, пригодного для сорбции БАВ, может быть использованы частицы фторуглеродных эмульсий. При этом основным признаком носителя является то, что при проникновении внутрь стволовых клеток он не подвергается процессам биодеградации и плохо или совсем не метаболизируется.
Эмульсии на основе перфторуглеродов (ПФУ) традиционно рассматриваются в качестве плазмозаменителей с газотранспортной функцией (13). Кроме того, перфторуглеродные наночастицы (НЧ) могут использоваться для визуализации тканей организма (магнитно-резонансная томография, рентгеноконтрастирование) (14). В последнее время появились работы, в которых наночастицы ПФУ эмульсий используются как метчики стволовых клеток (15). Мечение стволовых клеток перфторуглеродными наночастицами, которые легко детектируются с помощью магнитно-резонансной томографии, рентгена и газохроматографически, по предположению авторов вышеуказанной статьи, позволит отслеживать судьбу трансплантированных клеток в организме, используемых для активации роста сосудов в конечностях страдающих диабетом пациентов, восстановлении сосудов, поврежденных при инфаркте или при проведении операции шунтирования, проведении мониторинга опухолей. Это позволит также наблюдать за динамикой лечения и оценивать его эффективность.
Кроме того, известно, что наночастицы ПФУ эмульсии, стабилизированные неиогенными поверхностно-активными веществами (ПАВ) (проксанолами, плюрониками и т.д.) обладают способностью сорбировать и прочно удерживать различные биологически активные вещества (16). Можно предположить, что сорбированные на частицах лекарственные вещества с частицами ПФУ эмульсий будут проникать вовнутрь стволовых клеток и транспортироваться с ними к органам и тканям.
Учитывая вышесказанное, нами было предложено при помощи наночастиц ПФУ эмульсий сорбировать БАВ на стволовых клетках, полученных из костного мозга и/или переферической крови, и/или пуповинной крови, и/или жировой ткани, и с их помощью осуществлять направленный транспорт БАВ.
Таким образом, достигается адресность воздействия и исключается наличие системных поражений. Кроме того, нами неожиданно было установлено, что клетки «нагруженные» БАВ сохраняют его в течение длительного времени.
С учетом вышеизложенного нами был предложен способ направленного транспорта БАВ, при котором осуществляют следующие этапы:
а) проводят добавление БАВ к эмульсии перфторуглеродов (ПФУ), включающей по крайней мере: перфтордекалин и/или перфторметилциклогексилпиперидина, и/или перфтортрибутиламина, и/или перфтороктилбромида, стабилизированных раствором проксанола и/или фосфолипидами;
б) добавляют эмульсию ПФУ с БАВ к стволовым клеткам (СК) и проводят их совместное культивирование;
в) осуществляют введение СК после культивирования субъекту, нуждающемуся во введении БАВ.
При этом в качестве субъекта выступает млекопитающее, в частности человек.
В качестве БАВ нами были выбраны:
пептидно-белковые препараты: инсулин, фактор некроза опухоли, ронколейкин (ИЛ2), азаказеин, ДНК: плазмида, содержащая ген зеленого белка, антибиотики: гентамицин, канамицин, противовирусные препараты: ацикловир.
Также предложено применение стволовых клеток костного мозга с сорбированными на них биологически активными веществами с помощью эмульсии перфторуглеродов (ПФУ), включающей по крайней мере: перфтордекалин и/или перфторметилциклогексилпиперидина, и/или перфтортрибутиламина, и/или перфтороктилбромида, стабилизированных раствором проксанола 268 и/или фосфолипидами для направленного транспорта внутри организма.
Ниже данный способ и применение подтверждаются следующими примерами частного выполнения.
Пример 1. Первая фаза экспериментов
Предварительно в результате проведенных нами исследований было показано, что клетки, «нагруженные» БАВ, встраиваются в тропную ткань и препарат при этом сохранят свою активность.
ПФУ эмульсия. В работе использовались частицы ПФУ эмульсии, состоящие из смеси перфторуглеродов: перфтордекалина, перфторметилциклогексилпипередина, перфтортрибутиламина и перфтороктилбромида в соотношении 9:1:0,01:0,01 об.%, стабилизированных 4% раствором проксанола 268.
Сорбция БАВ на частицах ПФУ эмульсии. БАВ добавляли к эмульсии ПФУ, встряхивали в течение 5 мин. Затем частицы эмульсии осаждали центрифугированием в течение 30 мин при 4000 об/мин, надосадочную жидкость отбирали для анализа, осадок ресуспендировали в растворе Хенкса. Процедуру осаждения и отмывки частиц раствором Хенкса повторяли трижды.
Получение стволовых клеток. В качестве доноров стволовых клеток были использованы, в частности мыши линии C57black10. Клетки костного мозга выделяли из бедренной кости и культивировали в среде DMEM, содержащей 10% эмбриональной телячьей сыворотки и дексаметазон в течение 5-20 дней при 37°С.
Введение частиц с БАВ в стволовые клетки. После 5 дней культивирования к клеткам костного мозга добавляли частицы эмульсии, содержащие БАВ, и инкубировали в течение 30 минут при 37°С. После 5-кратной отмывки раствором Хенкса, клетки снимали трипсином и трансплантировали реципиенту в/в и в/брюшинно в дозе от 2×104 до 2×107 клеток. Реципиентами являлись однородные по группе мыши линии C57black10, содержащиеся в условиях вивария.
Через 3-7 дней после трансплантации животных забивали, извлекали костный мозг и готовили клеточную суспензию.
Детектирование БАВ.
Для определения лекарственного вещества использовали:
A) Радио-иммунный метод для инсулина (17); иммуноферментные (ИФА) тест системы фирмы (Biosourse (Бельгия)) для определения пептид-белковых препаратов (интерлейкина 2, фактор некроза опухоли), спектрофотометрически (азаказеин).
Б) Световая и ультрафиолетовая микроскопия для определения продукции зеленого белка, информация о котором кодируется в ДНК-плазмиде.
B) Хроматографически для гентамицина - канамицина (18) и ацикловира (19); циклоспорин - тест наборы для ИФА. Количество БАВ определяли:
а) В исходном растворе;
б) В надосадочной жидкости после центрифугирования частиц фторуглерода;
в) После 5 кратной промывки осадка (после центрифугирования) и выпаривания фторуглерода (лиофильная сушка);
г) В культуре клеток на 20 сутки после введения в клетки частицы, содержащие ЛВ (Культуру клеток 5-кратно отмывали раствором Хенкса; фторуглероды выпаривали на лиофильной сушке).
РЕЗУЛЬТАТЫ
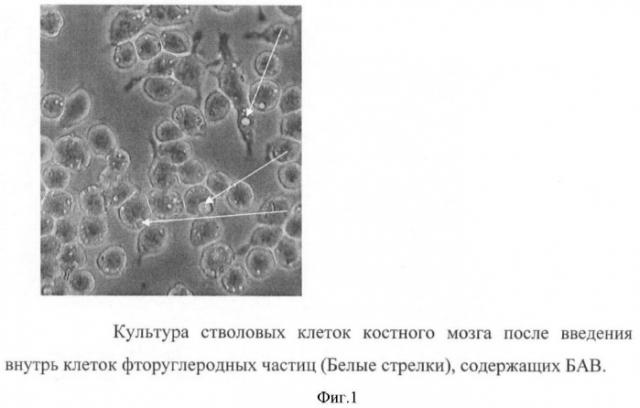
В ходе работы было показано, что частицы фторуглеродной эмульсии, содержащей БАВ, проникают внутрь стволовых клеток костного мозга. На фиг.1 стрелками указана локализация частиц эмульсии в клетках.
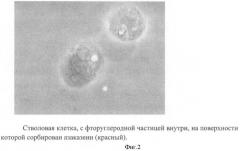
При этом проведенные исследования показали, что фторуглеродные частицы прочно сорбируют на своей поверхности БАВ (фиг.2) и удерживают их внутри стволовых клеток в неизмененном виде, по крайней мере, в течение 20 дней (Таблица). В контрольной культуре клеток, в которую не вводили частицы, содержащие БАВ, были отмечены следовые количества инсулина, ИЛ2 и ФНО, что, по-видимому, объясняется присутствием эмбриональной сыворотки.
Как видно, из представленной таблицы частицы эмульсии сорбируют на своей поверхности БАВ, проникают внутрь стволовой клетки и удерживают БАВ в неизмененном виде, по крайней мере, в течение 20 дней.
Введение плазмиды, содержащей ген зеленого белка
Добавление плазмиды к стволовым клеткам без предварительной сорбции на поверхности фторуглеродных частиц не приводит к проникновению плазмиды внутрь клетки и последующей активации гена зеленого белка (фиг.3). Этот результат можно объяснить тем, что для проникновения ДНК конструкций внутрь клетки необходимо плазмиду «упаковать» внутрь вирусной капсиды или провести процедуру электропорации. По-видимому, в свободном виде плазмида просто разрушается под действие нуклеаз.
После сорбции плазмиды на поверхности фторуглеродных частиц и проникновения их внутрь стволовых клеток, плазмида сохраняется, активируется и клетка начинает секретировать ген зеленого белка, что проявляется специфическим свечением под действие ультрафиолета (фиг.4).
Пример 2. Вторая фаза экспериментов.
Цель данной фазы заключалась в выяснении вопроса о том, имеет ли место накопление стволовых клеток с БАВ, в частности в опухолевой ткани, т.е. выяснялся вопрос адресной доставки.
Приготовление ПФУ эмульсии, сорбцию БАВ на частицах ПФУ эмульсии и получение стволовых клеток осуществляли способом, описанным в примере 1.
Введение частиц с БАВ в стволовые клетки. После 5 дней культивирования к клеткам костного мозга добавляли частицы эмульсии, содержащие БАВ, и инкубировали в течение 30 минут при 37°С. После 5-кратной отмывки раствором Хенкса, клетки снимали трипсином и трансплантировали реципиенту в/в и в/брюшинно в дозе от 2×104 до 2×107 клеток. Реципиентами являлись мыши линии С 57 black и содержащиеся в условиях вивария. У данных животных развивался спонтанный рак молочной железы.
Через 5 дней после трансплантации стволовых клеток, содержащих частицы с сорбированными на них БАВ, животных с опухолью забивали, извлекали ткань опухоли, печень, селезенку. Проводили газовую хроматографию в сочетании с масс-спектрометрией для определения абсолютного содержания фторуглерода в тканях (фиг.5). А также определяли хроматографически содержание гентамицина, канамицина, ацикловира, ИФА-циклоспорина в тканях реципиента. Т.к. на ИФА наборе нельзя было определить уровень экзогенного инсулина, ИЛ2 и ФНО на фоне эндогенных цитокинов, то определяли окрашенный белок азаказеин. Также у животных, которым вводили стволовые клетки, содержащие частицы с плазмидой (ген зеленого белка), из тканей опухоли, печени и селезенки готовили криосрезы и проводили УФ-микроскопию с поиском специфического свечения (фиг.6 и 7).
Как было показано, по данным газовой хроматографии в сочетании с масс-спектрометрией опухолевая ткань (100±13 мг) накапливает более 30% введенных клеток (32,5±1,3%) (фиг.5). При этом ткань печени (4,5±1,5 г) и селезенки (2,1±0,5 г) 7,2±1,2% и 3,3±1,2% соответственно.
При этом соотношение (содержание лекарственного вещества/содержание фторуглерода) в вводимых клетках и ткани опухоли через 5 дней после трансплантации остается практически неизменным и колеблется в пределах 10-15% в зависимости от ЛВ.
При проведении УФ-микроскопии было показано, что по сравнению с контролем (трансплантация стволовых клеток, обработанных за 20 дней до трансплантации плазмидой - фиг.6) в ткани опухоли у опытной группы (трансплантация стволовых клеток, обработанных за 20 дней до трансплантации фторуглеродными частицами, содержащими плазмиду - фиг.7) наблюдается специфическое зеленое свечение.
Таким образом, стволовые клетки захватывают частицы фторуглеродной эмульсии, на поверхности которых сорбированы лекарственные вещества, относящиеся к разным класса химических веществ (пептиды, белки, сложные органические молекулы, ДНК и т.д.). Для всех этих веществ показано, что они прочно удерживаются внутри стволовых клеток в течение длительного времени (до 20 дней после введения) не вызывая гибель клеток. При этом было показано, что меченные частицами клетки при введении в организм мигрируют в быстропролиферирующую ткань и там накапливаются, т.е. осуществляется направленный транспорт БАВ.
Пример 3. Третья фаза экспериментов.
Для доказательства возможности применения данного метода для лечения патологических состояний в качестве БАВ использовали моноклональные антитела (Бевацизумаб) - АВАСТИН - антиангиогенный фактор, применяемый для лечения опухолей. Данное вещество - рекомбинантное гиперхимерное моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов и нейтрализует его. Авастин ингибирует связывание фактора роста эндотелия сосудов с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению васкуляризации и угнетению роста опухоли. Данное вещество вводится системно и вызывает большое количество осложнений, в частности развитие инсультов, перфорации и кровотечение.
В работе обработали эмульсию ПФУ антоангиогенным фактором и ввели полученные частицы внутрь стволовых клеток (методика описана выше). Затем полученные клетки вводили животным с опухолью молочной железы. Контролем служили животные, которым вводили стволовые клетки, содержащие частицы ПФУ без антиангеогенного фактора.
Через 14 дней животных забивали, извлекали опухолевую ткань и определяли массу опухоли, а также готовили криосрезы, на которых опеределяли плотность сосудистого русла с использованием метода морфометрии.
Были получены данные, что через 14 дней после трансплантации стволовых клеток в опытной группе (102,2±3,2) наблюдается снижение массы опухоли по сравнению с контролем (122,4±8,2 мг), а также снижение плотности сосудистого русла в опытной группе по сравнению с контролем на 22,7±1,2%.
Проведенные эксперименты доказывают, что БАВ, содержащиеся в частице эмульсии ПФУ и введенные внутрь стволовых клеток, достигают зоны патологического процесса, высвобождаются в нем, оказывая свое терапевтическое воздействие.
Таким образом, заявляемые изобретения могут быть широко применены в медицине как методы, направленные для доставки разного рода веществ, как для лечения различного рода опухолей, так и других видов терапии.
| Таблица | |||
| Содержание ЛВ, сорбированных на фторуглеродных частицах. | |||
| БАВ | Относительное содержание БАВ в растворе после добавления частиц фторуглеродной эмульсии (% от исходного раствора) | Относительное содержание БАВ на поверхности частицы фторуглеродной эмульсии после 5-кратной отмывки (% от исходного раствора) | Относительное содержание БАВ в культуре клеток через 20 дней после введения в стволовые клетки частиц фторуглеродной эмульсии, содержащейБАВ (% от исходного раствора) |
| Инсулин | 70±4,5 | 24±6 | 19±5 |
| Интерлейкин 2 | 68±5 | 24±4 | 18±6 |
| Фактор | 65±4 | 25±5 | 22±8 |
| некроза | |||
| опухоли | |||
| азаказеин | 80±8 | 18±4 | 15±3 |
| Гентамицин | 73±4 | 23±8 | 20±2 |
| Канамецин | 76±7 | 22±5 | 19±7 |
| Ацикловир | 60±8 | 22±5 | 19±6 |
| Циклоспорин | 67±8 | 23±5 | 20±5 |
ЛИТЕРАТУРА
1) Чазов Е.И., Смирнов В.Н., Торчилин В.П. Направленный транспорт лекарств: проблемы и перспективы // Журн. Всесоюз. хим. общества им. Д.И.Менделеева. - 1987.- №5. - С.485-487.
2) Торчилин В.П., Клибанов А.Л. "Липосомы как средства направленного транспорта лекарств", Журнал Всесоюзного химического общества им. Д.И.Менделеева, 1987, Т.32, №5, с.502-513.
3) Рингсдорф Г., Шмидт Б. "Системы полимерных носителей лекарств", Журнал Всесоюзного химического общества им. Д.И.Менделеева, 1987, Т.32, №5, с.487-501.
4) Костюченко А.Л., Гуревич К.Я., Лыткин М.И. Инстенсивная терапия послеоперационных осложнений (руководство). - СПб.: Спец Лит., 2000. - 575 с.
5) Генинг Т.П., Колкер И.И., Жумадилов Ж.Ш. Использование форменных элементов крови для направленной доставки химиотерапевтических и диагностических препаратов в очаг поражения // Антибиотики и химиотерапия. - 1988.- №11. - С.867-871.
6) Самохин Г.П., Долисадский С.П. "Направленный транспорт лекарств с помощью эритроцитов", Журнал Всесоюзного химического общества им. Д.И.Менделеева, 1987, Т.32, №5, с.527-533.
7) Сипливая Л.Е., Ласкова И.Л., Шевцова Е.М., Костебелов Н.В., Шульга Т.А., Рудская В.И. Иммуномодулирующая активность некоторых аминогликозидов, введенных в эритроцитарных носителях // Тр. 4-го Рос. нац. конгресса "Человек и лекарство" - 2000 г.
8) Конопля А.И., Хмелевской В.И., Хмелевская И.Г. Иммунотропное действие фторхинолонов, адсорбированных на мембранах эритроцитов и включенных в эритроцитарную строму // Морфогенез и регенерация. Сб. научных трудов, посвященный 80-летию со дня рождения проф. Давида Ароновича Сигалевича. - Курск, КГМУ - 1999.
9) Смирнова Л.В., Шмидт И.Р., Власов С.В. Применение метода реинфузии клеточной массы крови с реланиумом при лечении эпилепсии у детей // Эфферентная терапия. - 2000, - Т.6, №4. - С.27-30.
10) Шабалин В.А., Капралов И.А., Абляев Э.В. Экстракорпоральная тромболейкомодификация в комплексной терапии облитерирующих заболеваний сосудов нижних конечностей // Тезисы докладов 6-го Всероссийского съезда анестезиологов и реаниматологов. - М. - 7-10 октября 1998.
11) Лохвицкий С.В., Кивман Г.Я., Гуляев А.Е., Пьянов С.Г., Губенко Л.В., Зубцов В.Н. Способ лечения хирургической инфекции. A.C. SU 1805390 А1.
12) Смолянинов А.Б. и др. Клеточные технологии при ишемической болезни сердца, АГ-инфо, 2006, №2, с.6-15.
13) Geyer R.P, Perfluorochemicals as oxygen transport vehicles // Biomater. Artif. Cells Artif. Organs., 1988, Vol.16, N1-3. P.455-457.
14) Winter PM, Cat K, Caruthers SD, Wickline SA, Lanza GM. // Expert Rev Med Devices. 2007 Mar; (2):137-145.
15) Kathryn С.и др. 19F magnetic resonance imaging for stem/progenitor cell tracking with multiple unique perfluorocarbon nanobeacons, The FASEB Journal, 2007, June, Vol.21, p.1647-1654.
16) Norman M.E., Williams P., Ilium L. // J. of Biomedical Materials Research, 1993, vol.27, P.861-866.
17) Bell J.L.: Methods for monitoring neuroleptic drugs. AACC TDM, T.6, 1-6,1985.
18) Perhere J.C. and Dugal R.: Clinical pharmacokinetics of aminoglycoside antibiotics. Clin, Pharmacokinet., 4:170-199, 1977.
19) Land G., Bye A.: Simple high-performance liquid chromatographic method for the analysis of 9-(2-hydroxyethoxymetyl) guanine (acyclovir) in human plasma and urine. J. Chromatogr., 224, 51-58, 1981.
1. Способ направленного транспорта биологических активных веществ (БАВ) у субъекта, нуждающегося во введении БАВ, включающий следующие этапы:а) проводят добавление БАВ к эмульсии перфторуглеродов (ПФУ), включающей по крайней мере перфтордекалин, и/или перфторметилциклогексилпиперидин, и/или перфтортрибутиламин, и/или перфтороктилбромид, стабилизированных раствором проксанола и/или фосфолипидами;б) добавляют эмульсию ПФУ с БАВ к стволовым клеткам (СК) и проводят их совместное культивирование;в) осуществляют введение СК после культивирования субъекту, нуждающемуся во введении БАВ.
2. Способ по п.1, отличающийся тем, что в качестве субъекта выступает млекопитающее.
3. Способ по п.2, отличающийся тем, что в качестве млекопитающего выступает человек.
4. Способ по п.1, отличающийся тем, что ПФУ эмульсия состоит из смеси перфторуглеродов - перфтордекалина, перфторметилциклогексилпиперидина, перфтортрибутиламина и перфтороктилбромида в соотношении 9:1:0,01:0,01 об.%, стабилизированных 4%-ным раствором проксанола 268.
5. Способ по п.1, отличающийся тем, что ПФУ эмульсия состоит из смеси перфторуглеродов перфтордекалина и перфторметилциклогексилпиперидина, в соотношении 9:1 об.%, стабилизированных 4%-ным раствором проксанола 268.
6. Способ по п.1, отличающийся тем, что в качестве БАВ выступает по меньшей мере один из пептидно-белковых препаратов: инсулин, фактор некроза опухоли, ронколейкин, азаказеин; ДНК: плазмида, содержащая ген зеленого флуоресцентного белка; антибиотики: гентамицин, канамицин; противовирусные препараты: ацикловир.
7. Способ по п.1, отличающийся тем, что в качестве СК используют аутологичные СК.
8. Способ по п.7, отличающийся тем, что в качестве СК используют СК костного мозга (СККМ).
9. Способ по п.8, отличающийся тем, что в качестве СККМ используют аутологичные СККМ.
10. Применение стволовых клеток костного мозга с сорбированными на них биологически активными веществами (БАВ) с помощью эмульсии перфторуглеродов (ПФУ), включающей по крайней мере перфтордекалин, и/или перфторметилциклогексилпиперидин, и/или перфтортрибутиламин, и/или перфтороктилбромид, стабилизированных раствором проксанола и/или фосфолипидами, для направленного транспорта внутри организма.
11. Применение по п.10, отличающееся тем, что ПФУ эмульсия состоит из смеси перфторуглеродов - перфтордекалина, перфторметилциклогексилпипередина, перфтортрибутиламина и перфтороктилбромида в соотношении 9:1:0,01:0,01 об.%, стабилизированных 4%-ным раствором проксанола 268.
12. Применение по п.10, отличающееся тем, что ПФУ эмульсия состоит из смеси перфторуглеродов перфтордекалина и перфторметилциклогексилпиперидина, в соотношении 9:1 об.% стабилизированных 4%-ным раствором проксанола 268.
13. Применение по п.10, отличающееся тем, что в качестве БАВ выступает по меньшей мере один из пептидно-белковых препаратов: инсулин, фактор некроза опухоли, ронколейкин, азаказеин; ДНК: плазмида, содержащая ген зеленого флуоресцентного белка; антибиотики: гентамицин, канамицин; противовирусные препараты: ацикловир.
14. Применение по п.10, отличающееся тем, что в качестве СК используют аутологичные СК.
15. Применение по п.14, отличающееся тем, что в качестве СК используют СК костного мозга (СККМ).
16. Применение по п.15, отличающееся тем, что в качестве СККМ используют аутологичные СККМ.