Рекомбинантная плазмидная днк pet32m/mtrx-rhil-11, кодирующая интерлейкин -11 человека, способ ее получения и штамм escherichia coli bl21(de3)/pet32m/mtrx-rhil-11 - продуцент рекомбинантного интерлейкина-11
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для получения рекомбинантного интерлейкина-11 (рИЛ-11) человека. Рекомбинантную плазмидную ДНК pET32M/mTrx-rhIL-11 получают способом, который включает синтез четырех фрагментов гена рекомбинантного интерлейкина-11 человека из олигонуклеотидных праймеров, клонирование каждого фрагмента в рестрицированный эндонуклеазой EcoRV плазмидный вектор pGEM5z, трансформацию каждой из 4-х плазмид клеток E.coli штамма DH5a, отбор кодирующих соответствующие фрагменты гена интерлейкина-11 человека клонов, отбор плазмид с фрагментами гена интерлейкина-11 человека без мутаций, объединение всех фрагментов гена рекомбинантного интерлейкина-11 человека в плазмидном векторе pUC19, конструирование вектора рЕТ32М на основе плазмиды pET32b, переклонирование гена рекомбинантного интерлейкина-11 человека в экспрессионный вектор рЕТ32М, кодирующий тиоредоксин 1 E.coli с заменой Asn84/Gln. Полученной ДНК трансформируют клетки штамма E.coli BL21(DE3) с получением штамма E.coli BL21(DE3)/pET32M/mTrx-rhIL-11 - продуцента рекомбинантного интерлейкина-11 человека в составе растворимого слитного белка mTrx-rhIL-11. Изобретение обеспечивает эффективную продукцию рИЛ-11 в клетках E.coli. 3 н.п. ф-лы, 5 ил., 1 табл.
Реферат
Изобретение относится к биотехнологии, а именно к технологии получения рекомбинантного интерлейкина-11 человека, и может быть использовано в медицине в терапии тромбоцитопений, анемий, при пересадках костного мозга, для борьбы с цитопениями как следствия химиотерапии опухолевых заболеваний.
Интерлейкин-11 - многофункциональный цитокин, вырабатывается преимущественно клетками стромы (фибробластами) костного мозга и лимфоидных органов, стимулирует пролиферацию ранних стволовых клеток и дифференцированных клеток-предшественниц из разных источников, включая кровь и костный мозг. ИЛ-11 вызывает выраженную стимуляцию тромбоцитопоэза путем индукции пролиферации, дифференцировки и созревания мегакариоцитов. Действуя на клетки костного мозга и клетки печени эмбрионов, ИЛ-11 совместно с другими цитокинами может стимулировать различные стадии эритропоэза.
Известны способы получения рекомбинантной плазмидной ДНК, содержащей ИЛ-11 человека в клетках E.coli или дрожжей Pichia pastoris, которые основаны на изолировании мРНК ИЛ-11 из клеток тканей человека, получении кДНК методом обратно-транскриптазной ПЦР с последующим клонированием в экспрессирующий вектор [Paul S.R. et al. Molecular cloning of a cDNA encoding interleukin 11, a stromal cell-derived lymphopoietic and hematopoietic cytokine. Proc. Natl. Acad. Sci. USA, 1990. 87 (19): p.7512-7563; Morris J.C. et al. Molecular cloning and characterization of murine interleukin-11. Exp. Hematol, 1996. 24 (12): p.1369-1376; Wang T.Y. et al. Expression of the Recombinant Human Interleukin-11 in Pichia pastoris. Sheng Wu Hua Xue Yu, Sheng Wu Wu Li Xue Bao (Shanghai), 2001. 33 (6): p.659-664]. Недостатком известных методов является невозможность получения целевого белка, в полной мере сохраняющего биологическую активность.
Известен способ получения синтетического гена ИЛ-11 для последующей экспрессии в клетках E.coli с использованием для экспрессии отдельных фрагментов полноразмерного гена (патент США №5215895, опубл. 1993). Однако полного сохранения биологической активности у рекомбинантного продукта не достигается.
Известен способ получения белка слияния тиоредоксин/целевой белок с помощью трансформированных штаммов E.coli с последующим расщеплением белка слияния и выходом целевого белка с сохраненной биологической активностью цитокинов (пат. США 6143524, опубл. 2000).
В качестве экспрессирующего вектора плазмидной рекомбинантной ДНК в указанном патенте используют вектор pALtrxA-781, определяющий устойчивость к ампициллину и содержащий сайт для распознавания энтерокиназы, а в качестве исходного штамма E.coli для трансформации указанной плазмидной ДНК используют триптофан-зависимый штамм GI724. Данный способ позволяет получать белок слияния в расворимой форме, а не в составе телец включения, что способствует сохранению биологической активности целевого белка. Однако выход целевого белка (ИЛ-11) при таком способе получения снижен из-за его деградации протеазами E.coli.
Известен наиболее близкий к заявленному способ получения рекомбинантной плазмидной ДНК, содержащей ген агониста ИЛ-11, с помощью штамма E.coli DH5.alpha и плазмидного вектора рЕТ-22b(+), а также штамм-продуцент агониста ИЛ-11 на основе штамма E.coli BL21 (DE3) (заявка США №20070190024, опубл. 2007). Однако целевой белок содержит не собственно ИЛ-11 человека, а его агонист, который отличается по аминокислотному составу от ИЛ-11. Кроме того, при получении целевого продукта, соответствующего по структуре ИЛ-11 человека, плазмидный вектор рЕТ-22b(+) требует модификации для выделения слитного белка и очистки ИЛ-11 с применением метода металлохелатной хроматографии.
Задачей изобретения является расширение ассортимента препаратов рекомбинантного интерлейкина-11 человека в растворимой форме в составе слитного белка mTrx-rhIL-11.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11, созданной на основе модифицированного вектора рЕТ32М и содержащей синтетический ген интерлейкина-11 (ИЛ-11) человека, также за счет разработки способа получения рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11, включаюшего синтез гена ИЛ-11 из 4-х фрагментов, конструирование вектора рЕТ32М на основе плазмиды pET32b, несущей ген мутантного тиоредоксина mTrx, переклонирование синтетического гена ИЛ-11 в экспрессирующий вектор рЕТ32М, а также за счет создания штамма E.coli BL21(DE3)/pET32M/mTrx-rhIL-11, трансформированного рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 и продуцирующего интерлейкин-11 человека в растворимой форме составе слитного белка mTrx-rhIL-11.
Способ получения рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 предусматривает получение синтетического гена (рИЛ-11), 4 фрагмента которого синтезируют методом ПЦР с использованием набора перекрывающихся специфических олигонуклеотидных праймеров. Для объединения полученных фрагментов рИЛ-11 каждый из них клонируют в плазмидный вектор pGEM5z, предварительно рестрицированный эндонуклеазой EcoRV. Затем каждой из 4-х плазмид трансформируют штамм E.coli DH5α и проводят отбор клонов, кодирующих соответствующие фрагменты гена ИЛ-11. Путем секвенирования отбирают плазмиды, содержащие фрагменты гена без мутаций. Далее при использовании набора эндонуклеаз рестрикции (BamHI, EheI, PstI, Van91I, XhoI) в сочетании с процессами лигирования проводят объединение всех фрагментов рИЛ-11 человека в плазмидном векторе pUC19.
Синтетический ген ИЛ-11 с помощью эндонуклеаз рестрикции BamHI и XhoI переклонируют в экспрессионный вектор рЕТ32М, несущий ген измененного тиоредоксина I - mTrx. Особенностью данного этапа является конструирование вектора рЕТ32М на основе плазмиды pET32b, позволяющее успешно экспрессировать целевой продукт в растворимой форме в виде слитного белка с тиоредоксином E.coli. Данный рекомбинантный белок содержит непосредственно перед последовательностью ИЛ-11 сайт Asn-Gly для специфического расщепления полипептидной цепи при помощи гидроксиламина. Дополнительный сайт гидролиза, находящийся в последовательности тиоредоксина I, элиминируют заменой Asn84 на Gln с использованием метода направленного мутагенеза, а также делегируют участки последовательностей расщепления тромбином и энтерокиназой, но не удаляют гексагистидиновый кластер. Наличие гексагистидинового кластера предполагает использование для выделения слитного белка и очистки конечного продукта высокоэффективного метода металлохелатной хроматографии.
Рекомбинантная плазмидная ДНК pET32M/mTrx-rhIL-11 характеризуется следующими признаками:
- кодирует ИЛ-11 (SEQ ID №1) человека в составе слитного белка с мутантным Asn84/Gln тиоредоксином I E.coli (SEQ ID №2);
- состоит из плазмиды рЕТ32М и нуклеотидной последовательности, кодирующей синтетический ген ИЛ-11 человека;
- содержит промотор T7lac, ген мутантного Asn84/Gln тиоредоксина I Е.coli, гексагистидиновый кластер, сайт Asn-Gly, синтетический ген ИЛ-11 человека, терминатор фага Т7, ген устойчивости к ампициллину bla и ген репрессора лактозного оперона lacI.
Создание штамма E.coli, продуцирующего ИЛ-11 в составе слитного белка с тиоредоксином, на основе исходного штамма BL21(DE3) и с использованием полученной рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 приводит к получению целевого белка преимущественно в растворимой форме, а не в составе телец включения, что позволяет избежать дорогостоящей и технически сложной процедуры ренатурации при выделении и очистке целевого белка.
Штамм E.coli BL21(DE3), трансформированный плазмидой pET32M/mTrx-rhIL-11, выращивают на среде LB (10 г/л бактотриптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl) с добавлением селективного антибиотика (ампициллина натриевая соль, 50 мкг/мл) при перемешивании при 37°С в течение 12 часов (посевной материал), инокулируют новую порцию питательной среды в соотношении 1:50, растят культуру до достижения оптической плотности 18 оптических единиц, индуцируют изопропилтио-бета-D-галактозидом (IPTG) и растят еще 16 часов. Клетки E.coli BL21(DE3)/pET32M/mTrx-rhIL-11 являются суперпродуцентом. При индукции IPTG (изопропил-бета-D-1-тиогалактопиранозидом) происходит эффективный биосинтез слитного белка, который накапливается в клетках как в растворимой форме, так и в виде телец включения при доле растворимого продукта 75%.
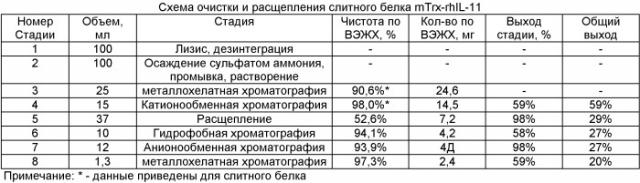
Выделение и очистка рекомбинантного ИЛ-11 (рИЛ-11) включает несколько стадий. Клетки отделяют от культуральной среды и разрушают ультразвуком в присутствии ЭДТА-Na. Центрифугированием отделяют растворимую клеточную фракцию от телец включения. Очистка слитного белка из растворимой клеточной фракции включает следующие этапы: двукратная преципитация гибридного белка сульфатом аммония; металлохелатная хроматография; катионообменная хроматография. Выход полученного таким способом слитного белка составляет примерно 250 мг с 1 л бактериальной культуры. Отделение и тонкую очистку рИЛ-11 проводят по следующей схеме: расщепление в присутствии гидроксиламина и последовательная хроматографическая очистка с использованием методов гидрофобной, анионообменной и металлохелатной хроматографии. При этом окончательный выход рИЛ-11 составляет примерно 20 мг с 1 л бактериальной культуры.
Полученный штамм-продуцент E.coli BL21(DE3)/pET32M/mTrx-rhIL-11 характеризуется следующими признаками.
Морфологические признаки: клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, мутные, матовые, с неровными краями. Диаметр колоний 2-4 мм. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением, осадок легко седиментирует.
Физиолого-биохимические признаки: клетки растут при температуре 4-42°С, температурный оптимум для роста клеток 37°С, оптимум рН 6,8-7,5. В качестве источника азота используют как минеральные соли азота, так и органические соединения в виде аминокислот, пептона, триптона, дрожжевого экстракта. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину. Устойчивость к ампициллину у штамма не ниже 100 мкг/мл на твердых агаризованных средах, при наращивании в жидких полноценных средах - не менее 50 мкг/мл.
Генотипические признаки: основной генотипический признак штамма E.coli BL21(DE3)/pET32M/mTrx-rhIL-11 состоит в наличии под регуляцией T7lac промотора нуклеотидной последовательности кодирующей области генов рИЛ-11 и тиоредоксина I, интегрированных в состав экспрессионного вектора.
Стабильность плазмиды pET32M/mTrx-rhIL-11 в штамме E.coli BL21(DE3)/pET32M/mTrx-rhIL-11: при хранении клеток на агаризованной среде (сроком до 1 месяца) и в процессе культивирования в жидкой среде с антибиотиком не происходит потери и перестройки плазмиды pET32M/mTrx-rhIL-11. Штамм сохраняет плазмиду в процессе не менее 6 пересевов на бесселективной среде.
Изобретение иллюстрируют чертежами
Фиг.1. Схема синтеза гена ИЛ-11 из олигонуклеотидных праймеров.
Фиг.2. Схема создания экспресионной конструкции, содержащей синтетический ген ИЛ-11 человека.
Фиг.3. Рестрикционные карты плазмидных векторов рЕТ-32b и рЕТ-32М.
Фиг.4. Карта экспрессионной конструкции, содержащей синтетический ген ИЛ-11 человека.
Фиг.5. Схема расщепления слитного белка mTrx/rhIL-11.
Изобретение иллюстрируют примеры.
Пример 1. Получение синтетического гена рекомбинантного интерлейкина-11 человека.
Нуклеотидную последовательность, соответствующую гену интерлейкина-11 человека, получают химико-ферментативным синтезом. Для этого теоретически рассчитанную последовательность ДНК, кодирующую аминокислотную последовательность, идентичную таковой для интерлейкина-11 человека и предназначенную для эффективого синтеза белка в клетках Е.coli, разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, выполняют твердофазным фосфоамидитным методом при помощи, например, ДНК-синтезатора ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3′-конца к 5′-концу с помощью защищенных фосфамидитов-5′-диметокситритил-N-ацил-2′-дезоксинуклеозид-3′-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3′-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г).
Синтез 4 фрагментов рИЛ-11 из полученных таким образом олигонуклеотидных праймеров проводят с использованием полимеразной цепной реакции (ПЦР) на приборе РТС-200 (M&J Research, США). Готовят инкубационную смесь следующего состава: 25 мкл стандартного буфера для Taq-полимеразы (Cycle ReaderTM DNA Sequencing Kit, Fermentas, Литва); 10/0,2 pmol (пикомоля) каждого специфического праймера; 2 мМ (миллимоля) каждого дезоксирибонуклеотидтри-фосфата; 2 единицы Taq-полимеразы.
Амплификацию проводят по схеме, отраженной на фиг.1.
Расчет температуры отжига праймера (X) производят по формуле
Х=2°С×n(А/Т)+4°С×n(G/C)-5°С,
где n - число соответствующих нуклеотидов (А, Т, G, С). Для праймеров длиной более 24 нуклеотидов используют максимальную возможную температуру отжига, определенную экспериментально (68°С). Для увеличения выхода полноразмерного продукта ПЦР концентрация внешних праймеров составляет 10 pmol, а концентрация внутренних праймеров 0,2 pmol.
Схема создания синтетического гена рекомбинантного интерлейкина-11 человека представлена на фиг.2.
Продукты амплификации очищают электрофорезом в 5% полиакриламидном геле, фрагменты ДНК соответствующей величины выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Проводят лигирование продуктов ПЦР в плазмидный вектор pGEM5z (Promega, USA), предварительно обработанный рестриктазой EcoRV.
Для рестрикции аликвоты плазмиды pGEM5z инкубируют в течение 1 часа в водном термостате при 37°С с рестриктазой EcoRV. В последние 10 минут инкубации добавляют панкреатичекую рибонуклеазу до конечной концентрации 1 мкг/мл.
Полную линеаризацию плазмиды контролируют электрофорезом в 1% агарозном геле. По окончании электрофореза ДНК визуализируют в ультрафиолетовом свете (254 нм, трансиллюминатор LKB).
Для лигирования продуктов ПЦР в рестрицированный плазмидный вектор используют ДНК-лигазу фага Т4 и стандартный буферный раствор (Fermentas, Литва) в соответствии с методикой производителя. Лигирование ведут в объеме 10 мкл при молярном соотношении вектора и вставки 1:10 в течение 20 часов при комнатной температуре.
Полученные лигаты используют для электротрансформации компетентных клеток E.coli штамма DH5α, которую проводят, например, при помощи аппарата для электротрансформации ВТХ 600 при зазоре между пластинами электропорационной кюветы 1 мм и напряжении разряда 1,4 кВ. После трансформации суспензию бактерий смешивают с питательной средой SOC, растят 1 час на +37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Клоны, отобранные в результате бело-голубого скрининга, дополнительно проверяются на наличие олигонуклеотидной последовательности клонированных фрагментов гена рИЛ-11 определенного размера методом ПЦР с колоний с использованием плазмидных праймеров M13for 5′-GCCAGGGTTTTCCCAGTCACGA-3′и M13rev 5′-GAGCGGATAACAATTTCACACACAGG-3′.
Проводят 25 циклов амплификации (95°С, 20 с; 62°С, 40 с; 72°С, 60 с) с последующим электрофоретическим анализом ПЦР продуктов в 5% ПААГ на наличие ПЦР-продукта соответствующей длины. Отобранные клоны используют для подроста в жидкой среде и выделения плазмидной ДНК, которую анализируют на наличие вставки с помощью эндонуклеаз рестрикции по сайтам NcoI и SalI, а также по фланкирующим сайтам, специфичным для каждого фрагмента, с последующим разделением продуктов гидролиза в 5% полиакриламидном геле. Окончательное строение плазмид, содержащих фрагменты синтетического гена рИЛ-11, подтверждают определением нуклеотидной последовательности методом секвенирования по Сенгеру. По данным секвенирования отбирают 4 плазмиды, нуклеотидная и соответствующая ей аминокислотная последовательности фрагмента которых полностью идентичны запланированной.
Далее проводят объединение фрагментов гена рИЛ-11 попарно по соответствующим концевым сайтам рестрикции. Для объединения фрагментов 1 и 2 друг с другом соответствующую ДНК нарабатывают с плазмид методом ПЦР с использованием специфических праймеров по описанной выше методике. Полученные продукты ПЦР обработывают рестриктазой Van91I, очищают методом вертикального электрофореза в ПААГ с последующей электроэлюцией и затем лигируют друг с другом. Аналогично объединяют фрагменты 3 и 4 с использованием рестриктазы EheI.
Продукты лигирования используют в качестве матрицы для ПЦР со специфических праймеров. Наработанные таким образом фрагменты ДНК рестрицируют: фрагмент 1+2 по сайтам BamHI и PstI, фрагмент 3+4 по сайтам PstI и XhoI, очищают и лигируют в аналогично рестрицированные и дефосфорилированные плазмидные вектора pUC19 и pGEM5z соответственно.
Отбор клонов IL1-2pUC и IL3-4GEM, использованных в дальнейшей работе, проводят, как описано выше, методами бело-голубого скрининга, ПЦР с клонов, с последующим рестрикционным анализом и секвенированием по Сенгеру плазмидной ДНК. Для получения полноразмерного гена рИЛ-11 PstI-XhoI фрагмент плазмиды IL3-4GEM переклонируют в плазмиду IL1-2pUC по соответствующим рестриктным сайтам. Скрининг плазмид IL11pUC проводят по стандартной схеме с использованием методов ПЦР с клонов, рестриктного анализа и секвенирования с использованием специфических праймеров IL11-1forw1, IL-11-1rev2, IL11-2forw1, IL11-2rev2 и IL-11-2rev1 (фиг.1).
Пример 2. Получение рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11
Создание экспрессионной конструкции pET32M/mTrx-rhIL-11, кодирующей рекомбинантный ИЛ-11 человека в составе белка, слитного с мутантным тиоредоксином I E.coli (mTrx), проводят по схеме фиг.2.
Экспрессионный вектор рЕТ32М, несущий ген мутантного тиоредоксина (mTrx), конструируют на основе вектора pET32b (Novagen, США) по схеме, представленной на фиг.3. Для получения вектора рЕТ32М модифицируют участок вектора pET32b между сайтами рестрикции RsrII и BamHI заменой Asp84 на Gln (удаление дополнительного сайта расщепления этаноламином), делегируют участки, кодирующие сайты расщепления тромбином и энтерокиназой, а также второй шестигистидиновый домен.
Для получения рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 BamHI-XhoI фрагмент плазмиды IL11pUC, содержащий полноразмерный ген рИЛ-11, переклонируют в вектор рЕТ32М по соответствующим сайтам. Карта полученной экспрессионной конструкции представлена на фиг.4.
По результатам отбора, включавшего ПЦР с клонов, рестриктный анализ и секвенирование, получают окончательную конструкцию pET32M/mTrx-rhIL-11, кодирующую слитный белок mTrx-rhIL-11.
Пример 3. Получение штамма E.coli BL21(DE3), продуцирующего слитный белок mTrx-rhIL-11
Для проведения аналитической экспрессии слитного белка mTrx-rhIL-11 в клетках E.coli штамма BL21(DE3) плазмидную ДНК трансформируют методом электропорации в компетентные клетки штамма-продуцента. Клетки отдельно взятой колонии подращивают в течение 3 часов при 37°С и индуцируют 1 mM IPTG 3 часа при 30°С. Анализ суммарного клеточного белка методом электрофореза по Лэммли [Laemmli, U.K., Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature, 1970. 227 (259): p.680-685] показывает наличие целевого продукта mTrx-rhIL-11 с молекулярным весом около 32 кДА.
Для определения состояния целевого продукта (слитного белка mTrx-rhIL-11) в клетках E.coli штамма BL21(DE3) клеточный лизат фракционируют на белки в растворимой и нерастворимой (тельца включения) форме.
Для каждой из фракций проводят аналитическую металлохелатную хроматографию с использованием сорбции в объеме в соответствующих условиях, с последующим анализом методом электрофореза по Леммли. В качестве контроля используют клон клеток BL21(DE3), трансформированных вектором рЕТ32М. Данные, полученные при денситометрии гелей, свидетельствуют о том, что после 3 часов индукции большая часть (75%) рекомбинантного белка mTrx-rhIL-11 находится в растворимом состоянии, и только небольшая часть присутствует в виде телец включения.
Оптимизацию экспрессии продукта - слитного белка mTrx-rhIL-11 - проводят по следующим параметрам: количество индуктора (0.1-1 mM IPTG), температура экспрессии (25, 30 и 37°С) и время экспрессии (3-24 ч). Выход целевого белка анализируют раздельно для растворимой и нерастворимой (тельца включения) формы методом электрофореза по Леммли с последующей денситометрией геля с использованием бычьего сывороточного альбумина в качестве стандарта (0.33 мг/мл). Наивысший уровень экспрессии слитного белкаТгх-rhIL-11 наблюдается при индукции 1 mM IPTG и температуре 30°С в течение 16 часов и составляет 156 и 300 мг белка с 1 литра культуры клеток E.coli при выращивании в колбах и в ферментере соответственно.
Идентификацию полученного белка проводят методом масс-спектрометрии (MALDI-TOF). Масс-спектрометрический анализ показывает точное соответствие массы полученного молекулярного иона теоретически рассчитанной. Теоретически рассчитанная масса слитного белка mTrx-rhIL-11 составляет 32,642 кДа, тогда как при расчете массы по двухзарядному иону масса комплекса для клона-продуцента IL-11pET/2BL составляет 32,620 кДа и 32,628 кДа - для IL-11pET/5BL. Отклонения полученных молекулярных масс от теоретически рассчитанных составляют 0,067% и 0,042% соответственно.
Пример 4. Получение рИЛ-11 путем очистки и расщепления слитного белка mTrx-rhIL-11.
Для контроля возможности использования полученного штамма E.coli BL21(DE3) слитный белок mTrx-rhIL-11 подвергают очистке и расщеплению с целью получения целевого продукта - рекомбинантного ИЛ-11 человека. Очистка слитного белка включает следующие этапы: лизис и дезинтеграция клеток в присутствии ЭДТА-Na; двухкратное осаждение гибридного белка сульфатом аммония; металлохелатная хроматография; катионобменная хроматография.
Схема расщепления слитного белка представлена на фиг.5. Для реализации этого процесса смешивают: 100 мМ NaHCO3, рН 9,3; 1 М гидроксиламина; 3,75 мг/мл слитного белка. Время инкубации 10,5 часов при константе скорости 0,17 ч-1.
Схема расщепления и очистки mTrx-rhIL-11 и условия их осуществления на примере одной из партий слитного белка (S8_2007) при количестве биомассы 3,7 г и контроле выхода целевого продукта методом высокоэффективной жидкостной хроматографии (ВЭЖХ) представлена в таблице.
Конечные показатели выхода рИЛ-11 по результатам очистки и расщепления 10 партий препаратов слитного белка:
| - Выход: | 20% (20 мг/л) |
| - Родственные белки по о/ф хроматографии: | <4% |
| - Белки штамма-продуцента по ИФА: | <20 нг/мг |
1. Рекомбинантная плазмидная ДНК pET32M/mTrx-rhIL-11, имеющая размер 6459 п.о., кодирующая слитный белок mTrx-rhIL-11, состоящий из тиоредоксина 1 E.coli с заменой Asn84/Gln, гексагистидинового кластера, сайта Asn-Gly и интерлейкина-11 человека, представленный в SEQ ID NO:2, состоящая из плазмиды рЕТ32М и нуклеотидной последовательности синтетического гена интерлейкина-11 человека, содержащая следующий набор функциональных элементов, расположенных последовательно после точки начала репликации плазмиды в направлении хода репликации: ген репрессора лактозного оперона lacI, промотор T7lac, ген измененного Asn84/Gln тиоредоксина 1 E.coli, гексагистидиновый кластер, сайт Asn-Gly, синтетический ген ИЛ-11 человека, терминатор фага Т7, ориджин фаговой репликации f1, ген устойчивости к ампициллину Bla, ориджин репликации ori и предназначенная для экспрессии в клетках E.coli.
2. Способ получения рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 по п.1, включающий синтез четырех фрагментов гена рекомбинантного интерлейкина-11 человека из олигонуклеотидных праймеров, клонирование каждого фрагмента в рестрицированный эндонуклеазой EcoRV плазмидный вектор pGEM5z, трансформацию каждой из 4-х плазмид клеток E.coli штамма DH5a, отбор кодирующих соответствующие фрагменты гена интерлейкина-11 человека клонов, отбор плазмид с фрагментами гена интерлейкина-11 человека без мутаций, объединение всех фрагментов гена рекомбинантного интерлейкина-11 человека в плазмидном векторе pUC19, конструирование вектора рЕТ32М на основе плазмиды pET32b, переклонирование гена рекомбинантного интерлейкина-11 человека в экспрессионный вектор рЕТ32М, кодирующий тиоредоксин 1 E.coli с заменой Asn84/Gln.
3. Штамм E.coli BL21(DE3)/pET32M/mTrx-rhIL-11 - продуцент рекомбинантного интерлейкина-11 человека в составе растворимого слитного белка mTrx-rhIL-11, полученный путем трансформации клеток штамма E.coli BL21(DE3) рекомбинантной плазмидной ДНК pET32M/mTrx-rhIL-11 по п.1.