Способ хирургического лечения постпневмонэктомического синдрома
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к торакальной хирургии, может найти применение при лечении постпневмонэктомического синдрома. Сущность способа состоит в том, что операцию проводят через 1-3 года после пневмонэктомии. При этом на стороне ранее произведенной пневмонэктомии выполняют разрез длиной 8 см паравертебрально параллельно медиальному краю лопатки от уровня остистого отростка третьего грудного позвонка. Послойно рассекают кожу, подкожно-жировую клетчатку, часть трапециевидной, широчайшей мышцы спины и большой ромбовидной мышцы. Частично рассеченные мышцы и лопатку отслаивают от наружной поверхности ребер в проекции предстоящей декостации и отводят в стороны и кнаружи, образуя полость для хирургических манипуляций между большими скелетными мышцами и реберным каркасом. В нее устанавливают видеоторакоскоп, под контролем которого выполняют все дальнейшие манипуляции. Расслаивают волокна мышцы, выпрямляющей спину, открывая доступ к задним отрезкам ребер, и выполняют последовательно частичное удаление V, IV, III, II и I ребер. Затем в экстраплевральную полость через микроирригатор вводят медленно рассасывающийся пломбировочный материал. Рану герметично ушивают. В послеоперационном периоде производят удаление экссудата из плевральной полости. В экстраплевральную полость ежедневно вводят растворы антибиотиков. Через 1-1,5 месяца микроирригатор удаляют. Использование данного изобретения позволяет ликвидировать постпневмонэктомический синдром, предупредить перерастяжение оставшегося единственного легкого, снизить риск рецидива туберкулеза. 10 ил.
Реферат
Изобретение относится к области медицины, а именно к торакальной хирургии, и может быть использовано для лечения постпневмонэктомического синдрома после пневмонэктомии.
В торакальной хирургии существует проблема постпневмонэктомического синдрома после удаления легкого (пневмонэктомии). Даже при неосложненном течении послеоперационного периода постпневмонэктомический синдром по данным литературы встречается нередко (Амосов Н.М. Пневмонэктомия и резекции легкого при туберкулезе. - Москва. - Медгиз. - 1957. - 196 с.; Wihlm J.M., Massard G. Late complications. Late respiratory failure. // Chest Surg. Clin. N. Am. - 1999. - Vol.9. - N.3. - P.633-654).
Чаще всего постпневмонэктомический синдром встречается у лиц молодого возраста, что связано с более быстрым формированием фиброторакса и более выраженным смещением средостения у этой категории больных. Формирующийся рубец в плевральной полости занимает объем значительно меньший, чем удаленное легкое, и происходит резкое смещение сердца и других органов средостения в оперированную сторону с их ротацией (поворотом) вокруг позвоночника и своей оси. Это вызывает появление следующих патологических симптомов: дисфагии (затруднение глотания) в результате резкого смещения и перегиба пищевода; появление медиастинальной легочной грыжи, часто с нарушением вентиляции и рецидивирующими воспалительными процессами в легочной ткани, выходящей в грыжевое выпячивание; стридор (затруднение дыхания) из-за перегиба трахеи и главного бронха; сердечно-сосудистых нарушений из-за резкого смещения и ротации сердца, вызывающего перегиб полых вен; желудочной симптоматики за счет резкой дислокации желудка.
Помимо этого у больных туберкулезом перерастяжение единственного легкого ведет к развитию в нем викарной эмфиземы с нарастанием легочно-сердечной недостаточности, а также к прогрессированию туберкулеза в оставшихся в нем очагах.
Перечисленные симптомы в той или иной степени возникают у всех больных, перенесших пневмонэктомию.
Диагноз постпневмонэктомического синдрома устанавливают при значительной выраженности симптомов, что способствует высокой частоте инвалидизации оперированных больных и угрожает их жизни.
Несмотря на то, что существует большое количество больных с постпневмонэктомическим синдромом, данная проблема в настоящее время не решена.
В доступных источниках информации имеется лишь 3 публикации с описанием хирургической коррекции постпневмонэктомического синдрома у единичных больных (Mehran R.J., Deslauriers J. Late complications. Postpneumonectomy syndrome. // Chest Surg. Clin. N. Am. - 1999. - Vol.9. - N.3. - P.655-673; Birdi I., Bughai M., Wells F.C. Surgical correction of postpneumonectomy stridor by saline breast implantation. // Ann. Thorac. Surg. - 2001. - Vol.71. - N.5. - P.1704-1706; Casanova V.J., Marinan G.M., Rumbero S.J. // Surgical repair of postpneumonectomy syndrome with vascular compromise. // Arch. Bronconeumol. - 2002. - Vol.38. - N.1. - P.51-54).
Коррекцию производят больным с установленным постпневмонэктомическим синдромом, как правило, через 1-3 года после выполненной пневмонэктомии. Операцию выполняют из боковой торакотомии длиной 20-25 см обычно в V межреберье. После вскрытия плевральной полости выполняют расслоение фиброторакса на всем протяжении плевральной полости до средостения для обеспечения возможности возвращения органов средостения к средней линии. Затем для фиксации средостения в срединном положении в расслоенный фиброторакс устанавливают силиконовые протезы молочной железы. Количество их определяется размерами плевральной полости пациента и величиной смещения органов средостения. Обычно необходимо установить 2-3 силиконовых протеза. Операцию заканчивают установкой дренажей в плевральную полость и послойным ушиванием раны.
Единственный известный способ коррекции постпневмонэктомического синдрома не получил распространения из-за большой технической сложности и высокого травматизма операции.
Наличие в плевральной полости нескольких силиконовых протезов нефизиологично. Являясь для организма инородным телом, они увеличивают риск нагноительных осложнений. Протезы могут давить и вызывать пролежни в грудной стенке и органах средостения. Силикон со временем может разрушаться, вызывать аллергические реакции.
Способ не может быть принят в качестве аналога, так как не содержит приемов, общих с предлагаемым способом, и не является способом лечения постпневмонэктомического синдрома.
Задачей изобретения является создание способа хирургического лечения постпневмонэктомического синдрома, позволяющего получить выраженный и стойкий клинический эффект при минимальном риске послеоперационных осложнений и малой травматичности.
Сущность изобретения состоит в том, что способ хирургического лечения постпневмонэктомического синдрома характеризуется тем, что операцию проводят через 1-3 года после пневмонэктомии, на стороне которой выполняют разрез длиной 8 см паравертебрально параллельно медиальному краю лопатки от уровня остистого отростка третьего грудного позвонка, послойно рассекают кожу, подкожно-жировую клетчатку, часть трапециевидной, широчайшей мышцы спины и большой ромбовидной мышцы, частично рассеченные мышцы и лопатку отслаивают от наружной поверхности ребер в проекции предстоящей декостации и отводят в стороны и кнаружи, образуя полость между большими скелетными мышцами и реберным каркасом, в эту полость через отдельный прокол на 2 см выше верхнего угла раны через торакопорт вводят видеоторакоскоп, под контролем которого выполняют все дальнейшие манипуляции, расслаивают волокна мышцы, выпрямляющей спину, открывая доступ к задним отрезкам ребер, после чего выполняют последовательно частичную декостацию V, IV, III, II и I ребер, начиная с V ребра: электроножом рассекают надкостницу по его наружной поверхности, полностью очищают ребро от надкостницы и межреберных мышц без вскрытия плевральной полости, рассекают сухожилия и связки, прикрепляющиеся к поперечному отростку V грудного позвонка, кусачками перекусывают шейку ребра вместе с поперечным отростком грудного позвонка, а затем - по средне-подмышечной линии, и частично удаляют, аналогично производят рассечение надкостницы IV и III ребер и очищение их от мышц и надкостницы, после пересечения сухожилий и связок вокруг головки IV ребра и поперечного отростка четвертого грудного позвонка шейку ребра перекусывают вместе с поперечным отростком позвонка, ребро частично удаляют кпереди до передне-подмышечной линии, третье ребро удаляют кпереди до хрящевой части, аналогичным образом выполняют частичное удаление II ребра, затем рассекают надкостницу по наружному краю I ребра, очищают его нижнюю поверхность от надкостницы и межреберных мышц, рассекают сухожилия и связки в области головки, перекусывают ее без захвата поперечного отростка первого грудного позвонка, задний отрезок ребра захватывают крючком, отводя книзу и на себя, очищают от надкостницы верхнюю и внутреннюю поверхности ребра и перекусывают кпереди по границе с хрящевой частью, после этого в экстраплевральную полость через микроирригатор вводят медленно рассасывающийся пломбировочный материал, рану герметично ушивают, в послеоперационном периоде производят удаление экссудата из плевральной полости, а в экстраплевральную полость ежедневно вводят растворы антибиотиков, через 1-1,5 месяца микроирригатор удаляют.
Использование изобретения позволяет получить следующий технический результат.
Впервые разработан высокоэффективный способ лечения постпневмонэктомического синдрома.
Способ позволяет практически ликвидировать постпневмонэктомический синдром, исключить перерастяжение оставшегося единственного легкого, снизить риск рецидива туберкулеза.
Достигается возврат смещенных в сторону удаленного легкого органов средостения (сердца, сосудов, трахеи и бронхов) назад к средней линии тела и одновременное практически полное исчезновение легочной грыжи, т.е. перерастяжение единственного легкого.
Способ отличается малой травматичностью, минимальным риском послеоперационных осложнений, и хорошим косметическим эффектом без видимой деформации грудной клетки.
В целом у больных наблюдается гладкое и нетяжелое течение послеоперационного периода, не резко выраженный болевой синдром, ранняя и полная функциональная реабилитация.
Все это приводит к улучшению качества и сохранению жизни оперированных пациентов.
Способ целесообразно использовать у всех больных с постневмонэктомическим синдромом.
Технический результат достигается за счет разработанной авторами принципиально новой технологии, включающей выполнение доступа с минимальной травматизацией тканей, сохранением мышечного массива пояса верхней конечности и формированием объемной полости в области хирургического поля, а также выполнения экстраплевральной торакопластики из «малоинвазивного» доступа под контролем видеоторакоскопии.
Отслаивание частично рассеченных мышц и лопатки от наружной поверхности ребер в проекции предстоящей декостации с отведением в стороны и кнаружи позволяет сформировать пространство для хирургических манипуляций между большими скелетными мышцами и реберным каркасом и обеспечить таким образом возможность видеоассистирования с использованием видеоторакоскопа, который устанавливают в образованную полость через отдельный прокол.
Использование видеоторакоскопии позволяет из минимизированного доступа уверенно произвести декостацию минимальной и достаточной части ребер для обеспечения податливости грудной клетки и инвагинации грудной стенки в полость гемиторакса. Введенный через микроирригатор временный рассасывающийся пломбировочный материал удерживает грудную стенку за счет давления извне в инвагинированном состоянии. Удаление экссудата из плевральной полости в послеоперационном периоде создает внутри гемиторакса отрицательное давление, а ежедневное введение в экстраплевральную полость лекарственных растворов, например антибиотиков, создает положительное давление, способствуя получению выраженной максимально возможной инвагинации, что обеспечивает возвращение смещенных органов средостения к средней линии тела.
Происходит формирование костных регенератов ребер на новом уровне, которые фиксируют в последующем грудную стенку в достигнутом положении, что препятствует в последующем смещению органов средостения в сторону удаленного легкого, предупреждает перерастяжение единственного оставшегося легкого и прогрессирование туберкулезного процесса в оставшихся очагах.
Способ осуществляется следующим образом.
Больному с установленным диагнозом постпневмонэктомического синдрома, обычно через 1-3 года после пневмонэктомии, выполняют операцию на стороне ранее произведенной пневмонэктомии под комбинированным интубационным наркозом в положении больного на животе.
Выполняют разрез длиной 8 см паравертебрально параллельно медиальному краю лопатки от уровня остистого отростка III грудного позвонка. Послойно рассекают кожу, подкожно-жировую клетчатку, часть трапециевидной, широчайшей мышцы спины и большой ромбовидной мышцы. Частично рассеченные мышцы и лопатку отслаивают от наружной поверхности ребер в проекции предстоящей декостации и отводят в стороны и кнаружи широкими крючками, образуя полость для хирургических манипуляций между большими скелетными мышцами и реберным каркасом. В эту полость через отдельный прокол на 2 см выше верхнего угла раны устанавливают торакопорт, вводят видеоторакоскоп и дальнейшие манипуляции выполняют под видеоторакоскопическим контролем. Расслаивают волокна мышцы, выпрямляющей спину, и открывают доступ к задним отрезкам ребер.
Последовательно выполняют частичную декостацию V, IV, III, II и I ребер, начиная с V ребра.
Под контролем оптики электроножом рассекают надкостницу по его наружной поверхности в зоне декостации. Респатером ребро полностью очищают от надкостницы и межреберных мышц, при этом плевральную полость не вскрывают. Электроножом рассекают сухожилия и связки, прикрепляющиеся к поперечному отростку пятого грудного позвонка. Костными кусачками Дэвиса перекусывают шейку ребра вместе с поперечным отростком грудного позвонка. Затем ребро перекусывают кусачками по средне-подмышечной линии и удаляют.
После частичного удаления V ребра аналогично рассекают электроножом надкостницу IV ребра и респатером очищают от мышц и надкостницы. После пересечения электроножом сухожилий и связок вокруг головки ребра и поперечного отростка четвертого грудного позвонка шейку ребра перекусывают вместе с поперечным отростком позвонка. IV частично ребро удаляют кпереди до переднее-подмышечной линии.
III ребро удаляют кпереди до хрящевой части, у которой перекусывают его кусачками Дэвиса. После этого аналогичным образом частично удаляют II ребро.
Затем электроножом рассекают надкостницу по наружному краю I ребра. Сначала тупым респатером очищают его нижнюю поверхность от надкостницы и межреберных мышц, затем рассекают сухожилия и связки в области головки. Кусачками Дэвиса перекусывают головку ребра без захвата поперечного отростка первого грудного позвонка. Задний отрезок ребра захватывают крючком для первого ребра и отводят книзу и на себя. Изогнутым респатером очищают от надкостницы верхнюю поверхность ребра, затем осторожными движениями респатера очищают его внутреннюю поверхность. После этого ребро перекусывают кпереди по границе с хрящевой частью и удаляют.
Последним этапом в экстраплевральную полость через микроирригатор вводят медленно рассасывающийся пломбировочный материал, например структурированный 2% коллаген. Рану герметично ушивают по общепринятой методике.
Для удержания органов средостения (сердца, сосудов, трахеи и бронхов) в срединном положении в послеоперационном периоде производят удаление экссудата из плевральной полости для создания отрицательного давления, а в экстраплевральную полость ежедневно вводят растворы лекарственных веществ, например антибиотиков, создавая положительное давление. По мере рассасывания пломбировочного материала происходит формирование костных регенератов ребер. Через 1-1,5 месяца микроирригатор удаляют.
Предлагаемый способ использован в ГУ ЦНИИТ РАМН. Всего прооперировано 3 пациентов (добровольцев) в возрасте от 21 до 49 лет по поводу существующего постпневмонэктомического синдрома.
Послеоперационных осложнений не отмечено. Послеоперационной летальности не было. Во всех 3-х случаях лечения постпневмонэктомического синдрома удалось ликвидировать его проявления.
Пример: Больная А., 20 лет, поступила в 1 х.о. ГУ ЦНИИТ РАМН 18.03.08 г. При поступлении предъявляла жалобы на слабость, температуру до 38,0; одышку при нагрузке, кашель с серозно-гнойной мокротой.
Из анамнеза: туберкулез выявлен в октябре 2006 г. Длительная химиотерапия в условиях стационара, без эффекта. Сформировался ФКТ.
В мокроте люминесцентным методом обнаружены микобактерии туберкулеза ++, устойчивые к изониазиду, рифампицину, стрептомицину, этамбутолу, канамицину, этионамиду, фторхинолонам.
В общем анализе крови отмечалось ускорение СОЭ - 77 мм/ч по Westergren. При функциональном исследовании легких ЖЕЛ - 95,4%. Вентиляционная способность легких в норме. Незначительная патология мелких бронхов, отмечалась умеренная гипоксемия и гиперкапния (pO2 - 75 мм, pCO2 - 31,7 мм рт.ст).
На обзорной рентгенограмме при поступлении (фиг.1) справа - уменьшение объема в/доли легкого за счет фиброза и каверны неправильной формы в верхней доле и в S6 с толстыми стенками размерами до 3,0 см. Бронхогенная диссеминация в нижние отделы правого легкого. Очаговый туберкулез левого легкого.
После полного клинического обследования поставлен клинический диагноз: фиброзно-кавернозный туберкулез правого легкого в фазе обсеменения. МБТ(+). XDR (H, R, S, E, Et, K, Fq).
Больная получала химиотерапию: амикацин - 1,0 в/м, пиразинамид - 0,5з3 р/д, офлоксацин - 0,2×2 р/д, циклосерин - 0,25×2 р/д; гепатотропную, неспецифическую антибактериальную терапию.
10.04.08 г. произведена операция - видеоассистент-торакоскопическая пневмонэктомия справа.
Гистологическое заключение: фиброзно-кавернозный туберкулез легкого в фазе выраженного прогрессирования. Туберкулезное воспаление бронха. Туберкулез ВГЛУ.
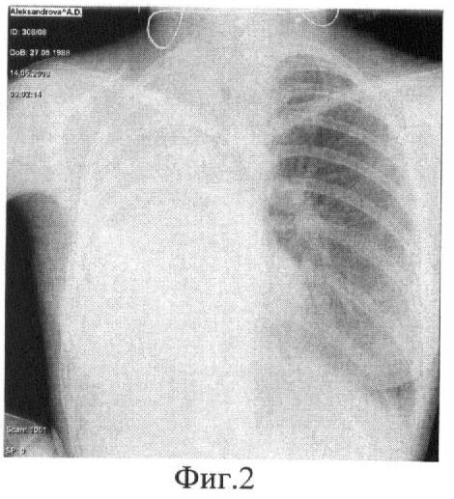
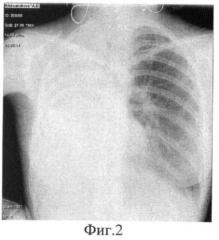
Послеоперационный период протекал без осложнений. Заживление раны первичным натяжением. Через 1 месяц после операции на обзорной рентгенограмме в левом легком - без динамики (фиг.2) Правосторонний гемиторакс гомогенно затемнен.
В неоднократном исследовании мокроты люминесцентным методом после операции: МБТ не обнаружены. Газы крови: PCO2 - 32,8; PO2 - 84 мм рт.ст.
Больная 21.05.2008 г. в удовлетворительном состоянии была выписана для продолжения лечения в санатории. Дальнейшее лечение продолжила в санатории "Лесное" с 30.05.08 г. по 18.06.08 г. Получала химиотерапию: пиразинамид 1,5, ПАСК 0,75, авелокс 0,4. С 19.06.08 г. по 26.02.09 г. лечилась амбулаторно по индивидуальному режиму: ПАСК 4,0, пиразинамид 1,0, циклосерин 0,5, рифабутин 0,3.
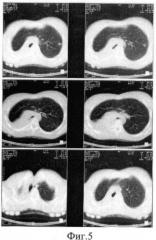
На серии рентгенограмм от июня, сентября, ноября, декабря 2008 года, февраля 2009 года - гемиторакс справа гомогенно затемнен, слева легочная ткань прозрачна, определяется медиастинальная грыжа, смещение трахеи вправо (фиг.3, 4). На рентгенограмме от 25.02.09 г. степень смещения органов средостения и объем медиастинальной грыжи увеличились, в верхних отделах левого легкого визуализировалось крупное очаговое образование, неправильно-округлой формы, с нечеткими контурами, однородной структуры 8,8×10 мм (фиг.5). В посевах мокроты люминесцентным методом обнаружены микобактерии.
Направлена на консультацию в ЦНИИТ РАМН для решения вопроса о госпитализации и дальнейшем лечении с клиническим диагнозом: туберкулема S1-2 левого легкого в фазе инфильтрации. Состояние после пульмонэктомии справа по поводу ФКТ (10.04.08 г.). XDR (H, R, S, E, Et, K, Fq). 06.04.09 г. больная А. госпитализирована в I хирургическое отделение ГУ ЦНИИТ РАМН с диагнозом: постпневмонэктомический синдром, туберкулема верхней доли единственного левого легкого в фазе уплотнения. Состояние после пневмонэктомии справа (10.04.08 г.) по поводу ФКТ. XDR (H, R, S, E, Et, K, Fq).
При поступлении предъявляла жалобы на затруднение глотания твердой пищи, периодически жидкой, свистящее затрудненное дыхание (стридор), одышку, похудание (рост - 160 см, вес - 44 кг).
На ЭКГ при повторном поступлении: ритм синусовый. ЧСС - 64 уд/мин. Нормальное положение ЭОС. Синдром ранней реполяризации миокарда. При функциональном исследовании легких ЖЕЛ - 61,6%. Обструкция значительно выражена.
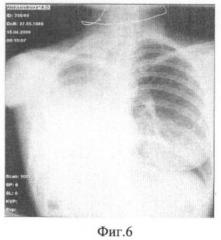
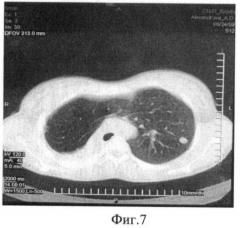
На обзорной рентгенограмме при поступлении (фиг.6) и КТ (фиг.7) отмечалось увеличение по сравнению с предыдущим обследованием размеров медиастинальной грыжи и смещения средостения в сторону операции, а также увеличение туберкулемы в С2 до 1,5 см.
Больная получала химиотерапию: пиразинамид - 0,5×3 р/д, офлоксацин - 0,2×2 р/д, циклосерин - 0,25×2 р/д; гепатотропную, неспецифическую антибактериальную терапию. После наложения пневмоперитонеума (800 мл 1 раз в неделю) газовый пузырь сформировался под правым куполом диафрагмы, уменьшив степень смещения органов средостения, что сопровождалось уменьшением одышки и дисфагии.
Убедившись в возможности ликвидации тягостных симптомов дисфагии и стридора путем уменьшения смещения средостения, больной предложено проведение хирургического лечения по предлагаемму способу. 27.08.2009 г. произведена операция.
В положении больной на животе произведен разрез кожи и подкожной клетчатки медиальнее правой лопатки длиной 8,0 см. паравертебрально параллельно медиальному краю лопатки от уровня остистого отростка третьего грудного позвонка. Послойно рассечены кожа, подкожно-жировая клетчатка, часть трапециевидной, широчайшей мышцы спины и большой ромбовидной мышцы. Частично рассеченные мышцы и лопатка отслоены от наружной поверхности ребер в проекции предстоящей декостации и отведены в стороны и кнаружи с образованием полости для хирургических манипуляций между большими скелетными мышцами и реберным каркасом, в эту полость через торакопорт введен видеоторакоскоп, под контролем которого выполнены все дальнейшие манипуляции. Открыт доступ к задним отрезкам ребер путем расслаивания волокон мышцы, выпрямляющей спину. Выполнена частичная декостация V, IV, III, II и I ребер, начиная с V ребра: электроножом рассечена надкостница по его наружной поверхности, ребро очищено от надкостницы и межреберных мышц без вскрытия плевральной полости, рассечены сухожилия и связки, прикрепляющиеся к поперечному отростку V грудного позвонка, костными кусачками перекусили шейку ребра вместе с поперечным отростком грудного позвонка, а затем - по средне-подмышечной линии, аналогично рассечена надкостница IV и III ребер, которые очищены от мышц и надкостницы. После пересечения сухожилий и связок вокруг головки ребра и поперечного отростка четвертого грудного позвонка шейку ребра перекусили вместе с поперечным отростком позвонка, ребро частично удалено кпереди до передне-подмышечной линии. Третье ребро удалено кпереди до хрящевой части. Аналогичным образом выполнена декостация II ребра. Электроножом рассечена надкостница по наружному краю I ребра, его нижняя поверхность очищена от надкостницы и межреберных мышц, рассечены сухожилия и связки в области головки с последующим перекусыванием ее без захвата поперечного отростка первого грудного позвонка, задний отрезок ребра захвачен крючком, отведен книзу и на себя, очищены от надкостницы верхняя и внутренняя поверхности ребра и перекушены кпереди по границе с хрящевой частью. В экстраплевральную полость через микроирригатор введен медленно рассасывающийся пломбировочный материал - структурированный 2% коллаген, рана герметично ушита (фиг.8А, Б, В, Г). В послеоперационном периоде произведено удаление экссудата из плевральной полости, а в экстраплевральную полость ежедневно вводились растворы антибиотиков. Через 1 месяц микроирригатор удален.
Продолжительность операции составила 40 минут, интраоперационная кровопотеря - 80,0 мл. Послеоперационный период протекал без осложнений. Заживление раны первичным натяжением.
На обзорной рентгенограмме после операции: легочная грыжа ликвидирована, органы вернулись к средней линии (фиг.9). Все явления стридора и дисфагии полностью исчезли, уменьшилась одышка. При этом грубой деформации грудной клетки после выполненной торакопластики не отмечалось (фиг.10).
В послеоперационном периоде отмечены: ранняя активация, маловыраженный болевой синдром, отсутствие ограничения подвижности верхней конечности, отсутствие грубой деформации грудной клетки.
Таким образом, в результате выполнения предложенного способа достигнут возврат органов средостения к средней линии и одновременное практически полное исчезновение легочной грыжи, т.е. перерастяжения единственного легкого.
Способ хирургического лечения постпневмонэктомического синдрома, характеризующийся тем, что операцию проводят через 1-3 года после пневмонэктомии, на стороне которой выполняют разрез длиной 8 см паравертебрально параллельно медиальному краю лопатки от уровня остистого отростка третьего грудного позвонка, послойно рассекают кожу, подкожно-жировую клетчатку, часть трапециевидной, широчайшей мышцы спины и большой ромбовидной мышцы, частично рассеченные мышцы и лопатку отслаивают от наружной поверхности ребер в проекции предстоящей декостации и отводят в стороны и кнаружи, образуя полость между большими скелетными мышцами и реберным каркасом, в эту полость через отдельный прокол на 2 см выше верхнего угла раны через торакопорт вводят видеоторакоскоп, под контролем которого выполняют все дальнейшие манипуляции, расслаивают волокна мышцы, выпрямляющей спину, открывая доступ к задним отрезкам ребер, после чего выполняют последовательно частичную декостацию V, IV, III, II и I ребер, начиная с V ребра: электроножом рассекают надкостницу по его наружной поверхности, полностью очищают ребро от надкостницы и межреберных мышц без вскрытия плевральной полости, рассекают сухожилия и связки, прикрепляющиеся к поперечному отростку V грудного позвонка, кусачками перекусывают шейку ребра вместе с поперечным отростком грудного позвонка, а затем - по средне-подмышечной линии и частично удаляют, аналогично производят рассечение надкостницы IV и III ребер и очищение их от мышц и надкостницы, после пересечения сухожилий и связок вокруг головки IV ребра и поперечного отростка четвертого грудного позвонка шейку ребра перекусывают вместе с поперечным отростком позвонка, ребро частично удаляют кпереди до передне-подмышечной линии, третье ребро удаляют кпереди до хрящевой части, аналогичным образом выполняют частичное удаление II ребра, затем рассекают надкостницу по наружному краю I ребра, очищают его нижнюю поверхность от надкостницы и межреберных мышц, рассекают сухожилия и связки в области головки, перекусывают ее без захвата поперечного отростка первого грудного позвонка, задний отрезок ребра захватывают крючком, отводя книзу и на себя, очищают от надкостницы верхнюю и внутреннюю поверхности ребра и перекусывают кпереди по границе с хрящевой частью, после этого в экстраплевральную полость через микроирригатор вводят медленно рассасывающийся пломбировочный материал, рану герметично ушивают, в послеоперационном периоде производят удаление экссудата из плевральной полости, а в экстраплевральную полость ежедневно вводят растворы антибиотиков, через 1-1,5 мес микроирригатор удаляют.