Способ неинвазивного качественного и количественного определения магнитоуправляемых нанопрепаратов и оценки их функций в реальном времени у экспериментальных животных
Иллюстрации
Показать всеИзобретение относится в экспериментальной медицине, а именно к онкологии, и может быть использовано для качественного и количественного определения нелинейно намагниченных магнитоуправляемых нанопрепаратов (МН), вводимых в организм экспериментальных животных, и оценки функций, которые МН могут выполнять в реальном времени. Для этого определяют изменение откликов МН на воздействие переменными магнитными полями в процессе электронно-сенсорного сканирования тела животного на устройстве, генерирующем и излучающем переменные магнитные поля, принимающем и регистрирующем отклики МН, находящихся в опухоли и печени. По величине откликов определяют присутствие и содержание МН у экспериментальных животных. Функции МН определяют из отношения содержания МН в опухоли к содержанию МН в печени. Если МНопухоли>МНпечени - МН могут выполнять терапевтические функции. При МНопухоли<МНпечени - МН могут выполнять диагностические функции. Предлагаемый способ оценки является неинвазивным, информативным и безопасным и позволяет количественно и качественно оценить распределение МН в организме животных, а также эффективность концентрации и иммобилизации МН в опухоли в зависимости от способа их введения. 3 табл., 10 ил.
Реферат
Изобретение относится к экспериментальной медицине и может быть использовано в онкологии для неинвазивного качественного и количественного определения магнитоуправляемых нанопрепаратов (МН) и оценки их функций в реальном времени у экспериментальных животных.
Внутриопухолевое, внутрибрюшинное и внутрисосудистое введение МН общей формулы: Zn2+ x Mn2+ y Fe2+ 1-x-y [Gd3+ z Fe3+ 2-z], где 0<у<1, 0<x<1, 0<z<1 [1-3] животным, находящимся вне искусственных магнитных полей, приводит к их концентрации в органах ретикуло-эндотелиальной системы (РЭС) [4-7]. Введение МН животным, находящимся в сильном неоднородном постоянном магнитном поле (НПМП), в процессе направленной доставки и иммобилизации МН (таргетинг), приводит к их концентрации в области максимального градиента НПМП [8-12].
Для качественного и количественного контроля МН, доставленных и иммобилизованных в опухоли, в процессе магнитогидродинамической термохимиотерапии и других терапевтических н диагностических воздействий необходимо определять их наличие и концентрацию в опухоли, органах сердечно-сосудистой системы и РЭС в реальном времени. Присутствие МН в этих органах в процессе магнитогидродинамической и магнитожидкостной термохимиотерапии противопоказано из-за их побочного действия.
Известен способ качественного и количественного определения МН у животных после забоя путем омыления их органов и тканей с последующим выделением МН [12] (аналог).
Недостатки аналога:
- определения МН по этому способу занимают от 24 до 48 часов и не дают в реальном времени однозначной картины распределения МН у животных, снижая диагностическую ценность результатов.
Известен способ качественного и количественного определения МН у животных с помощью СКВИД-магнитометров (SQUID-relaxometer), работающих при температуре жидкого гелия [13] (аналог).
Недостатки аналога:
- дорогостоящие исследования с использованием жидкого гелия проводят в помещениях, изолированных от проникновения магнитных полей, создающих помехи (пермалоевая комната);
- длительность подготовки к проведению исследования затрудняет контроль доставки и иммобилизации МН в ткани опухоли, сосудах и в органах РЭС в реальном времени в процессе термохимиотерапии, что снижает диагностическую ценность способа.
Наиболее близким к предлагаемому способу является МР-томографический способ качественного и количественного определения МН с помощью биоспектротомографа BIOSPEC [1], (прототип).
Определения МН проводят на четырех группах самок мышей C57B1/6j весом ~25 г, по 10 самок в каждой группе и на 2 крысах Вистар весом ~250 г следующим образом:
- 10 здоровым самкам мышей C57B1/6j в хвостовую вену вводят 0,04 мл золя МН в полиглюкине из расчета 0,2 мг МН/кг ~0,02 ммол Fе/кг;
- 10 самкам мышей C57B1/6j с аденокарциномой молочной железы Ас 755 (объем опухолей 300-600 мм3) в хвостовую вену вводят 0,1 мл золя МН в полиглюкине из расчета 0,5 мг МН/кг ~0 05 ммол Fe/кг (Фиг.1);
- 10 самкам мышей C57B1/6j с аденокарциномой молочной железы Ас 755 (объем опухолей 300-600 мм3) в опухоль вводят 0,16 мл золя МН в полиглюкине из расчета 0,8 мг МН/кг ~0,08 ммол Fe/кг;
- 2 самкам крыс со спонтанными опухолями молочной железы (объем опухолей 3000-6000 мм3) в глазной синус вводят 0,1 мл золя МН в полиглюкине из расчета 5 мг МН/кг ~0,05 ммол Fe/кг (Фиг.2 а, б);
- по 2 животных из каждой группы используют в качестве контроля, МР-сигналы, полученные от их тканей, принимают за величину шума.
Сразу после инъекций МН каждому животному проводят по семь 3D градиент эхо МРТ-сканирований. Для выбранных областей целевых тканей (опухоль и печень) измеряют интенсивность сигналов и сравнивают с величинами шума. Полученные результаты показывают длительное увеличение отношения сигнал/шум для всех взятых концентраций Fe. По сравнению со средними значениями, полученными при сканировании контрольных животных, средние величины отношения сигнал/шум для всех концентраций Fe и трех исследуемых доз через 2 минуты после контрастирования превышают шум на фактор 6,0, 10,0 и 12,0. Через 26 минут после контрастирования средние величины остаются выше шума на фактор 4,0, 9,0, и 10,0, соответственно. Полупериод элиминации МН из плазмы, наблюдаемый при дозе 0,05 ммол Fe/кг, составляет 25,0-30,0 мин. Это позволяет получить визуализацию васкуляризации опухолей грудной и брюшной областей у мышей и крыс при концентрациях от 0,02 до 0,05 ммол Fe/кг.
Васкулярнзацию опухолей и полупериод элиминации МН из плазмы при дозе 0,08 ммол Fe/кг определить не удается из-за высокой концентрации Fe.
Качественное определение МН у животных успешно проводят при концентрации Fе, непревышающей 0,05 ммол Fe/кг массы тела, по увеличению контраста МРТ-изображений в сравнении с контролем и по синему окрашиванию гистологических препаратов, приготовленных из биоптатов, после их обработки Берлинской лазурью (качественная реакция на Fe).
Количественное содержание МН в опухоли, органах, биологических жидкостях и тканях до концентрации Fe, непревышающей 0,05 ммол Fe/кг массы тела, определяют по уменьшению МРТ-сигнала протонов в сравнении с контролем. Сканирование проводят на магнитно-резонансном биоспектротомографе BIOSPEC ВС 70/30 USR. (Bruker) в режимах: Т1-взвешенное (TR/TE=500/15 мс), Т2-взвешенное (TR/TE=6000/63 мс) на основе спинового эха и Т3-взвешенное градиентное эхо (TR/TE=500/15 мс, угол поворота 15°).
Недостатки прототипа:
- при концентрации Fe в печени, превышающей 0,05 ммол Fe/кг ткани, на МР-томограммах наблюдаются искажения изображений в виде сливающихся темных пятен (артефакты), которые затрудняют количественное определение Fe;
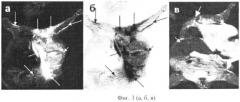
- на МР-томограммах внутренних органов наблюдают искажение изображений: слияние изображений легких и печени в общее темное пятно при повышении содержания МН, что объясняется высокой концентрацией Fe в печени (Фиг.3а, б, в);
- превышение содержания МН в печени, селезенке, легких и сердце приводит к подавлению слабых сигналов от метастазов сигналами от здоровых тканей и метастазы в этих органах не обнаруживаются;
- качественное определение Fe проводят на гистологических препаратах из биоптатов, подготовка которых требует более 24 часов;
- МРТ-исследования проводят на дорогостоящих сверхпроводящих магнитных томографах в специальных стационарных условиях.
Задачей изобретения является устранение указанных недостатков путем создания неинвазивного, информативного, доступного и безопасного способа качественного и количественного определения МН и оценки функций, которые МН могут выполнять в реальном времени у животных.
Указанная задача решается следующим образом:
- мышей весом 20-35 г или крыс весом 150-500 г с опухолями молочной железы размещают в неоднородном постоянном магнитном поле (НПМП) индукцией 0,2-7,0 Тл, градиент 0,01-0,35 Тл/см в опухоль и окружающие ткани вводят 0,1-1,0 мл 10-40% золя МН в виде наночастиц диаметром 10-900 нм, выдерживают 4 минуты и перемещают в переменные магнитные поля (ПеМП) электронно-сенсорного устройства, излучающего ПеМП, принимающего и регистрирующего отклики нелинейно намагниченных МН у животных (Фиг.1, 2а, б; 4, 5). Нелинейно намагниченные МН увеличивают отклик биологических тканей. Электронно-сенсорное сканирование опухоли проводят на устройстве "МСУ ИОФ РАН" в шести направлениях в режимах последовательного проецирования сенсора на ткани опухоли и исследуемые органы над и под исследуемыми объектами (опухоль, печень, почки, легкие, мочевой пузырь и др.) с выдержками длительностью от 2 до 120 секунд (Фиг.2а, б; 4, 5, 6а, б). В процессе сканирования сенсор излучает ПеМП и принимает на комбинаторных частотах отклик нелинейно намагниченных МН, расположенных в близлежащих биологических тканях. По величине регистрируемых компьютером откликов определяют с помощью калибровочных графиков содержание МН в опухоли, органах и тканях в порядке их сканирования в реальном времени (Фиг.7, 8). Для иммобилизации МН в опухоли используют постоянные магниты индукцией 0,2 Тл, сверхпроводящие магниты индукцией 4,0, 7,0 Тл, градиент 0,01 - 0,35 Тл/см и сверхпроводящий магнит индукцией 4,0 Тл, в теплом отверстии которого установлен концентратор магнитного потока (Фиг.9 а, б, 10).
Функции, которые МН могут выполнять, вычисляют по формуле (1):
Ф=МНопухоли/МНпечени, где
- Ф - функции, которые МН могут выполнять в реальном времени в организме животных;
- МНопухоли - содержание МН мг в опухоли;
- МНпечени - содержание МН мг в печени.
Результаты вычислений используют в процессах:
- диагностики (магнитно-резонансная томография);
- терапии (магнитогидродинамическая термохимиотерапия и индукционная магнитожидкостная гипертермия);
- направленной доставки лекарственных и диагностических средств (таргетинг);
- планирования по результатам электронно-сенсорного сканирования объемов термохимиотерапевтических и лучевых воздействий.
В процессе электронно-сенсорного сканирования животных с онкологическими заболеваниями, внимание акцентируют на опухолях, метастазах и органах РЭС со стороны живота и спины (Фиг.2, 4-6). Качественное и количественное определение нелинейно намагниченных МН и оценку динамики концентрации МН в кровотоке животного в реальном времени проводят по величине откликов, регистрируемых в средней части хвоста животного, через определенные промежутки времени. В зависимости от концентрации МН у животных они могут выполнять диагностическую или терапевтическую функции.
По величине откликов качественно определяют присутствие МН, содержащихся в опухоли и органах, в сравнении с контролем, не содержащим МН, при этом синее окрашивание биоптатов после их обработки Берлинской лазурью подтверждает присутствие МН.
В зависимости от величины градиента и конфигурации НПМП, приложенного к опухоли с целью иммобилизации МН в тканях опухоли, содержание МН в опухоли, органах и тканях животного изменяется (Фиг.9а,б,10). Пропорционально этому изменяется величина отношения МНопухоли/МНпечени и величины откликов опухоли, органов, биологических жидкостей и тканей. В зависимости от количества МН, регионарно введенного в опухоль НПМП, и его намагниченности насыщения (Ms) содержание МН в опухоли и в печени животного изменяется. Пропорционально этому изменяются величины откликов тканей опухоли, тканей печени и величины Ффункции по которым можно судить о функции, выполняемой МН в момент получения откликов. Ффункции≤1 соответствует использованию МН в качестве диагностического средства. Чем больше величины Ффункции, тем меньше побочное действие МН и благоприятнее ожидаемые результаты терапии (Таблицы 1-3).
При электронно-сенсорном сканировании опухоли и тела крысы до введения МН величина откликов не превышает фоновых значений (~5-12) и графически соответствует отсутствию МН у экспериментальных животных (Фиг.2а, б; 7, 8). После введения 0,1 мл 10% МН в полиглюкине в глазной синус самки крысы Вистар с опухолью молочной железы ее размещают в ПеМП электронно-сенсорного устройства. Сканирование опухоли проводят в шести направлениях верх и низ (большие стрелки), север, запад, юг, восток (маленькие стрелки. Фиг.2а, б). Тело животного сканируют в режимах последовательного взаимного проецирования сенсора с исследуемыми органами. В присутствии нелинейно намагниченных МН увеличивается магнитная восприимчивость биологических тканей и повышается их отклик. В процессе сканирования сенсор принимает отклики нелинейно намагниченных МН от опухоли ~12, печени ~190, селезенки ~150, и других органов, средние величины которых составляют ~31. Величины откликов используют формуле (1), по которой определяют величину Ффункции=0,06 которая указывает на повышение магнитной гетерогенности биологических тканей и увеличение контраста МРТ-изображений, что соответствует диагностической функции МН в реальном времени (Фиг.3а, 6, в).
Полученные данные обрабатывают статистически по стандартизованным критериям, за достоверные принимают различия при ρ<0,05 [14].
Прививку опухоли мышам и оценку полученных результатов проводят согласно рекомендациям по химиотерапии злокачественных опухолей [15].
30 самкам мышей C57B1/6j весом 18-21 г, в возрасте 6-10 недель, разводки вивария РОНЦ им Н.Н. Блохина РАМН, имплантируют под кожу правого первого соска аденокарциному молочной железы Ас 755, 1×106 клеток/мышь в стерильном 0,9% растворе хлорида натрия рН 7,4 в объеме 0,2 мл. Через 6-10 дней после прививки отбирают 28 мышей, размеры опухолей которых достигают 6-17 мм. Вычисляют объем каждой опухоли по формуле: V=0,5·(l·n2), где V - объем, l - длина, n2 - площадь опухоли. Объем опухолей составляет от 60 мм3 до 450 мм3. Мышей с привитыми опухолями делят на 6 групп: 1, 2, 3, 4, 5 и 6. Первая (контрольная) группа состоит их 8 мышей; 2, 3, 4, 5, 6 - опытные группы, состоящие из 4 мышей каждая.
Условия электронно-сенсорного качественного и количественного определения МН в организме самок мышей C57B1/6j с опухолями аденокарциномы молочной железы Ас 755
Мышей контрольной и опытных групп размещают в НПМП (Фиг.9а, б; 10). Мышам контрольной группы вводят в опухоль полиглюкин, мышам опытных групп вводят в опухоль МН в полиглюкине. Для иммобилизации МН в опухоли мышей выдерживают 4-6 минут в НПМП и перемещают в ПеМП электронно-сенсорного устройства. Отклики тканей у мышей первой (контрольной) группы качественно отрицательны. Их величины соответствуют фоновому уровню содержания МН, по которым на калибровочных графиках количество МН не определяется (Фиг.7, 8). Отклики органов мышей опытных групп выше фонового уровня, что указывает на присутствие МН. По их величинам на калибровочных графиках определяют содержание МН в граммах в опухоли и печени, и по формуле (1) оценивают функции (Ф), которые МН могут выполнять в реальном времени у животных (Фиг.7, 8).
Главные функции, которые МН могут выполнять у животных в реальном времени, - диагностика и терапия:
- при величинах Ф, меньших 1, МН могут выполнять диагностические функции;
- при величинах Ф, больших 1, МН могут выполнять терапевтические функции.
Пример 1. Первая (контрольная) группа
Мышам первой группы вводят 0,3 мл полиглюкина в опухоль и размещают их в НПМП концентратора магнитного потока, установленного в теплом отверстии сверхпроводящего магнита так, чтобы опухоль находилась в поле индукцией 4,0 Тл, градиент 0,2 Тл/см (Фиг.9а, б, 10). Выдерживают 4 минуты, перемещают из НПМП в ПеМП электронно-сенсорного устройства. Сканирование опухоли проводят в шести направлениях: верх и низ (большие стрелки), север, запад, юг, восток (маленькие стрелки) в режимах последовательного взаимного проецирования сенсора с тканями опухоли и исследуемых органов (Фиг.1а, б, 5, 6а, б). В процессе сканирования сенсор принимает от тканей опухоли и других органов отклики фонового уровня, равные ~5-12. По этим величинам на калибровочных графиках определяют отсутствие МН в опухоли, органах, биологических жидкостях и тканях (Фиг.7, 8). Отсутствие МН у животного подтверждается также отрицательными результатами теста на Fe при обработке биоптатов раствором Берлинской лазури.
Пример 2. Зависимость величины откликов опухоли аденокарциномы молочной железы Ас 755, органов и тканей на введение МН в опухоль у мышей C57B1/6j от величины градиента НПМП
Мышам второй группы вводят 0,3 мл 40% МН в полиглюкине в опухоль и размещают в НПМП так, чтобы опухоль находилась в поле индукцией 0,2 Тл, градиент 0,01 Тл/см. Выдерживают 4 минуты и перемещают из НПМП в ПеМП электронно-сенсорного устройства. Сканирование опухоли проводят в шести направлениях: верх и низ, север, запад, юг, восток. Тело животного сканируют в режимах последовательного взаимного проецирования с задержками сенсора на исследуемых органах. В процессе сканирования сенсор принимает от опухоли отклик повышенного уровня ~380, от печени отклик - ~43. По этим величинам определяют терапевтические функции МН, а на калибровочном графике определяют содержание МН в граммах в тканях опухоли и здоровых тканях, распределение и способность МН перемагничиваться и нагреваться в ПеМП в реальном времени (Фиг.7).
Пример 3. Зависимость величины откликов опухоли аденокарциномы молочной железы Ас 755 и внутренних органов от величины градиента НПМП при введении МН в опухоль у мышей C57B1/6j
Мышам третьей группы вводят 0,3 мл 40% МН в полиглюкине в опухоль и размещают в НПМП так, чтобы опухоль находилась в поле индукцией 0,7 Тл, градиент 0,035 Тл/см. Выдерживают 4 минуты, перемещают из НПМП в ПеМП электронно-сенсорного устройства. Тело сканируют в режимах последовательного взаимного проецирования поверхности сенсора с опухолью и исследуемыми органами. Сканирование опухоли проводят в шести направлениях верх и низ (большие стрелки), север, запад, юг, восток (маленькие стрелки) (Фиг.4). В процессе сканирования сенсор принимает отклик МН повышенного уровня от опухоли ~550, от печени - ~40. По этим величинам на калибровочном графике определяют содержание, распределение в тканях и функциональное состояние МН в реальном времени (Фиг.7).
Пример 4. Зависимость величины откликов опухоли аденокарциномы молочной железы Ас 755, органов и тканей от величины градиента НПМП при введении МН в опухолевые ткани у мышей C57B1/6j
Мышам четвертой группы вводят 0,3 мл 40% МН в полиглюкине в опухоль и размещают в НПМП так, чтобы опухоль находилась в поле индукцией 4,0 Тл, градиент 0,2 Тл/см (Фиг.10), выдерживают 4 минуты, перемещают из НПМП в ПеМП электронно-сенсорного устройства. Тело животного сканируют в режимах последовательного взаимного проецирования поверхности сенсора с опухолью и исследуемыми органами. Сканирование опухоли проводят в шести направлениях: верх, низ, север, запад, юг, восток. В процессе сканирования сенсор в течение 2-120 секунд принимает отклик МН повышенного уровня от опухоли ~750, от печени - ~33. По этим величинам на калибровочном графике определяют содержание, распределение в тканях и функциональное состояние МН в реальном времени (Фиг.7).
Пример 5. Зависимость величины откликов опухоли у мышей C57B1/6j с аденокарциномой молочной железы Ас 755, органов и тканей при введении МН в опухоль от величины градиента НПМП
Мышам пятой группы вводят 0,3 мл 40% МН в полиглюкине в опухоль и размещают в НПМП сверхпроводящей катушки индукцией 4 Тл без концентратора магнитного потока, выдерживают 4 минуты, перемещают из НПМП в ПеМП электронно-сенсорного устройства и сканируют тело в режимах последовательного взаимного проецирования поверхности сенсора с опухолью и исследуемыми органами. Сканирование опухоли проводят в шести направлениях: верх, низ, север, запад, юг, восток. В процессе сканирования сенсор в течение 2-120 секунд принимает отклик МН повышенного уровня от опухоли - ~750, от печени - ~28. По этим величинам на калибровочном графике определяют содержание, распределение в тканях и функциональное состояние МН в реальном времени (Фиг.8).
Пример 6. Зависимость величины откликов опухоли мышей C57B1/6j с аденокарциномой молочной железы Ас 755, органов и тканей при введении МН в опухоль от величины и конфигурации НПМП
Мышам шестой группы вводят 0,3 мл 40% МН в полиглюкине в опухоль и размещают в НПМП сверхпроводящей магнитной системы индукцией 7 Тл, выдерживают 4 минуты, перемещают из НПМП в ПеМП электронно-сенсорного устройства и сканируют тело в режимах последовательного взаимного проецирования поверхности сенсора с опухолью и исследуемыми органами (Фиг.9б). Сканирование опухоли проводят в шести направлениях: верх, низ, север, запад, юг, восток. В процессе сканирования сенсор в течение 2-120 секунд принимает отклик МН повышенного уровня от опухоли - ~1250, от печени - ~18. По этим величинам на калибровочном графике определяют содержание, распределение в тканях и функциональное состояние МН в реальном времени (Фиг.8).
Для подтверждения результатов количественного определения МН в опухоли, и в органах РЭС проводят сравнение данных электронно-сенсорных определений с результатами гистопатологических исследований [1, 8], фотометрических [10], токсикологических [11] и весовых определений [12]. Среднее содержание МН в 3 биоптатах, взятых из определенных частей опухоли сразу после количественного определения МН по заявленному способу, соответствует количеству МН (г/см3), введенного в опухоль.
Для получения воспроизводимых результатов в процессе количественного определения МН в тканях опухоли и в органах РЭС они должны находиться на том же расстоянии от рабочей поверхности сенсора, как и в предыдущем определении. Лучшая воспроизводимость результатов количественного определение МН у животных достигается при проведении электронно-сенсорного сканирования сразу после перемещения животного из НПМП в ПеМП электронного сенсора.
Примеры использования результатов электронно-сенсорного количественного определения нелинейно намагниченных МН в организме животных
Перед проведением магнитогидродинамической и регионарной магнитожидкостной индукционной термохимиотерапии основной задачей является адекватное количественное определение МН в опухоли, печени, лимфатических узлах и других органах РЭС.
Для достижения высокой эффективности термохимиотерапии и низкого побочного действия МН на здоровые ткани определяют:
- содержание МН в опухолевых тканях (МНопухоли);
- содержание МН в тканях печени (МНпечени) и отношение МНопухоли/МНпечени.
При внутриартериальном, внутривенном и внутрибрюшинном введении золей МН проникновение наночастиц в опухоль и метастазы затруднено из-за повышенного внутриопухолевого давления и атипичного строения глубоких сосудов, питающих опухолевые ткани. В этих случаях наночастицы концентрируются в первую очередь в органах РЭС, в здоровых тканях и капсуле, окружающей опухоль. Ткани капсулы, богатые кровеносными сосудами, хорошо снабжаемыми кровью, расположены по перетуморальному валу опухоли, контраст которого усиливают МН, находящиеся в сосудах. На МР-томограммах опухоли, в этом случае, в виде темного кольца изображен слой капсулы, окружающий светлое ядро опухолевых тканей. Опухолевые ткани и метастазы, имеющие недостаточный кровоток, длительное время остаются светлыми из-за медленной диффузии МН (Фиг.3 а, в). Концентрация МН в опухоли и метастазах повышается значительно медленнее, чем в здоровых тканях. Это ведет к увеличению разности между величинами откликов здоровых и опухолевых тканей и уменьшению соотношения МНопухоли/МНпечени.
В процессе внутрнопухолевого введения золей МН концентрация наночастиц в опухолевых тканях повышается и достигает максимального уровня в конце введения МН. Это ведет к увеличению разности между величинами откликов опухолевых и здоровых тканей. В связи с этим соотношение МНопухоли/МНпечени увеличивается до максимума. В этот момент повышение концентрации наночастиц в опухолевых тканях прекращается, начинается ее уменьшение с пропорциональным повышением их концентрации в здоровых тканях за счет диффузии. Это ведет к уменьшению магнитной гетерогенности органов и тканей организма и к уменьшению разности между величинами откликов опухолевых и здоровых тканей. В связи с этим соотношение МНопухоли/МНпечени постепенно уменьшится.
Таблица 1. Изменение соотношения МНопухоли/МНпечени при неинвазивном количественном определении МН с намагниченностью насыщения золя МН Ms 4,0 кА/м и 7,8 кА/м через 6 минут после внутриопухолевого введения 0,1 мл 40% золя МН в НПМП мышам C57B1/6j с опухолями Ас 755 объемом ~300 мм3.
Таблица 2. Изменение соотношения МНопухоли/МНпечени при неинвазивном количественном определении МН с намагниченностью насыщения золя МН Ms 4,0 кА/м и 7,8 кА/м через 6 минут после внутриопухолевого введения 0,3 мл 40% золя МН в НПМП мышам C57B1/6j с опухолями Ас 755 объемом ~300 мм3.
Таблица 3. Изменение соотношения МНопухоли/МНпечени при неинвазивном количественном определении МН с намагниченностью насыщения золя МН Ms 4,0 кА/м и 7,8 кА/м через 6 минут после внутриопухолевого введения 0,6 мл 40% золя МН в НПМП мышам C571/6j с опухолями Ас 755 объемом ~300 мм3.
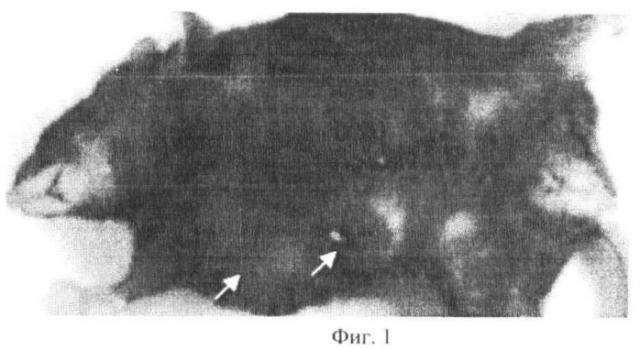
Фиг.1. Аденокарцинома молочной железы Ас 755 у самки мыши C57B1/6j на 13 день после инокуляции 106 клеток Ас 755 в область первого правого соска: бугристая подкожная опухоль объемом более 500 мм3 в области первого и второго сосков молочной железы (стрелки).
Фиг.2 (а, б).
(а) Крыса Вистар весом 350 г со спонтанной опухолью молочной железы (наркоз, внутрибрюшинное введение золетила 8 мг/кг, Zoletil 100, Virbac), введение в глазной синус 0,1 мл 10% золя МН в полиглюкине, (стрелки - направления электронно-сенсорного сканирования);
(б) крыса Вистар весом 400 г со спонтанной опухолью молочной железы после многократных введений в глазной синус 0,1 мл 10% золя МН в полиглюкине, который обладает низкой токсичностью ЛД50 3-5 г/кг массы тела животного.
Фиг.3 (а, б, в). МРТ-изображения аденокарциномы молочной железы, контрастированные МН; (а) через 15-30 минут после внутривенного введения МН 100 мг/кг массы тела животного. На МР-томограммах видна структура первичной опухоли (маленькая стрелка) и инвазия по лимфатической системе в здоровые ткани (большие стрелки). Изображения легких и печени сливаются, метастазы не обнаруживаются; (б) негатив, подтверждающий слияние МРТ-изображений печени и легких, инвазия в органы брюшной полости, богатые лимфатическими сосудами; (в) пути инвазии опухоли органов брюшной полости (стрелки).
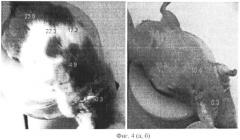
Фиг.4 (а, б). Результаты электронно-сенсорного сканирования мышей, (а) со стороны спины, (б) со стороны живота. Цифры соответствуют величинам откликов внутренних органов, расположенных в проекции к поверхности электронного сенсора в момент сканирования.
Фиг.5. Крыса Вистар весом 450 г со спонтанной опухолью молочной железы (наркоз, внутрибрюшинное введение золетила 20 мг/кг, Zoletil 100, Virbac), внутриопухолевое введение 1,0 мл 40% золя МН в полиглюкине (стрелки - направления электронно-сенсорного сканирования).
Фиг.6. Крыса Вистар весом 400 г со спонтанной опухолью молочной железы (наркоз, внутрибрюшинное введение золетила 20 мг/кг, Zoletil 100, Virbac), внутриопухолевое введение 1,0 мл 40% золя МН в полиглюкине (стрелки - направления электронно-сенсорного сканирования).
Фиг.7. Калибровочный график магнитоуправляемого нанопрепарата (МН)№356.
Фиг.8. Калибровочный график магнитоуправляемого нанопрепарата (МН) №365.
Фиг.9 (а, б). (а) Сверхпроводящий магнит индукцией 4 Тл, теплое отверстие которого снабжено концентратором магнитного потока (стрелка); (б) теплое отверстие сверхпроводящей магнитной системы индукцией 7 Тл снабжено капсулой для размещения животного (стрелка).
Фиг.10. Крыса Вистар весом 350 г с опухолью (стрелка) в неоднородном постоянном магнитном поле сверхпроводящего магнита индукцией 4 Тл, теплое отверстие которого снабжено концентратором магнитного потока (наркоз, внутрибрюшинное введение гексенала 8 мг/кг), внутриопухолевое введение 1,0 мл 40% золя МН в полиглюкине.
Технический результат заявленного способа состоит в неинвазивном качественном и количественном определении МН и оценки функций, которые могут выполнять МН в реальном времени у экспериментальных животных.
Заявленный способ позволяет качественно и количественно оценить:
- распределение МН в организме животных;
- эффективность концентрации и иммобилизации МН в опухоли в зависимости от способа их введения и может использоваться в диагностических и терапевтических целях.
Источники информации
1. N.A.Brusentsov, T.N.Brusentsova, et al., Magnetohydrodinamic thermochemotherapy and MR1 of mause tumors. J. Magn. Magn. Mat. 311, 176-180 (2007).
2. T.N.Brusentsova, N.A.Brusentsov, V.D.Kuznetsov, et al. Synthesis and investigation of magnetic properties of Gd-substituted Mn-Zn ferrite nanoparticles as a potential low-Tc agent for Magnetic Fluid Hyperthermia. J. Mag. Magn. Mat. 253,298-302 (2005).
3. T.N.Brusentsova, V.D.Kuznetsov, Synthesis and investigation of magnetic properties of substituted ferrite nanoparticles of spinel system. J. Magn. Magn. Mat. 311, (2007) 22-25.
4. Н.А.Брусенцов, Возможности и перспективы применения транспортных и магнитоуправляемых депо-форм противоопухолевых препаратов. Ж. Всес.Хим. О. им. Д.И.Менделеева 32(5), 562-569 (1987).
5. Н.А.Брусенцов, В.В.Лыков, Управляемые композиционные материалы в биологии и медицине, Ж. Всес.Хим. О. им. Д И.Менделеева 34(5), 566-572 (1989).
6. Н.А.Брусенцов, Н.А.Лесная, З.П.Софьина, М.Н.Преображенская, В.М.Бухман, Фаго цитируемые депо-формы противоопухолевых препаратов и метаболитов обмена нуклеиновых кислот. Экспериментальная онкология, 1983, T.5,N 1,55-57.
7. Н.А.Брусенцов, М.Н.Преображенская, А.Д.Шумакова. Т.Г.Николаева Я.В.Добрынин, Эндоцитируемые формы противоопухолевых антибиотиков. Экспериментальная онкология, 1983, т.5, N1 с.79-81.
8. Н.А.Брусенцов, Т.Н.Брусенцова, Е.Ю.Филинова, Ю.А.Пирогов, Д.А.Куприянов, А.И.Дубина и др., Магнитогидродинамическая термохимиотерапия злокачественных опухолей нанопрепаратами с магнитно-резонансным мониторингом, Хим. - фарм. Ж. 42 (4), 3-10 (2008).
9. N.A.Brusentsov, T.N.Brusentsova, A.Yu. Baryshnikov et al., Magnetic carriers biological preparations for diagnostics and therapy of oncological diseases, in: Biocatalytic Technology and Nanotechnology, G.E. Zaikov, (Eds) Nova Science Publishers, Inc., (2004), pp.59-63.
10. H.A.Брусенцов, О.П.Анашкин, В.В.Лыков, В.Е.Кейлин, Н.А.Черноплеков, Синтез и свойства магнитоуправляемых противоопухолевых соединений, "Вопросы атомной науки и техники", сер. общая ядерная физика, 1987, с.52, 53.
11. Н.А.Брусенцов, М.Н.Преображенская, А.В.Иванов, Л.А.Севастьянова, А.Б.Сыркин, Состав для определения параметров магнитного поля. Авт.свид. СССР N946546, Бюлл. нзобр. N28,0.21,1982.
12. П.И.Никитин, Н.А.Брусенцов, Т.И.Ксеневич, Т.Н.Брусенцова, М.П.Никитин, Е.Р.Вольтер. Определение магнитовосприимчивых наноматериалов в органах и тканях экспериментальных животных. Фундаментальные и прикладные проблемы медицины и биологии в опытах на обезьянах (Сателитный симпозиум). Материалы международной научной конференции 19-22 сентября 2007 г. Сочи-Адлер, с.16-25
13. Cohen D., Measurements of the magnetic fields produced by the human heart, brain, and lungs. IEEE Transactions on magnetics, v. MAG-11, # 2, 1975,694-700.
14. О.Ю.Реброва, Статистический анализ медицинских данных, Медиа Сфера, Москва (2002). 15. Л.Ф. Ларионов. Химиотерапия злокачественных опухолей, Мед. Лит.М. 1962.
| Таблица 1 | ||||
| СПОСОБ НЕИНВАЗИВНОГО КАЧЕСТВЕННОГО И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МАГНИТОУПРАВЛЯЕМЫХ НАНОПРЕПАРАТОВ И ОЦЕНКИ ИХ ФУНКЦИЙ В РЕАЛЬНОМ ВРЕМЕНИ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | ||||
| №№ Оп. | Намагничен насыщен (MS кА/м) | Индукция НПМП (Тл) | Градиент НПМП (Тл/см) | МНопух/МНпечень (раз) |
| 1 | 4 | 0,2 | 0,01 | 15 |
| 2 | 4 | 0,7 | 0,03 | 45 |
| 3 | 4 | 3,0 | 0,12 | 180 |
| 4 | 4 | 4,0 | 0,18 | 270 |
| 5 | 4 | 4,0+ | 0,20 | 300 |
| концентратор | ||||
| магнитного | ||||
| потока | ||||
| 6 | 4 | 7,0 | 0,30 | 450 |
| 7 | 7,8 | 0,2 | 0,01 | 30 |
| 8 | 7,8 | 0,7 | 0,03 | 90 |
| 9 | 7,8 | 3,0 | 0,12 | 360 |
| 10 | 7,8 | 4,0 | 0,18 | 540 |
| 11 | 7,8 | 4.0+ | 0,20 | 600 |
| концентратор | ||||
| магнитного | ||||
| потока | ||||
| 12 | 7,8 | 7,0 | 0,30 | 900 |
| Таблица 2 | ||||
| СПОСОБ НЕИНВАЗИВНОГО КАЧЕСТВЕННОГО И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МАГНИТОУПРАВЛЯЕМЫХ НАНОПРЕПАРАТОВ И ОЦЕНКИ ИХ ФУНКЦИЙ В РЕАЛЬНОМ ВРЕМЕНИ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | ||||
| №№ Оп | Намагничен насыщен (MS кА/м) | Индукция НПМП (Тл) | Градиент НПМП (Тл/см) | МНопух/МНпечени (раз) |
| 1 | 4 | 0,2 | 0,01 | 10 |
| 2 | 4 | 0,7 | 0,03 | 30 |
| 3 | 4 | 3,0 | 0,12 | 120 |
| 4 | 4 | 4,0 | 0,18 | 180 |
| 5 | 4 | 4,0+ | 0,20 | 200 |
| концентратор | ||||
| магнитного | ||||
| потока | ||||
| 6 | 4 | 7,0 | 0,30 | 300 |
| 7 | 7,8 | 0,2 | 0,01 | 20 |
| 8 | 7,8 | 0,7 | 0,03 | 60 |
| 9 | 7,8 | 3,0 | 0,12 | 240 |
| 10 | 7,8 | 4,0 | 0,18 | 360 |
| 11 | 7,8 | 4.0+ | 0,20 | 400 |
| концентратор | ||||
| магнитного | ||||
| потока | ||||
| 12 | 7,8 | 7,0 | 0,30 | 600 |
| Таблица 3 | ||||
| СПОСОБ НЕИНВАЗИВНОГО КАЧЕСТВЕННОГО И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МАГНИТОУПРАВЛЯЕМЫХ НАНОПРЕПАРАТОВ И ОЦЕНКИ ИХ ФУНКЦИЙ В РЕАЛЬНОМ ВРЕМЕНИ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | ||||
| №№ Оп | Намагничен насыщен (MS кА/м) | Индукция НПМП (Тл) | Градиент НПМП (Тл/см) | МНопух/МНпечени (раз) |
| 1 | 4 | 0,2 | 0,01 | 7 |
| 2 | 4 | 0,7 | 0,03 | 22 |
| 3 | 4 | 3,0 | 0,12 | 90 |
| 4 | 4 | 4,0 | 0,18 | 130 |
| 5 | 4 | 4.0+концентратор магнитного потока | 0,20 | 150 |
| 6 | 4 | 7,0 | 0,30 | 220 |
| 7 | 7,8 | 0,2 | 0,01 | 15 |
| 8 | 7,8 | 0,7 | 0,03 | 45 |
| 9 | 7,8 | 3,0 | 0,12 | 180 |
| 10 | 7,8 | 4,0 | 0,18 | 270 |
| 11 | 7,8 | 4,0+концентратор магнитного потока | 0,20 | 300 |
| 12 | 7,8 | 7,0 | 0,30 | 450 |
Способ неинвазивного качественного и количественного определения нелинейно намагниченных магнитоуправляемых нанопрепаратов (МН), введенных в организм экспериментальных животных, и оценки функций, которые МН могут выполнять в реальном времени, по изменению их откликов на воздействие переменными магнитными полями в процессе электронно-сенсорного сканирования тела животного на устройстве, генерирующем и излучающем переменные магнитные поля, принимающем и регистрирующем отклики МН, находящихся в опухоли и печени, по величине которых определяют присутствие и содержание МН у экспериментальных животных, функции МН определяют из отношения содержания МН в опухоли к содержанию МН в печени по формуле:Ф=МНопухоли/МНпечени, где- Ф - функции, которые МН могут выполнять в организме экспериментальных животных в реальном времени;- МНопухоли - содержание МН мг в опухолевых тканях;- МНпечени - содержание МН мг в тканях печени;- при Ф≤1 - диагностические функции;- при Ф>1 - терапевтические функции.