Моногидрохлориды и натриевые соли таутомерных 5(6)-алкоксикарбониламинопроизводных 2-арил-1-гидроксибензимидазол-3-оксида с высокой противогрибковой активностью и способ их получения
Иллюстрации
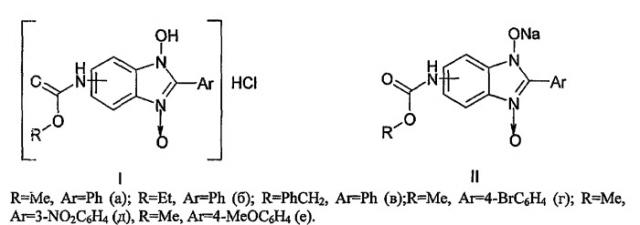
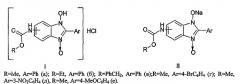
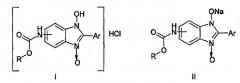
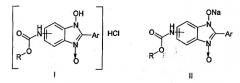
Показать всеНастоящее изобретение относится к противогрибковым средствам, которые представляют собой 5(6)-алкоксикарбоксаминопроизводных 2-арил-1-гидроксибензимидазол-3-оксида формул I, II, где R-Me, Ar=Ph (a); R=Et, Ar=Ph (б); R-PhCH2, Ar=Ph (в); R=Me, Ar=4-BrC6H4 (г); R=Me, Ar=3-NO2C6H4 (д), R=Me, Ar=4-МеОС6Н4 (е). Также изобретение относится к способу получения указанных противогрибковых средств. Технический результат: получены новые противогрибковые средства на основе соединения формул I, II, обладающие высокой фунгицидной и фунгистатической активностью в отношении Microsporum canis, Trichophyton rubrum, Candida albicans. 3 н.п. ф-лы, 1 табл.
Реферат
Изобретение относится к области химии, точнее касается способа получения моногидрохлоридов и натриевых солей таутомерных 5(6)-алкоксикарбонилпроизводных бензимидазол-3-гидроксида, проявляющих высокую противогрибковую активность, имеющих формулы I, II:
Поиск малотоксичных соединений с противогрибковой активностью является актуальной проблемой.
/1/ Производные карбаматов обладают широким спектром противогрибковой активности [1].
/2/ Проблема лечения грибковых поражений кожи и ее дериватов остается актуальной и в настоящее время, что обусловлено способностью микроорганизмов приобретать резистентность в отношении противогрибковых препаратов. Наибольшее распространение среди грибковых поражений кожи имеет микроспория, занимающая второе место после микозов стоп [2]. Микроспория в подавляющем большинстве случаев вызывается зоофильным видом возбудителя Microsporum canis. Заболевание характеризуется поражением кожи, волос, изредка - ногтей. Актуальность проблемы зоонозной микроспории вытекает из ее чрезвычайно высокой распространенности и контагиозности, особенно у детей; а также высокой устойчивостью возбудителя к факторам внешней среды [3]. Для местного лечения микроспории и других дерматофитий в настоящее время наибольшее распространение получили следующие препараты: канестен, микозолон, микоспор, мифунгар, низорал, нитрофунгин, эконазол. Эффективность этих препаратов зависит, главным образом, от локализации грибкового процесса и степени чувствительности возбудителя к лекарственному веществу.
/3/ Целью изобретения является способ получения моногидрохлоридов и натриевых солей таутомерных 5(6)-алкоксикарбонилпроизводных 2-арил-1-гидроксибензимидазол-3-оксида, активных в отношении Microsporvm canis, Trichophyton rubrum, Candida albicans.
Поставленная цель достигается соединениями формул I, II.
Моногидрохлориды таутомерных 5(6)-алкоксикарбоксаминопроизводных 2-арил-1-гидроксибензимидазол-3-оксида (I) получают взаимодействием алкил-N-(n-нитрозофенил)карбаматов с N-оксидами бензонитрилов в системе растворителей метиленхлорид - диэтиловый эфир при 0 ÷ -1°С в течение 48 ч, фильтрованием, обработкой образующихся таутомерных 5(6)-алкоксикарбонилпроизводных 2-арил-1-гидроксибензимидазол-3-оксида в диоксане эфирным раствором хлороводорода при 20°С в течение 8 ч и фильтрованием образующихся кристаллических продуктов.
Натриевые соли (II) получают путем обработки таутомерных 5(6)-алкоксикарбонилпроизводных 2-арил-1 -гидроксибензимидазол-3-оксида эквимольным количеством водного раствора гидроксида натрия при 20°С, удаления растворителя в вакууме, сушки на воздухе и переосаждения бензолом из ДМФА.
Образцы солей таутомерных 5(6)-алкоксикарбоксаминопроизводных 2-арил-1-гидроксибензимидазол-3-оксида (I, II) стабильны и сохраняют свои свойства в течение трех лет.
Изучение противогрибковой активности проводилось в соответствии со стандартом М27 методом серийного разведения NCCLS [4,5] в плотной и жидкой среде Сабуро [6]. К серийно разведенному препарату в пробирке добавляли взвесь микроорганизма и определяли минимальную концентрацию вещества, способную задерживать рост тест-культуры. В качестве тест-культур использовали микроорганизмы Microsporum canis, Trichophyton rubrum, Candida albicans.
Пробирки термостатировали при 24±3°С в течение 7 суток (Candida albicans) и 30 суток (Microsporum canis, Trichophyton rubrum). С целью определения характера действия препарата (фунгистатическое - ФС) или (фунгицидное - ФЦ) производили высевы на чашки Петри с суслом-агаром из всех пробирок. Чашки помещали в термостат при 24±3°С в течение 7 суток (Candida albicans) и 30 суток (Microsporum canis, Trichophyton rubrum).
Острую суточную токсичность (ЛД50) соединений определяли in vivo на белых беспородных мышах весом 20-25 г при внутрибрюшинном введении в трех дозах. Группы животных были составлены из шести особей, продолжительность наблюдения 6 суток. Перед опытом животные находились в одинаковых условиях кормления и содержания в течение 10 дней. При определении острой суточной токсичности доза соединений составляла от 400 до 5000 мг/мл. Токсичность солей была определена in vivo на белых беспородных мышах весом 20-25 г, при внутрибрюшном введении в трех дозах и составила 840-890 мг/кг.
Противогрибковые испытания in vitro (протокол испытаний от 08.06.2009 г. в ГОУ ВПО АГМА) показали, что моногидрохлориды и натриевые соли таутомерных 5(6)-алкоксикарбоксамидопроизводных 2-арил-1-гидроксибензимидазол-3-оксида (I, II) характеризуются высокой противогрибковой активностью в отношении Candida albicans, Microsporum canis и Trichophyton rubrum.
Результаты подвергали статистической обработке с использованием t-критерия Стьюдента и представлены в таблице.
| Таблица | ||||
| Противогрибковая активность моногидрохлоридов и натриевых солей таутомерных 5(6)-алкоксикарбоксамидопроизводных 2-арил-1-гидроксибензимндазол-3-оксида | ||||
| Соединение | ЛД50, мг/кг | Концентрация, мкг/мл* | ||
| Microsporum canis | Trichophyton rubrum | Candida albicans | ||
| Ia | 890 | - | ||
| IIa | 850 | |||
| Iб | 865 | - | ||
| IIб | 840 | - | ||
| Iв | 870 | - | ||
| IIв | 850 | |||
| Iг | 875 | - | - | |
| IIг | 860 | - | ||
| Iд | 785 | - | - | |
| IIд | 740 | |||
| IIe | 850 | |||
| эконазол | 462 | |||
| * В числителе - фунгистатическое действие, в знаменателе - фунгицидное действие.** Различия между повторами достоверны при р=0,95. |
Сущность изобретения иллюстрируется следующими примерами.
Пример 1. 1-Гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксид. К раствору 0.83 г (5.2 ммоль) хлорангидрида фенилгидроксамовой кислоты в 20 мл абсолютного диэтилового эфира при энергичном перемешивании и при температуре - 5°С прибавляют 0.5 г триэтиламина в 10 мл абсолютного диэтилового эфира. Через 10 мин раствор быстро отфильтровывают от осадка гидрохлорида триэтиламина и по каплям при охлаждении до 0 ÷ -1°С прибавляют к раствору 0.9 г (5 ммоль) метил-N-(n-нитрозофенил)карбамата в 20 мл метиленхлорида. Через 48 ч осадок отфильтровывают, промывают на фильтре 15 мл диэтилового эфира и очищают растворением в 5%-ном водном растворе NaOH и пропусканием CO2 до слабокислой реакции среды.. Получают 1.36 г (68%) 1-гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксида, белый порошок, т.пл. 232-233°С (с разложением). ИК спектр, ν, см-1: 3300 (NH, ОН), 1730 (С=O), 1635 (C=N), 1625-1565 (), 1250 (N→O). Найдено, %: С 45.48; Н 3.06; N 10.94. C15H13N3O4. Вычислено, %: С 45.11; Н 3.26; N 10.53.
Моногидрохлорид 1-гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксида (Ia). К 1 г (3.3 ммоль) 1-гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксида в 10 мл диоксана добавляют 20 мл диэтилового эфира, насыщенного сухим хлороводородом, выдерживают смесь в течение ночи, образовавшийся многидрохлорид отфильтровывают и сушат в вакуум-эксикаторе в течение 3-х часов. Получают 1.07 г (95%) моногидрохлорида (1а) в виде белого порошка, т.пл. 223-227°С. Найдено, %: С 53.49; Н 3.97; N 12.33. C15H14ClN3O4. Вычислено, %: С 53.65; Н 4.17; N12.52.
Натриевая соль 1-гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксида (IIа). К 0.87 г (2.9 ммоль) 1-гидрокси-5(6)-метоксикарбониламино-2-фенилбензимидазол-3-оксида при 20°С прибавляют 0.12 г (2.9 ммоль) гидроксида натрия в 30 мл воды и перемешивают до полного растворения органического соединения. После удаления растворителя в вакууме, сушки на воздухе и переосаждения бензолом из ДМФА получают 0.92 г (98%) соли IIa, т. разл. 187-190°С. Найдено, %: С 55.91; Н 3.80; N 12.94. C15H12N3NaO4. Вычислено, %: С 56.08; Н 3.74; N 13.08.
По аналогичной методике получены другие моногидрохлориды и натриевые соли 1-гидрокси-5(6)-алкоксикарбониламино-2-арилбензимидазол-3-оксида.
Пример 2. 1-Гидрокси-5(6)-этоксикарбониламино-2-фенилбензимидазол-3-оксид. Выход 74%, белый порошок, т.пл. 212-213° (с разложением). Спектр ЯМР 1Н, (ДМСО-d6), δ, м.д.: 9.70 с (1Н, N-OH), 8.23, 8.15, 8.02, 7.21 д (2Hаром., J 8 Гц), 7.90, 7.80 с (Н4), 7.68-7.34 м (5Hаром., NH), 4.20 к (2Н, CO2 CH 2CH3, J 6.4 Гц), 1.31 т (3Н, Me). ИК спектр, ν, см-1: 3300 (NH, ОН), 1725 (C=O), 1635 (C=N), 1610-1525 (С=С, ), 1250 (N→O). Найдено, %: С 61.09; Н 4.82; N 13.37. C16H15N3O4. Вычислено, %: С 61.34; Н 4.79; N 13.42.
Моногидрохлорид 1-гидрокси-5(6)-этоксикарбониламино-2-фенилбензимидазол-3-оксида (Iб), выход 94%, белый порошок, т.пл. 226-227°С. Найдено, %: С 55.02; Н 4.68; N 11.72. C16H17ClN3O4. Вычислено, %: С 54.78; Н 4.85; N11.98.
Натриевая соль (IIб), выход 86%, белый порошок, т. разл. 189-190°С. Найдено, %: С 56.98; Н 4.08; N 12.37. C16H14N3NaO4. Вычислено, %: С 57.31; Н 4.18; N12.54.
Пример 3. 1-Гидрокси-5(6)-бензилоксикарбониламино-2-фенилбензимидазол-3-оксид. Выход 76%, белый порошок, т.пл. 217-218°С (с разложением). ИК спектр, ν, см-1: 3310 (NH, ОН), 1725 (С=O), 1635 (C=N), 1610-1515 (С=С, ), 1250 (N→O). Найдено, %: С 67.02; Н 4.64; N 10.95. C21H17N3O4. Вычислено, %: С 67.20; Н 4.53; N 11.20.
Моногидрохлорид (Iв), выход 85%, белый порошок, т.пл. 225-228°С. Найдено, %: С 60.99; Н 4.42; N 10.03. C21H18ClN3O4. Вычислено, %: С 61.24; Н 4.37; N10.21.
Натриевая соль (IIв), выход 92%, белый порошок, т. разл. 186-188°С. Найдено, %: С 63.62; Н 3.87; N 10.26. C21H16N3NaO4. Вычислено, %: С 63.48; Н 4.03; N10.58.
Пример 4. 2-(4-Бромфенил)-1-гидрокси-5(6)-метоксикарбониламинобензимидазол-3-оксид. Выход 72%, порошок слегка желтоватого цвета, т.пл. 242-244°С (с разложением). ИК спектр, ν, см-1: 3320 (NH, ОН), 1730 (СО), 1635 (C=N), 1610-1535 (С=С, ), 1250 (N→O). Найдено, %: С 47.31; Н 3.20; N 10.90. C15H12BrN3O4. Вычислено, %: С 47.62; H 3.18; N 11.11.
Моногидрохлорид (Iг), выход 93%, почти белый порошок, т.пл. 250-254°С. Найдено, %: С 43.61; Н 2.97; N 10.05. C15H13BrClN3O4. Вычислено, %: С 43.43; Н 3.14; N10.13.
Натриевая соль (IIг), выход 94%, слегка желтого цвета порошок, т. разл. 191-193°С. Найдено, %: С 44.81; Н 2.38; N 10.27. C15H11BrN3NaO4. Вычислено, %: С 45.00; Н 2.75; N 10.50.
Пример 5. 1-Гидрокси-5(6)-метоксикарбониламино-2-(3-нитрофенил)бензимидазол-3-оксид. Выход 64%, порошок светло-желтого цвета, т.пл. 222-224°С (с разложением). ИК спектр, ν, см-1: 3260 (NH, ОН), 1735 (С=O), 1630 (C=N), 1620-1560 (С=С, ), 1530, 1355 (NO2), 1250 (N→O). Найдено, %: С 52.07; Н 3.71; N 16.10. C15H12N4O6. Вычислено, %: С 52.33; Н 3.49; N 16.28.
Моногидрохлорид (Iд), выход 86%, слегка желтоватый порошок, т.пл. 237-240°С. Найдено, %: С 45.32; Н 3.16; N 14.09. C15H13ClN4O6. Вычислено, %: С 45.63; Н 3.30; N 14.20.
Натриевая соль (IIд), выход 85%, порошок светло-желтого цвета, т. разл. 179-181°С. Найдено, %: С 48.97; Н 2.95; N 15.27. C15H11N4NaO6. Вычислено, %: С 49.18; Н 3.01; N 15.30.
Пример 6. 1-Гидрокси-5(6)-метоксикарбониламино-2-(4-метоксифенил)бензимидазол-3-оксид. Выход 89%, белый порошок, т.пл. 213-215°С (с разложением). ИК спектр, ν, см-1: 3300 (NH, ОН), 1710 (С=O), 1625 (C=N), 1610-1520 (С=С, ), 1250 (N→O). Найдено, %: С 58.11; Н 4.21; N 12.84. C16H15N3O5. Вычислено, %: С 58.36; Н 4.56; N 12.77.
Моногидрохлорид (Ie), выход 87%, белый порошок, т.пл. 226-227°С. Найдено, %: С 52.61; Н 4.38; N 11.23. C16H16ClN3O5. Вычислено, %: С 52.53; Н 4.38; N 11.49.
Натриевая соль (IIe), выход 92%, порошок светло-желтого цвета, т. разл. 193-196°С. Найдено, %: С 54.65; Н 4.05; N 11.77. C16H14N3NaO5. Вычислено, %: С 54.70; Н 3.99; N 11.97.
Таким образом, проведенные испытания позволили сделать заключение, что новые моногидрохлориды и натриевые соли таутомерных 5(6)-алкоксикарбоксамидопроизводных 2-арил-1-гидроксибензимидазол-3-оксида обладает ярко выраженной противогрибковой активностью в отношении Microsporum canis, Trichophyton rubrum, Candida albicans, низкой токсичностью, доступностью реагентов и простотой синтеза.
СПИСОК ЛИТЕРАТУРЫ
1. Pat. USA №4710514, A01N 47/20, C07C 125/073. Fungicidal саrbamates and thiolcarbamates / J. Takahashi, T. Kato, K. Kamoshita - Publ. 26.04.1983.
2. Шилова И.Б., Гуськова Т.А., Волчкова Н.В. Сравнительная эффективность некоторых современных противогрибковых средств // Хим. - фарм. журн. 2005. Т. 39. Вып.5. С.3-5.
3. Скрипкин Ю.К. Кожные и венерические болезни. - М.: Медицина, 1980. с.164.
4. Espinel-Ingroff F., Boyle K., Sheehan D.J. In vitro untifunginal activities of voriconzole and reference agent as determined by NCCLS methods: review of the literature // Mycopathologia. - 2001. - Vol.150. P.101-115.
5. Rex J.H., Pfaller M.A., Galgiani J.N., Bartlett M.S., Espinel-Ingroff A., et al. Development of interpretive breakpoints for antifungal susceptibility testing: conceptual framework and laboratory medicine. Ed. Baltimore: Williams and Wilkins, 1966.
6. Сергеев Ю.В., Шпигель Б.И., Сергеев А.Ю. Фармакотерапия микозов. - М.: Медицина для всех. 2003. - С.199.
1. Противогрибковые средства, представляющие собой моногидрохлориды и натриевые соли таутомерных 5(6)-алкоксикарбоксаминопроизводных 2-арил-1-гидроксибензимидазол-3-оксида формул I, II R-Me, Ar=Ph (a); R-Et, Ar=Ph (б); R=PhCH2, Ar=Ph (в); R=Me, Ar=4-BrC6H4 (г); R=Me, Ar=3-NO2C6H4 (д), R=Me, Ar=4-МеОС6Н4 (е).
2. Способ получения новых противогрибковых средств по п.1, отличающийся от описанного в литературе способа тем, что соединения формул I, II с высокими выходами и чистотой получают взаимодействием алкил-N-(n-нитрозофенил)карбаматов с N-оксидами бензонитрилов, замещенных как электронодонорными, так и электроноакцепторными заместителями в системе растворителей CH2Cl2 - Et2O при 0 ÷ -1°С в течение 48 ч и последующей обработкой таутомерных 5(6)алкоксикарбоксамидо-производных 2-арил-1-гидроксибензимидазол-3-оксида при 20°С в диоксане эфиром, насыщенным хлороводородом в течение 8 ч или эквимольным количеством водного раствора гидроксида натрия при перемешивании.
3. Моногидрохлориды и натриевые соли таутомерных 5(6)алкоксикарбоксамидопроизводных 2-арил-1-гидроксибензимидазол-3-оксида по п.1 характеризующиеся высокой фунгицидной и фунгистатической активностью в отношении Microsporum canis, Trichophyton rubrum, Candida albicans.