Электростанция, например, для бурых углей (способ и устройство)
Иллюстрации
Показать всеИзобретение относится к области переработки малоценных углей с целью получения электроэнергии и тепла и может быть применено для сжигания, например, бурых углей в любых регионах. В устройстве для сжигания малоценных углей, содержащем систему обеспечения пылевидным топливом, топку, теплообменники, топка выполнена с внутренним охлаждаемым и размещенным внутри эмитирующей спирали обтекателем, направляющим топочные газы в зоны высокой ионизации с целью использования получаемой плазмы в МГД генераторе; причем устройство выполнено с возможностью подачи перегретого пара из обтекателя в паровые турбины и использования их для выработки электроэнергии; помимо этого теплообменники, принимающие раскаленные топочные газы, выполнены с возможностью осуществления функции циклонов, при этом корпус теплообменников изолирован от выходной трубы, что позволяет использовать высокие электрические потенциалы, создаваемые на разных частях аппаратуры. Изобретение позволяет получить электроэнергию и тепловою энергии при почти абсолютном выгорании углерода в топливной смеси. 2 н.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области переработки малоценных углей с целью получения электроэнергии и тепла и может быть применено для сжигания, например, бурых углей в любых регионах.
Техническим результатом изобретения является параллельное получение электроэнергии и тепловой энергии при почти абсолютном выгорании углерода в топливной смеси.
Частным результатом изобретения является возможность получения водяного пара существенно разных кондиций, в том числе и пригодного для использования в паровых турбинах для выработки электроэнергии.
Дополнительным частным результатом изобретения является возможность получения существенно разных качеств отходов производства (например, сажа, микрогранулы наноразмеров и т.п.), что может быть использовано в строительной индустрии, производстве керамики и др. отраслях народного хозяйства.
Поставленная задача решается с помощью следующих приемов:
а) исходное сырье для сжигания измельчается до микрогранул в мельнице оригинальной конструкции, относящейся к предмету изобретения, но которое будет описано в отдельной заявке;
б) микрочастицы топлива сжигаются после предварительной обработки сверхвысокочастотным электромагнитным полем (предварительный поджиг) с последующей активацией горения в зоне коронного разряда и/или в присутствии холодного плазменного разряда реактивной плазмы (для некоторых углей процесс осуществляют с добавками кислородобразующей присадки (например, бертолетова соль) и ионообразующей соли (например, солей щелочных металлов)), что будет описано в отдельной заявке;
в) реактивная струя взрывообразно горящей смеси газов и микрогранул топлива подается в сопло магнитогидродинамического (МГД) генератора с шинами съема электрического тока (подробное описание в отдельной заявке);
г) реактивная струя газов после МГД генератора подается тангенциально в теплообменники, выполняющие также роль циклонов с двумя и более системами водяного охлаждения;
д) температурные, ионизационные и электрические режимы на каждом этапе регулируются автоматическими системами в соответствии в конкретными особенностями бурых углей и особенностью окислительно-восстановительных реакций (что будет описано в отдельной заявке).
В основу изобретения положены следующие рассуждения.
По химическому составу бурые угли не одинаковы, но все же, в среднем, они содержат примерно 69% углерода. 25% кислорода, 5,2% водорода и около 0,8% азота. Влаги может содержаться от 15 до 40%. Кроме того, имеется комплекс органических соединений, представляющих из себя производные гуминовых кислот, гуминов и битумов.
При свободном сжигании на воздухе бурые угли выделяют примерно 45-65% летучих веществ при удельной теплоте сгорания 25,5-31,2 МДж/кг.
Если же организовать другие условия для сжигания (новые параметры топочного процесса), например, при создании избытка свободных электронов в топочном пространстве, то можно заметно изменить кинетику горения бурого угля с существенным изменением химических реакций. Этому способствуют особенности химических элементов, содержащихся в бурых углях. Например, углерод, азот, сера имеют несколько степеней окисления как в положительном, так и в отрицательном заряде. Одно это уже создает огромные возможности для регулирования топочного процесса и управления большинством основных химических реакций в топочном пространстве.
До настоящего времени такие возможности не использовались в технических устройствах и технологиях при сжигании бурых углей.
Далее, ковалентные радиусы атомов и молекул в разных химических соединениях заметно отличаются у многих элементов, находящихся в топочном пространстве. Это открывает дополнительные возможности воздействия на молекулярном уровне на кинетику горения, например, при использовании высокочастотных устройств и любой аппаратуры, применяемой в ионизационных процессах (например, устройства для создания коронного или другого разряда).
Приведем некоторые известные особенности главных компонентов топочного процесса.
УГЛЕРОД
Электронная конфигурация в основном состоянии 1s22s22p2. Атомы углерода способны соединяться друг с другом в цепи различного строения - открытые (неразветвленные, разветвленные), замкнутые; образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи; образовывать прочные связи почти с любым другим элементом. Эти уникальные свойства углерода объясняются сочетанием двух факторов: 1) наличие на внешнем энергетическом уровне (2s и 2р) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов); 2) малый размер атома (в сравнении с другими элементами IV группы). Вследствие этого углерод образует главным образом ковалентные (прочные), а не ионные связи, и проявляет валентность, равную 4.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Ǻ, ковалентные радиусы 0,77Ǻ; 0,67Ǻ; 0,60Ǻ соответственно в одинарной, двойной и тройной связях; ионный радиус С4- 2,60Ǻ; С4+ 0,20Ǻ. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Диссоциация молекул начинается при температуре около 2000°С и почти полностью заканчивается при 5000°С, ей могут способствовать ультрафиолетовое излучение или электрические разряды.
Взаимодействие с кислородом воздуха (горение) происходит при температурах выше 300-500°С с образованием двуокиси углерода CO2 и окиси углерода СО. Так как степень окисления углерода в углекислом газе наибольшая (+4), он не является восстановителем и поддерживает горение только простых веществ, сходство к кислороду которых больше, чем у углерода, например, с магнием по реакции: 2Mg+CO2 (500°С)⇔2MgO+С.
http://www.cultinfo.ru/fulltext/1/001/008/113/484.htm
Восстановительный потенциал топочного газа в нашем изобретении обеспечивается избытком свободных электронов от коронного или другого (по внешним характеристикам) разряда, в том числе и импульсного (высокочастотного). Это в первую очередь тормозит образование окиси углерода, где реакция сопровождается поглощением энергии. Общий выигрыш в энергии топочного газа может быть существенным, пропорционально количеству возможного при данном процессе угарного газа (окись углерода). Стабильность горения при этом не нарушается.
В нашем случае необходимо сказать несколько слов и про технический углерод, с которым мы чаще всего будем иметь дело в технологическом процессе. Техуглерод обладает высокоразвитой поверхностью (5-150 м2/г), со значительной активностью. На поверхности обнаруживаются т.н. концевые группы (-СООН, -СНО, -ОН, -С(O)-O-, -С(O)-), а также сорбированные остатки неразложившихся углеводородов. (Это тем более заметно в бурых углях!) Количество подобных концевых групп напрямую зависит от способа получения и последующей обработки углеродных частиц. Во многих случаях эти группы ответственны за некоторые особые свойства углерода, например, электропроводность, способность поглощать ультрафиолетовое излучение, а также излучение радаров (то есть СВЧ-излучение).
Одно только перечисление установленных свойств углерода предполагает теоретическую возможность широкого управляющего воздействия на многие химические реакции, происходящие или могущие происходить с углеродом в условиях топки при высокой температуре.
Одним из таких способов воздействия на топочные процессы является избыток электронов, обладающих выраженным агрессивным воздействием на атомы и молекулы в свободном состоянии. Такие электроны появляются, например, при напряжении 35 тысяч вольт и выше между катодом и анодом, в качестве которых могут выступать определенные части оборудования.
АЗОТ - химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде - газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью.
Конфигурация внешнего электронного слоя 2s22p3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3- - 0,132, N3+ - 0,030 и N5+ - 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53; 29,60; 47,45; 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05.
Энергия связи атомов в молекуле N2 очень велика и составляет 941,6 кДж/моль. Расстояние между центрами атомов в молекуле 0,110 нм. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие s- и р-орбитали. Молекула азота немагнитна (диамагнитна). При нагревании азот взаимодействует со многими неметаллами, например с водородом: N2+3Н2 (500°С, 25 МПа, Fe+МеОН+SiO2)⇔2NH3; при высокой температуре и под действием электрической дуги азот соединяется с кислородом: N2+O2 (2000°С)=2NO, а также с серой, фосфором, бором, углеродом (http://www.biochem.nm.ru/science/literatur.htm).
Степени окисления азота в соединениях -3, -2, -1, +1, +2, +3, +4, +5.
Соединения азота в степени окисления -3 представлены нитридами, из которых практически наиболее важен аммиак.
Соединения азота в степени окисления -2 менее характерны, и представлены пернитридами, из которых самый важный пернитрид водорода N2H4 или гидразин.
Соединения азота в степени окисления -1 NH2OH (гидроксиламин) - неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе.
Соединения азота в степени окисления +1 оксид азота (I) N2O (закись азота, веселящий газ).
Соединения азота в степени окисления +2 оксид азота (II) NO (монооксид азота).
Соединения азота в степени окисления +3 оксид азота (III) N2O3, азотистая кислота, производные аниона NO2-, трифторид азота NF3.
Соединения азота в степени окисления +4 оксид азота (IV) NO2 (диоксид азота, бурый газ).
Соединения азота в степени окисления +5 - оксид азота (V) N2O5, азотная кислота и ее соли - нитраты, и др. (http://ru.wikipedia.org/wiki/Азот).
С водородом азот соединяется только при высокой температуре и в присутствии катализаторов, при этом образуется аммиак NH3.
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2(N2O4), N2O5.
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легкоокисляющихся материалов.
Оксид азота (II) NO - можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями.
Оксид азота(III) N2O3 (триоксид азота) - ангидрид азотистой кислоты: N2O3+H2O=2HNO2.
Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон. Молекула проявляет свойства свободного радикала. При комнатной температуре NO2 - газ темно-коричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона.
Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) - белое кристаллическое вещество, хороший окислитель (http://www.krugosvet.ru/articles /42/1004242/1004242a5.htm).
Самым прочным во всей гамме преобразования азота является его молекулярная форма N2. Даже при 3000°С степень ее термической диссоциации составляет всего 0,1%, и лишь при температуре около 5000°С достигает нескольких процентов (при нормальном давлении).
В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разряжении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов.
При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. В отличие от молекулярного, активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
В нашем изобретении появляется возможность использовать атомарный и активный азот для реакций со всеми элементами топочной смеси и таким образом связать его не в оксидах, опасных для окружающей среды, а в относительно безвредных соединениях.
КИСЛОРОД - второй по силе (после фтора) окислитель среди всех элементов Периодической системы. С этим связано большинство его химических свойств. Многие реакции окисления протекают бурно, с выделением большого количества тепла и света. В быту мы называем такие реакции горением. Кислород соединяется почти со всеми элементами с образованием оксидов как металлов, так и неметаллов.
Озон О3 образуется из кислорода при грозовых разрядах. В лаборатории его также получают при "тихом" (без искр) электрическом разряде сквозь стеклянную трубку, через которую пропускают кислород. Молекула озона поглощает ультрафиолетовый свет и рассеивает его энергию в виде тепла.
Существование модификации молекулы кислорода, состоящей из четырех атомов, эмпирическим путем было предсказано еще в 20-е годы прошлого столетия. Но получить такой кислород на практике удалось совсем недавно. Для его создания ученые Римского университета заставили взаимодействовать парные молекулы кислорода и положительно заряженные ионы. В результате образовался положительный ион O4. А после добавления к полученному иону электрона была получена нейтральная молекула.
http://www.vokrugsveta.ru/quiz/159/
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500°С она становится заметной.
Атомная масса (молярная масса) 15.9994 а.е.м. (г/моль)
Радиус атома 60 (48) пм
Энергия ионизации (первый электрон) 1313.1(13.61) кДж/моль (эВ)
Электронная конфигурация [Не] 2s2 2p4
Ковалентный радиус 73 пм
Радиус иона 132 (-2е) пм
Электроотрицательность (по Полингу) 3.44
Электродный потенциал 0
Степени окисления -2, -1, +2, +1, -1/2
При различных реакциях энергия активации кислорода разная. С фосфором кислород активно реагирует при нагревании последнего до 60, с серой - до 250, с водородом - больше 300, с углеродом (в виде графита) - при 700…800°С.
В нашем изобретении имеется возможность образования на разных этапах процесса как атомарного кислорода, так и молекул с 3 и 4-мя атомами, что позволит вырабатывать дополнительную энергию.
Как в природе, так и в технике единственной возможностью получить энергию (в нашем случае - в виде тепла) является создание условий для образования прочных связей в молекулах. И в момент, когда слабые связи заменяются прочными, происходит выделение энергии. Это единственный путь выработки энергии за пределами условий, допускающих ядерные реакции. Поэтому в нашем изобретении создаваемые в топке условия для горения углерода и протекания химических реакций предполагают образование именно прочных связей и недопущение их разрушения.
СЕРА - химический элемент с атомным номером 16, атомная масса 32,066. Природная сера состоит из четырех стабильных нуклидов: 32S (содержание 95,084% по массе), 33S (0,74%), 34S (4,16%) и 36S (0,016%). Радиус атома серы 0,104 нм. Радиусы ионов: иона S2- 0,170 нм (координационное число 6), иона S4+ 0,051 нм (координационное число 6) и иона S6+ 0,026 нм (координационное число 4). Энергии последовательной ионизации нейтрального атома серы от S0 до S6+ равны, соответственно, 10,36; 23,35; 34,8; 47,3; 72,5 и 88,0 эВ. Конфигурация внешнего электронного слоя 3s23p4. Степени окисления серы может изменяться в широких пределах: -2, +2, +4, +6 (реже -1, 0, +1, +3, +5). Значение электроотрицательности серы по Полингу 2,6. Каменные угли содержат в среднем 1,0-1,5% серы.
Сера - достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.
Свойства атома: Атомная масса (молярная масса) 32,066 а.е.м. (г/моль)
Радиус атома 127 пм
Энергия ионизации (первый электрон) 999,0 (10,35) кДж/моль (эВ)
Электронная конфигурация [Ne] 3s2 3p4
Ковалентный радиус 102 пм
Радиус иона 30 (+6е) 184 (-2е) пм
Электроотрицательность (по Полингу) 2,58
Электродный потенциал 0
Степени окисления 6, 4, 2, -2
С водородом при нагревании сера образует сероводород H2S и в небольшом количестве сульфаны (соединения состава H2Sn)
Образующиеся в реакциях с металлами сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS5. Полисульфиды типа CaSn или Na2Sn при взаимодействии, например, с соляной кислотой образуют сульфаны H2Sn, причем значение n может составлять от 1 до приблизительно 10.
Сера может присоединяться к сульфидам (Na2S+(n-1)S=Na2Sn) и к сульфитам (Na2SO3+S=Na2S2O3). При нагревании сера реагирует почти со всеми элементами, кроме инертных газов и благородных металлов.
Кроме устойчивых диоксида серы SO2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S2O (при пропускании тока SO2 через тлеющий разряд) и S8O (при взаимодействии H2S с SOCl2). Пероксиды SO4 и S2O7 образуются при пропускании SO2 в смеси с кислородом через тлеющий разряд или за счет окисления SO2 озоном.
http://www.alhimikov.net/element/S.html
Особенностью серы (и ее соединений) является возможность образовывать разные вещества при избытке и недостатке кислорода. Например, образующийся при горении серы сероводород обладает сильными восстановительными свойствами и в восстановительной атмосфере топки может сохраниться, несмотря на его горючесть. И в этом случае из сероводорода при недостатке кислорода можно получать элементарную серу по реакции: 2H2S-2+O2 ® 2S0+2H2O.
http://ru.wikipedia.org/wiki/Cepa
Взаимодействие серы с «аморфным» углеродом начинается при 700-800°С; во всех случаях образуется сероуглерод CS2 (на воздухе).
http://www.cultinfo.ru/fulltext/l/001/008/113/484.htm
В условиях топки в восстановительной среде при недостатке кислорода сероуглерод может сохранять стабильность молекулы до температуры примерно 1000°С. А при избытке воздуха и водяных паров сероуглерод гидролизируется уже при температуре выше 150°С.
Эти особенности делают возможными большой круг манипуляций по образованию различных химических соединений при наличии избытка активных свободных электронов и вариаций электрического поля в топочном объеме. Широкая изменчивость химических и физических качеств серы как активного химического элемента предоставляет большие возможности для регулирования процесса горения бурых углей в топке.
В камере сгорания (в топке) при обычных условиях весь кислород (правильнее сказать: сумма электронов, которые может акцептировать кислород в топочной смеси) быстро восполняется углеродом, отдающим эти электроны с образованием прочного соединения (двуокись углерода).
В случае с бурыми углями этот постулат требует серьезного уточнения. Но при более высоких температурах соединения углерода с кислородом разваливаются и углерод становится донором электронов для азота. Появляются окислы азота, молекулы которых более устойчивы к высокой температуре, чем у соединений углерода с кислородом. И в топке появляется недоокисленный углерод (способный к образованию окиси углерода) и окислы азота.
При создании избытка электронов в топке температура процесса может быть много выше, а сам процесс горения будет исключительно восстановительным. То есть имеются возможности для образования чистого атомарного (молекулярного) углерода, атомарного (молекулярного) азота, атомарного (молекулярного) кислорода, а все промежуточные соединения также имеют возможность превратиться в устойчивые отдельные атомы (молекулы). Это касается и серы с ее достаточно высокой реагентоспособностью. Реакционная способность смеси таких веществ, получаемой при избытке свободных электронов, станет минимальной (но только в условиях топочного пространства с избытком электронов и особенностями электрических полей локального пространства топки).
При выходе из топочной камеры многие устойчивые в пространстве топки атомы (молекулы) превращаются в ионы, теряя часть электронов (акцептированных в принудительном режиме и не соответствующих природной структуре этих атомов и молекул), и общее количество ионов заметно возрастает. Кроме того, многие свободные электроны, полученные в результате ионизационного процесса, выносятся струей из топочного пространства и увеличивают ионную составляющую струи газов, что выгодно для использования топочных газов в МГД генераторе.
Перечисленные процессы (и тенденции к протеканию этих процессов) можно усилить, если в топочном пространстве будет достаточное (не избыточное) количество водяных паров для появления в реакционной смеси (в топочном газе) гидроксил-ионов с их малой энергией активации и возможностью участия в огромном количестве промежуточных реакций. Этому обстоятельству способствует и наличие в топочной смеси ионов легких щелочных металлов, которых в бурых углях всегда достаточное количество. В условиях электрического поля все ионизированные (и даже неионизированные) частицы топочной смеси начинают быстро вращаться и генерировать свои волны в диапазонах СВЧ, КВЧ и более высоких частот.
Параметры этих явлений можно регулировать разными способами (например, величинами напряженности электрического поля, частотными характеристиками электрических разрядов, использованием резонаторов и др.), вплоть до приближения параметров процесса к виброрезонаторным системам и достижения подобия многорезонаторной бегущей волны.
То есть, фактически, появляются возможности получения дополнительной энергии, как это было выполнено еще в 1929 году М.А.Бонч-Бруевичем на его многорезонаторном магнетроне с круговой бегущей волной (будет описано в отдельной заявке).
Техническим результатом изобретения являются следующие главные моменты:
1) прямое получение электрического тока в МГД генераторе;
2) получение тепла в водяных рубашках охлаждающих модулей (систем) установки;
3) получение острого перегретого пара, пригодного для использования в паровых электрических турбинах, а также в системах электролиза воды (что также может быть дополнительным фактором получения электроэнергии и тепла);
4) получение мелкой и очень мелкой золы, являющейся товарным продуктом, с возможностью использования во многих отраслях промышленности;
5) получение выбрасываемых в атмосферу топочных газов с минимальными концентрациями окислов азота и серы.
Немаловажным фактором является и то обстоятельство, что электростанция по предложенной схеме может быть небольших размеров, производя большие мощности по току, теплу и пару. Существующие котлы тепловых электростанций имеют огромные размеры. Так, например, высота даже П-образного (двухгазоходного) котла типа П-67 для блока 800 МВт, изготовленного российским заводом «ЗИО-Подольск» и установленного в России на Березовской ГРЭС, составляет более 100 м.
В предлагаемом изобретении указанную мощность можно достичь в установке всего 15 м высотой и на полезной площади 150×150 метров.
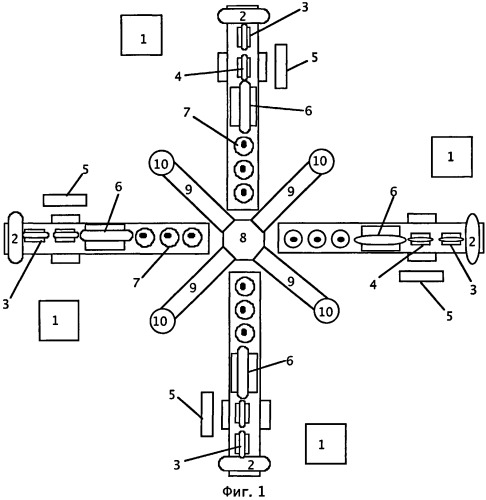
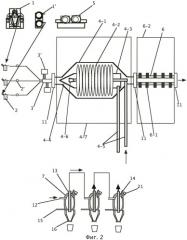
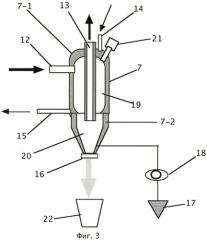
В настоящей заявке мы рассмотрим только камеру сгорания (топку) и теплообменник-циклон предлагаемого устройства. Другие составляющие устройства будут обозначены в отдельных заявках на изобретение.
Известен способ сжигания твердого органического топлива с использованием плазменного разряда реактивной плазмы (RU 2253070, 2003.07.02) и перевода топлива в генераторный газ с последующим сжиганием последнего для получения пара, который подают на паровую турбину.
Недостатком этого способа является невозможность создания высоких скоростей горения топлива (наличие стадии пиролизации органического вещества, воспринимаемой ныне, как дополнительная стадия переработки топлива). Кроме того, несмотря на скоростной характер пиролизации, эта стадия препятствует скоростному сжиганию органических веществ и достижению высоких (звуковых и сверхзвуковых) скоростей течения продуктов сгорания внутри системы, необходимых для использования МГД генераторов в качестве прямых преобразователей теплового процесса в электрический ток. Это резко ограничивает мощность и скоростные характеристики системы сжигания органических веществ как с точки зрения использования МГД генераторов, так и быстрого преобразования органических соединений в теплоту.
В предлагаемом изобретении эти недостатки устранены, и пылеобразному топливу не требуется стадия пиролизации, поскольку оно само по себе (и тем более после стадии предварительной обработки СВЧ-полем) способно к взрывоподобному горению в присутствии доноров и акцепторов электронов.
Известен также плазменный источник тока (RU 2277643, 2004.11.18), являющийся прототипом МГД генератора, в основу работы которого положен принцип разделения газового потока на электронную и ионную компоненты за счет продувания в поперечном магнитном поле. Дальнейшее соединение потоков электронов и ионов через проводники полезной нагрузки (лампочки, электродвигатели и т.д.) дает необходимое количество электрической мощности для потребителей. Коэффициент полезного действия устройства достигает 70-80% [Фаворский О.Н. и др. Основы теории космических электрореактивных двигательных установок. М.: Высшая школа, 1978, с.170].
Автор исходит из хорошо установленного факта, что при истечении из сопла ускоренного ионного потока в космическое пространство, обычно положительного, на корпусе двигателя образуется заряд противоположного знака и, если не принять необходимых мер, то кулоновская сила останавливает ионный поток, и все вылетевшие заряженные частицы вынужденно возвращаются назад. И какой бы мощный источник электрического тока не работал на создание ионной струи, возврат ионов назад обеспечен. Ввиду этого возле среза сопла устанавливают другой источник противоположного заряда (обычно электронный) для нейтрализации струи ионов, слияние с электронами компенсирует заряд основного потока [Гришин С.Д. и др. Электрические ракетные двигатели. М.: Машиностроение, 1975, с.111] и тем самым снимается заряд с корпуса за счет электрического соединения проводами нейтрализующего устройства электронов с дальним от сопла электродом двигателя.
По нашему мнению, в условиях Земли далеко не всегда оправдано такое решение. Поскольку истекающая из МГД генератора струя газов имеет в большинстве случаев положительный потенциал, для выравнивания электронного состояния газа (и всей аппаратуры соответственно) достаточно простого, но качественного заземления корпуса, например, теплообменника. Более того, на этом принципе можно получить полезную мощность через включенную в цепь заземления нагрузку.
Известен магнитогидродинамический способ преобразования тепловой энергии в электрическую замкнутого цикла (RU 2226737, 2002.03.29). Способ включает разгон потока инертного газа, создание в потоке перед входом в канал МГД генератора с помощью импульсных пучков электронов высокой энергии и сильноточных электрических разрядов периодических по времени электропроводных слоев, перемещаемых газовым потоком в поперечном магнитном поле. При этом реализуется режим самоподдержания электропроводных слоев в канале МГД генератора за счет энергии потока и генерирования полезной мощности. В электропроводных плазменных слоях создают состояние "замороженной ионизации", для чего используют электронные пучки только для начальной ионизации, а окончательную ионизацию осуществляют с помощью импульсного сильноточного разряда с характерным временем разряда не более 2·10-6 с. Сильноточный разряд однородно повышает концентрацию электронов в предварительно ионизованном электропроводном слое, при этом напряжение разряда подбирают так, чтобы концентрация электронов к моменту выключения тока разряда составила (0,8-1,5)·1015 см-3.
Недостатками упомянутого технического решения является его выраженный академизм, в результате которого работающая в лабораторных условиях установка не будет принята производственными условиями. И дело здесь не только в дороговизне инертного газа, но и в создании сгустков электропроводных слоев плазмы в режиме «замороженной ионизации».
Такая электростанция может работать в космических условиях, но в земных она станет отвергнутой ввиду неоправданных сложностей создания стабильного непрерывного процесса воспроизводства электроэнергии и ее съема на уровень потребителя. Авторами игнорируется факт, что плазма - это уже электропроводный субстрат (или материал), и зависимость получения электротока полезной нагрузки весьма нелинейно зависит от увеличения концентрации ионов в плазменном потоке. Гораздо в большей степени возрастают энергозатраты на создание сгустков плазмы с высоким содержанием ионов.
В предлагаемом изобретении мы отказались от максимально возможных мощностей по электрическому току на уровне потребителя в пользу более простого, дешевого и стабильного режима работы электростанции.
Известен способ эффективного сжигания топлива с использованием тлеющего разряда (RU 2160414, 1996.12.11), создания озонирующей среды. В изобретении предложен способ сжигания топлива путем подачи и взаимосвязанного регулирования топлива и окислителя, их смешивания и воспламенения, с последующей обработкой факела пламени регулируемым электрическим полем с напряженностью порядка 1 кВ/см от его устья до вершины путем подачи высокого напряжения на электроизолированные от корпуса горелки топливную форсунку и рабочий электрод, с регулированием напряженности поля и тока эмиссии электронов в пламя по условию предотвращения электрического разряда источника электрического поля через пламя, который дополнен операцией регулирования тока эмиссии путем введения дополнительного управляющего потенциала через дополнительный подвижный электрод, между топливной форсункой и началом факела пламени, операцией механического регулирования положения этих электродов относительно факела пламени, операцией выработки и подачи взаимосвязанных управляющих воздействий на изменение электрических параметров электрического поля.
Недостатком этого способа и устройства является его неприспособленность для твердых топлив, в частности для угольных частиц.
Известен способ сжигания угля (см. Ф.А.Серант и др. Разработка и внедрение новых технологий сжигания топлива в энергетике. // Международная научно-практическая конференция «Инновационная энергетика», Институт теплофизики СО РАН, Новосибирск 15-16 ноября 2005 г.) в круговых восьмигранных топках с вращающимся факелом. Там также предложено размельчение угля и вдувание пыли в зону сгорания. При этом для уменьшения крутки газов перед их входом в конвективные газоходы верхний ввод воздуха организован по тангенциальной схеме с направлением, противоположным вращению основного потока топочных газов.
Недостатком известного способа является то обстоятельство, что соблюдение предложенных требований с учетом необходимости сжигания бурых углей с повышенной влажностью и высокой теоретической температурой горения (1550…1560°С) является весьма сложной задачей. Кроме того, установки приобретают гигантские размеры.
За прототип взяты отдельные приемы и отдельные инженерные решения перечисленных изобретений, но подлинного прототипа, отвечающего всем требованиям этой категории, мы не нашли.
Описание изобретения
Изобретение состоит в мелком и сверхмелком размоле малоценного угля в специально предложенной мельнице, затаривание пыли угля в питатели, подсоединение питателей к системе воздушной подачи пыли в систему сжигания угля, проводя пыль через камеру обработки СВЧ-генератором, топочное пространство с ионизационным процессом, МГД генератор, теплообменники и электрофильтры, причем углерод и сера выгорают практически полностью или же высаждаются в теплообменниках и электрофильтрах в виде неагрессивных соединений.
Процесс начинают с измельчением угля в мельнице, где организуют движение воздуха вместе с загрузкой угля через горловину ротора и принудительным выходом его через штуцеры (трубы) из герметизированных камер, в которых производят затаривание питателей угольной пылью. Ротор выполнен грушевидной формы, перфорированным, имеет на внутренней стороне множество выступов (игл) для размельчения комочков угля и вращается в свободно подвешенном состоянии, совершая сложные микровибрации, благодаря особенностям обмоток и соответствующей импульсации тока в некоторых обмотках статора и ротора.
Затаривание питателя производят через центральное отверстие на верхней стороне корпуса, и после заполнения питателя пылью, его отвозят на места хранения перед использованием.
Пыль из питателя подают сжатым воздухом в полость активатора (СВЧ-генераторами), причем система подачи пыли в активатор защищена двумя клапанами, препятствующими обратному движению воздушно-пылевой смеси.
Активацию ведут СВЧ-генераторами, вызывающими возникновение плазменных образований (процессов) на поверхности угольных частиц. Активированную и уже горящую (тлеющую) пылевую массу (с необходимым количеством водяных паров) вдувают в топочное пространство, оборудованное спиралью из тугоплавкого металла для создания коронного или другого разряда и охлаждаемым обтекателем из тугоплавкого металла, причем подачу воздушно-пылевой смеси осуществляют по периметру топочной камеры в зоне нахождения эмиттирующей спирали.
Скорость подачи пылевоздушной (или пылегазовой) смеси регулируют с учетом заданных требований по поддержке требуемой температуры горения угля и предотвращению образования большого количества оксидов азота. Эти же задачи решают и с помощью принудительного внутреннего охлаждения обтекателя, расположенного внутри эмиттирующей спирали (и камеры сгорания). Образующийся в обтекатели перегретый пар подают на паровые турбины и/или на электролиз водяного пара для образования чистого водорода и кислорода. Для улучшения теплообменных процессов обтекатель может быть выполнен с металлическими стержнями, закрепленными в оболочке обтекателя и связывающими собою внутреннее пространство обтекателя и пространство топочной камеры.
Дальнейшее движение топочных газов осуществляют через МГД генератор с шинами съема электротока, также охлаждаемый, но внешним теплообменным контуром.
После МГД генератора топочные газы подают тангенциально в теплообменники, выполняющие дополнительно функции циклонов. В данных устройствах имеется возможность манипуляции мощными статическими зарядами: как прямым зарядом (от вылетающей из МГД генератора раскаленной струи газов и заряженной в большей степени положительно), так и наведенным на выходную трубу (изолированную от корпуса) высоким отрицательным зарядом. Зарядами манипулируют по особой программе, в зависимости от качественных характеристик конкретного угля, но в любом случае - получают дополнительную электрическую мощность на включенной в цепь заземления нагрузке.
Процесс горения (правильнее сказать - процесс получения энергии из угольной пыли направленным физико-химическим регулированием) проводят с помощью автоматических электронных систем регулирования основных параметров. Для большинства бурых углей такими параметрами являются:
- температура в разных участках цепи превращения углерода и сопутствующих веществ в предпочтительные для экологии соединения,
- скорость подачи воздушно-пылевой смеси в активационную и топочную систему,
- частота и напряженность электрического тока и поля при ионизационном процессе,