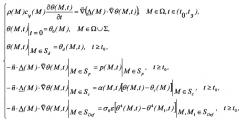Способ диагностики сосудистой патологии путем активного термолокационного зондирования
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для диагностики, контроля лечения и прогноза сосудистой патологии. Регистрируют температурное поле кожного покрова, имеющее минимальные температурные аномалии, и принимают его за аномальное. Определяют пространственное разрешение для регистрации температурного поля, исходя из обнаружения минимальных по размеру температурных аномалий, определяемых размерами минимальной температурной аномалии. Регистрируют температурное поле кожного покрова до введения лекарственных препаратов, которое принимают за безаномальное в отсутствии патологии. Определяют критерий минимальной аномальности. Вводят в кровяное русло сосудорасширяющий лекарственный препарат. Определяют допустимый максимальный временной период регистрации на период повышения температуры. Измеряют время запаздывания как интервал времени достижения максимального температурного контраста, начиная от момента введения препарата. Во временном интервале, включающем время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени, которое определяют, исходя из характеристик скорости измерения температурного поля. Сравнивают измеренные значения температурных полей поверхности кожи до и после введения лекарственных препаратов, производя суммирование по координатам поверхности и по времени. По результатам проведенных измерений определяют границы участков поверхности кожи, в области которых имеется патология кровотока. При наличии патологии кровотока формируют диагностическое заключение путем сравнения динамических температурных аномалий с рассчитанными температурными аномалиями и определяют характеристики внутренних температурных источников: температуру, глубину залегания, геометрические размеры, которые вызвали зарегистрированные динамические температурные аномалии на кожной поверхности. Способ повышает достоверность диагностики сосудистой патологии. 4 з.п. ф-лы, 5 табл., 25 ил.
Реферат
Изобретение относится к области медицины и может быть использовано для диагностики, контроля лечения и прогноза сосудистой патологии, для повышения эффективности лечения сосудистой патологии и снижения количества терапевтических осложнений, снижения себестоимости лечения больных за счет своевременной и достоверной диагностики.
В настоящее время широко распространено мнение, что диагностика и средства диагностики суть одно и то же. Достаточно приобрести тепловизор, направить на объект контроля, получить хорошие термограммы - и контроль проведен. Однако необходимо понять, что результаты измерений - всего лишь поле информационного сигнала с кожи пациента. По анализу характеристик поля возможно определить лишь участки с той или иной степенью отклонения. Однако невозможно определить количественные показатели внутренней патологии.
Для определения количественных показателей необходимо не просто поле измерений, а проведение диагностики по специальной методике контроля, т.е. необходимо поставить в соответствие аномалии поля поверхности с конкретными внутренними нарушениями функционирования внутренних органов. При этом этап регистрации информационного поля на поверхности кожного покрова является лишь одним из многих.
К настоящему времени накоплен большой опыт применения термографии в диагностической медицине. В работах отечественных и зарубежных ученых показаны широкие возможности метода в комплексной диагностике заболеваний, приведены достаточно надежные критерии для выявления многих болезней. Такие методы дают возможность определить отсутствие или наличие нарушения регионарного кровообращения, степень его выраженности, в большинстве случаев установить причину патологии и т.п.
Живой организм непрерывно расходует на поддержание жизненно важных функций энергию, которая появляется в результате окислительных процессов, происходящих в организме. Организм способен поддерживать температуру на постоянном уровне независимо от температуры окружающей среды. Температура внутренних органов у таких организмов находится в пределах от 37 до 38°С. Данная температура способствует метаболическим процессам, поддерживает функционирование ферментов, определяет физико-химические процессы. В различных частях тела температура неодинакова и определяется расположением органа, степенью кровоснабжения, функциональной активностью, температурой внешней среды. Основное количество тепла вырабатывается во внутренних органах, но при физической работе положение изменяется в связи с усилением метаболических процессов в мышцах: температура сокращающихся мышц повышается на 7°C. Температура тела генетически детерминирована и способна изменяться в известных пределах [Макаров В.А., Судаков К.В., 1983; Fujishima H. et al., 1994; Khizhnyak E.P. et al., 1994; Hussley D.L. et al., 1995; Gersing E. et al., 1995].
Тепловая энергия постоянно вырабатывается в организме и зависит от интенсивности метаболических процессов и состояния кровообращения.
За 40 последних лет метод диагностики заболеваний по анализу температурных полей - термолокационое зондирование - проявил себя как метод функционального исследования, который позволяет получать сведения, необходимые для выявления различной патологии. Термолокационное зондирование, в т.ч. термография - практически единственный способ эффективной оценки продукции и переноса тепла в тканях. Путем анализа распределения тепла на поверхности тела человека можно констатировать наличие патологических изменений, происходящих во внутренних органах, и оценивать их динамику под влиянием лечения [Morgan P.D. et al., 1995; Parada M.A. et al., 1995; Sherman R.A. et al., 1995; Varon M. et al., 1995; Veo S. et al., 1995].
Среди имеющихся методов инструментального исследования термолокационое зондрование занимает особое место, так как помогает выявить соотношение между выраженностью клинических проявлений заболевания и температурой кожных покровов. Этот метод открывает новые широкие возможности в диагностике различных заболеваний человека.
Одна из первых попыток применения этого метода в медицине была осуществлена в 1925 г. немецким ученым М.Черни. В 1956 г. канадский хирург Р.Лауссон обследовал молочные железы больных раком этого органа и получил определенную тепловую картину, отличающуюся от таковой у здоровых лиц. Это открытие положило начало медицинской практике. Первые термографические исследования в нашей стране выполнены на отечественном аппарате М.М.Мирошниковым и М.А.Собакиным в 1962 г. [Розенфельд Л.Г., 1988].
Б.В.Петровский и др. (1966), А.Г.Выховская (1966), Т.П.Макаренко (1970), G.Biasi и др. (1994), M.E.Weiss и др. (1994) определили диагностические возможности метода при различных заболеваниях.
Термолокационное зондирование относится к категории исследований, которые расширяют возможности анализа биологических процессов, происходящих в органах и тканях организма. Короткая история метода дает возможность определить его место в диагностике многих заболеваний организма человека, прежде всего в их ранней стадии, когда еще отсутствуют болезненные симптомы. В этом немалую и роль играет применение вычислительной техники, позволяющей проводить анализ информационных полей.
Заявленный способ отличается от других методов исследования своей физиологичностью, количественной характеристикой, возможностью применения у ослабленных больных. Он дает хорошие результаты при использовании с целью раннего выявления многих заболеваний, особенно на первом этапе диагностики в амбулаторно-поликлинической практике, а также при проведении профилактических осмотров и наблюдении за диспансерной группой больных.
В настоящее время только с помощью данного метода можно легко определить сосудистою патологию, нарушение кровообращения в нижних конечностях, особенно на ранних стадиях его развития и т.п. Аналогично диагностируются и другие заболевания: тромбофлебиты, посттромбофлебитический синдром и др. Все воспалительные заболевания организма, включая острую хирургическую патологию органов брюшной полости, являются идеальной областью для диагностики с помощью термолокационного зондирования. Динамичное наблюдение за этой категорией больных позволяет оценить эффективность лечения и выявить возможные послеоперационные осложнения.
Интенсивное развитие метод термолокационного зондирования в медицине получил, когда к нему стали подходить с мерками функционального метода, т.е. исследовать реакцию динамики изменения температурных полей в ответ на различные провоцирующие нагрузки.
В настоящее время в России и за рубежом отсутствуют объективные, достоверные методы диагностики сосудистой патологии в клинике нервных болезней.
Все существующие методы направлены на качественный анализ температурных полей кожного покрова пациента. Диагноз базируется на опыте врача. При этом отсутствуют методы, позволяющие по видеоизображению температурного поля определять причины образования аномальных участков - предположительные причины заболеваний тех или иных внутренних органов человека. При такой постановке процесса диагностирования достоверность диагноза, как сказано выше, будет определяться исключительно опытом врача, а роль компьютерной тепловизионной системы сводится к «большому дорогому термометру».
С учетом существующей приборной базы и созданного Российскими учеными математического аппарата и программно-методического обеспечения (в т.ч. биологических объектов) созданы все необходимые предпосылки для перехода методов диагностики на качественно новый практический уровень.
Из уровня техники известны способы и устройства для диагностики заболеваний по анализу температурных полей кожи человека. К ним относятся:
1. SU 1748820 Способ определения состояния кровообращения верхних конечностей (03.11.1989).
2. RU 2094037 Способ экспресс-диагностики патологии внутренних органов (27.10.1997).
3. RU 2088137 Способ экспресс-диагностики патологии внутренних органов (27.08.1997).
4. RU 2085110 Способ диагностики хронической окклюзии бедренной артерии в гунтеровом канале (27.07.1997).
5. RU 2077257 Способ дифференциональной диагностики врожденных ангиодисплазий конечностей (20.04.1997).
6. RU 2043074 Способ ранней диагностики опухолевых заболеваний молочной железы (10.09.1995).
7. RU 2168931 Способ экспресс-диагностики нарушений нейроэндокринной регуляции отделов гипоталамо-гипофизарно-гонадной системы (20.06.2001).
8. RU 2143220 Способ термографической диагностики окклюзионных заболеваний артерий (27.12.1999).
9. RU 2066976 Способ экспресс-диагностики группы риска патологии внутренних органов (27.09.1996).
10. RU 2123670 Способ диагностики ишемического поражения головного мозга у недоношенных детей (12.20.1998).
11. RU 2018263 Способ определения реактивности кровеносных сосудов (30.08.1994).
12. RU 2115360 Способ диагностики ишемической болезни сердца (20.07.1998).
13. RU 2145791 Способ определения термореактивности кожи (27.02.2000).
Недостатки приведенных способов диагностики общие для всех и очевидны:
- диагностическое заключение о заболевании производится на основании сравнения реального распределения температурного поля на поверхности кожи человека с некоторым идеальным распределением, которое априори принимается за распределение на здоровом человеке. Количество «идеальных» распределений может быть достаточно большим, что определяется физиологическими и анатомическими особенностями людей. Поэтому данные методы являются в большой степени субъективными, а достоверность диагностического заключения практически полностью определяется квалификацией и опытом работы врача, осуществляющего обследование и диагностику,
- каждый метод диагностики является строго индивидуальным и направлен на диагностику своего специфического заболевания, т.к. формирование диагностического заключения определяется архивом (базой) идеальных термограмм здорового человека,
- методы не позволяют «заглянуть внутрь» человека и достоверно определить причину температурной аномалии (заключение осуществляется только на основе существующего архива термограмм), что снижает вероятность назначения правильного лечения заболевания,
- некоторые одинаковые аномалии образуются вследствие различных заболеваний, т.е. некоторые различные внутренние заболевания дают одинаковые аномалии, и существующий способ не позволяет их распознавать.
Наиболее близким к заявляемому способу является способ диагностики заболеваний, описанный в книге: Зеновко Г.И. Термография в медицине. - М., Медицина, 1998, 168 с.
В отличие от рассмотренных выше методов он включает специальные функциональные нагрузки на организм, усиливающие контраст температурного поля кожной поверхности от диагностируемого заболевания (изменение температуры между различными областями поверхности), регистрацию распределения температурного поля по поверхности и сравнение зарегистрированного распределения с некоторым эталонным распределением. По результатам анализа отличий двух распределений формируется диагностическое заключение.
Все остальные недостатки, описанные выше, присущи и этому способу.
В последнее десятилетие произошел принципиально качественный скачок в развитии метода диагностики объектов по температурным полям. Это связано с появлением принципиально новых методов тепловой дефектометрии (или тепловой томографии), позволяющих по анализу динамических и статических температурных полей поверхности объекта определять характеристики внутренних тепловых источников, образовавших поверхностные температурные аномалии.
В свете изложенного возникает необходимость создания достоверного метода диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней путем неинвазивного термолокационого зондирования.
Это позволит решать следующие задачи:
1 - диагностика распространенности и глубины поражения при различных патологических состояниях;
2 - контроль эффективности проводимой патогенетической терапии;
3 - прогноз течения и возможности рецидивирования заболевания;
4 - создание и клиническая апробация методики объективной тепловизионной (неинвазивной) диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней;
5 - диагностика заболеваний, связанных с нарушением мозгового кровообращения - с достоверностью не менее 0,85-0,95;
6 - распознавания заболеваний органов по анализу аномалий полей поверхности кожного покрова на основе:
- статистического анализа клинической картины распространения температурных полей и т.п.;
- возможности осуществления диспансерного комплексного обследования с применением в различных возрастных группах и группах риска развития нарушения мозгового кровообращения.
Таким образом, появится возможность решения актуальных для практики задач повышения качества жизни людей, страдающих вышеназванными заболеваниями.
Технический результат, который достигается в результате использования настоящего изобретения, состоит в
- повышении объективности оценки распространенности заболевания,
- повышении эффективности лечения,
- повышении эффективности подбора лекарств,
- обеспечении контроля за ремиссией заболевания и разработке прогнозов рецидивов заболевания,
- удешевлении дифференциальной диагностики заболевания и формирования оценки эффективности терапии за счет индивидуального подбора лекарственных средств,
- уменьшении сроков выздоровления или наступления ремиссии заболевания.
Технический результат достигается за счет того, что в способе диагностики сосудистой патологии путем термолокационного зондирования, включающем регистрацию температурного поля кожного покрова человека, сравнение температурного поля кожного покрова человека, сравнение зарегистрированных термограмм с эталонными и определении патологии по обнаружению аномалий температурного поля,
- регистрируют температурное поле Тан(х,у) кожного покрова, имеющее минимальные температурные аномалии Δхдmin, Δудmin, которое принимается за аномальное,
- определяют пространственное разрешение для регистрации температурного поля, исходя из обнаружения минимальных по размеру температурных аномалий Δа, определяемых размерами минимальной температурной аномалии:
где Δхдmin, Δудmin - геометрические размеры минимальной температурной аномалии кожного покрова,
- температурное поле To(x,y,t) кожного покрова регистрируют до введения лекарственных препаратов, которое принимается за безаномальное температурное поле в отсутствие патологии,
- определяют критерий минимальной аномальности Δmin следующим образом:
- вводят в кровяное русло лекарственный препарат, способствующий сосудорасширяющему эффекту и увеличению скорости кровотока, за счет чего в течение определенного времени Δτиз=(0…τиз) увеличивают температуру кожной поверхности,
- определяют допустимый максимальный временной период регистрации (τизм) на период повышения температуры вследствие введения препарата,
- измеряют время запаздывания (Δτзап), представляющее интервал времени достижения максимального температурного контраста на поверхности кожи, начиная от момента введения препарата,
- во временном интервале (Δτконтр), включающем время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени (τизм), которое определяется заранее исходя из характеристик скорости измерения температурного поля - Тизм(х,у,t),
- сравнивают измеренные значения температурных полей кожной поверхности до и после введения лекарственных препаратов, производя суммирование по координатам поверхности и по времени:
где
Nx - количество точек суммирования по координате х,
Ny - количество точек суммирования по координате у,
Nt - количество точек суммирования по времени t,
- формируют предварительное диагностическое заключение следующим образом:
,
- по результатам проведенных измерений определяют границы участков поверхности кожи L(х,у), в области которых имеется патология кровотока, решая уравнение:
где
- среднее значение температурного профиля,
- среднее значение температуры,
Nx, Ny, Nt - количество точек для суммирования, соответственно, по координате, х, y, t,
Dуч - характерный размер исследуемого участка кожной поверхности,
Dуч =(Хн-Хк) или (Ун-Ук)=max,
L(x,y) - контур области температурной аномалии,
(х,у) - координаты контура области,
Нконстр - толщина исследуемого объекта от внутренней патологии до поверхности кожного покрова,
(Хн-Хк) или (Ун-Ук) - координаты границы аномального участка,
- при наличии патологии кровотока формируют окончательное диагностическое заключение путем сравнения динамических температурных аномалий с рассчитанными температурными аномалиями и определяют характеристики внутренних температурных источников: температуру, глубину залегания, геометрические размеры, которые вызвали зарегистрированные динамические температурные аномалии на кожной поверхности,
где F - функционал невязки (квадрат величины среднеквадратичного отклонения),
δ - величина критерия невязки - точность определения параметров внутренней патологии,
Тр - рассчитанная величина температурного поля посредством адекватной математической модели, описывающий процесс распределения теплового поля в исследуемой подкожной области,
Θ - вектор характеристик внутренней патологии.
Технический результат усиливается за счет того, что геометрические размеры минимальной температурной аномалии Δхдmin, Δудmin определяют следующим образом:
- измеряют размеры всех температурных аномалий, содержащихся на поверхности кожного покрова, выявленных в результате предварительной регистрации температурного поля: Δхдi, Δудi,
- определяют размеры минимальной аномалии Δхдmin, Δудmin, решая систему уравнений:
где δ - вероятность того, что (Δхдi, Δудi)≥(Δхдmin, Δудmin)
p(ΔXi) - функция распределения величин Δхдi, Δудi,
Δхдi, Δудi - размеры всех температурных аномалий, содержащихся на поверхности кожного покрова по двум поверхностным координатам x и у.
Временной интервал проведения измерений температуры определяют путем измерения времени тепловой инерции τин, измеряя время прохождения теплового фронта от внутренней патологии до поверхности кожи.
Оптимальный интервал последовательного измерения температуры τизм на поверхности кожи определяют путем решения уравнения
.
где f(T) - плотность распределения длительности во времени информационного сигнала,
τ - временной интервал измерения,
Р - вероятность пропуска информационного сигнала,
Т0 - временная разрешающая способность измерительных датчиков,
η - параметр.
Температурное поле регистрируют путем тепловизионного обследования поверхности кожного покрова с учетом его физиологических и анатомических особенностей и заболевания. Возможно выявление немых зон, не реагирующих на медикаментозное воздействие (склеротические изменения, стеноз, опухоль).
Сущность заявленного способа диагностики и возможность достижения технического результата будет раскрыта далее со ссылками на сопровождающие чертежи, на которых представлено:
Фиг.1. Анатомия сонной артерии.
Фиг.2. Гистограмма распределения размеров аномальных участков в области участка поверхности кожи сонной артерии.
Фиг.3. Функциональная схема программно-аппаратной реализации термолокационного зондирования.
Фиг.4. График времени измерения и контроля.
Фиг.5. Схема методики вычислительной диагностики аномалий кровотока.
Фиг.6. Изображение 10-узлового тетраэдра.
Фиг.7. Пространство параметров hm µl zk.
Фиг.8. Диагностируемая композитная пластина.
Фиг.9. Чертеж пластины с двумя расслоениями круглой формы.
Фиг.10. Геометрическая модель пластины с двумя дефектами круглой формы.
Фиг.11. Температурное поле поверхности пластины с дефектами, полученное с термографа.
Фиг.12. Температурное поле исследуемого участка пластины (повернуто на 90° относительно фиг.11).
Фиг.13. Система контуров для исследуемой области с дефектом в 3D.
Фиг.14. Система контуров для исследуемой области с дефектом (вид сверху).
Фиг.15. Конечно-элементная расчетная сетка: ортографическая проекция (а) и вид сверху (б).
Фиг.16. Поле возможных дефектов (в плане).
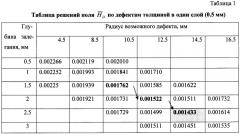
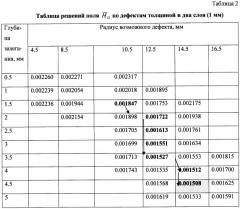
Фиг.17. Решения HD для поля возможных дефектов толщиной 0.5 мм.
Фиг.18. Распознанный «оптимальный» возможный дефект.
Фиг.19. Геометрическая модель половины пластины с распознанным дефектом.
Фиг.20. Структурная схема алгоритма модуля подготовки исходных данных.
Фиг.21. Структурная схема алгоритма работы программного комплекса.
Фиг.22. Структурная схема комплекса программно-аппаратных средств.
Фиг.23. Функциональная схема программно-аппаратных средств.
Фиг.24. Пример синтеза послойного распределения температурного поля при использовании метода активного термолокационого зондирования (неинвазивного) в соответствии с заявляемым способом диагностики, контроля лечения и прогноза сосудистой патологии в клинике внутренних болезней.
Фиг.25. Термограммы, полученные в результате экспериментальных исследований пациентов.
Заявленный способ осуществляется следующим образом.
Несмотря на то, что в качестве примера далее рассмотрена диагностика инклюзии сонной артерии (фиг.1), очевидно, что заявленный способ может быть применен для диагностики иных сосудистых патологий и других сосудов.
30% инсультов связано с патологией внутренней сонной артерии, которые не диагностируются у 70% у больных старше 40 лет с проявлениями атеросклероза (повышение АД, уровня холестерина и т.д.), процент инвалидности и смерти доходит до АД, уровня холестерина и т.д.), процент инвалидности и смерти доходит до 40% от общего числа перенесших инсульт.
Роль диагностики патологий сонной артерии заключается в локальной диагностике, увеличении скорости начала специфической терапии для исключения оперативного лечения, профилактическом проведении оперативного лечения (ангеопластика), бужирования внутренней сонной артерии, ускорении проведения оперативного лечения для больных с развивающемся инсультом, вызванным данной патологией внутренней сонной артерией.
В настоящее время диагноз стеноза внутренней сонной артерии ставится только после клинических проявлений инсульта. Заявленный способ обеспечивает диагностику на раннем этапе развития заболевания.
Согласно изобретению регистрируют температурное поле Тан(х,у) кожного покрова в шейной области, которое принимается за аномальное, имеющее минимальные дефекты (температурные аномалии на поверхности кожного покрова) Δхдmin, Δудmin.
На основании статистического анализа распределения аномалий температурного поля (на фиг.2 в качестве примера приведена гистограмма распределения размеров аномальных участков) определяют размеры минимальной аномалии (температурные аномалии на поверхности кожного покрова) Δхдmin, Δудmin путем решения системы уравнений:
где δ - вероятность того, что (Δхдi, Δудi)≥(Δхдmin, Δудmin);
р(ΔXi) - функция распределения величин Δхдi, Δудi.
На основании (Δхдmin, Δудmin) определяют пространственное разрешение аппаратуры (Δа), необходимое для регистрации температурного поля без потери пространственной информации, следующим образом:
где Δхдmin, Δудmin - геометрические размеры минимальной аномалии контролируемого объекта.
Определяют режимы регистрации температурного поля тепловизионной аппаратурой (на фиг.3 приведена геометрическая схема термолокационного зондирования).
Тепловизионную систему размещают перед контролируемой поверхностью на расстоянии, обеспечивающем:
- во-первых, одновременное наблюдение максимальной площади контролируемой поверхности с учетом поля обзора тепловизионной системы,
- во-вторых, достоверную регистрацию минимального по размерам локального участка изменения температуры (возможного дефектного участка) поверхности контролируемой поверхности.
При этих условиях расстояние от тепловизионной системы до контролируемой поверхности определяется следующим образом:
S≥Aдеф/(2Ntg(γ/2)),
где S - расстояние от тепловизионной системы до зоны контроля,
Адеф - характерный размер участка с локальным изменением температуры (дефектный участок),
N - коэффициент, определяющий достоверность регистрации локального участка (обычно на практике принимают N=3-10),
γ - угол мгновенного линейного поля зрения оптической системы тепловизионного прибора 6 (угловая разрешающая способность. Обычно, на практике, γ=5-10 угл. мин),
tg - тригонометрическая функция «тангенс».
Определяют оптимальный (или допустимый максимальный) временной период регистрации (τизм) на период повышения температуры вследствие введения препарата, исходя из скорости ее изменения.
В случае дискретного во времени наблюдения, т.е. когда температурное поле измеряется через определенный интервал времени (τизм=τ), появляется опасность пропустить (не обнаружить) аномалию, присущую патологии, если величина τ слишком велика. С другой стороны, при резком уменьшении τ появляется избыточная информация, и возникают трудности, связанные с ограниченными возможностями ЭВМ при обработке больших массивов информации в реальном времени.
Таким образом, возникает задача выбора такого «компромиссного» значения величины τ, чтобы, во-первых, обеспечить достаточную степень надежности при обнаружении аномалий, а во-вторых, не загружать ЭВМ избыточной информацией.
Поэтому решают задачу оптимального выбора интервала контроля при заданном значении вероятности Р необнаружения аномалий, т.е. задача о нахождении максимально возможного значения τ при заданной величине Р при длительности аномалии - Т:
Вероятность Р того, что дефект не будет обнаружен, определяется равенством:
.
где f(T) - плотность распределения длительности во времени информационного сигнала,
τ - временной интервал измерения,
Р - вероятность пропуска информационного сигнала,
Т0 - временная разрешающая способность измерительных датчиков,
η - параметр.
Решая данное равенство, определяют необходимый интервал (период) регистрации температурного поля (τизм).
Регистрируют температурное поле T0(x,y,t) кожного покрова до введения лекарственных препаратов, которое принимается за безаномальное - температурное поле в отсутствие патологии.
Определяют критерий минимальной аномальности Δmin следующим образом:
В кровь вводятся лекарственные препараты, например, никотиновую кислоту, витамин РР, продигиозан (внутримышечно), селективные препараты - группы нитратов (нитросорбит и др.), которые способствуют сосудорасширяющему эффекту и изменению скорости кровотока, что в течение определенного времени Δτиз=(0…τиз) увеличивает температуру кожной поверхности и температурные контрасты температурных аномалий на поверхности кожного покрова, т.е. увеличивают процесс нестационарности температурного поля.
Повышение температуры тела при назначении медикаментозных средств относится к осложнениям терапии. Однако эти проявления носят транзитный характер и легко купируются назначением жаропонижающих, антигистаминных средств.
Основной эффект повышения температуры тела связан с высвобождением биологически активных медиаторов (гистамин, серотинин и др., витаминно подобный эффект РР, никотиновая кислота), что способствует сосудорасширяющему эффекту и увеличению скорости кровотока. Это приводит к повышению температуры тела более чем на 2°С.
Важным является селективное повышение температуры, т.е. увеличение скорости кровотока в определенных органах, тканях, очагах инфекции, метастатических поражениях, местонахождения атеросклеротических бляшек и др.
Под действием лекарственных препаратов происходит увеличение кровотока.
Далее определяют оптимальный (или допустимый максимальный) временной период регистрации (τизм) на период повышения температуры вследствие введения препарата.
Измеряют время оптимального запаздывания (Δτзап) - интервал времени достижения максимального температурного контраста на поверхности кожи, начиная от момента приема препарата, определяемое характеристиками подкожного пространства.
Оптимальное время запаздывания измеряют следующим образом.
На поверхности кожи с временным периодом (τизм) фиксируют в течение времени одновременно значения температуры на качественной (Ткач) и «дефектной» (Т∂) области. Далее измеряют зависимость модуля разности этих температур от времени: и фиксируют максимальное значение модуля этой разности.
Время запаздывания будет равно времени, при котором достигается наибольшее значение . Т.е.
.
Далее определяют временной интервал измерения (Δτконтр) температурного поля поверхности кожи, включающий оптимальное время запаздывания (оптимальное время контроля). Как правило, исходя из практического опыта, временной интервал (длительность) проведения многократных измерений определяется следующим образом:
f(t)=0,5x f(t)max⇒Δτконтр
На фиг.4 в качестве примера приведен график, иллюстрирующий времена измерения и контроля.
Во временном интервале (Δτконтр), включающем оптимальное время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени (τизм), которое определяют заранее исходя из характеристик скорости измерения температурного поля - Тизм(х,у,t).
Сравнивают измеренные значения температурных полей кожной поверхности до и после введения лекарственных препаратов, например, следующим образом:
где суммирование ведется по координатам поверхности и по времени,
Nx - количество точек суммирования по координате x,
Ny - количество точек суммирования по координате у,
Nt - количество точек суммирования по времени t.
На основании сравнения формируют предварительное диагностическое заключение следующим образом:
По результатам проведенных измерений определяют границы участков поверхности кожи L(x,y), в области которых имеется патология кровотока, т.е. выполняется условие:
т.е. определяют контуры температурных аномалий на поверхности кожи при наличии патологий кровотока,
где L(x,y) - контур области температурной аномалии,
(х,у) - координаты контура области,
Нконстр - толщина исследуемого объекта от внутренней патологии до поверхности кожного покрова,
Dуч - характерный размер исследуемого участка кожной поверхности.
При наличии патологии кровотока в соответствии с предварительным диагностическим заключением на основе проведенных исследований формируют окончательное диагностическое заключение следующим образом.
Динамические температурные аномалии сравнивают с рассчитанными температурными аномалиями (например, методом невязки) на основе адекватной математической модели и определяют характеристики внутренних температурных источников (температуры, глубина залегания, геометрические размеры и др.), которые вызвали зарегистрированные температурные динамические температурные аномалии на кожной поверхности,
где F - функционал невязки (квадрат величины среднеквадратичного отклонения),
δ - величина критерия невязки - точность определения параметров внутренней патологии,
Тр - рассчитанная величина температурного поля посредством адекватной математической модели, описывающей процесс распределения теплового поля в исследуемой подкожной области,
Θ - вектор характеристик внутренней патологии,
Таким образом, решается задача неинвазивной термолокации (тепловой томографии).
Предпосылками для разработки методики по определению реальных трехмерных геометрических характеристик патологий (дефектов) являются значительные успехи в развитии теории и практики теплового неразрушающего контроля (работы О.Н.Будадина [1], В.П.Вавилова), теории распознавания образов и работы с цифровыми изображениями (работы Ю.И. Журавлева, Я.А. Фурмана [2], И.А. Биргера, Д. Терзополоуса, А.Розенфельда [3]), численного моделирования процессов теплопередачи в различных элементах конструкций, в том числе композитных (работы Зенкевича О., Кутателадзе С.С [4], Зарубина B.C., Димитриенко Ю.И.).
Основной идеей предлагаемой в настоящей статье методики распознавания трехмерных дефектов [5-7] является определение максимальной меры схожести имеющегося температурного поля поверхности диагностируемого объекта с температурным полем поверхности трехмерной модели, полученным путем численного моделирования трехмерной задачи теплопроводности [8] (численным моделированием условий теплового контроля). При этом сама трехмерная модель объекта контроля в начальный момент исследования предполагает отсутствие дефектов.
Разработанная методика вычислительной диагностики трехмерных дефектов состоит из следующих методик распознавания: 1) плоскостных геометрических параметров дефектов (методика распознавания контуров дефектов), решающей задачу приближенного нахождения с заданной точностью формы дефектов и их положение в плоскости; 2) трехмерных дефектов в элементах конструкций, в том числе из композитных материалов, основанной на численном решении трехмерной задачи теплопроводности и решении задачи распознавания дефекта, имеющего максимальную схожесть с реальным.
Общая схема методики вычислительной диагностики аномалий кровотока (дефектов) на основе теплового неразрушающего контроля представлена на фиг.5.
Рассмотрим алгоритм работы методики распознавания плоскостных геометрических параметров.
Имеется видеоизображение теплового поля (тепловизионное изображение) поверхности исследуемого объекта, представленное в виде двухмерной матрицы, элементами которой являются значения температуры. Данная матрица температур является входными данными алгоритма выделения контуров (реализованы отслеживающие алгоритмы «жука» и Розельфельда [3, 9-10]), который преобразует данную матрицу в систему замкнутых контуров [2].
Размеры каждого контура оцениваются относительно площади контролируемой поверхности, и осуществляется определение их геометрических центров. Далее производится построение контурного «скелета», образуемого геометрическими центрами контуров смежных уровней и показывающего количество предполагаемых дефектов и изменение их формы по толщине исследуемого объекта контроля.
Производится распознавание формы контуров (рассматривается п