Катализатор для получения сложных эфиров карбоновых кислот, способ его получения и способ получения сложных эфиров карбоновых кислот
Иллюстрации
Показать всеИзобретение относится к катализаторам для получения сложного эфира карбоновой кислоты. Описан катализатор для получения сложного эфира карбоновой кислоты путем взаимодействия (а) альдегида и спирта или (b) одного или нескольких видов спиртов, в присутствии кислорода, содержащий окисленный никель; и X, где Х представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из палладия, платины, рутения, золота, серебра и меди, нанесенных на носитель в интервале атомного соотношения Ni/(Ni+X) от 0,20 до 0,99. Описан способ получения катализатора для получения сложного эфира карбоновой кислоты, включающий первую стадию получения предшественника катализатора осаждением никеля и компонента X, где Х представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из палладия, платины, рутения, золота, серебра и меди на носителе нейтрализацией кислого раствора растворимой металлической соли, содержащего никель и X; и вторую стадию окисления никеля термообработкой полученного предшественника катализатора, причем атомное соотношение Ni/(Ni+X) составляет от 0,20 до 0,99. Описан также способ получения сложного эфира карбоновой кислоты, включающий стадию взаимодействия описанного выше катализатора с (а) альдегидом и спиртом или (b) одним или несколькими видами спиртов, в присутствии кислорода. Технический результат - получен активный катализатор для получения сложного эфира карбоновой кислоты. 3 н. и 14 з.п. ф-лы, 5 табл., 5 ил.
Реферат
Область техники
Настоящее изобретение относится к катализатору для получения сложных эфиров карбоновых кислот путем взаимодействия альдегида и спирта, или одного, или нескольких видов спиртов, в присутствии кислорода, к способу получения катализатора и к способу получения сложных эфиров карбоновых кислот с использованием катализатора.
Предшествующий уровень техники
Способ получения сложных эфиров карбоновых кислот в промышленных масштабах, в случае метилметакрилата, например, может включать способ, в котором метакриловую кислоту получают окислением метакролеина кислородом с последующим взаимодействием метакриловой кислоты с метанолом, чтобы получить метилметакрилат. Однако гетерополикислотный катализатор, используемый на стадии получения метакриловой кислоты окислением метакролеина, имеет проблемы, связанные с термической стабильностью, и постепенно разлагается при температурных условиях реакции. Кроме того, выход также еще остается недостаточным, предоставляя, таким образом, возможность для улучшения промышленного катализатора.
С другой стороны, прямой метапроцесс получения метилметакрилата или метилакрилата за одну стадию путем взаимодействия метакролеина или акролеина с метанолом и молекулярным кислородом является простым способом, который не требует отделения легко полимеризуемой метакриловой кислоты или акриловой кислоты и в настоящее время привлекает внимание вследствие более высокого выхода метилметакрилата по сравнению с вышеуказанным способом.
В таком способе в качестве катализатора используется катализатор, содержащий преимущественно палладий. Однако в процессе получения метилметакрилата или метилакрилата за одну стадию путем взаимодействия метакролеина или акролеина с метанолом и молекулярным кислородом, поскольку метакролеин или акролеин является ненасыщенным альдегидом, многочисленные ацетали ненасыщенного альдегида и алкокси-формы, образуемые добавлением спирта к ненасыщенным связям, образуются в виде побочных продуктов, что также приводит к проблеме, связанной с образованием газообразного диоксида углерода, который является конечным продуктом окисления (см. патентный документ 1).
В связи с этим созданы модификации катализатора для преодоления этих проблем. Например, сообщалось, что вышеуказанные проблемы, относящиеся к образованию побочных продуктов, решены, и сложный эфир карбоновой кислоты может быть получен с высоким выходом в результате использования катализатора, содержащего интерметаллическое соединение, имеющее в своем составе палладий и по меньшей мере один элемент, выбранный из группы, состоящей из свинца, ртути, висмута и таллия, или катализатора, содержащего соединение щелочного металла или соединение щелочноземельного металла (см. патентный документ 2).
С другой стороны, хотя, как полагали в течение длительного времени, для катализаторов, используемых в данном способе, требуется присутствие катализатора, содержащего палладий, в последнее время сообщалось об использовании катализаторов, которые содержат благородный металл, такой как рутений или золото, нанесенный на носитель. Конкретные примеры таких способов включают использование катализатора, в котором золото нанесено на носитель (см. патентный документ 3), или использование катализатора, содержащего рутений (см. патентный документ 4), в процессе получения сложного эфира карбоновой кислоты путем взаимодействия альдегида и спирта в присутствии содержащего кислород газа.
Патентный документ 1: публикация патента Японии № S45-34368
Патентный документ 2: публикация патента Японии № S62-7902
Патентный документ 3: выложенная заявка на патент Японии № 2000-154164
Патентный документ 4: выложенная заявка на патент Японии № 2001-220367.
Описание изобретения
Задачи, решаемые настоящим изобретением
Как бы то ни было, в каждом из известных способов, описанных выше, селективность полученных сложных эфиров карбоновых кислот и активность катализатора являются недостаточными, и, поскольку дорогие благородные металлы, такие как палладий, рутений и золото, используют путем нанесения на носитель в больших количествах, экономическое бремя, вытекающее из увеличенных затрат на производство катализатора, велико, что затрудняет, следовательно, рассмотрение этих способов как выгодных в промышленных масштабах.
Кроме того, поскольку палладий, рутений и золото, которые используются в вышеуказанных способах производства, являются представителями благородных металлов, они являются дорогостоящими, и в качестве компонента катализатора их часто используют посредством диспергирования и нанесения на носитель, делая, тем самым, в таких случаях чрезвычайно важным выбор носителя.
Ставя задачу практического применения промышленного способа, в результате проведенных обширных исследований катализаторов с нанесенными композитными наночастицами, содержащими окисленный никель и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди), авторами настоящего изобретения сделан несомненный вывод о том, что катализатор, удовлетворительный с точки зрения его срока службы, необязательно получается в случае использования активированного угля, карбоната кальция, оксида алюминия, оксида кремния или оксида кремния с диоксидом титана в качестве носителя. А именно, в случае участия в реакции катализатора в виде суспензии в обычно применяемом промышленном реакторе-резервуаре с перемешиванием или барботажном реакторе в виде башни и т.п., механическая прочность была недостаточной и отслаивание никеля и компонента X, которые являются компонентами катализатора, наблюдалось в случае активированного угля. Кроме того, хотя оксид алюминия обладает высокой механической прочностью, прочность носителя уменьшается вследствие коррозии под действием кислых веществ, примерами которых являются типичные побочные продукты реакции, метакриловая кислота и акриловая кислота, что приводит к недостатку, заключающемуся в более легком отслаивании никеля и компонента X, которые являются компонентами катализатора. Использование карбоната кальция для носителя приводит к еще большей чувствительности к возникновению коррозии под воздействием кислых веществ, чем в случае оксида алюминия, делая его, тем самым, непригодным для промышленного применения. В случае оксида кремния или оксида кремния с диоксидом титана, часть оксида кремния постепенно разъедается водой, введенной в ходе процесса, или водой, полученной в виде побочного продукта реакции, что приводит к вымыванию оксида кремния, при этом одновременно также наблюдается отслаивание и вымывание никеля и компонента X, которые являются компонентами катализатора. Следовательно, имеют место проблемы, связанные с тем, будут ли эти вещества оставаться стабильными на протяжении длительного периода использования. Кроме того, имеются также проблемы с механической прочностью, которая ниже, чем у вышеупомянутого оксида алюминия.
С другой стороны, сообщалось об исследованиях способов получения силикагеля и исследованиях по применению высокотемпературного спекания для модификации силикагеля с целью повышения механической прочности и коррозионной стойкости оксида кремния. Однако не сообщалось о примерах успешного повышения механической прочности и устойчивости к гидролизу без ухудшения функциональных качеств катализатора. Например, известно, что кварц, который представляет собой вид вещества на основе оксида кремния, является твердым, имеет высокую механическую прочность и обладает высокой устойчивостью к гидролизу. Однако в случае использования кварца в качестве носителя, хотя механическая прочность и коррозионная стойкость заметно улучшаются, это также приводит к уменьшению удельной поверхности (1 м2/г или меньше), и поскольку это препятствует тому, чтобы металлический катализатор был загружен в виде тонких частиц в высокодисперсном состоянии, возникает проблема, связанная с чрезвычайно низкой реакционной способностью полученного в результате катализатора.
С учетом этого технического уровня, как описано выше, в настоящее время существует потребность в носителе катализатора, который обладает высокой механической прочностью и является физически стабильным, а также имеет большую площадь поверхности, подходящую для использования в качестве носителя катализатора, проявляет достаточную коррозионную стойкость по отношению к характерной жидкофазной реакции в форме реакции синтеза сложного эфира карбоновой кислоты в присутствии кислорода и способен к стабильному нанесению никеля и компонента X, которые являются активными компонентами катализатора, на протяжении длительного периода времени.
С учетом изложенного выше, задачей настоящего изобретения является создание катализатора для получения сложного эфира карбоновой кислоты путем взаимодействия альдегида и спирта, или одного, или нескольких видов спиртов, в присутствии кислорода, в котором высокий уровень реакционной способности поддерживается за счет использования в качестве основных компонентов катализатора стабильных металлических элементов, обладающих превосходной реакционной способностью, вместо обычных дорогостоящих благородных металлов, создание способа получения такого катализатора и создание способа получения сложных эфиров карбоновых кислот с использованием такого катализатора.
Средства для разрешения проблем
В результате проведения обширных исследований для разрешения вышеуказанных проблем авторами данного изобретения найдено, что вышеуказанные проблемы могут быть решены с помощью катализатора для получения сложного эфира карбоновой кислоты, в котором окисленный никель и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди) наносят на носитель в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99.
А именно, данное изобретение описано ниже.
[1] Катализатор для получения сложного эфира карбоновой кислоты путем взаимодействия (a) альдегида и спирта, или (b) одного, или нескольких видов спиртов, в присутствии кислорода, содержащий:
окисленный никель; и
X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди), нанесенные на носитель в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99.
[2] Катализатор для получения сложного эфира карбоновой кислоты по п.[1], содержащий композитную наночастицу, состоящую из окисленного никеля и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди).
[3] Катализатор для получения сложного эфира карбоновой кислоты по п.[2], в котором композитная наночастица является частицей, имеющей X в своей сердцевине, и поверхность сердцевины покрыта окисленным никелем.
[4] Катализатор для получения сложного эфира карбоновой кислоты по п.[2] или [3], в котором дополнительно к композитной наночастице на носитель наносят независимо окисленный никель.
[5] Катализатор для получения сложного эфира карбоновой кислоты по любому из пп.[1]-[4], в котором окисленный никель является оксидом никеля и/или сложным оксидом, содержащим никель.
[6] Катализатор для получения сложного эфира карбоновой кислоты по любому из пп.[1]-[5], в котором носитель является алюминийсодержащей композицией на основе оксида кремния, которая содержит оксид кремния и оксид алюминия, и количество алюминия находится в интервале от 1 до 30 мол.%, в расчете на общее молярное количество кремния и алюминия.
[7] Катализатор для получения сложного эфира карбоновой кислоты по п.[6], в котором носитель дополнительно содержит по меньшей мере один вид основного металлического компонента, выбранного из группы, состоящей из щелочного металла, щелочноземельного металла и редкоземельного металла.
[8] Катализатор для получения сложного эфира карбоновой кислоты по п.[6] или [7], в котором соотношение никеля и оксида алюминия составляет от 0,01 до 1,0, в расчете на атомное соотношение Ni/Al.
[9] Катализатор для получения сложного эфира карбоновой кислоты по п.[7] или [8], в котором соотношение никеля и основного металлического компонента составляет от 0,01 до 1,2, в расчете на атомное соотношение Ni/(щелочной металл + щелочноземельный металл + редкоземельный металл).
[10] Катализатор для получения сложного эфира карбоновой кислоты по любому из п.п.[1]-[9], в котором носитель является композицией, содержащей оксид кремния, оксид алюминия и оксид магния, и содержит от 42 до 90 мол.% кремния, от 5,5 до 38 мол.% алюминия и от 4 до 38 мол.% магния, в расчете на общее молярное количество кремния, алюминия и магния.
[11] Катализатор для получения сложного эфира карбоновой кислоты по п.[10], в котором соотношение никеля и оксида алюминия составляет от 0,01 до 1,0, в расчете на атомное соотношение Ni/Al, и соотношение никеля и оксида магния составляет от 0,01 до 1,2, в расчете на атомное соотношение Ni/Mg.
[12] Катализатор для получения сложного эфира карбоновой кислоты по любому из пп.[1]-[11], в котором удельная поверхность составляет от 20 до 350 м2/г, диаметр пор с максимальной повторяемостью составляет от 3 до 50 нм, объем пор составляет от 0,1 до 1,0 мл/г и диаметр частиц составляет от 10 до 200 мкм.
[13] Способ получения катализатора для получения сложного эфира карбоновой кислоты, включающий:
первую стадию получения предшественника катализатора осаждением никеля и компонента X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди) на носителе нейтрализацией кислого раствора растворимой металлической соли, содержащего никель и X; и
вторую стадию окисления никеля термообработкой полученного предшественника катализатора.
[14] Способ получения сложного эфира карбоновой кислоты, включающий стадию взаимодействия катализатора для получения сложного эфира карбоновой кислоты по любому из пп.[1]-[12] с (a) альдегидом и спиртом, или (b) одним или несколькими видами спиртов, в присутствии кислорода.
[15] Способ получения сложного эфира карбоновой кислоты по п.[14], в котором альдегидом является соединение, выбранное из акролеина, метакролеина и их смеси.
[16] Способ получения сложного эфира карбоновой кислоты по п.[14], в котором альдегидом является соединение, выбранное из акролеина, метакролеина и их смеси, а спиртом является метанол.
[17] Способ получения сложного эфира карбоновой кислоты по п.[14], в котором одним видом спирта является этиленгликоль, а другим видом спирта является метанол.
Преимущества данного изобретения
В соответствии с данным изобретением могут быть созданы катализатор для получения сложного эфира карбоновой кислоты, который поддерживает высокий уровень реакционной способности за счет использования для основного компонента катализатора стабильного соединения никеля, обладающего превосходной реакционной способностью, вместо обычных дорогостоящих благородных металлов, способ получения такого катализатора и способ получения сложного эфира карбоновой кислоты с использованием такого катализатора.
Краткое описание чертежей
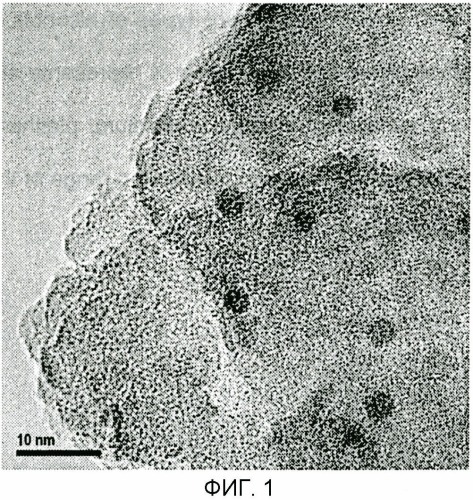
На фиг.1 показана микрофотография, полученная с помощью просвечивающего электронного микроскопа (TEM, светлопольное изображение), катализатора для получения сложного эфира карбоновой кислоты примера 4;
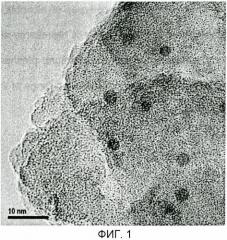
На фиг.2 показана увеличенная микрофотография, представленная на фиг.1, и изображение ее части, полученное с использованием быстрого преобразования Фурье (FFT);
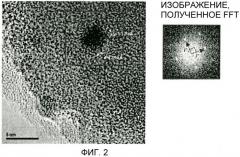
На фиг.3 показана микрофотография, полученная с помощью сканирующего просвечивающего электронного микроскопа (STEM, светлопольное изображение), катализатора для получения сложного эфира карбоновой кислоты примера 4 вместе с результатами анализа состава в указанных точках методом энергодисперсионной рентгеновской спектроскопии;
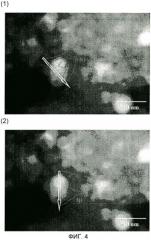
На фиг.4 показаны микрофотографии, полученные с помощью сканирующего просвечивающего электронного микроскопа (STEM, светлопольное изображение), катализатора для получения сложного эфира карбоновой кислоты примера 4 вместе с линейным профилем его состава, полученным методом энергодисперсионной рентгеновской спектроскопии; и
На фиг.5 показан график, иллюстрирующий результаты анализов методом спектроскопии в УФ и видимой областях катализатора для получения сложного эфира карбоновой кислоты примера 4.
Лучший вариант осуществления данного изобретения
Представленное ниже описание дает подробное пояснение лучшего варианта осуществления данного изобретения (ссылка на который дается как на «данный вариант осуществления»). Кроме того, данное изобретение не ограничивается вариантами осуществления, представленными ниже, и может быть осуществлено при некотором изменении различным образом в пределах объема данного изобретения.
Катализатор для получения сложного эфира карбоновой кислоты в соответствии с данным вариантом осуществления представляет собой катализатор для получения сложного эфира карбоновой кислоты путем взаимодействия (a) альдегида и спирта, или (b) одного или нескольких видов спиртов, в присутствии кислорода, в котором окисленный никель и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди) нанесены на носитель в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99.
Катализатор для получения сложного эфира карбоновой кислоты в соответствии с данным вариантом осуществления предпочтительно дополнительно содержит композитные наночастицы, состоящие из окисленного никеля и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди).
Окисленный никель предпочтительно является оксидом никеля, образованным связыванием никеля и кислорода, (например, Ni2O, NiO, NiO2, Ni3O4 или Ni2O3), или сложным оксидом, содержащим никель, например, соединением оксида никеля, твердым раствором или их смесью, и образованным связыванием никеля и X и/или одного или нескольких видов другого металлического элемента и кислорода.
Термин «оксид никеля», используемый в данном описании, относится к соединению, содержащему никель и кислород. Оксид никеля включает Ni2O, NiO, NiO2, Ni3O4 или Ni2O3, или гидраты вышеуказанных соединений, гидропероксиды никеля, содержащие группу OOH, или пероксиды никеля, содержащие группу O2, или смесь вышеуказанных соединений и т.п.
Кроме того, термин «сложный оксид», используемый в данном описании, относится к оксиду, содержащему два или более видов металлов. Термин «сложный оксид» относится к оксиду, в котором два или более видов оксидов металла образуют соединение, и хотя это включает двойные оксиды, в которых ионы оксокислот не присутствуют в качестве структурных единиц (такие как оксиды никеля типа перовскита или шпинели), он также включает все оксиды в более широком смысле, чем двойные оксиды, в которых объединены два или более видов металлов. Оксиды, в которых два или более видов металлических оксидов образуют твердый раствор, также попадают в диапазон сложных оксидов.
Ниже дается разъяснение действия, в результате которого проявляется чрезвычайно высокая эффективность действия катализатора за счет нанесения окисленного никеля и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди) на носитель в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99.
Авторами данного изобретения найдено, что каталитическая активность, присущая оксидам никеля, обладающим активностью в отношении окислительной этерификации, достигается объединением оксида никеля и X, и что проявляется необыкновенно высокая эффективность действия катализатора, не проявляемая катализаторами, состоящими из каждого отдельного компонента. Это может быть приписано уникальному эффекту, проявляющемуся как результат объединения оксида никеля и X, и, как полагают, может быть результатом образования нового каталитического действия, который полностью отличается от действия катализаторов, состоящих из каждого отдельного компонента, вследствие, например, образования бинарного функционального катализатора или новых активных компонентов между обоими металлическими компонентами. На основании этой новой концепции, в случае нанесения окисленного никеля и X на носитель в высокодисперсном состоянии, могли быть, в частности, реализованы характеристики катализатора, коренным образом отличающиеся от тех, что получены для катализаторов в соответствии с известным уровнем техники.
В прошлые годы наночастицы, которые привлекли значительное внимание вследствие достижений, полученных в технологии синтеза ультратонких частиц, получили признание в качестве основного материала в области нанотехнологии, и исследование их прогрессирует во всем мире. Наночастицы, имеющие диаметр частицы 100 нм или меньше, отличаются от крупных частиц в том, что они имеют высокую долю поверхностного металлического элемента среди металлических элементов, которые составляют наночастицы, что в результате приводит к тому, что площадь поверхности металлического элемента на единицу массы быстро увеличивается с уменьшением размера частицы. Примеры наночастиц, известных в области каталитических материалов, могут включать металлические наночастицы, такие как наночастицы платины, палладия, рутения, родия, золота, серебра и меди, или наночастицы металлического оксида, такие как наночастицы оксида железа, оксида кобальта, оксида никеля, оксида цинка, оксида титана, оксида циркония, оксида индия, оксида алюминия и оксида кремния, и эти наночастицы привлекают внимание в качестве гетерогенных каталитических материалов. А именно, одна из причин в возрастающем внимании, которое уделяется применению наночастиц в каталитических материалах, заключается в том, что, поскольку фактор, который способствует каталитическому действию, ограничивается металлическим элементом, присутствующим на поверхности частиц, то в случае применения на наноуровне площадь поверхности на единицу массы металлического элемента, вовлеченного в реакцию (удельная поверхность), увеличивается, посредством чего увеличивается активность катализатора в расчете на массу металлического элемента. Изменения в каталитическом действии, приписываемые размеру наночастиц, таким образом, широко известны как «эффекты размера частиц».
С другой стороны, имеются также случаи, в которых проявляются новые эффекты, в дополнение к этим эффектам размера частиц. Например, действие бинарных металлических наночастиц известно как один из факторов, оказывающих значительное влияние на каталитическое действие наночастиц. Это действие относится к эффекту, который не может быть проявлен единственным металлическим компонентом и проявляется лишь как результат объединения. Сплавы, как на них ссылаются в соответствии с известным уровнем техники, являются известным примером этого (бинарные металлические наночастицы относятся не только к случаю элементарных компонентов, являющихся металлами, но также включают случаи, в которых объединены металлические соединения или металлы и металлические соединения. Хотя размер и форма частиц являются основными параметрами, контролируемыми в случае наночастиц, состоящих из единственного элемента, в случае наночастиц, состоящих из двух или более видов элементарных компонентов, дополнительные контролируемые параметры включают состав, кристаллическую структуру и фазовую структуру (например, структуру сплава или твердого раствора, в которой кристаллические позиции случайным образом заняты химическими компонентами, структуру сердцевина-оболочка, в которой каждый химический компонент отделен в форме концентрических сфер, анизотропную фазовую структуру, в которой фазы разделены анизотропным образом, и структуру с гетерофильными связями, в которой оба химических компонента присутствуют рядом друг с другом на поверхности частиц). А именно, как результат использования структуры бинарного соединения, происходят изменения в массе металлического компонента, приводя к проявлению химических и электронных свойств, которые отчетливо отличаются от одиночных наночастиц. Таким образом, найдено, что бинарные металлические наночастицы проявляют новые каталитические, магнитные и оптические свойства, которые не обнаруживаются у наночастиц, состоящих из единственного вида металлического элемента, и разработаны способы их применения, помимо катализаторов, в различных областях, таких как материалы для электронной техники, медицина и биотехнология.
Авторами данного изобретения проведен широкомасштабный поиск материалов с целью создания катализаторов, обладающих высокой селективностью и активностью при получении сложного эфира карбоновой кислоты, а также имеющих в качестве их основного компонента недорогой металлический элемент с высокой реакционной способностью, чтобы заменить ими дорогостоящие благородные металлы в соответствии с известным уровнем техники. Внимание было сосредоточено на никеле как на элементе, имеющем свойства, которые сходны со свойствами благородных металлов, и были проведены обширные исследования по корреляции между его химическим состоянием и реакционной способностью, которые привели к завершению данного изобретения. А именно, как было описано ранее, катализатор по данному варианту осуществления содержит окисленный никель и X в качестве бинарного металлохимического компонента (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди), нанесенные на носитель в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99. Катализатор по данному варианту осуществления предпочтительно дополнительно содержит наночастицы, состоящие из окисленного никеля и X (где X представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди). Ниже представлено более подробное пояснение такого катализатора.
Когда авторы данного изобретения использовали в качестве катализатора оксиды никеля, в настоящее время привлекающие внимание в качестве катализатора окисления спирта, было впервые найдено, что, несмотря на низкий уровень активности, даже один оксид никеля (NiO) проявляет активность в отношении образования сложного эфира карбоновой кислоты. Более того, в результате проведения дополнительных исследований авторы данного изобретения отчетливо показали, что высокоокисленный пероксид никеля (NiO2) проявляет более высокие эксплуатационные качества по сравнению с оксидом никеля. С другой стороны, активность не наблюдалась в случае применения одного лишь металлического никеля (Ni).
На основании этих сведений было сделано предположение, что недорогой металлический элемент, никель, может быть использован в качестве основного компонента катализатора. Затем авторы данного изобретения исследовали добавление различных металлических элементов к оксиду никеля по изменению окисленного состояния никеля, рассчитывая выяснить возможности дополнительного улучшения характеристик катализатора путем регулирования окисленного состояния никеля и нанесения активного компонента на носитель в высокодисперсном состоянии. В результате авторами данного изобретения найдено, что путем нанесения окисленного никеля и по меньшей мере одного металлического компонента, выбранного из группы, состоящей из никеля, палладия, платины, рутения, золота, серебра и меди, на носитель в высокодисперсном состоянии в интервале атомного соотношения Ni/(Ni + X) от 0,20 до 0,99 происходит конверсия оксида никеля из нормального окисленного состояния в высокоокисленный оксид никеля, посредством чего значительно повышается активность и селективность по сравнению с катализаторами, состоящими единственно из каждого элемента, или катализаторами, в которых атомное соотношение Ni/(Ni + X) находится вне вышеуказанного интервала.
Например, когда золото выбрано в качестве X и оксид никеля и золото нанесены на носитель в высокодисперсном состоянии, проявляется очень высокая активность катализатора. Наблюдалось, что этот катализатор проявляет более высокую селективность при получении сложного эфира карбоновой кислоты по сравнению с катализаторами, в которых только один оксид никеля или только лишь золото нанесены на носитель, и значительное повышение активности наблюдалось для конкретного соотношения Ni/(Ni + Au). В отношении активности катализатора в расчете на атом металла, активность (Ni + Au) при образовании сложного эфира карбоновой кислоты выше, чем активность катализаторов, состоящих из каждого компонента в отдельности, и функционирование катализатора, относимое к их объединению, в значительной степени зависит от нанесенной композиции никеля и золота. Это, как предполагают, обусловлено наличием соотношения, оптимального для образования окисленного состояния никеля, которое оптимально для реакции. Таким образом, в результате нанесения на носитель двух компонентов, оксида никеля и золота, в дисперсном состоянии проявлялись заметные эффекты объединения, которые не могли быть спрогнозированы простым суммированием эффектов, создаваемых каждым компонентом в отдельности.
В вышеуказанном катализаторе окисленный никель и золото нанесены на носитель в высокодисперсном состоянии, и оба компонента объединены на наноуровне. На основании результатов наблюдений с помощью просвечивающего электронного микроскопа/сканирующего просвечивающего электронного микроскопа (TEM/STEM) почти сферические наночастицы, имеющие распределение частиц по диаметру от 2 до 3 нм, были нанесены равномерно диспергированными на носитель. На основании элементного анализа наночастиц методом энергодисперсионной рентгеновской спектроскопии (EDS) как никель, так и золото присутствуют во всех частицах и, как наблюдали, находятся в виде наночастиц из золота, поверхность которых покрыта никелем. Кроме того, отдельный компонент никеля был обнаружен нанесенным на носитель, в дополнение к наночастицам, содержащим никель и золото.
Согласно результатам рентгеновской фотоэлектронной спектроскопии (XPS) и порошковой рентгеновской дифракции (порошковая XRD), хотя золото присутствует в виде кристаллического металла, никель, как предполагают, присутствует в виде аморфного оксида с валентностью 2.
На основании результатов спектроскопии в УФ и видимой области спектра, обеспечивающей возможность наблюдения изменений электронных возбужденных состояний, было установлено, что объединение окисленного оксида никеля и золота вызывает исчезновение пика поглощения поверхностных плазмонов (примерно при 530 нм), обусловленного наночастицами золота и наблюдавшегося в наночастицах золота, состоящих единственно из золота в качестве компонента. Исчезновение этого пика поглощения поверхностных плазмонов не наблюдалось в комбинациях золота и компонента металлического оксида, иного, чем оксид никеля, например оксида хрома, оксида марганца, оксида железа, оксида кобальта, оксида меди или оксида цинка, комбинации с которыми, как наблюдалось, не оказывают влияния на реакцию. Исчезновение этого пика поглощения поверхностных плазмонов является, как полагают, результатом смешивания электронных состояний на границе раздела между окисленным никелем и золотом или, иными словами, гибридизацией двух видов металлохимических компонентов.
Конверсию в высокоокисленный оксид никеля можно наблюдать по изменению цвета в катализаторе и с помощью спектроскопии в УФ и видимой части спектра. В результате добавления золота к оксиду никеля цвет оксида никеля изменяется от серовато-зеленого до коричневого, и УФ-спектр показывает поглощение на протяжении почти всей видимой области спектра. Вид УФ-спектра и цвет катализатора сходны с видом спектра и цветом высокоокисленного пероксида никеля (NiO2), использованного в качестве сравнительного образца. На основании этого вывода предполагают, что оксид никеля конвертирован в высокоокисленный оксид никеля в результате добавления золота.
На основании этих результатов полагают, что структура композитных наночастиц такова, что наночастицы золота расположены в сердцевине, поверхность наночастиц золота покрыта высокоокисленным оксидом никеля и атомы золота не присутствуют на поверхности композитных наночастиц.
Предполагаемый принцип действия
Ниже представлено пояснение предполагаемого принципа действия катализаторов в соответствии с данным вариантом осуществления с использованием примера модификации и улучшения соединений никеля, для которых были проведены исследования в отношении их использования в качестве катализаторов и материалов электронной техники.
Примеры применения гетерогенных соединений никеля для окислительных реакций в соответствии с известным уровнем техники могут включать (1) способ окисления спирта с использованием пероксида никеля (NiO2) в качестве стехиометрического окислителя (J. Org. Chem. 27 (1962) 1597), (2) реакцию окисления спирта на основе кислорода с использованием Ni-Al гидротальцита в качестве катализатора (Angew. Chem. Int. Ed. 40 (2001) 763), (3) реакцию окисления спирта на основе кислорода с использованием Mg-Al гидротальцита, содержащего Ni(II), в качестве катализатора (J. Mol. Catal. A 236 (2005) 206), (4) реакцию окисления спирта на основе кислорода с использованием наночастиц пероксида никеля (NiO2) в качестве катализатора (Appl. Catal. A 290 (2005) 25) и т.п.
Хотя высокоокисленный пероксид никеля имеет более высокую окислительную способность, чем обычный оксид никеля, и давно известно, что он способен окислять различные спирты стехиометрическим образом, в результате различных модификаций и улучшений никелевых катализаторов в прошлые годы осуществлены реакции каталитического окисления спирта молекулярным кислородом. Катализаторы на основе содержащего никель гидротальцита предоставляют возможность никелю функционировать в качестве мест активации кислорода посредством объединения никеля и другого металлического элемента (такого как Al или Mg), и это, как полагают, приводит к образованию пероксидного компонента в качестве реакционного компонента на никеле. Кроме того, сообщалось о том, что в способах с использованием наночастиц пероксида никеля реакции протекают каталитически в результате образования пероксида никеля в виде наночастиц.
Оксид никеля используют в качестве электрохромного материала, например, в области материалов для электронной техники, иных, чем катализаторы. Для того чтобы повысить скорость реакции пленок оксида никеля при фотопоглощении, проведены исследования (5) пленки химического соединения NiO-Me (где Me представляет собой Au, Ag, Cu, Ni, Pd или Pt), в которой металл (Me) легирован оксидом никеля (J. Phys. D: Appl. Phys. 36 (2003) 2386). Металлы, легированные оксидом никеля, действуют в качестве дырочного материала, и скорость окрашивания при окислении, как полагают, возрастает, когда оксид никеля конвертируется в высокоокисленный оксид никеля.
Такие примеры применения соединений никеля дают важные указания в отношении понимания проявления каталитической способности, демонстрируемой катализатором по данному варианту осуществления. Хотя авторами данного изобретения найдено, что пероксид никеля проявляет активность в реакциях синтеза сложного эфира карбоновой кислоты, уровень активности катализатора был низким. Чистый пероксид никеля и его ангидриды еще должны быть получены, в этом отношении имеется много аспектов их структуры, которые остаются неясными, и он также рассматривается как форма оксида никеля (двухвалентного), которая имеет адсорбированный кислород. Однако поскольку пероксид никеля широко применим в качестве аген