Сукцинат n-(2,4,6-триметилфенил)амида 2-(бета-n, n-диэтиламиноэтиламино)-4-оксо-4-(4-метилфенил)-2-бутеновой кислоты, проявляющий местноанестезирующую и противомикробную активность
Иллюстрации
Показать всеЗаявляемое новое соединение относится к аминопроизводным амидов ацилпировиноградных кислот и является биологически активным - сукцинат N-(2,4,6-триметилфенил)амида 2-(β-N,N-диэтиламиноэтиламино)-4-оксо-4-(4-метил-фенил)-2-бутеновой кислоты формулы (I). Технический результат заключается в том, что заявленное соединение проявляет выраженную местноанестезирующую и противомикробную активность. 3 табл.
Реферат
Заявляемое соединение относится к области органической химии, к аминопроизводным амидов ацилпировиноградных кислот, а именно к новым биологически активным веществам - сукцинату N-(2,4,6-триметилфенил)амида 2-(β-N,N-диэтиламиноэтиламино)-4-оксо-4-(4-метилфенил) 2-бутеновой кислоты формулы (I):
который может найти применение в качестве местноанестезирующего, антисептического лекарственного препарата.
Известны структурные аналоги заявляемого соединения, получаемые взаимодействием амидов ароилпировиноградных кислот с ароматическими аминами [А.О.Беляев, Е.Н.Козьминых, P.P.Махмудов, В.О.Козьминых, Т.Ф.Одегова. Амиды и гидразиды ацилпировиноградных кислот. Сообщение 10. Синтез, противомикробная и анальгетическая активность ариламидов 4-арил-ариламино-4-оксо-2-бутеновых кислот // Хим.-фарм. журн. - 2004. - Т.38. - №7. - С.19-21].
В качестве эталона сравнения взят местноанестезирующий препарат - тримекаин [Машковский М.Д. Лекарственные средства. В 2 т. - 14-е изд., перераб., испр. и доп. - М.: ООО «Издательство Новая Волна», 2000].
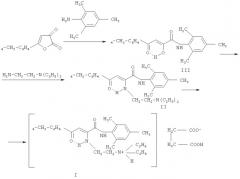
Целью предлагаемого изобретения является синтез нового не описанного ранее сукцината N-(2,4,6-триметилфенил)амида 2-(β-N,N-диэтиламиноэтиламино)-4-оксо-4-(4-метилфенил)2-бутеновой кислоты, обладающего местноанестезирующим и противомикробным свойствами. Поставленная цель достигается дециклизацией 5-(4-метилфенил)-2,3-дигидро-2,3-фурандиона с 2,4,6-триметиланилином в мягких условиях с последующим взаимодействием с N,N-диэтиламиноэтилендиамином по схеме:
Синтез N-(2,4,6-диметилфенил)амида 2-гидрокси-4-оксо-4-(4-хлорфенил) 2-бутеновой кислоты (III) осуществлен по аналогии с ранее описанной методикой [Андрейчиков Ю.С., Милютин А.В., Крылова И.В., Сараева Р.Ф., Дормидонтова Е.В., Дровосекова Л.П., Назметдинов Ф.Я., Колла В.Э. Синтез и биологическая активность гетериламидов ароилпировиноградных кислот и 5-арилпиразол-3-карбоновых кислот // Хим.-фарм. журн. - 1990. - Т.24. - №7. - С.33-35].
Пример получения соединения (II)
К раствору 3,25 г (0,01 моля) N-(2,4,6-триметилфенил)амида 4-(4-метилфенил)-2-гидрокси-4-оксо-2-бутеновой кислоты (III), растворенного в 15-20 мл абсолютного толуола, при перемешивании добавляли раствор 1,16 г (0,01 моля) N,N-диэтиламиноэтиламина и кипятили в течение 15 минут. Смесь оставляли на 1 сутки при комнатной температуре. Раствор выпаривали, смолу затирали гексаном, сухой остаток перекристаллизовывали из циклогексана. Получали 2.53 г (60%) кристаллического вещества (II) с Тпл 119-121°С. C26H35N3O2. Спектр ПМР, δ, м.д., 0,98 т (6Н, 2СН2-СН 3), 2,22 с (12Н, 4СН3), 2,55 гр.с, (4Н, СН2-СН2), 3,43 кв, (4Н, 2СН 2-СН3), 5,90 с (1Н, СН), 7,05-7,74 м (7Н, С6Н4, С6Н3), 10,06 с (1Н, CONH), 10,56 т (1H, NH).
Пример получения заявляемого соединения (I)
К раствору 4,22 г (0,01 моля) N-(2,4,6-триметилфенил)амида 4-(4-метилфенил)-2-(β,β-N,N-диэтиламиноэтиламино)-4-оксо-2-бутеновой кислоты, растворенного в 15-20 мл спирта, при перемешивании добавляли раствор 1,18 г (0,01 моля) янтарной кислоты в 10-15 мл спирта кипятили в течение 5-7 минут. Смесь оставляли на 1 сутки при комнатной температуре. Раствор выпаривали, смолу затирали гексаном, сухой остаток перекристаллизовывали из изопропилового спирта и сушили на воздухе до постоянного веса. Получали 4,70 г (87%) кристаллического вещества (I) с Тпл. 126-128°С. C30H41N3O6. ИК-спектр, v, см-1 (кристаллы): 3232 (NH), 1720 (COOH), 1656 (CONH), 1608, 1596 (СО хелат, С=С). Спектр ПМР, δ, м.д., CDCl3: 1,13 т (6Н, 2СН2-СН 3), 2,18 с (3Н, СН3), 2,22 с (6Н, 2СН3), 2,35 с (3Н, СН3), 2,96 гр.с (8Н, СН2-СН2), 3,66 кв (4H, 2СН 2-СН3), 5,92 с (1Н, СН), 6,07 с (1Н, СН), 6,83 с (2Н, С6Н2), 7,07-7,78 м (5Н, С6Н4, NH+), 8,74 с (1Н, CONH), 10,53 т (1H, NH), 14,34 с (1Н, СООН).
Заявляемое соединение (I) представляет собой бесцветное кристаллическое вещество, растворимое в воде, ДМФА, этиловом спирте, малорастворимое в изопропиловом спирте, нерастворимое в гексане.
Исследование биологической активности
Острую токсичность при внутрибрюшинном введении определяли на белых нелинейных мышах-самцах массой 18-24 г. Исследуемое вещество и препарат сравнения вводили в брюшную полость в виде раствора в 1%-ной крахмальной слизи из расчета 0,1 мл на 10 г массы животного в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при Р<0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. Фармакол. токсикол., т.41, №4, с.497-502 (1978)].
Проведено исследование соединения на наличие местноанестезирующей активности. В опыте использовали ненаркотизированных кроликов - самцов массой 2,0-2,5 кг. Определяли порог чувствительности роговицы глаза кролика к тактильному воздействию. Исходную чувствительность роговицы глаза кролика (контроль) определяли дважды с интервалом в 5 минут. Раствор исследуемого вещества в объеме 0,4 мл вводили в конъюнктивальный мешок глаза кролика за 2 раза, с интервалом 30 секунд. Каждую концентрацию вещества проверяли 8 раз, используя роговицу различных глаз. Определяли индекс Ренье, характеризующий глубину поверхностной анестезии и представляющий собой сумму механических раздражений роговицы в течение часа, и продолжительность анестезии в минутах. [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., Минздрав РФ, 2005].
Результаты обработаны статистически с использованием критерия Стьюдента [Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л., 1963]. Полученные результаты считают достоверными при p≤0,05. Результаты исследования острой токсичности и местноанестезирующей активности заявляемого соединения и препарата сравнения представлены в таблицах 1 и 2.
| Таблица 1 | |
| Острая токсичность соединений при внутрибрюшинном введении | |
| Соединения | Токсичность при внутрибрюшинном введении, мг/кг |
| I | 255,0 (290,0÷420,0) |
| Тримекаин | 154,0 (132,0÷178,0) |
| Таблица 2 | ||
| Активность соединений при поверхностной анестезии | ||
| Соединения | Поверхностная анестезия | |
| Индекс Ренье | Продолжительность анестезии, мин | |
| I | 1257,5±42,6 | 73,8±2,7 |
| Тримекаин | 559,0±26,1 | 31,8±4,4 |
Определение бактериостатической активности проводили методом двукратных серийных разведений в жидкой питательной среде [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2000, с.264-273]. Для всех исследуемых соединений были определены МПК в отношении фармакопейных штаммов: S. aureus ATCC 6538-P, E.coli ATCC 25922, С.albicans ATCC 885-653. Посевы производили в мясопептонный бульон, pH 7,0 с различной концентрацией испытуемых соединений. Культуры выращивали в пробирках на скошенной агаризированной среде (мясопептонный агар, плотная среда Сабуро). Для определения противомикробной активности использовалась 18-20-48-часовые культуры микроорганизмов. Для приготовления рабочей взвеси микробов производили смыв выросшей культуры изотоническим раствором натрия хлорида и устанавливали плотность микробной взвеси по стандарту мутности 5 единиц. Далее из полученной микробной взвеси (500 млн м.т./мл) готовили рабочий раствор бактерий с концентрацией 5 млн м.т./мл. Данную взвесь микробов вносили в количестве 0,1 мл в пробирки с серийными разведениями изучаемого препарата. Таким образом, микробная нагрузка при определении ПМА составила 250000 м.т./мл. Изучаемое соединение в количестве 0,05 г растворяли в 5 мл диметилсульфоксида, 1 мл полученного разведения 1:100 соединяли с 4 мл мясопептонного бульона или жидкой среды Сабуро (1:500). Далее готовили ряд серийных разведений соединения с двукратно уменьшающей концентрацией.
Учет результатов производили через 18-20 часов выдержки контрольных и опытных пробирок в термостате при температуре 37°С для бактерий и через 48 часов при 22°С - для грибов. Минимальную подавляющую концентрацию (МПК) устанавливали по отсутствию признаков роста на питательной среде: последняя пробирка с задержкой роста (прозрачный бульон) соответствует МПК препарата в отношении данного штамма. Бактериостатический эффект исследуемых соединений сравнивали с действием диоксидина [Падейская Е.Н. Инфекции и антимикробная терапия, 2001, т.3, №5, с.150-155], фунгиостатический - флуконазола [Rex J.Y., Walsh Т.J., Sobel J. d/ et all, Clin. Infect. Dis., 2000, v.30, №4, р.662-678]. Результаты исследований представлены в таблице 3.
| Таблица 3 | |||
| Противомикробная активность (мкг/мл) соединения (I) | |||
| Соединение | S. aureus | Е. coli | С.albic. |
| I | 31-62 | 31-62 | 125-250 |
| Диоксидин | 62,5-1000 | 3,9-62,5 | - |
| Флуконазол | - | - | 16-32 |
Соединение (I) обладает противомикробной активностью по отношению к золотистому стафилококку и кишечной палочке (МПК 31-62 мкг/мл) и дрожжевым грибам (МПК 125-250 мкг/мл).
Таким образом, сукцинат N-(2,4,6-триметилфенил)амида 2-(β-N,N-диэтиламиноэтиламино)-4-оксо-4-(4-метилфенил)-2-бутеновой кислоты проявляет более выраженное местноанестезирующее действие при меньшей токсичности, превосходя препараты сравнения по показателю активности и продолжительности действия. Следовательно, заявляемое соединение может найти применение в медицине в качестве местноанестезирующего и противомикробного лекарственного средства.
Сукцинат N-(2,4,6-триметилфенил)амида 2-(β-N,N-диэтиламино-этил амино)-4-оксо-4-(4-метилфенил)-2-бутеновой кислоты формулы