Спирогетероциклические соединения и их применение в качестве терапевтических средств
Иллюстрации
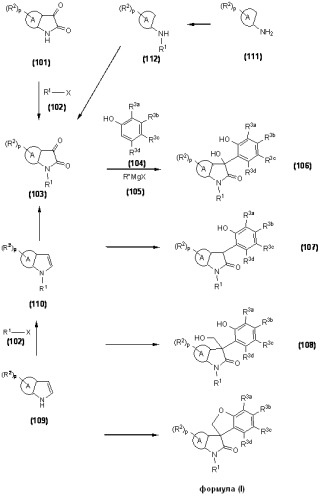
Показать всеИзобретение относится к спирогетероциклическому соединению формулы (I)
где p равно 1-4; j и k каждый независимо равен 0, 1, 2 или 3; Q означает -О-; означает конденсированное 5-членное с одним атомом S или 6-членное с одним атомом N гетероарильное кольцо; R1 означает С1-8алкил; каждый R2 независимо означает Н, С1-8алкил; каждый R3a, R3b, R3c и R3d независимо означает Н, С1-8алкил, или R3a и R3b, или R3b и R3c, или R3c и R3d, вместе с атомами углеродного кольца, к которым они непосредственно присоединены, могут образовывать конденсированное диоксолильное кольцо, и оставшаяся группа R3a, R3b, R3c или R3d является такой, как определено выше; или его фармацевтически приемлемая соль. Соединения могут быть использованы для лечения опосредованных натриевым каналом заболеваний или состояний, таких как боль. Описана фармацевтическая композиция. 5 н. и 8 з.п. ф-лы, 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к спирогетероциклическим соединениям. В частности, настоящее изобретение относится к спирогетероциклическим соединениям, которые являются блокаторами натриевых каналов и, таким образом, могут использоваться при лечении заболеваний или состояний, опосредованных натриевыми каналами, таких как боль, а также других заболеваний и состояний, связанных с натриевыми каналами.
Уровень техники
Потенциалозависимые натриевые каналы, трансмембранные белки, которые инициируют потенциалы действия в нервных, мышечных и других электрически чувствительных клетках, являются необходимым компонентом нормальной чувствительности, эмоций и двигательной активности (Catterall, W.A., Nature (2001), Vol. 409, pp.988-990). Эти каналы состоят из высокодифференцированной альфа-субъединицы, а именно размером приблизительно 260 кДа, связанной со вспомогательными бета-субъединицами. Каналообразующая альфа-субъединица является достаточной для проявления функции, однако кинетика и потенциалозависимость воротного механизма ионных каналов модифицируется за счет бета-субъединиц (Goldin et al., Neuron (2000), Vol. 28, pp.365-368). Каждая альфа-субъединица содержит четыре гомологичных домена, I-IV, каждый с шестью определенными трансмембранными сегментами. Альфа-субъединица натриевого канала, образующая ион-проводящую пору и содержащая «сенсоры потенциала», регулирующие прохождение ионов натрия, имеет относительную молекулярную массу, равную 260000. Благодаря электрофизиологической регистрации, биохимической очистке и молекулярному клонированию было идентифицировано десять различных альфа-субъединиц и четыре бета-субъединицы натриевых каналов (Yu, F.H., et al., Sci STKE (2004), 253; и Yu, F.H., et al., Neurosci. (2003), 20:7577-85).
Отличительные признаки натриевых каналов включают быструю активацию и инактивацию при деполяризации напряжения на плазматической мембране чувствительных клеток (потенциалозависимое открытие мембранного канала) и эффективную и селективную проводимость ионов натрия через проводящие поры каналы, характерные для структуры белка (Sato, C., et al., Nature (2001), 409:1047-1051). При отрицательном потенциале или гиперполяризации мембраны натриевые каналы закрыты. После деполяризации мембраны натриевые каналы быстро открываются и инактивируются. Каналы проводят ток только в открытом состоянии и, при инактивации, должны вернуться в состояние покоя за счет мембранной гиперполяризации. Различные подтипы натриевых каналов различаются диапазоном потенциала, в пределах которого они активируются и инактивируются, а также кинетикой активации и инактивации.
Белки семейства натриевых каналов были тщательно изучены, и было обнаружено, что они участвуют в ряде жизненно важных функций организма. Исследование в этой области выявили различия в альфа-субъединицах, которые приводят к существенным изменениям функции и активности канала, и что, в конечном счете, может привести к главным патофизиологическим состояниям. Из-за своей функции это семейство белков рассматривается как основная цель терапевтического воздействия. NaV1.1 и NaV1.2 высокоэкспрессированы в головном мозге (Raymond, C.K., et al., J. Biol. Chem. (2004), 279(44):46234-41) и являются жизненно важными для его нормальной функции. Мутации в NaV1.1 и NaV1.2 человека приводят к тяжелым эпилептическим состояниям и, в некоторых случаях, к снижению умственной деятельности (Rhodes, T.H., et al., Proc. Natl. Acad. Sci. USA (2004),101(30):11147-52; Kamiya, K., et al., J. Biol. Chem. (2004), 24(11):2690-8; Pereira, S., et al., Neurology (2004), 63(1):191-2). Оба канала рассматривали в качестве проверенной мишени для лечения эпилепсии (смотри опубликованную патентную заявку PCT WO01/38564).
NaV1.3 широко экспрессирован во всем организме (Raymond, C.K., et al., op. cit.). Была показана его положительная регуляция в чувствительных нейронах спинного рога крыс после повреждения нервной системы (Hains, B.D., et al., J. Neurosc. (2003), 23(26):8881-92). Многие специалисты в данной области также полагают, что NaV1.3 является подходящей мишенью для терапии боли (Lai, J., et al., Curr. Opin. Neurobiol. (2003), (3):291-72003; Wood, J.N., et al., J. Neurobiol. (2004), 61(1):55-71; Chung, J.M., et al., Novartis Found Symp. (2004), 261:19-27; discussion 27-31, 47-54).
Экспрессия NaV1.4 по существу ограничена мышечной тканью (Raymond, C.K., et al., op. cit.). Было показано, что мутации в этом гене приводят к глубоким нарушениям мышечной функции, включая паралич (Tamaoka A., Intern. Med. (2003), (9):769-70). Таким образом, этот канал может рассматриваться как мишень для лечения патологического мышечного сокращения, спазма или паралича.
Натриевый канал сердца, NaV1.5, экспрессирован главным образом в желудочках сердца и предсердии (Raymond, C.K., et al., op. cit.) и может быть обнаружен в сино-атриальном узле, антрио-вентрикулярном узле и, вероятно, в клетках Пуркинье. Быстрое повышение потенциала действия в сердце и быстрое прохождение импульса через сердечную ткань связано с открытием NaV1.5. По существу NaV1.5 является центром возникновения сердечной аритмии. Мутации в NaV1.5 у человека приводят к множественным аритмическим синдромам, включая, например, синдром удлиненного интервала QT3 (LQT3), синдром Бругада (BS), наследственную патологию проводящей системы сердца, синдром внезапной смерти во сне (SUNDS) и синдром внезапной смерти младенцев (SIDS) (Liu, H. et al., Am. J. Pharmacogenomics (2003), 3(3):173-9). Терапия блокаторами натриевого канала имеет широкое применение при лечении сердечных аритмий. Первый противоаритмический лекарственный препарат, хинидин, созданный в 1914, классифицируется как блокатор натриевого канала.
NaV1.6 кодирует потенциалозависимый натриевый канал, широко представленный во всей центральной и периферической нервной системе, образующий скопления в узлах Ранвье нейронных аксонов (Caldwell, J.H., et al., Proc. Natl. Acad. Sci. USA (2000), 97(10):5616-20). Хотя в организме человека не было выявлено никаких мутаций, полагают, что NaV1.6 играет роль в проявлении симптомов, связанных с рассеянным склерозом, и его можно рассматривать как мишень при лечении этого заболевания (Craner, M.J., et al., Proc. Natl. Acad. Sci. USA (2004), 101(21):8168-73).
NaV1.7 был впервые клонирован из клеточной линии феохромоцитомы PC12 (Toledo-Aral, J. J., et al., Proc. Natl.Acad. Sci. USA (1997), 94:1527-1532). Он находится в большом количестве в конусах роста нейронов малого диаметра, что предполагает его роль в передаче ноцицептивной информации. Это предположение вызывает сомнения у специалистов в данной области, так как NaV1.7 также экспрессирован в нейроэндокринных клетках, связанных с вегетативной нервной системой (Klugbauer, N., et al., EMBO J. (1995), 14(6):1084-90) и по существу вовлечен в процессы вегетативной нервной системы. Предполагаемая роль в функциях вегетативной нервной системы была показана на мутантах ноль-NaV1.7; делеция NaV1.7 во всех чувствительных и симпатических нейронах приводила к летальному перинатальному фенотипу (Nassar, et al., Proc. Natl. Acad. Sci. USA (2004), 101(34):12706-11). В отличие от этого, при прекращении экспрессии NaV1.7 в субпопуляции чувствительных нейронов, являющихся преимущественно ноцицептивными, была показана роль в механизмах боли (Nassar, et al., op. cit.). Дополнительным доказательством того, что блокаторы NaV1.7 активны в субпопуляции нейронов, являются данные, что два наследственных болевых синдрома человека, семейная эритермалгия и наследственный ректальный болевой синдром, были показаны на карте NaV1.7 (Yang, Y., et al., J. Med. Genet. (2004), 41(3):171-4).
Экспрессия NaV1.8 по существу ограничивается DRG (Raymond, C.K., et al., op. cit.). Мутации NaV1.8 у человека не обнаружены. Тем не менее, мыши с мутацией ноль-NaV1.8 были жизнеспособны, фертильны и имели нормальный внешний вид. Выраженная аналгезия к чрезмерному механическому стимулированию, небольшое нарушение терморецепции и замедленное развитие воспалительной гипералгезии дали исследователям основания полагать, что NaV1.8 играет главную роль в передаче болевого сигнала (Akopian, A. N., et al., Nat. Neurosci. (1999), 2(6):541-8). Блокирование этого канала широко используется в качестве перспективного способа лечения боли (Lai, J, et al., op. cit.; Wood, J.N., et al., op. cit.; Chung, J.M., et al., op. cit.). В опубликованной патентной заявке PCT WO03/037274A2 описаны пиразол-амиды и сульфонамиды для лечения заболеваний центральной или периферической нервной системы, в частности боли и хронической боли, за счет блокирования натриевых каналов, связанных с возникновением или рецидивом указанных состояний. В опубликованной патентной заявке PCT WO03/037890A2 описаны пиперидины для лечения заболеваний центральной или периферической нервной системы, в частности боли и хронической боли, за счет блокирования натриевых каналов, связанных с возникновением или рецидивом указанных состояний. Соединения, композиции и способы, раскрытые в указанных изобретениях, представляют собой конкретные варианты применения для лечения нейропатической боли или боли при воспалении за счет ингибирования ионного потока через канал, который включает субъединицу PN3 (NaV1.8).
Нечувствительный к тетродотоксину периферический натриевый канал NaV1.9 описан Dib-Hajj, S.D., et al. (смотри Dib-Hajj, S.D., et al., Proc. Natl. Acad. Sci. USA (1998), 95(15):8963-8). Было показано, что NaV1.9 лежит в основе нейротрофической деполяризации, вызываемой BDNF, и раздражения и является единственным членом суперсемейства потенциалозависимого натриевого канала, который, как было показано, является лиганд-опосредуемым (Blum, R., Kafitz, K.W., Konnerth, A., Nature (2002), 419 (6908):687-93). Ограниченный характер экспрессии этого канала сделал его вероятной мишенью при лечении боли (Lai, J, et al., op. cit.; Wood, J.N., et al., op. cit.; Chung, J.M. et al., op. cit.).
NaX представляет собой псевдонатриевый канал, который, как было показано, не является потенциалозависимым. Кроме экспрессии в легком, сердце, заднем корешке ганглия и клеток Шванна периферической нервной системы, NaX обнаружен в нейронах и эпендимных клетках определенных областей ЦНС, в частности, в околовентрикулярных областях, которые участвуют в гомеостазе жидкости в организме (Watanabe, E., et al., J. Neurosci. (2000), 20(20):7743-51). NaX-нуль мышь демонстрирует патологическое потребление гипертонического солевого раствора при состояниях, связанных с нехваткой воды и соли. Эти данные позволяют предположить, что NaX играет важную роль в центральной чувствительности уровней натрия в жидкости организма и регулировании потребления соли. Характер его экспрессии и функции указывает на то, что его можно использовать в качестве мишени при лечения кистозного фиброза и других заболеваний, связанных с регулированием соли.
Исследования с тетрадотоксином (ТТХ), блокирующим натриевый канал, применяемым для снижения нейронной активности в некоторых областях мозга, указали на его возможное применение при лечении наркомании. Стимулирующее воздействие наркотического препарата вызывает наркотическую зависимость и рецидив у наркоманов и определенное поведение у крыс, характеризующееся как добывание наркотика. Функциональная целостность базолатерального миндалевидного тела (BLA) необходима для восстановления поведения, направленного на добычу кокаина, которое вызывает стимулирующее воздействие кокаина, но не сам кокаин. BLA играет сходную роль в восстановлении поведения, направленного на добычу героина: TTX-induced inactivation of the BLA on conditioned and heroin-primed reinstatement of extinguished heroin-seeking behavior in a rat model (Fuchs, R.A. and See, R.E., Psychopharmacology (2002) 160(4):425-33).
Это близкородственное семейство белков долгое время рассматривали в качестве мишени для терапевтического воздействия. Натриевые каналы являются мишенями множества разнообразных фармакологических средств. Эти средства включают нейротоксины, противоаритмические средства, противосудорожные средства и местные анестетики (Clare, J.J., et al., Drug Discovery Today (2000), 5:506-520). Все существующие на настоящий момент фармакологические средства, которые воздействуют на натриевые каналы, используют рецепторные участки альфа-субъединиц. Было идентифицировано по крайней мере шесть разных рецепторных участков для нейротоксинов и один рецепторный участок для местных анестетиков и аналогичных лекарственных препаратов (Cestule, S. et al., Biochimie (2000), Vol. 82, pp. 883-892).
Низкомолекулярные блокаторы натриевых каналов или местные анестетики и аналогичные противоэпилептические и противоаритмические лекарственные препараты связываются с перекрывающими рецепторными сайтами, расположенными во внутренней полости натриевого канала (Catterall, W.A., Neuron (2000), 26:13-25). Вместе с сегментом IVS6, играющим основную роль, в состав этого комплексного рецепторного сайта для лекарственных препаратов входят аминокислотные остатки в сегментах S6 по крайней мере трех из четырех доменов. Эти области являются высококонсервативными, и по существу большинство известных на сегодняшний день блокаторов натриевого канала взаимодействуют с аналогичной эффективностью со всеми подтипами канала. Несмотря на это стало возможным получение блокаторов натриевого канала с терапевтической селективностью и удовлетворительным терапевтическим диапазоном для лечения эпилепсии (например, ламотригин, фенитоин и карбамазепин) и некоторых видов аритмии сердца (например, лигнокаин, токаинид и мексилитин). Однако эффективность и терапевтический индекс этих блокаторов не является оптимальным и ограничивает применение этих соединений в различных областях терапии, где блокатор натриевого канала может иметь превосходный эффект.
Терапия острой и хронической боли
Лекарственная терапия является основным способом терапии острой и хронической боли в группах всех возрастов, включая новорожденных, грудных детей и детей младшего возраста. Лекарственные препараты для лечения боли классифицированы American Pain Society на три основные группы: 1) неопиоидные анальгетики, ацетоминофен и нестероидные противовоспалительные лекарственные препараты (NSAID), включая салицилат (например, аспирин), 2) опиоидные анальгетики и 3) коанальгетики.
Неопиоидные анальгетики, такие как ацетоминофен и NSAID, применяют при лечении острой и хронической боли, обусловленной различными причинами, включая хирургические операции, травмы, артрит и рак. NSAID показаны при лечении боли, связанной с воспалением, так как ацетоминофен не имеет противовоспалительной активности. Опиоиды также не имеют противовоспалительной активности. Все NSAID ингибируют фермент циклооксигеназу (COX), таким образом, ингибируя синтез простагландина, и снижают воспалительную болевую реакцию. Существует по крайней мере две изоформы COX: COX-1 и COX-2. Обычные неселективные ингибиторы COX включают ибупрофен и напроксен. Как полагают, ингибирование COX-1, обнаруженной в тромбоцитах, желудочно-кишечном тракте, почках и в большинстве других тканей человека, вызывает побочные эффекты, такие как желудочно-кишечное кровотечение. Создание селективных в отношении COX-2 NSAID, таких как целекоксиб, валдекоксиб и рофекоксиб, имеет преимущества по сравнению с неселективными NSAID, так как они дают меньше побочных эффектов на кишечник и почки. Тем не менее, существующие на настоящий момент данные показывают, что постоянное применение некоторых селективных ингибиторов COX-2 может привести к повышенному риску возникновения инсульта.
Применение опиоидных анальгетиков, рекомендованных American Pain Society, начинают на основании анамнеза боли и медосмотра, который включает неоднократную оценку боли. Из-за большого количества побочных эффектов, связанных с применением опиоидов, терапия должна включать диагностику, комплексный междисциплинарный подход к лечению и надлежащее постоянное наблюдение пациента. Кроме того, опиоидные препараты рекомендуют назначать вместе с неопиоидными препаратам для контроля острой боли и боли, связанной с раком, в отсутствии эффекта применения одних неопиоидных препаратов. Опиоидные анальгетики действуют как агонисты конкретных рецепторов, мю и каппа типа, в центральной и периферической нервной системе. В зависимости от опиоида и его композиции или способа введения опиодный препарат может иметь короткий или продолжительный период действия. Все опиоидные анальгетики могут вызывать дыхательную недостаточность, печеночную недостаточность, привыкание и зависимость, и как таковые не являются идеальными для контроля длительной или хронической боли.
Ряд других классов лекарственных препаратов может усиливать действие опиоидов или NSAID, обладая, в некоторых случаях, независимой анальгетической активностью или нейтрализуя побочные эффекты анальгетиков. Независимо от того, какой из этих активностей обладает лекарственный препарат, все они называются «коанальгетиками». Трициклические антидепрессанты, противоэпилептические лекарственные препараты, местные анестетики, глюкокортикоиды, релаксанты скелетных мышц, спазмолитические средства, антигистаминные средства, бензодиазепины, кофеин, местнодействующие средства (например, капсайцин), декстроамфетамин и фенотизины, все эти препараты используются в терапевтической практике, в качестве вспомогательной терапии или самостоятельно, при лечении боли. В частности, применение противоэпилептических лекарственных препаратов в некоторой степени успешно при лечении болевых состояний. Например, габапентин, который имеет неподтвержденную терапевтическую мишень, показан при нейропатической боли. В других клинических испытаниях были сделаны попытки подтвердить, что центральная нейропатическая боль может реагировать на блокаторы каналов, такие как блокаторы кальциевого, натриевого и/или NMDA (N-метил-D-аспартат) канала. В настоящее время разрабатываются низкоаффинные средства, блокирующие канал NMDA, для лечения нейропатической боли. В литературе описаны данные важных доклинических электрофизиологических исследований в поддержку применения антагонистов NMDA для лечения нейропатической боли. Такие средства также могут найти применение для контролирования боли после возникновения толерантности к опиоидам, в частности, у пациентов, больных раком.
Системные анальгетики, такие как NSAID и опиоиды, отличаются от других терапевтических средств, которые используются только в качестве местных анальгетиков/анестезирующих средств. Хорошо известные местные анальгетики, такие как лидокаин и ксилокаин, являются неселективными блокаторами ионных каналов, которые при систематическом применение могут привести к летальному исходу. Подробное описание неселективных блокаторов натриевого канала можно найти в Madge, D. et al., J. Med. Chem (2001), 44(2):115-37.
Известно, что некоторые модуляторы натриевых каналов применяются в качестве противосудорожных средств или антидепрессантов, например карбамазепин, амитриптилин, ламотригин и рилузон, которые направлены на чувствительные к тетрадотоксину (TTX-S) натриевые каналы головного мозга. Такие средства TTX-S имеют побочные эффекты, включая вертиго, атаксию и сонливость, ограничивающие дозу, в первую очередь благодаря действию на TTX-S каналы в головном мозге.
Роль натриевых каналов в механизме боли
Натриевые каналы играют различные роли в поддержании нормальных и патологических состояний, включая общепризнанную роль, которую потенциалозависимые натриевые каналы играют в формировании патологической нейронной активности и нейропатической или патологической боли (Chung, J.M. et al.). Поражение периферических нервов в результате травмы или заболевания может привести к изменениям активности натриевого канала и развитию патологической афферентной активности, включая эктопические разряды афферентных аксонов и спонтанной активности сенсибилизированных интактных ноцирецепторов. Эти изменения могут вызвать продолжительную патологическую гиперчувствительность к обычно безвредному стимулирующему воздействию или аллодинии. Примеры нейропатической боли включают, но ими не ограничиваются, постгерпетическую невралгию, невралгию тройничного нерва, диабетическую нейропатию, хроническую боль в пояснице, фантомную боль и боль, обусловленную раком и химиотерапией, хроническую боль в области таза, комплексный зональный болевой синдром и связанные с ним невралгии.
Был достигнут некоторый успех в лечении симптомов нейропатической боли благодаря применению лекарственных средств, таких как габапентин и, позднее, прегабалин, в качестве средств первой помощи. Однако фармакотерапия нейропатической боли, как правило, имеет ограниченный эффект из-за слабой реакции на обычно применяемые ослабляющие боль лекарственные препараты, такие как NSAID и опиоиды. Поэтому до сих пор существует большая потребность в разработке новых способов лечения.
В клинической практике существует лишь небольшое число эффективных блокаторов натриевого канала с минимальным количеством побочных эффектов. Также существует неудовлетворенная потребность в эффективном, не имеющем побочных эффектов, лечении нейропатической боли и других патологических состояний, обусловленных натриевыми каналами. Настоящее изобретение относится к соединениям, способам применения и композициям, которые содержат эти соединения, которые удовлетворяют эти важные потребности.
Сущность изобретения
Настоящее изобретение относится к спирогетероциклическим соединениям, которые применяются для лечения и/или профилактики заболеваний, опосредованных натриевыми каналами, или состояний, таких как боль. Также соединения по настоящему изобретению применяются для лечения других заболеваний, опосредованных натриевыми каналами или состояний, включая, но ими не ограничиваясь, заболевания центральной нервной системы, такие как эпилепсия, тревожные расстройства, депрессия и биполярное расстройство; сердечно-сосудистые заболевания, такие как аритмия, фибрилляция предсердий и фибрилляция желудочков; нейромышечные заболевания, такие как синдром усталых ног и мышечный паралич или тетанус; нейропротективное действие против инсульта, при травмах мозга и рассеянном склерозе; и каналопатии, такие как эритромиалгия и наследственный ректальный болевой синдром.
Таким образом, одним из аспектов изобретения являются соединения формулы (I)
где
p равно 1-4;
каждый j и k независимо равен 0, 1, 2 или 3;
Q представляет собой -C(R1a)H-, -C(O)-, -O-, -S-, -N(R5)-, -CF2-, -C(O)O-, -C(O)N(R5)- или -N(R5)C(O)-;
R1a представляет собой водород или -OR5;
представляет собой конденсированное гетероарильное кольцо или конденсированное гетероциклическое кольцо;
R1 представляет собой водород, алкил, алкенил, алкинил, галогеналкил, арил, циклоалкил, циклоалкилалкил, гетероарил, гетероциклил, -R8-OR5, -R8-CN, -R9-P(O)(OR5)2 или -R9-O-R9-OR5;
или R1 представляет собой аралкил, замещенный -C(O)N(R6)R7, где
R6 представляет собой водород, алкил, арил или аралкил; и
R7 представляет собой водород, алкил, галогеналкил, -R9-CN, -R9-OR5, -R9-N(R4)R5, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, гетероарил, гетероарилалкил;
или R6 и R7, вместе с атомом азота, к которому они присоединены, образуют гетероциклил или гетероарил;
и где каждый арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, гетероарил и гетероарил групп R6 и R7 могут быть необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из алкила, циклоалкила, арила, аралкила, галогена, галогеналкила, -R8-CN, -R8-OR5, гетероциклила и гетероарила;
или R1 представляет собой аралкил, необязательно замещенный -R8-OR5, -C(O)OR5, галогеном, галогеналкилом, алкилом, нитро, циано, арилом (необязательно замещенным циано), аралкилом (необязательно замещенным одной или несколькими алкильными группами), гетероциклилом или гетероарилом;
или R1 представляет собой -R9-N(R10)R11, -R9-N(R12)C(O)R11 или -R9-N(R10)C(O)N(R10)R11, где
каждый R10 представляет собой водород, алкил, арил или аралкил;
каждый R11 представляет собой водород, алкил, галогеналкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероарилалкил, -R9-OC(O)R5, -R9-C(O)OR5, -R9-C(O)N(R4)R5, -R9-C(O)R5, -R9-OR5 или -R9-CN;
R12 представляет собой водород, алкил, арил, аралкил или -C(O)R5;
и где каждый арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, гетероарил и гетероарилалкил групп R10 и R11 может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкила, циклоалкила, арила, аралкила, галогена, галогеналкила, нитро, -R8-CN, -R8-OR5, -R8-C(O)R5, гетероциклила и гетероарила;
или R1 представляет собой гетероциклилалкил или гетероарилалкил, где гетероциклилалкильная или гетероарилалкильная группа необязательно замещена одним или несколькими заместителями, выбранными из группы, состоящей из алкила, галогена, галогеналкила, -R8-OR5, -R8-C(O)OR5, арила и аралкила;
каждый R2 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, алкокси, галогена, галогеналкила, галогеналкенила, галогеналкокси, циклоалкила, циклоалкилалкила, арила, аралкила, аралкенила, гетероциклила, гетероциклилалкила, гетероарила, гетероарилалкила, -R8-CN, -R8-NO2, -R8-OR5, -R8-N(R4)R5, -N=C(R4)R5, -S(O)mR4, -R8-C(O)R4, -C(S)R4, -C(R4)2C(O)R5, -R8-C(O)OR4, -C(S)OR4, -R8-C(O)N(R4)R5, -C(S)N(R4)R5, -N(R5)C(O)R4, -N(R5)C(S)R4, -N(R5)C(O)OR4, -N(R5)C(S)OR4, -N(R5)C(O)N(R4)R5, -N(R5)C(S)N(R4)R5, -N(R5)S(O)nR4, -N(R5)S(O)nN(R4)R5, -R8-S(O)nN(R4)R5, -N(R5)C(=NR5)N(R4)R5 и -N(R5)C(=N-CN)N(R4)R5, где каждый m независимо равен 0, 1 или 2 и каждый n независимо равен 1 или 2;
и где каждый циклоалкил, циклоалкилалкил, арил, аралкил, аралкенил, гетероциклил, гетероциклилалкил, гетероарил и гетероарилалкил для каждого R2 может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, алкокси, галогена, галогеналкила, галогеналкенила, галогеналкокси, циклоалкила, циклоалкилалкила, арила, аралкила, аралкенила, гетероциклила, гетероциклилалкила, гетероарила, гетероарилалкила, -R8-CN, -R8-NO2, -R8-OR5, -R8-N(R4)R5, -S(O)mR4, -R8-C(O)R4; -R8-C(O)OR4, -R8-C(O)N(R4)R5, -N(R5)C(O)R4 и -N(R5)S(O)nR4, где каждый m независимо равен 0, 1 или 2 и каждый n независимо равен 1 или 2;
или две соседние R2 группы, вместе с атомами конденсированного гетероарильного кольца или конденсированного гетероциклильного кольца, к которым они непосредственно присоединены, могут образовывать конденсированное кольцо, выбранное из циклоалкила, арила, гетероциклила и гетероарила, а остальные группы R2, если присутствуют, такие, как определено выше;
каждый R3a, R3b, R3c и R3d независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, алкокси, галогена, галогеналкила, галогеналкенила, галогеналкокси, циклоалкила, циклоалкилалкила, арила, аралкила, аралкенила, гетероциклила, гетероциклилалкила, гетероарила, гетероарилалкила, -R8-CN, -R8-NO2, -R8-OR5, -R8-N(R4)R5, -N=C(R4)R5, -S(O)mR4, -R8-C(O)R4, -C(S)R4, -C(R4)2C(O)R5, -R8-C(O)OR4, -C(S)OR4, -R8-C(O)N(R4)R5, -C(S)N(R4)R5, -N(R5)C(O)R4, -N(R5)C(S)R4, -N(R5)C(O)OR4, -N(R5)C(S)OR4, -N(R5)C(O)N(R4)R5, -N(R5)C(S)N(R4)R5, -N(R5)S(O)nR4, -N(R5)S(O)nN(R4)R5, -R8-S(O)nN(R4)R5, -N(R5)C(=NR5)N(R4)R5 и -N(R5)C(N=C(R4)R5)N(R4)R5, где каждый m независимо равен 0, 1 или 2 и каждый n независимо равен 1 или 2;
или R3a и R3b, или R3b и R3c, или R3c и R3d, вместе с атомами углеродного кольца, к которым они непосредственно присоединены, могут образовывать конденсированное кольцо, выбранное из циклоалкила, гетероциклила, арила или гетероарила, а остальные группы R3a, R3b, R3c или R3d такие, как определено выше;
каждый R4 и R5 независимо выбран из группы, состоящей из водорода, алкила, алкенила, алкинила, галогеналкила, алкоксиалкила, циклоалкила, циклоалкилалкила, арила, аралкила, гетероциклила и гетероарила;
или, если каждый R4 и R5 присоединен к одному и тому же атому азота, то R4 и R5, вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклил или гетероарил; и
каждый R8 представляет собой прямую связь или прямую или разветвленную алкиленовую цепь, прямую или разветвленную алкениленовую цепь или прямую или разветвленную алкиниленовую цепь; и
каждый R9 представляет собой прямую или разветвленную алкиленовую цепь, прямую или разветвленную алкениленовую цепь или прямую или разветвленную алкиниленовую цепь;
в виде стереоизомера, энантиомера, таутомера или их смесей;
или их фармацевтически приемлемая соль, сольват или пролекарство.
В другом аспекте изобретение относится к способам лечения боли у млекопитающих, предпочтительно, человека, которые включают введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества описанного выше соединения по изобретению.
В другом аспекте настоящее изобретение относится к способу лечения или ослабления тяжести заболевания, состояния или расстройства, где активация или гиперактивация одного или нескольких NaV1.1, NaV1.2, NaV1.3, Nav1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9 вовлечена в болезненное состояние.
В другом аспекте изобретение относится к способам лечения ряда заболеваний, опосредованных натриевыми каналами, или состояний, например боли, связанной с ВИЧ, нейропатии возникающей при лечении ВИЧ, невралгии тройничного нерва, постгерпетической невралгии, эудинии, теплочувствительности, тосаркоидоза, синдрома раздраженной кишки, болезни Крона, боли, связанной с рассеянным склерозом (MS), бокового амиотрофического склероза (ALS), диабетической нейропатии, периферической нейропатии, артрита, ревматоидного артрита, остеоартрита, атеросклероза, пароксизмальной дистонии, синдрома миастении, миотонии, злокачественной гипертермии, кистозного фиброза, псевдоальдостеронизма, острого некроза скелетных мышц, гипотиреоза, биполярной депрессии, тревожного состояния, шизофрении, заболеваний, связанных с токсическим воздействием на натриевые каналы, наследственной эритермалгии, первичной эритермалгии, наследственной ректальной боли, рака, эпилепсии, частичных и генерализованных тонических судорог, синдрома усталых ног, аритмии, фибромиалгии, к нейропротективному воздействию при ишемических состояниях, вызванных инсультом или травмой мозга, тахиаритмии, фибриляции предсердий и фибриляции желудочков.
В другом аспекте изобретение относится к способам лечения ряда заболеваний или состояний, опосредованных натриевым каналом, путем ингибирования ионного потока, проходящего через потенциалозависимый натриевый канал у млекопитающего, предпочтительно, человека, где способы включают введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества описанного выше соединения по изобретению.
В другом аспекте изобретение относится к фармацевтическим композициям, содержащим описанные выше соединения по изобретению и фармацевтически приемлемые наполнители. В одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение по изобретению в фармацевтически приемлемом носителе и в количестве, эффективном для лечения заболеваний или состояний, связанных с болью, путем введения животному, предпочтительно, млекопитающему, наиболее предпочтительно, человеку.
В другом аспекте изобретение относится к терапии фармацевтическими средствами в сочетании с одним или несколькими другими соединениями по изобретению, или одной или несколькими другими общепринятыми терапиями, или в виде их комбинации для повышения эффективности существующей или будущей лекарственной терапии, или для уменьшения неблагоприятных последствий, связанных с общепринятой терапией. В одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, соединения в которой по настоящему изобретению комбинированы с общепринятыми или возможными терапевтическими средствами для случаев, перечисленных в изобретении.
Подробное описание изобретения
Определения
Перед некоторыми указанными в данном документе химическими группами указаны сокращения, указывающие на суммарное количество атомов углерода, имеющихся в указанной химической группе. Например, C7-C12алкил обозначает алкильную группу, определенную ниже, содержащую в сумме от 7 до 12 атомов углерода, а C4-C12циклоалкилалкил обозначает циклоалкилалкильную группу, определенную ниже, содержащую в сумме от 4 до 12 атомов углерода. Общее количество атомов углерода в сокращении не включает атомы углерода возможных заместителей описанных групп. Например, следующие термины имеют следующие обозначения:
Термин «C1-C10алкил» относится к алкильному радикалу, как определено ниже, содержащему от одного до десяти атомов углерода. C1-C10алкильный радикал может быть необязательно замещен, как определено ниже для алкильной группы.
Термин «C2-C12алкинил» относится к алкинильному радикалу, как определено ниже, содержащему от двух до двенадцати атомов углерода. C2-C12алкинильный радикал может быть необязательно замещен, как определено ниже для алкенильной группы.
Термин «C1-C12алкокси» относится к алкокси радикалу, как определено ниже, содержащему от двух до двенадцати атомов углерода. Алкильная часть C1-C12алкокси радикала может быть необязательно замещена, как определено ниже для алкильной группы.
Термин «C2-C12алкоксиалкил» относится к алкоксиалкильному радикалу, как определено ниже, содержащему от двух до двенадцати атомов углерода. Каждая алкильная часть C2-C12алкоксиалкильного радикала может быть необязательно замещена, как определено ниже для алкильной группы.
Термин «C7-C12аралкил» относится к аралкильной группе, как определено ниже, содержащей от семи до двенадцати атомов углерода. Арильная часть C7-C12аралкильного радикала может быть необязательно замещена, как определено ниже для арильной группы. Алкильная часть C7-C12аралкильного радикала может быть необязательно замещена, как определено ниже для алкильной группы.
Термин «C7-C12аралкенил» относится к аралкенильной группе, как определено ниже, содержащей от семи до двенадцати атомов углерода. Арильная часть C7-C12аралкенильного радикала может быть необязательно замещена, как определено ниже для арильной группы. Алкенильная часть C7-C12аралкенильного радикала может быть необязательно замещена, как определено ниже для алкенильной группы.
Термин «C3-C12циклоалкил» относится к циклоалкильному радикалу, как определено ниже, имеющему от трех до двенадцати атомов углерода. C3-C12циклоалкильный радикал может быть необязательно замещен, как определено ниже для циклоалкильной группы.
Термин «C4-C12циклоалкилалкил» относится к циклоалкилалкильному радикалу, как определено ниже, содержащему от четырех до двенадцати атомов углерода. C4-C12циклоалкилалкильный радикал может быть необязательно замещен, как определено ниже для циклоалкилалкильной группы.
Кроме того, термины, использующиеся в описании и в приложенной формуле изобретения, имеют следующие значения, если не указано иного:
Термин «амино» относит