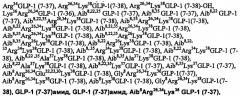Слитые конструкции лекарственного средства и конъюгаты
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описаны конъюгаты лекарственного средства, которые содержат инкретиновый терапевтический или диагностический агент, который слит или конъюгирован с антигенсвязывающим фрагментом антитела, которое связывает сывороточный альбумин. Конъюгаты имеют более длительный in vivo период полувыведения по сравнению с неконъюгированным или неслитым терапевтическим или диагностическим агентом. 10 н. и 17 з.п. ф-лы, 19 ил., 13 табл.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка имеет приоритет согласно предварительной заявке на патент США №60/632361, поданной 2 декабря 2004 г., и приоритет согласно заявке на патент Великобритании №0511019.2. Содержание вышеназванных заявок полностью включено в настоящий документ посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Многие лекарственные средства, обладающие биологической активностью, которая могла бы быть полезной для терапевтических и/или диагностических целей, обладают ограниченной ценностью, поскольку они быстро выводятся из организма при введении. Например, многие полипептиды, которые имеют терапевтически полезные виды активности, быстро выводятся из кровообращения почками. Соответственно, следует вводить большие дозы, чтобы достичь желаемого терапевтического эффекта. Существует необходимость в улучшенных терапевтических и диагностических агентах, которые имеют улучшенные фармакокинетические свойства. Полипептиды, которые связывают сывороточный альбумин, известны в уровне техники. (См., например, ЕР 0486525 В1 (Сети Bioteknik AB); US 6267964 В1 (Nygren et al.); WO 04/001064 A2 (Dyax, Corp.); WO 02/076489 A1 (Dyax, Corp.); WO 01/45746 (Genentech, Inc.).)
Один такой класс лекарственных средств, которые имеют короткий период полувыведения в организме или большом круге кровообращения, представляет собой инкретиновые гормоны, такие как глюкагон-подобный пептид 1, или Пептид YY.
Глюкагон-подобный пептид (GLP)-1 представляет собой инкретиновый гормон с ярко выраженными глюкозозависимыми инсулинотропным и глюкагоностатическим видами действия, трофическим действием на панкреатические В клетки и ингибиторными эффектами в отношении желудочно-кишечной секреции и перистальтики, вдобавок к способности понижать уровень глюкозы в плазме и уменьшать амплитуду изменения концентраций глюкозы. Кроме того, посредством своей способности усиливать чувство насыщения, GLP-1 уменьшает потребление пищи, таким образом, ограничивая увеличение массы тела, и может даже вызывать снижение массы тела. Все вместе, эти виды действия придают GLP-1 уникальный профиль, считающийся высоко желательным для противодиабетического агента, особенно в связи с тем, что зависимость глюкозы от его антигипергликемических эффектов должна минимизировать любой риск тяжелой гипогликемии. Однако его фармакокинетический/ фармакодинамический профиль таков, что природный GLP-1 не является терапевтически пригодным. Таким образом, в то время как GLP-1 является наиболее эффективным при постоянном введении, однократные подкожные инъекции имеют непродолжительные эффекты. GLP-1 в высшей степени подвержен ферментативному разрушению in vivo, и расщепление дипептидилпептидазой IV (DPP-IV) является, вероятно, наиболее правдоподобным, поскольку это происходит быстро и приводит к образованию неинсулинотропного метаболита. Следовательно, стратегии для мобилизации терапевтического потенциала GLP-1 на основе понимания факторов, влияющих на его метаболическую стабильность и фармакокинетический/ фармакодинамический профиль, находятся в центре интенсивных исследований.
Огромная работа была проделана с целью предпринять попытку ингибировать пептидазу или модифицировать GLP-1 таким образом, чтобы замедлить его разрушение при сохранении, тем не менее, биологической активности. В WO 05/027978 раскрыты производные GLP-1, имеющие пролонгированный профиль действия (и включенные ссылкой в настоящий документ в качестве примеров производных и аналогов GLP-1, которые можно применять в настоящем изобретении). В WO 02/46227 описаны гетерологичные слитые белки, содержащие полипептид (например, альбумин), слитый с GLP-1 или аналогами (описание данных аналогов включено ссылкой в настоящий документ в качестве примеров аналогов GLP-1, которые можно применять в настоящем изобретении). В WO 05/003296, WO 03/060071, WO 03/059934 раскрыт аминослитый белок, где GLP-1 слит с альбумином с целью увеличения периода полувыведения этого гормона.
Однако, несмотря на эти усилия, не был получен GLP-1, сохраняющий активность в течение длительного промежутка времени.
По существу, особенно в области диабета и ожирения, существует колоссальная потребность в улучшенных GLP-1 пептидах или других агентах, которые аналогично имеют инсулинотропный эффект, пригодный для лечения, в частности, диабета и ожирения. Следовательно, существует потребность в модифицировании GLP-1 и других инсулинотропных пептидов для предоставления большей продолжительности действия in vivo при поддержании их низкой токсичности и терапевтических преимуществ.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к слитым конструкциям лекарственного средства и конъюгатам лекарственного средства, которые имеют улучшенные периоды полувыведения в сыворотке. В одном аспекте, слитая конструкция лекарственного средства представляет собой непрерывную полипептидную цепь, имеющую формулу:
a-(X)n1-b-(Y)n2-c-(Z)n3-d или a-(Z)n3-b-(Y)n2-c-(X)n1-d,
где Х представляет собой полипептидное лекарственное средство, которое имеет связывающую специфичность в отношении первой мишени;
Y представляет собой вариабельный домен тяжелой цепи иммуноглобулина (VH), который имеет связывающую специфичность в отношении сывороточного альбумина, или вариабельный домен легкой цепи иммуноглобулина (VL), который имеет связывающую специфичность в отношении сывороточного альбумина;
Z представляет собой полипептидное лекарственное средство, которое имеет связывающую специфичность в отношении второй мишени;
каждое из а, b, с и d независимо отсутствует либо представляет собой от одного до примерно 100 аминокислотных остатков;
n1 равно от одного до примерно 10;
n2 равно от одного до примерно 10; и
n3 равно от нуля до примерно 10,
при условии, что, если оба n1 и n2 равны одному, а n3 равно нулю, Х не содержит цепь антитела или фрагмент цепи антитела.
В некоторых вариантах воплощения, Y содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23. В конкретных вариантах воплощения, Х представляет собой GLP-1 или аналог GLP-1.
В другом аспекте, слитая конструкция лекарственного средства содержит непрерывную полипептидную цепь, причем указанная цепь содержит группировки X' и Y', где
X' представляет собой полипептидное лекарственное средство при условии, что X' не содержит цепь антитела или фрагмент цепи антитела; и
Y' представляет собой вариабельный домен тяжелой цепи иммуноглобулина (VH), который имеет связывающую специфичность в отношении сывороточного альбумина, или вариабельный домен легкой цепи иммуноглобулина (VL), который имеет связывающую специфичность в отношении сывороточного альбумина. В некоторых вариантах воплощения, Y' содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23. В конкретных вариантах воплощения, X' представляет собой GLP-1 или аналог GLP-1.
В другом аспекте, изобретение представляет собой конъюгат лекарственного средства, содержащий вариабельный домен тяжелой цепи иммуноглобулина (VH), который имеет связывающую специфичность в отношении сывороточного альбумина, или вариабельный домен легкой цепи иммуноглобулина (VL), который имеет связывающую специфичность в отношении сывороточного альбумина, и лекарственное средство, которое ковалентно связано с указанным VH или VL. В некоторых вариантах воплощения, вариабельный домен тяжелой цепи иммуноглобулина содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23. В конкретных вариантах воплощения, лекарственное средство представляет собой GLP-1 или аналог GLP-1.
В изобретении также предложены рекомбинантные нуклеиновые кислоты и конструкции, кодирующие слитые конструкции лекарственного средства, описанные в настоящем документе, и клетки-хозяева, содержащие рекомбинантные нуклеиновые кислоты и/или конструкции. В изобретении дополнительно предложен способ получения слитой конструкции лекарственного средства, включающий поддержание клетки-хозяина, которая содержит рекомбинантную нуклеиновую кислоту и/или конструкцию, которая кодирует слитую конструкцию лекарственного средства, описанную в настоящем документе, в условиях, пригодных для экспрессии указанной рекомбинантной нуклеиновой кислоты, посредством чего получают слитую конструкцию лекарственного средства.
В изобретении также предложены композиции (например, фармацевтические композиции), содержащие слитую конструкцию лекарственного средства или конъюгат лекарственного средства по изобретению. В изобретении также предложен способ лечения индивидуума, имеющего заболевание или расстройство, такое как таковое, описанное в настоящем документе, включающий введение указанному индивидууму терапевтически эффективного количества конъюгата лекарственного средства или слитой конструкции лекарственного средства по изобретению. В некоторых вариантах воплощения, заболевание или расстройство представляет собой воспалительное заболевание, такое как артрит (например, ревматоидный артрит). В дополнительном варианте воплощения, заболевание или расстройство представляет собой метаболическое заболевание, такое как диабет или ожирение. В изобретении также предложено применение конъюгата лекарственного средства или слитой конструкции лекарственного средства по изобретению для изготовления лекарства для лечения заболевания или расстройства, такого как воспалительное заболевание (например, артрит (например, ревматоидный артрит)) или диабет или ожирение. Изобретение также относится к применению слитой конструкции лекарственного средства или конъюгата лекарственного средства, как описано в настоящем документе, для применения в терапии, диагностике или профилактике.
В другом аспекте, изобретение представляет собой нековалентный конъюгат лекарственного средства, содержащий вариабельный домен тяжелой цепи иммуноглобулина (VH), который имеет связывающую специфичность в отношении сывороточного альбумина, или вариабельный домен легкой цепи иммуноглобулина (VL), который имеет связывающую специфичность в отношении сывороточного альбумина, и лекарственное средство, которое нековалентно связано с указанным VH или VL. В некоторых вариантах воплощения, вариабельный домен тяжелой цепи иммуноглобулина содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23.
В дополнительном варианте воплощения, в изобретении предложен инактивированный вариант Dom7h-8, iDom7h-8, который не связывает сывороточный альбумин, который используют в качестве инструмента для исследования и который является предсказывающим вариантом для активного связывающего сывороточный альбумин Dom7h-8.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1А представлено выравнивание аминокислотных последовательностей трех VK, выбранных путем связывания с сывороточным альбумином мышей (MSA). Выровненные аминокислотные последовательности принадлежат VK, обозначенным MSA 16, который также обозначают DOM7m-16 (SEQ ID NO:1), MSA 12, который также обозначают DOM7m-12 (SEQ ID NO:2), и MSA 26, который также обозначают DOM7m-26 (SEQ ID NO:3).
На Фиг.1 В представлено выравнивание аминокислотных последовательностей шести VK, выбранных путем связывания с сывороточным альбумином крыс (RSA). Выровненные аминокислотные последовательности принадлежат VK, обозначенным DOM7M (SEQ ID NO:4), DOM7r-3 (SEQ ID NO:5), DOM7r-4 (SEQ ID NO:6), DOM7r-5 (SEQ ID NO:7), DOM7r-7 (SEQ ID NO:8) и DOM7r-8 (SEQ ID NO:9).
На Фиг.1C представлено выравнивание аминокислотных последовательностей шести VK, выбранных путем связывания с сывороточным альбумином человека (HSA). Выровненные аминокислотные последовательности принадлежат VK, обозначенным DOM7h-2 (SEQ ID NO:10), DOM7h-3 (SEQ ID NO:11), DOM7h-4 (SEQ ID NO:12), DOM7h-6 (SEQ ID NO:13), DOM7h-1 (SEQ ID NO:14), DOM7h-7 (SEQ ID NO:15).
На Фиг.1D представлено выравнивание аминокислотных последовательностей семи VH, выбранных путем связывания с сывороточным альбумином человека и консенсусной последовательностью (SEQ ID NO:23). Выровненные аминокислотные последовательности принадлежат VK, обозначенным DOM7h-22 (SEQ ID NO:16), DOM7h-23 (SEQ ID NO:17), DOM7h-24 (SEQ ID NO:18), DOM7h-25 (SEQ ID NO:19), DOM7h-26 (SEQ ID NO:20), DOM7h-21 (SEQ ID NO:21) и DOM7h-27 (SEQ ID NO:22).
На Фиг.1Е представлено выравнивание аминокислотных последовательностей трех VK, выбранных путем связывания с сывороточным альбумином человека и сывороточным альбумином крыс. Выровненные аминокислотные последовательности принадлежат VK, обозначенным DOM7h-8 (SEQ ID NO:24), DOM7r-13 (SEQ ID NO:25) и DOM7r-14 (SEQ ID NO:26).
На Фиг.2А и 2 В представлены схематичные карты векторов, использованных для экспрессии слитых конструкций MSA16IL-1ra (также обозначаемой DOM7m-16/IL-1ra) и IL-1raMSA16 (также обозначаемой IL-1ra/DOM7m-16), соответственно.
На Фиг.2С-2D представлена нуклеотидная последовательность (SEQ ID NO:27), кодирующая слитую конструкцию IL-1raMSA16 (также обозначаемую IL-1ra/DOM7m-16), и аминокислотная последовательность (SEQ ID NO:28) слитой конструкции.
На Фиг.2Е-2F представлена нуклеотидная последовательность (SEQ ID NO:29), кодирующая слитую конструкцию MSA16IL-1ra (также обозначаемую DOM7m-16/IL-1ra), и аминокислотная последовательность (SEQ ID NO:30) слитой конструкции.
На Фиг.2G-2Н представлена нуклеотидная последовательность (SEQ ID NO:31), кодирующая слитую конструкцию DummyIL-1ra, которая не связывала сывороточный альбумин, и аминокислотная последовательность (SEQ ID NO:32) слитой конструкции.
Фиг.3А представляет собой иллюстрацию, показывающую, что IL-1 индуцирует производство IL-8 HeLa-клетками, и показывающую механизм обнаружения IL-8 методом ELISA.
Фиг.3 В представляет собой график, показывающий, что каждый из IL-1rа (♦), MSA16IL-1ra (▀) и IL-1raMSA16 (▲ ) ингибировал IL-1-индуцированную секрецию IL-8 культивированными MRC-5 клетками. Наблюдаемое ингибирование носило дозозависимый характер для IL-1ra, MSA16IL-1ra и IL-1raMSA16.
Фиг.4А-4С представляют собой графики, показывающие, что IL-1ra (♦), а также MSA16IL-1ra (▀) ингибировали IL-1-индуцированную секрецию IL-8 культивированными MRC-5 клетками в анализах, которые не включали сывороточный альбумин мышей (4А), включали 5% сывороточного альбумина мышей (4В) или 10% сывороточного альбумина мышей (4С). Наблюдаемое ингибирование носило дозозависимый характер для IL-1ra и MSA16IL-1ra во всех условиях тестирования.
На Фиг.5 схематично представлены результаты ELISA (метод твердофазного иммуноферментного анализа), демонстрирующие, что слитая конструкция MSA16IL-1ra, а также слитая конструкция IL-1raMSA16 связывали сывороточный альбумин, а слитая конструкция DummyIL-1ra не связывала.
На Фиг.6А-6С представлены сенсограммы и таблицы, показывающие данные сродства BIACORE для клона DOM7h-1, связывающего сывороточный альбумин человека (HSA) (6А), DOM7h-7, связывающего HSA (6В), и DOM7M, связывающего сывороточный альбумин крыс (RSA).
На Фиг.7 представлена таблица, показывающая сродство DOM7h-1, DOM7r-1, DOM7h-2, DOM7r-3, DOM7h-7, DOM7h-8, DOM7r-8, DOM7r-13, DOM7r-14, DOM7m-16, DOM7h-22, DOM7h-23, DOM7h-26, DOM7r-16, DOM7m-26, DOM7r-27 и DOM7R-31 к сывороточным альбуминам, которые они связывают.
На Фиг.8А представлена нуклеотидная последовательность (SEQ ID NO:33) нуклеиновой кислоты, кодирующей рецепторный антагонист человеческого интерлейкина-1 (IL-1ra), помещенный в GenBank под регистрационным номером NM_173842. Нуклеиновая кислота имеет открытую рамку считывания, стартующую в положении 65.
На Фиг.8В представлена аминокислотная последовательность человеческого IL-1ra (SEQ ID NO:34), кодируемого нуклеиновой кислотой, показанной на Фиг.8А (SEQ ID NO:33). Зрелый белок состоит из 152 аминокислотных остатков (аминокислотные остатки 26-177 из SEQ ID NO:34).
На Фиг.9 представлена графическая зависимость концентрации (мкг/мл) MSA-связывающего слитого белка с dAb/HA-эпитопной меткой в сыворотке мышей после однократной внутривенной (в/в) инъекции (доза составляла примерно 1,5 мг/кг) животным мужского пола штамма CD1 от времени (сутки). Сывороточную концентрацию определяли методом ELISA с использованием реактивов детекции захвата козлиных анти-НА (Abeam, UK) и протеин L-HRP (Invitrogen, USA). Стандартные кривые известных концентраций MSA-связывающей слитой конструкции dAb/HA устанавливали в присутствии 1х мышиной сыворотки для обеспечения сравнимости с тест-образцами. Моделирование при помощи однокомпартментной модели (WinNonlin Software, Pharsight Corp., USA) показало, что MSA-связывающий слитый белок с dAb/HA-эпитопной меткой имел конечную фазу t1/2, равную 29,1 часа, и площадь под кривой, равную 559 час-мкг/мл.
На Фиг.10 представлены аминокислотные последовательности VK, выбранных путем связывания с сывороточным альбумином крыс (RSA). Иллюстрированные последовательности принадлежат VK, обозначаемым DOM7r-15 (SEQ ID NO:37), DOM7r-16 (SEQ ID NO:38), DOM7M7 (SEQ ID NO:39), DOM7r-18 (SEQ ID NO:40), DOM7r-19 (SEQ ID NO:41).
На Фиг.11А-11В представлены аминокислотные последовательности VK, которые связывают сывороточный альбумин крыс (RSA). Иллюстрированные последовательности принадлежат VK, обозначаемым DOM7r-20 (SEQ ID NO:42), DOM7r-21 (SEQ ID NO:43), DOM7r-22 (SEQ ID NO:44), DOM7r-23 (SEQ ID NO:45), DOM7r-24 (SEQ ID NO:46), DOM7r-25 (SEQ ID NO:47), DOM7r-26 (SEQ ID NO:48), DOM7r-27 (SEQ ID NO:49), DOM7r-28 (SEQ ID NO:50), DOM7r-29 (SEQ ID NO:51), DOM7r-30 (SEQ ID NO:52), DOM7r-31 (SEQ ID NO:53), DOM7r-32 (SEQ ID NO:54), DOM7r-33 (SEQ ID NO:55).
На Фиг.12 представлена графическая зависимость концентрации (% от исходной дозы) DOM7m-16, DOM7m-26 или контрольного dAb, которое не связывает MSA, каждый из которых содержал НА-эпитопную метку, в сыворотке мышей после однократной внутривенной (в/в) инъекции (доза составляла примерно 1,5 мг/кг) животным мужского пола штамма CD1 от времени. Сывороточную концентрацию определяли методом ELISA с использованием реактивов детекции захвата козлиных анти-НА (Abeam, UK) и протеин L-HRP (Invitrogen, USA). Стандартные кривые известных концентраций MSA-связывающей слитой конструкции dAb/HA устанавливали в присутствии 1х мышиной сыворотки для обеспечения сравнимости с тест-образцами. Моделирование при помощи однокомпартментной модели (WinNonlin Software, Pharsight Corp., USA) показало, что контрольное dAb имело конечную фазу t1/2a, равную 20 минутам, в то время как DOM7m-16, DOM7m-26 оставались в сыворотке значительно дольше.
На Фиг.13 графически представлено, что DOM7m-16/IL-1ra был более эффективен, чем IL-1ra или ENBREL® (энтаресепт; Immunex Corporation) при лечении артрита в модели коллаген-индуцированного артрита (CIA) у мышей. Индуцировали артрит и, начиная с 21 суток, вводили мышам дексаметазон в количестве 0,4 мг/кг (стероид), DOM7m-16/IL-1ra в количестве 1 мг/кг (IL-1ra/анти-SA 1 мг/кг) или 10 мг/кг (IL-lra/aHTH-SA 10 мг/кг), IL-1ra в количестве 1 мг/кг или 10 мг/кг, ENBREL® (энтаресепт; Immunex Corporation) в количестве 5 мг/кг или физиологический раствор. Результаты показывают, что DOM7m-16/IL-1ra был более эффективен, чем IL-1ra или ENBREL® (энтаресепт; Immunex Corporation) в данном исследовании. Отклик на IL-1ra имел дозозависимый характер, как ожидалось, и отклик на DOM7m-16/IL-1ra являлся также дозозависимым. Средние показатели в случае лечения DOM7m-16/IL-1ra в количестве 1 мг/кг были сообразно ниже, чем средние показатели, полученные в случае лечения IL-1ra в количестве 10 мг/кг. Результаты показывают, что лечение DOM7m-16/IL-1ra было в 10 раз эффективнее, чем применение IL-1ra в данном исследовании.
На Фиг.14A-14G представлены аминокислотные последовательности сапориновых полипетидов. На Фиг.14А представлена аминокислотная последовательность предшественника сапорина-2, зарегистрированная как Swissprot Accession Number P27559 (SEQ ID NO:60). Сигнальный пептид представляет собой аминокислоты с 1 по 24 из SEQ ID NO:60. На Фиг.14 В представлена аминокислотная последовательность сапорина-3, зарегистрированная как Swissprot Accession Number P27560 (SEQ ID NO:61). На Фиг.14С представлена аминокислотная последовательность предшественника сапорина-4, зарегистрированная как Swissprot Accession Number P27561 (SEQ ID NO:62). Сигнальный пептид представляет собой аминокислоты с 1 по 24 из SEQ ID NO:62. На Фиг.14D представлена аминокислотная последовательность сапорина-5, зарегистрированная как Swissprot Accession Number Q41389 (SEQ ID NO:63). На Фиг.14Е представлена аминокислотная последовательность предшественника сапорина-6, зарегистрированная как Swissprot Accession Number P20656 (SEQ ID NO:64). Сигнальный пептид представляет собой аминокислоты с 1 по 24 из SEQ ID NO:64, и потенциальный пропептид представляет собой аминокислоты с 278 по 299 из SEQ ID NO:64. Зрелый полипептид представляет собой аминокислоты с 25 по 277 из SEQ ID NO:64 (SEQ ID NO:65). На Фиг.14F представлена аминокислотная последовательность сапорина-7, зарегистрированная как Swissprot Accession Number Q41391 (SEQ ID NO:66). На Фиг.14G представлена консенсусная аминокислотная последовательность, охватывающая несколько вариантов и изоформ сапорина-6 (SEQ ID NO:67).
На Фиг.15 представлены аминокислотные последовательности нескольких Camelid VHH, которые связывают сывороточный альбумин мышей, которые описаны в WO 2004/041862. Последовательность A (SEQ ID NO:72), Последовательность В (SEQ ID NO:73), Последовательность С (SEQ ID NO:74), Последовательность D (SEQ ID NO:75), Последовательность Е (SEQ ID NO:76), Последовательность F (SEQ ID NO:77), Последовательность G (SEQ ID NO:78), Последовательность H (SEQ ID NO:79), Последовательность I (SEQ ID NO:80), Последовательность J (SEQ ID NO:81), Последовательность К (SEQ ID NO:82), Последовательность L (SEQ ID NO:83), Последовательность М (SEQ ID NO:84), Последовательность N (SEQ ID NO:85), Последовательность О (SEQ ID NO:86), Последовательность Р (SEQ ID NO:87), Последовательность Q (SEQ ID NO:88).
На Фиг.16А представлена нуклеотидная последовательность, кодирующая [Pro9]GLP-1-Dom7h8 слитую конструкцию (SEQ ID NO:177), и аминокислотная последовательность слитой конструкции (SEQ ID NO:179).
На Фиг.16В представлена нуклеотидная последовательность, кодирующая [Pro9]GLP-1-PSS-Dom7h8 слитую конструкцию (SEQ ID NO:180), и аминокислотная последовательность слитой конструкции (SEQ ID NO:182).
На Фиг.16С представлена нуклеотидная последовательность, кодирующая [Pro9]GLP-l-PSSGAP- Dom7h8 слитую конструкцию (SEQ ID NO:183), и аминокислотная последовательность слитой конструкции (SEQ ID NO:185).
Фиг.17 представляет собой график, показывающий, что [Pro9]GLP-1-PSSGAP-Dom7h8 слитая конструкция (□) имела эквивалентную дозозависимую активность клеточной пролиферации к GLP-1 контролю, (▲), Эксендин-4 (▼). Базальный зеро контроль показан (♦).
Фиг.18 представляет собой график, показывающий, что [Pro9]GLP-1-PSSGAP-Dom7h8 слитая конструкция (□) имела эквивалентное дозозависимое высвобождение инсулина к GLP-1 контролю, (▲), Эксендин-4 (▼). Базальный зеро контроль показан (♦).
На Фиг.19А-19С представлена аминокислотная последовательность Dom7h-8 PYY (3-36) (SEQ ID NO:186), PYY (3-36). Dom7h-8 (SEQ ID NO:187) и [Pro9]GLP-1(3-27)-Dom7h-8 PYY (3-36) (SEQ ID NO:188) слитых конструкций соответственно.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном описании варианты воплощения были описаны таким образом, чтобы создать четкое и ясное описание, однако подразумевается и следует понимать, что варианты воплощения можно различным образом объединять или разъединять без отклонения от объема изобретения.
Как использовано в настоящем описании, «лекарственное средство» относится к любому соединению (например, небольшая органическая молекула, нуклеиновая кислота, полипептид), которую можно ввести индивидууму для получения выгодного терапевтического или диагностического эффекта посредством связывания с и/или изменения функции биологической молекулы-мишени у индивидуума. Молекула-мишень может представлять собой эндогенную молекулу-мишень, кодируемую геномом индивидуума (например, фермент, рецептор, фактор роста, цитокин, кодируемый геномом индивидуума), или экзогенную молекулу-мишень, кодируемую геномом патогена (например, фермент, кодируемый геномом вируса, бактерии, гриба, нематоды или другого патогена).
Как использовано в настоящем описании, термин «основа лекарственного средства» относится к видам активности композиций лекарственного средства и лекарственных средств, которые нормализованы исходя их количества лекарственного средства (или лекарственной группировки), использованной для того, чтобы оценить, измерить или установить активность. Как правило, композиции лекарственного средства по изобретению (например, конъюгат лекарственного средства, нековалентный конъюгат лекарственного средства, слитая конструкция лекарственного средства) имеют большую молекулярную массу, чем лекарственное средство, которое они содержат. Таким образом, эквивалентные количества композиции лекарственного средства и лекарственного средства, по массе, будут содержать разные количества лекарственного средства на молекулярной или молярной основе. Например, если композиция лекарственного средства по изобретению имеет молекулярную массу вдвое большую, чем молекулярная масса лекарственного средства, которое она содержит, виды активности можно устанавливать на основе «основы лекарственного средства», используя 2 мкг композиции лекарственного средства и 1 мкг лекарственного средства, поскольку указанные количества содержали бы одинаковые количества лекарственного средства (в виде свободного лекарственного средства или в виде части композиции лекарственного средства). Виды активности можно нормализовать и выразить на основе «основы лекарственного средства» с использованием подходящих расчетов, например, выражая активность на основе сайта, связывающего мишень, или, для ферментативных лекарственных средств, на основе активного сайта.
Как использовано в настоящем описании, «композиция лекарственного средства» относится к композиции, содержащей лекарственное средство, которое ковалентно или нековалентно связано с полипептидсвязывающей группировкой, где полипептидсвязывающая группировка содержит связывающий сайт (например, антигенсвязывающий сайт), который имеет связывающую специфичность в отношении полипептида, который увеличивает период полувыведения в сыворотке in vivo. Композиция лекарственного средства может представлять собой конъюгат, где лекарственное средство ковалентно или нековалентно связано с полипептидсвязывающей группировкой. Лекарственное средство может быть ковалентно или нековалентно связано с полипептидсвязывающей группировкой прямым или непрямым образом (например, через подходящий линкер и/или нековалентное связывание комплементарных связывающих партнеров (например, биотина и авидина)). Если применяют комплементарные связывающие партнеры, один из связывающих партнеров может быть ковалентно связан с лекарственным средством напрямую или через подходящую линкерную группировку, и комплементарный связывающий партнер может быть ковалентно связан с полипептидсвязывающей группировкой напрямую или через подходящую линкерную группировку. Если лекарственное средство представляет собой полипептид или пептид, композиция лекарственного средства может представлять собой слитый белок, где полипептидное или пептидное лекарственное средство и полипептидсвязывающая группировка являются раздельными частями (группировками) непрерывной полипептидной цепи.
Как использовано в настоящем описании, «конъюгат» относится к композиции, содержащей антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, и который связан с лекарственным средством. Такие конъюгаты включают «конъюгаты лекарственного средства», которые содержат антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, с которым ковалентно связано лекарственное средство, и «нековалентные конъюгаты лекарственного средства», которые содержат антигенсвязывающий фрагмент антитела, который связывает сывороточный альбумин, с которым нековалентно связано лекарственное средство.
Как использовано в настоящем описании, «конъюгат лекарственного средства» относится к композиции, содержащей антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, с которым ковалентно связано лекарственное средство. Лекарственное средство может быть ковалентно связано с антигенсвязывающим фрагментом напрямую или непрямым путем через подходящую линкерную группировку. Лекарственное средство может быть связано с антигенсвязывающим фрагментом в любом подходящем положении, таком как аминоконец, карбоксиконец или через подходящие аминокислотные боковые цепочки (например, е аминогруппа лизина или тиольная группа цистеина).
Как использовано в настоящем описании, «нековалентный конъюгат лекарственного средства» относится к композиции, содержащей антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, с которым нековалентно связано лекарственное средство. Лекарственное средство может быть нековалентно связано с антигенсвязывающим фрагментом напрямую (например, электростатическое взаимодействие, гидрофобное взаимодействие) или непрямым путем (например, через нековалентное связывание комплементарных связывающих партнеров (например, биотина и авидина), где один партнер ковалентно связан с лекарственным средством, и комплементарный связывающий партнер ковалентно связан с антиген-связывающим фрагментом). Если применяют комплементарные связывающие партнеры, один из связывающих партнеров может быть ковалентно связан с лекарственным средством напрямую или через подходящую линкерную группировку и комплементарный связывающий партнер может быть ковалентно связан с антигенсвязывающим фрагментом антитела, которое связывает сывороточный альбумин, напрямую или через подходящую линкерную группировку.
Как использовано в настоящем описании, «слитая конструкция лекарственного средства» относится к слитому белку, который содержит антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, и полипептидное лекарственное средство. Антигенсвязывающий фрагмент антитела, которое связывает сывороточный альбумин, и полипептидное лекарственное средство присутствуют в виде раздельных частей (группировок) одной непрерывной полипептидной цепи.
Термин «альбуминсвязывающий остаток», как использовано в настоящем описании, означает остаток, который связывается нековалентно с человеческим сывороточным альбумином. Альбуминсвязывающий остаток, присоединенный к терапевтическому полипептиду, обычно имеет сродство менее 10 мкМ к человеческому сывороточному альбумину и, предпочтительно, менее 1 пМ. В одном варианте воплощения, известен ряд альбуминсвязывающих остатков среди линейных и разветвленных липофильных группировок, содержащих 4-40 углеродных атомов, соединений с циклопентанофенантреновым скелетом, пептидов, имеющих 10-30 аминокислотных остатков и т.д.
Как использовано в настоящем описании, «рецепторный антагонист интерлейкина-1» (IL-1ra) относится к природным или эндогенным IL-1ra белкам млекопитающих и к белкам, имеющим аминокислотную последовательность, которая является той же самой, что и аминокислотная последовательность у природного или эндогенного соответствующего белка IL-1ra млекопитающих (например, рекомбинантные белки, синтетические белки (т.е. полученные методами синтетической органической химии)). Соответственно, как указано в настоящем описании, термин включает зрелый белок, полиморфные или аллельные варианты и другие изоформы IL-1ra (например, полученные путем альтернативного сплайсинга или другими клеточными процессами), а также модифицированные или немодифицированные формы вышеназванного (например, с присоединенными липидами, гликозилированные, пэгилированные). Природные или эндогенные IL-1ra включают белки дикого типа, такие как зрелый IL-1ra, полиморфные или аллельные варианты и другие изоформы, которые встречаются в природе у млекопитающих (например, у человека, приматов кроме человека). Такие белки можно извлечь или выделить из источника, который, например, продуцирует IL-1ra в природе. Данные белки и IL-1ra белки, имеющие такую же аминокислотную последовательность, как природные или эндогенные соответствующие IL-1ra, обозначают по названию соответствующего млекопитающего. Например, если соответствующее млекопитающее представляет собой человека, белок обозначают как человеческий IL-1ra.
«Функциональные варианты» IL-1ra включают функциональные фрагменты, функциональные мутантные белки и/или функциональные слитые белки, которые можно получить с применением подходящих способов (например, мутагенез (например, химический мутагенез, радиационный мутагенез), методики рекомбинантных ДНК). «Функциональный вариант» противодействует рецептору типа 1 интерлейкина-1. Как правило, фрагменты или участки IL-1ra включают таковые, имеющие делецию и/или добавление (т.е. одну или более делеций и/или добавлений аминокислоты) аминокислоты (т.е. одна или более аминокислот) относительно зрелого IL-1ra (такие как N-концевые, С-концевые или внутренние делеций). Предусматриваются также фрагменты или участки, в которых были удалены только смежные аминокислоты или в которых были удалены несмежные аминокислоты относительно зрелого IL-1ra. Функциональный вариант человеческого IL-1ra может иметь по меньшей мер, примерно 80%, или по меньшей мере примерно 85%, или по меньшей мере примерно 90%, или по меньшей мере примерно 95%, или по меньшей мере примерно 96%, или по меньшей мере примерно 97%, или по меньшей мере примерно 98%, или по меньшей мере примерно 99% идентичности аминокислотной последовательности с зрелой формой человеческого IL-1ra, состоящей из 152 аминокислот, и противодействует рецептору типа 1 человеческого интерлейкина-1. (См. Eisenberg et al., Nature 343:341-346 1990). Вариант может содержать одну или более дополнительных аминокислот (например, содержать 153, или 154, или более аминокислот). Например, вариант IL-1ra может иметь аминокислотную последовательность, которая состоит из аминоконцевого метионинового остатка, за которым следуют остатки от 26 до 177 из SEQ ID NO:33. (KINERET® (anakinra), Amgen).
Как использовано в настоящем описании, термин «примерно» является возможным, но, предпочтительно, интерпретируется как означающий плюс или минус 20%, более предпочтительно, плюс или минус 10%, еще более предпочтительно, плюс или минус 5%, еще более предпочтительно, плюс или минус 2%, наиболее предпочтительно, плюс или минус 1%.
Термин «аналог», как использовано в настоящем описании, относящийся к полипептиду, означает модифицированный полипептид, где один или более аминокислотных остатков пептида были замещены другими аминокислотными остатками, и/или где один или более аминокислотных остатков пептида были удалены из пептида, и/или где один или более аминокислотных остатков пептида были удалены из пептида, и/или где один или более аминокислотных остатков пептида были добавлены к пептиду. Такое добавление или удаление аминокислотных остатков может произойти на N-конце пептида и/или на С-конце пептида, или они могут произойти внутри пептида. Используют простую систему для описания аналогов GLP-1: Например, [Arg34] GLP-1 (7-37) Lys обозначает аналог GLP-1, где природный лизин в положении 34 был замещен аргинином, и остаток лизина был добавлен к С-концу (положение 38). Формулы аналогов пептида и его производных рисуют с использованием стандартных единичных буквенных аббревиатур для аминокислот, используемых согласно номенклатуре IUPAC-IUB.
Термин «GLP-1 пептид», как использовано в настоящем описании, означает GLP-1 (7-37) (SEQ ID NO:158) или GLP-1 (7-36) (SEQ ID NO:159), аналог GLP-1, производное GLP-1 или производное аналога GLP-1. Такие пептиды, аналоги и производные представляют собой инсулинотропные агенты.
Термин «инсулинотропный агент», как использовано в настоящем описании, означает соединение, которое способно стимулировать, или вызывать стимулирование, синтез, или экспрессию, или активность гормона инсулина. Известные примеры инсулинотропных агентов включают, но не ограничены, глюкозу, GIP (глюкозозависимый инсулинотропный пептид), GLP, Эксендин и ОХМ (оксинтомодулин).
Термин «инкретин», как использовано в настоящем описании, означает тип желудочно-кишечного гормона, который вызывает увеличение количества инсулина, высвобождаемого, когда уровни глюкозы являются нормальными, или, особенно, когда они повышены. В качестве примера, они включают GLP-1, GIP и ОХМ.
Термин «пеп