Способ индивидуального подбора пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии для элиминации условно-патогенных микроорганизмов, выделенных от пациента при исследовании на дисбактериоз кишечника
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине и может использоваться в бактериологических лабораториях для индивидуального подбора пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии для элиминации условно-патогенных микроорганизмов (УПМ), выделенных от пациента при исследовании на дисбактериоз кишечника. Индивидуальный подбор пробиотиков осуществляют при средней или высокой степенях адгезивной активности пробиотических штаммов с использованием буккального эпителия конкретного пациента, а также наличии биосовместимости пробиотических и индигенных лакто- и бифидобактерий и высокой степени антагонистической активности пробиотических штаммов несколькими способами в отношении УПМ, выделенного от конкретного пациента. Изобретение обеспечивает повышение точности выявления антагонистической активности пробиотических препаратов, упрощение посева и учета полученного результата. 1 з.п. ф-лы, 5 ил., 19 табл.
Реферат
Изобретение относится к области медицины, а именно к микробиологии, и может использоваться в бактериологических лабораториях для индивидуального подбора пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии для элиминации условно-патогенных микроорганизмов (УПМ), выделенных от пациента при исследовании на дисбактериоз кишечника.
Антагонизм против произвольного набора патогенных микроорганизмов и адгезивность к стандартной культуре клеток (не к эпителию пациентов) могут использоваться в научно-производственных объединениях при поиске новых штаммов для будущих пробиотиков, но не используются в лабораториях для индивидуального подбора пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии для элиминации условно-патогенных микроорганизмов (УПМ), выделенных от пациента при исследовании на дисбактериоз кишечника.
Адгезивность является важным свойством для успешного приживления пробиотических штаммов. Интенсивность адгезии может существенно варьировать в зависимости от используемых пробиотических штаммов и от экспериментальных условий [1, 2, 3, 4, 5, 6].
Известен способ определения адгезивной активности лактобактерии к буккальному и влагалищному эпителию, где доказана возможность использования буккального эпителия при оценке адгезивности пробиотических штаммов к влагалищному эпителию, т.к. определена высокая корреляционная взаимосвязь между степенью адгезии лактобацилл к двум видам эпителия: буккальному и вагинальному (коэффициент ранговой корреляции Спирмена 0,7) [5].
Этот способ описан только для характеристики адгезивной активности лактобактерий к влагалищному эпителию, но не использовался для оценки адгезивной активности и ее степени у других пробиотических препаратов, содержащих как лактобактерии, так и бифидобактерии, к кишечному эпителию для индивидуального подбора препарата для коррекции дисбиотических состояний у данного пациента.
Пробиотические штаммы лактобактерий и/или бифидобактерий могут вступать в конкурентные взаимоотношения с собственными лактобактериями пациента [7]. Для успешного применения пробиотиков необходимо определить их биосовместимость. Известен способ определения биосовместимости пробиотических и индигенных лактобактерий, представляющий собой метод совместного культивирования (капельная методика) [7].
В литературе нами не обнаружено сведений о способах определения биосовместимости пробиотических и индигенных бифидобактерий.
Для выявления антагонистической активности пробиотических штаммов существуют 2 основные методики: 1) метод штрихов [8]; 2) метод двухслойного агара [9]. Кроме этого, описан метод перевернутого агара [10] и метод прямого совместного культивирования - капельная методика [11], которые широко не применяются.
При использовании метода штрихов по диаметру чашки Петри с питательной средой петлей наносят культуру пробиотика, инкубируют в течение двух суток при 37°С в анаэробных условиях, затем штрихом перпендикулярно выросшим культурам пробиотиков подсевают тест-штаммы УПМ. Инкубируют в аэробных условиях при 37°С. Учет результатов проводят через 24 ч по величине зоны задержки роста тест-культур в мм. Контролем роста тест-культур служит параллельный посев на чашки с той же средой, но без пробиотиков. В соответствии с требованиями к штаммам-пробиотикам зоны угнетения роста тест-культур должны составлять не менее 20 мм [8].
При использовании классического метода изучения антагонистической активности - метода двухслойного агара - в питательную среду вносят пробиотический микроорганизм в определенной концентрации, разливают в чашки Петри, а после застывания на поверхность нижнего слоя наливают второй слой питательной среды. Далее на поверхность верхнего слоя засевают тест-культуры условно-патогенных микроорганизмов в концентрации 106 КОЕ/мл [9]. Снижение концентрации тест-штаммов в присутствии пробиотика по сравнению с контролем без пробиотика свидетельствует об антагонистической активности пробиотика.
Для оценки взаимного влияния пробиотиков и УПМ можно использовать метод прямого совместного культивирования на поверхности плотной питательной среды (капельная методика) [11]. Суточную культуру пробиотика наносят на поверхность питательной среды бактериологической петлей диаметром 3 мм. Посев оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю культуры тестируемого микроорганизма. Растекаясь, вторая капля затекает на пятно культуры пробиотика до половины диаметра. В той части, где произошло наложение капель, возникают конкурирующие отношения культур. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. После подсыхания капель чашки инкубируют в анаэростате в микроаэрофильных условиях при 37°С. Наличие антагонизма выявляют визуально по наличию признаков подавления одной культуры другой.
Метод перевернутого агара описан для выявления антагонистической активности пробиотиков, содержащих Bacillus subtilis и Escherichia coli, в отношении оппортунистических дрожжей [10]. Для этого штаммы Bacillus subtilis и Escherichia coli засевают газоном на плотную питательную среду, через 2 суток агар переворачивают и на его обратную сторону засевают предварительно оттитрованную посевную дозу дрожжей. Инкубируют 24 ч в аэробных условиях при 37°С. Наличие антагонизма выявляют по подавлению роста дрожжей по сравнению с аналогичным посевом без пробиотических штаммов не менее чем на 1 порядок.
Одним из основных показателей качества пробиотиков при выборе кандидатов для создания новых пробиотиков является их антагонистическая активность, определяемая in vitro. Их антагонистическая активность в организме человека может быть обусловлена многими факторами: конкуренцией за рецепторы, выработкой биологически активных веществ, бактериоцинов и бактериоциноподобных веществ, лизоцима, молочной, уксусной и других кислот, перекиси водорода. Однако эти механизмы не универсальны для различных штаммов, входящих в состав пробиотиков. Также неизвестно, какой из этих факторов оказывает решающее значение в подавлении тех или иных микроорганизмов. Поэтому выбор методики выявления антагонизма пробиотических культур обычно осуществляется разными авторами произвольно. Вероятно, каждая из предложенных методик не позволяет оценить всю совокупность факторов, влияющих на выраженность антагонизма, а выявляет какую-либо ее составляющую, при этом какую именно, определить не представляется возможным. Анализируя потенциальную эффективность методов определения антагонистической активности пробиотических препаратов, следует отметить ограниченные возможности каждого отдельно взятого способа.
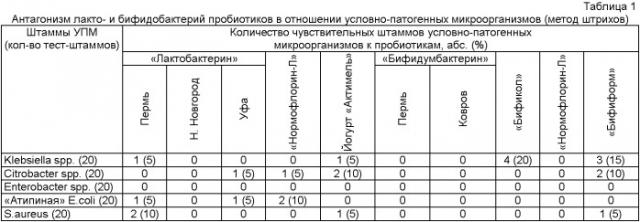
Так, например, достоинством метода штрихов является его очевидная простота. Однако такой подход не позволяет определить мощность антагонистической активности, так как посев проводится не количественно. Кроме этого, эта методика эффективна при выявлении антагонистической активности в отношении патогенных микроорганизмов, по данным литературы [8]. Но при использовании тест-культур условно-патогенных микроорганизмов, выделенных при дисбактериозе кишечника, выявляемость антагонистической активности, по собственным данным, крайне низкая (табл.1 - Антагонизм лакто- и бифидобактерий пробиотиков в отношении условно-патогенных микроорганизмов (метод штрихов)). Возможно, это связано с тем, что условно-патогенные микроорганизмы приспособлены к сосуществованию с лакто- и бифидобактериями и такие факторы антагонизма, как закисление среды в процессе культивирования, на них не действуют. Также, возможно, при перпендикулярном подсеве УПМ играет роль феномен «quorum sensing», не дающий реализовать пробиотическим штаммам свои антагонистические возможности.
Недостатком метода двухслойного агара, по мнению авторов заявляемого способа, является неудобство посева и учета полученного результата. Метод двухслойного агара требует подтитровки, так как посев тест-культур должен производиться с таким расчетом, чтобы после инкубации количество микроорганизмов было считабельным, т.е. не превышало бы 300 КОЕ на питательной среде. При проведении посева суспензии шпателем в количестве от 10 до 100 мкл с концентрацией микроорганизмов 106 KOE/мл, если в процессе инкубации количество микроорганизмов не уменьшится, это приведет к сложности (сплошной рост) и даже невозможности (зарост) учета результата. Это, безусловно, требует подтитровки и дополнительных исследований при тестировании каждого штамма. Подтитровка подразумевает приготовление дополнительных разведений и высевов из каждого разведения на отдельную чашку с питательной средой, что влечет за собой дополнительный расход питательных сред и лабораторной посуды.
Кроме этого, по собственным данным, интенсивность антагонистического воздействия на условно-патогенные микроорганизмы при использовании метода двухслойного агара в большинстве случаев недостаточно интенсивна - происходит снижением УПМ на 1 порядок по сравнению с контролем - посевом тех же культур УПМ без пробиотика (табл.2 - Различия в степени антагонистической активности пробиотиков в отношении условно-патогенных микроорганизмов. Метод двухслойного агара). Данная степень подавления ничтожно мала для успешного применения пробиотика. Следовательно, при использовании только метода двухслойного агара может потребоваться дополнительное тестирование с другими пробиотическими препаратами, поскольку единовременно охватить весь спектр имеющихся на рынке препаратов невозможно.
Метод перевернутого агара описан и протестирован для оценки антифунгального действия пробиотиков, содержащих Bacillus subtilis и Escherichia coli [10]. Но оценка антагонистического действия лакто- и/или бифидосодержащих пробиотиков на другие условно-патогенные микроорганизмы (не оппортунистические дрожжи) не производилась. Кроме этого, оригинальная методика подразумевает подбор посевной дозы дрожжей, при которой на агаре вырастало бы не более 70 колоний. Это, безусловно, требует подтитровки и дополнительных исследований при тестировании каждого штамма, как и при методе двухслойного агара. При использовании метода перевернутого агара также нередки случаи низкой антагонистической активности, поэтому применяя только метод перевернутого агара, невозможно дифференцированно подходить к выбору пробиотика или возникает необходимость в дополнительном тестировании с другими пробиотическими препаратами, как и при использовании метода двухслойного агара (табл.3 - Различия в степени антагонистической активности пробиотиков в отношении условно-патогенных микроорганизмов. Метод перевернутого агара).
Недостатком метода совместного культивирования, по мнению авторов заявляемого способа, является невозможность соблюдения обязательного условия для применения этого метода - способность обоих тестируемых микроорганизмов (пробиотика и условно-патогенного микроорганизма) к росту на используемой питательной среде и в используемой атмосфере инкубации. Так, бифидобактерии не растут в микроаэрофильных условиях, а УПМ при культивировании в анаэробных условиях вырастают в значительно меньшем количестве, чем при культивировании в присутствии кислорода. Поэтому эта методика наиболее подходит для тестирования пробиотических лактобактерий, которые менее требовательны по сравнению с бифидобактериями. Кроме этого, невозможность количественной оценки антагонистической активности в данной методике существенно ограничивает ее применение, т.к. не позволяет дать прогноз успешности применения пробиотика.
Все разработанные на сегодняшний день методики оценки антагонистической активности направлены на определение таковой при выборе производственных штаммов для массового производства пробиотических препаратов. Поэтому пробиотики могут оказаться неэффективны в отношении штаммов УПМ, выделенных от конкретного пациента.
В качестве прототипа по наиболее близкой технической сущности нами выбран способ определения адгезивной активности лактобактерий к буккальному и влагалищному эпителию. Данный способ может быть использован для индивидуального подбора пробиотических препаратов, содержащих лактобактерии для элиминации условно-патогенных микроорганизмов [5].
Способ выполняется следующим образом. Клетки вагинального эпителия забираются врачом-гинекологом с заднего свода влагалища с помощью ложки Фолькмана, после тщательного удаления слизи ватным тампоном. Соскоб буккального эпителия забирают с помощью стерильного деревянного шпателя. Соскобы помещают в цитрат-фосфатный буфер и доставляют в лабораторию в течение 2-3 часов. Непосредственно перед началом исследования эпителиальные клетки отмывают путем трехкратного центрифугирования (1000 об/мин - 5 минут). После отмывки из осадка готовят контрольные мазки. Для этого на поверхность предметного стекла наносят 1 каплю осадка и распределяют в диск диаметром около 1,5 см. Мазки фиксируют и окрашивают водным раствором метиленового синего. Образец считают пригодным для дальнейшего исследования, если при микроскопии (увеличение ×900) в каждом поле зрения обнаруживают не менее 2-3 эпителиальных клеток. Для изучения адгезивной активности в пробирку Эппендорфа вносят 800 мкл суспензии эпителиальных клеток и 600 мкл суспензии лактобактерий. Содержимое пробирок тщательно перемешивают и инкубируют в течение 2 часов при температуре 37°C с периодическим повторным перемешиванием путем переворачивания пробирок. После инкубации неадсорбированные бактериальные клетки удаляют двухкратным отмыванием путем центрифугирования (1000 об/мин в течение 3 минут). Из осадка готовят мазки, которые после фиксации окрашивают метиленовым синим. При микроскопии препарата подсчитывают количество бактериальных клеток, прикрепившихся к поверхности каждой эпителиальной клетки. Результат выражают в виде среднеарифметического числа лактобактерий на поверхности одного эпителиоцита.
Этот способ описан только для характеристики адгезивной активности лактобактерий к влагалищному эпителию, но не использовался для оценки адгезивной активности и ее степени у других пробиотических препаратов, содержащих как лактобактерии, так и бифидобактерии, к кишечному эпителию для индивидуального подбора препарата для коррекции дисбиотических состояний у данного пациента.
К недостаткам данного способа, рассматриваемого нами как способ индивидуального подбора пробиотических препаратов, содержащих лактобактерии, в отношении УПМ, можно отнести также и то, что не учитываются такие важные моменты, как определение биосовместимости исследуемых пробиотических препаратов с индигенными лакто- и бифидобактериями пациента, а также выявление антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, в отношении УПМ, выделенных от пациента.
Отсутствие определения биосовместимости повышает риск использования пробиотиков, которые могут подавлять собственную индигенную микрофлору данного пациента и приводить к дисбалансу кишечной микрофлоры, усугубляя дисбиоз.
Отсутствие определения антагонистической активности также значительно сужает спектр подобранных пробиотических препаратов, поскольку только лишь определение адгезивности указывает на вероятность колонизации биотопа данными пробиотическимй штаммами, но не характеризует вероятность подавления УПМ, выделенных у данного пациента, с использованием данного перечня препаратов, а значит, не делает назначение препаратов с целью элиминации УПМ в достаточной мере индивидуализированным и подходящим для конкретного пациента с достаточной для данного пациента адгезивностью.
Задачей изобретения является снижение риска использования пробиотиков, которые могут подавлять собственную индигенную микрофлору данного пациента, а также расширение спектра оптимально подобранных пробиотических препаратов, содержащих как лактобактерии, так и бифидобактерии, для конкретного пациента для элиминации УПМ, выделенных от пациента при исследовании на дисбактериоз кишечника.
Техническим результатом изобретения является:
- разработка способа индивидуального подбора пробиотических препаратов, содержащих как лактобактерии, так и бифидобактерии, для элиминации УПМ, выделенных от пациента при исследовании на дисбактериоз кишечника, способа, учитывающего антагонистическую и адгезивную активности указанных пробиотических препаратов, а также их биосовместимость с индигенными лакто- и бифидобактериями пациента;
- повышение точности выявления антагонистической активности пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, в отношении УПМ, выделенных при исследовании на дисбактериоз кишечника у конкретного пациента;
- упрощение посева и учета полученного результата.
Технический результат достигается тем, что получают буккальный эпителий пациента. Выделяют штаммы УПМ, лактобактерии и бифидобактерии из фекалий обследуемого. Затем выделяют лактобактерии и/или бифидобактерии, входящие в состав пробиотиков в чистой культуре, после чего определяют адгезивную активность пробиотических лакто- и бифидобактерий к клеткам буккального эпителия пациента путем подсчета количества микроорганизмов, адсорбировавшихся на каждой из не менее чем 5 клеток. Определяют индекс адгезивности по среднему числу адгезировавшихся микроорганизмов и присваивают балльную оценку: 1 балл - до 30 адгезированных микроорганизмов на одной клетке, 2 балла - 31-60, 3 балла - 61-90, 4 балла - 91-120, 5 баллов - 121 и более. При количестве адгезированных микроорганизмов в 1-2 балла определяют низкую степень адгезии, в 3 балла - среднюю степень, 4-5 - высокую. Затем выявляют биосовместимость пробиотических штаммов лактобактерий и/или бифидобактерий и штаммов лактобактерий и бифидобактерий, выделенных от конкретного пациента, с использованием капельной методики и определяют ее наличие или отсутствие. Затем при наличии биосовместимости определяют антагонистическую активность лактобактерий и/или бифидобактерий одновременно методом двухслойного агара и методом перевернутого агара, при этом посев осуществляют по Gold. Оценивают мощность антагонистического воздействия пробиотических штаммов по степени интенсивности подавления штаммов УПМ по сравнению с контролем: низкая степень - подавление на 1-2 lg, средняя степень - на 3-4 lg, высокая степень - на 5-9 lg, вплоть до полного подавления роста УПМ. Выявляют наличие антагонистической активности в отношении УПМ, выделенного от конкретного больного, при выявлении антагонистической активности пробиотиков одним из этих методов или двумя. При отсутствии антагонистической активности или выявлении низкой или средней степени интенсивности подавления УПМ антагонистическую активность дополнительно определяют капельной методикой и выявляют наличие антагонистической активности в отношении УПМ, выделенного от конкретного больного, при выявлении антагонистической активности пробиотика. Пробиотический препарат подбирают при наличии средней или высокой степеней адгезивности к буккальному эпителию пациента и/или наличии биосовместимости с лакто- и бифидобактериями этого же пациента и высокой степени антагонистической активности к штамму УПМ, выделенного от данного пациента.
Способ осуществляется следующим образом.
Стандартными способами выделяют чистую культуру условно-патогенных микроорганизмов, лактобактерий и бифидобактерий из фекалий обследуемого и чистую культуру пробиотических лактобактерий и/или бифидобактерий. Деревянным стерильным шпателем получают клетки буккального эпителия пациента с выявленным дисбактериозом кишечника.
Перед исследованием полученные клетки отмывают путем трехкратного центрифугирования в цитрат-фосфатном буфере (1000 об/мин - 5 мин). После отмывки из осадка готовят контрольные мазки. Образец считают пригодным для дальнейшего исследования, если при микроскопии в каждом поле зрения не менее 2-3 эпителиальных клеток.
Для изучения адгезивной активности в центрифужную пробирку вносят 200 мкл суспензии эпителиальных клеток и 200 мкл суспензии лакто- или бифидобактерий. Содержимое пробирок перемешивают и инкубируют в течение 2 часов при температуре 37°C с периодическим перемешиванием. После инкубации неадсорбированные бактериальные клетки удаляют путем двухкратного отмывания центрифугированием (1000 об/мин - 3 мин). Из осадка готовят мазки, которые окрашивают метиленовым синим. При микроскопии подсчитывают количество прикрепившихся бактериальных клеток. В каждом препарате анализируют не менее 5 клеток. Результат выражают в виде среднеарифметического числа бактерий на поверхности одного эпителиоцита. Интенсивность адгезии пробиотических микроорганизмов оценивают в баллах: до 30 адгезированных клеток - 1 балл, от 31 до 60 - 2 балла, от 61 до 90 - 3 балла, от 91 до 120 - 4 балла, 121 и более - 5 баллов. При количестве адгезированных микроорганизмов в 1-2 балла определяют низкую степень адгезии, в 3 балла - среднюю степень, 4-5 - высокую.
Для определения биосовместимости пробиотических и индигенных лактобактерий и бифидобактерий используют капельную методику. Суточную культуру пробиотических лакто- и/или бифидобактерий, выращенных в жидкой среде Шедлера, наносят на поверхность колумбийского агара бактериологической петлей диаметром 3 мм. Посев оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю культуры индигенного штамма лакто- или бифидобактерий, предварительно выращенного в жидкой среде Шедлера. Индигенными считались микроорганизмы, которые обнаруживались в фекалиях пациентов в количестве не менее 105-6 KOE/г. Растекаясь, вторая капля затекает на пятно культуры пробиотика до половины диаметра. В той части, где произошло наложение капель, возникают конкурирующие отношения культур. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. Авторская модификация данной методики заключается в том, что в случае посева двух штаммов лактобактерий после подсыхания капель чашки инкубируют в анаэростате в микроаэрофильных условиях при 37°C, при посеве двух штаммов бифидобактерий или одного штамма лактобактерий и одного штамма бифидобактерий - в анаэростате в анаэробных условиях. Наличие антагонизма выявляют визуально по наличию признаков подавления одной культуры другой. Культуры считают биосовместимыми в случае обнаружения роста двух исследуемых культур, сходного с ростом в контроле. При задержке или отсутствии роста одной из культур (при росте контрольных) взаимоотношения между ними рассматриваются как антагонистические и культуры считаются бионесовместимыми.
Оценку антагонистического влияния пробиотических препаратов, содержащих лактобактерии и/или бифидобактерии, на УПМ, выделенные от данного пациента, осуществляют одновременно методом двухслойного агара и методом перевернутого агара, а при необходимости оценку антагонистического влияния пробиотических препаратов, содержащих лактобактерии, дополнительно осуществляют капельной методикой.
Метод двухслойного агара для тестирования штаммов пробиотиков и УПМ используют в варианте, модифицированном авторами заявляемого способа, то есть используя посев по Gold. Нижний слой среды готовят из колумбийского агара. В расплавленную остывающую среду вносят 1 мл тестируемого пробиотического штамма в конечной концентрации 109 клеток по стандарту мутности ГИСК им. Л.А.Тарасевича на 1 мл среды, разливают по 10 мл в чашки Петри и оставляют на 1 час в термостате при 37°С. Затем на поверхность нижнего слоя наливают 10 мл колумбийского агара. Приготовленный таким образом двухслойный агар оставляют на 1 час при 37°С. Засеянные лактобактерии и бифидобактерии инкубируют в аэробных условиях. При посеве бифидобактерий в толщу агара и наслаивании сверху дополнительного слоя плотной среды создаются условия культивирования, близкие к анаэробным, поэтому анаэробная техника не используется.
Далее на поверхность верхнего слоя засевают мерно по Gold тест-культуры УПМ, выделенные от обследуемого. Для этого готовят суспензию культуры условно-патогенного микроорганизма в конечной концентрации 109 клеток по стандарту мутности ГИСК им. Л.А.Тарасевича. Методика проведения посева градуированной петлей штриховым методом по Gold заключается в следующем: бактериологической петлей диаметром 3 мм и емкостью 2 мкл производят посев исследуемого материала на сектор А чашки Петри с питательной средой (30-40 штрихов). После этого петлю прожигают и делают 4 штриховых посева из сектора А в сектор 1, аналогично из первого во второй, из второго в третий, каждый раз прожигая петлю. После инкубации подсчитывают число колоний, выросших на разных секторах питательной среды. Количество бактерий в 1 мл суспензии определяют по расчетной таблице 4 (Расчетная таблица для определения количества бактерий в мл жидкости) [12].
Контролем служат чашки с такой же питательной средой без пробиотиков, на которые засевают УПМ в таком же количестве, как и в опыте. Засев тест-культур может осуществляться уже через 2 часа после начала инкубации. Кроме этого, появляется возможность культивировать тест-культуры с различными потребностями, варьируя состав второго слоя.
Антагонистически активными считают пробиотики, при тестировании которых с использованием метода двухслойного агара происходит снижение роста УПМ по сравнению с контролем. Авторами заявляемого способа предлагается оценивать мощность антагонистического воздействия пробиотических штаммов по степени интенсивности подавления штаммов УПМ по сравнению с контролем: 1 степень (низкая) - подавление на 1-2 lg, 2 степень (средняя) - на 3-4 lg, 3 степень (высокая) - на 5-9 lg, вплоть до полного подавления роста УПМ (таблица 1).
Метод перевернутого агара для тестирования штаммов пробиотиков и УПМ используют в варианте, модифицированном авторами заявляемого способа, то есть используя посев по Gold. Пробиотические препараты лактобактерий и/или бифидобактерий в концентрации 1×109 по стандарту мутности ГИСК им. Л.А.Тарасевича в количестве 50 мкл засевают газоном на колумбийский агар. Предполагаемые антагонистические метаболиты пробиотиков диффундируют в толщу агара и в дальнейшем влияют на рост тест-культур. Инкубируют в анаэробных условиях при 37°С 48 ч. Затем агар переворачивают с помощью стерильного деревянного шпателя и засевают тест-культуры УПМ с обратной стороны в концентрации 109 клеток/мл, используя количественный посев УПМ мерной петлей по Gold для простоты дальнейшего подсчета (табл.4 - Расчетная таблица для определения количества бактерий в мл жидкости).
Инкубируют 24 ч в аэробных условиях при 37°С. Для контроля штаммы УПМ высевают на колумбийский агар без пробиотиков по Gold.
Антагонистическую активность данного пробиотического штамма считают выявленной с использованием метода перевернутого агара, если происходит снижение количества УПМ на питательной среде по сравнению с контролем. Оценивают мощность антагонистического воздействия пробиотических штаммов по степени интенсивности подавления штаммов УПМ по сравнению с контролем: низкая степень -подавление на 1-2 lg, средняя степень - на 3-4 lg, высокая степень - на 5-9 lg, вплоть до полного подавления роста УПМ (табл.3 - Различия в степени антагонистической активности пробиотиков в отношении УПМ. Метод перевернутого агара).
В случае выявления низкой или средней степени интенсивности подавления УПМ или полного отсутствия антагонистической активности изучаемого лактосодержащего пробиотика используют капельную методику, дающую качественную оценку наличия антагонизма. Суточную культуру пробиотических лактобактерий, выращенных в жидкой среде Шедлера, наносят на поверхность колумбийского агара бактериологической петлей диаметром 3 мм. Посев оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю культуры тестируемого УПМ, предварительно выращенного в мясо-пептонном бульоне (МПБ). Растекаясь, вторая капля затекает на пятно культуры пробиотика до половины диаметра. В той части, где произошло наложение капель, возникают конкурирующие отношения культур. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. После подсыхания капель чашки инкубируют в анаэростате в микроаэрофильных условиях при 37°С. Чтобы исключить возможность влияния последовательности наслоения капель тест-штаммов УПМ и культур лактобактерий, каждый опыт ставят в двух вариантах, меняя очередность посева культур. Наличие антагонизма выявляют визуально по наличию признаков подавления одной культуры другой. При задержке или отсутствии роста одной из культур (при росте контрольных) взаимоотношения между ними рассматривают как антагонистические.
При регистрации антагонистической активности хотя бы одним способом антагонистическая активность пробиотика в отношении УПМ, выделенного от данного больного, считается выявленной. При этом наиболее эффективными в отношении штамма УПМ, выделенного от конкретного пациента, считаются пробиотики с третьей (высокой, сильной) степенью интенсивности антагонистического воздействия.
Пробиотический препарат подбирают при наличии средней или высокой степеней адгезивности к буккальному эпителию пациента, наличии биосовместимости с лакто- и бифидобактериями этого же пациента и высокой степени антагонистической активности к штамму условно-патогенного микроорганизма, выделенного от данного пациента.
Существенными отличительными признаками заявляемого способа являются:
- получают клетки буккального эпителия от конкретного пациента, выделяют штаммы условно-патогенных микроорганизмов, лакто- и бифидобактерий из фекалий обследуемого, выделяют лактобактерии и/или бифидобакгерии, входящие в состав пробиотиков, в чистой культуре;
- определяют степень адгезивности пробиотических лакто- и/или бифидобактерий к буккальному эпителию пациента путем подсчета количества микроорганизмов, адсорбировавшихся на каждой из не менее чем 5 клеток, после чего определяют индекс адгезивности по среднему числу адгезировавшихся микроорганизмов и присваивают балльную оценку: 1 балл - до 30 адгезированных микроорганизмов на одной клетке, 2 балла - 31-60, 3 балла - 61-90, 4 балла - 91-120, 5 баллов - 121 и более, и при количестве адгезированных микроорганизмов в 1-2 балла определяют низкую степень адгезии, в 3 балла - среднюю степень, 4-5 - высокую;
- определяют биосовместимость лакто- и бифидобактерий из фекалий обследуемого и лактобактерий и/или бифидобактерий, входящих в состав пробиотиков, капельной методикой, при этом при посеве двух штаммов лактобактерий инкубацию осуществляют в анаэростате в микроаэрофильных условиях, при посеве двух штаммов бифидобактерий или одного штамма лактобактерий и одного штамма бифидобактерий - в анаэростате в анаэробных условиях;
- определяют антагонистическую активность лактобактерий и/или бифидобактерий в отношении условно-патогенных микроорганизмов одновременно методом двухслойного агара и методом перевернутого агара;
- посев осуществляют по Gold и оценивают мощность антагонистического воздействия пробиотических штаммов по степени интенсивности подавления штаммов условно-патогенных микроорганизмов по сравнению с контролем: низкая степень - подавление на 1-2 lg, средняя степень - на 3-4 lg, высокая степень - на 5-9 lg, вплоть до полного подавления роста УПМ;
- при выявлении низкой или средней степени интенсивности подавления условно-патогенных микроорганизмов или при ее отсутствии антагонистическую активность лактобактерий дополнительно определяют капельной методикой;
- выявляют наличие и степень антагонистической активности в отношении условно-патогенного микроорганизма, выделенного от конкретного больного, при выявлении антагонистической активности пробиотика хотя бы одним из этих методов;
- пробиотический препарат подбирают при наличии средней или высокой степеней адгезивности к буккальному эпителию пациента, наличии биосовместимости с лакто- и бифидобактериями этого же пациента и высокой степени антагонистической активности к штамму условно-патогенного микроорганизма, выделенного от данного пациента.
Причинно-следственная связь между существенными отличительными признаками и достигаемым результатом
- Одним из важных требований к препаратам пробиотиков является их адгезивная активность [1, 2, 6]. Пробиотические штаммы лакто- и бифидобактерий способны в той или иной степени связываться со слизистой оболочкой кишечника. Однако их адгезивность значительно ниже, чем адгезивность штаммов, выделенных от человека [3, 4]. Предполагается, что эффективность адгезии и дальнейшее приживление пробиотических штаммов зависит от соответствия рецепторов штамма пробиотиков рецепторам эпителиальных клеток [5]. Именно чужеродностью пробиотических штаммов иногда объясняют тот факт, что положительный эффект от применения пробиотиков носит транзиторный характер [8].
Авторами заявляемого способа впервые определена взаимосвязь между степенью адгезии пробиотических лактобактерий и бифидобактерий, применяемых для коррекции дисбиоза, к буккальному и кишечному эпителию данного пациента, что позволяет использовать в качестве тест-объекта адгезии буккальный эпителий данного пациента.
Оценивали адгезивную активность пробиотических штаммов к эпителиальным клеткам конкретных пациентов с использованием 10 пробиотиков, содержащих штаммы лакто- и бифидобактерий: 1) «Лактобактерин», «Микроген», Пермь, 2) «Лактобактерин», «Имбио», Н.Новгород, 3) «Лактобактерин», «Иммунопрепарат», Уфа, 4) «Нормофлорин-Л», 5) лактобактерии йогурта «Актимель», 6) «Бифидумбактерин», «Микроген», Пермь, 7) «Бифидумбактерин», «Экополис», Ковров, 8) «Бификол», 9) «Нормофлорин-Б», 10) «Бифиформ».
Объектом, на который адгезировали микроорганизмы, служили клетки кишечного эпителия, забранные с помощью ректальной петли. Ввиду того что забор данных клеток часто сопряжен с определенными трудностями, параллельно использовали буккальный эпителий этих же больных, чтобы сравнить степень адгезии на двух типах эпителия одного и того же пациента и оценить возможность использования буккального эпителия вместо кишечного в качестве тест-объекта.
Провели 81 тест параллельно с буккальным и кишечным эпителием 11 пациентов. Сопоставление различий в результатах, полученных на сопоставляемых тест-объектах (буккальном и кишечном эпителии), проводили с помощью двухвыборочного F-теста для дисперсии для каждого препарата и каждого пациента отдельно, учитывая количество адгезированных микроорганизмов на каждой из пяти клеток одного вида эпителия. Только в пяти опытах была отклонена нулевая гипотеза и доказана достоверность различий, в 94,4% случаях (в 85 опытах) была доказана недостоверность различий между двумя выборками. Таким образом, степень прикрепления к разным видам эпителия одного пациента была сопоставима. F-критерий составил от 0,004 до 6,205 при критическом F=7,71; α=0,05 (dF=5, критерий односторонний).
Для определения силы взаимосвязи между количеством адгезированных пробиотических микроорганизмов на буккальном и кишечном эпителиях результаты обрабатывали методами корреляционного анализа - расчета коэффициента корреляции Пирсона (r) и Спирмена (ρ). Степень адгезии на каждой из пяти клеток одного вида эпителия соответствовала нормальному распределению. При расчете коэффициентов r и ρ использовали среднее арифметическое адгезированных бифидо- или лактобактерий на буккальном и кишечном эпителиях. Коэффициент Пирсона определяли как для всей совокупности пациентов для выявления общей тенденции корреляции, так и для каждого пациента отдельно (табл.5 - Коэффициент корреляции Пирсона для всей выборки биопрепаратов, тестируемых на ад