Препарат стволовых клеток с репрограммированным клеточным сигналингом, способ получения этого препарата и его применение
Иллюстрации
Показать всеИзобретение относится к области медицины и касается препарата стволовых клеток (СК) с репрограммированным клеточным сигналингом, способа получения этого препарата и его применения. Сущность изобретения включает препарат СК с репрограммированным клеточным сигналингом, содержащий базовый препарат СК, в мембрану, и/или ядро, и/или цитоплазму которых имплантирован способный к регулированию сигнальных путей СК и клеток патологического очага в организме млекопитающего белковый или фармацевтический препарат, предварительно инкапсулированный в наноконтейнеры размером до 100 нм, полученные из биодеградируемого материала, интактного для органелл и компартаментов СК базового препарата. Этот материал имеет заданные сроки биодеградации в организме млекопитающего для обеспечения программируемого выхода белкового или фармацевтического препарата во внутри- или межклеточное пространство и осуществления тем самым перепрограммирования сигнальной трансдукции ключевых генов СК в требуемом терапевтическом направлении развития физиологических событий клеточного цикла непосредственно в патологической зоне органа или ткани организма. Преимущество изобретения заключается в обеспечении целевой добавки сигнальных веществ строго в пораженную зону организма. 3 н. и 11 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Изобретение относится к области медицины, в частности к неврологии, нейрохирургии и онкологии, и предназначено для лечения опухолей головного и спинного мозга, дегенеративных, гипоксических, ишемических заболеваний и травматических повреждений центральной нервной системы (ЦНС) и других заболеваний человека и животных.
Проблема лечения опухолей, дегенеративных заболеваний и повреждений головного и спинного мозга до настоящего времени остается крайне трудной и практически нерешаемой задачей. Несмотря на значительные достижения современной медицины, выживаемость больных с глиальными опухолями мозга остается на уровне не более 12-15 месяцев. Не получено существенных результатов и в лечении дегенеративных, гипоксических и ишемических заболеваний нервной системы. По-видимому, это связано, с одной стороны, с ограниченными возможностями нервной ткани к регенерации и саногенезу и особенностями нейрогенеза во взрослом мозге, а с другой стороны, со спецификой патогенеза ряда нервных болезней.
Однако за последние два десятилетия представления о возможностях лечения указанных нарушений существенно изменились. Это связано с накоплением научных фактов о регенераторном потенциале ЦНС, открытием механизмов накопления генетических мутаций в нервных клетках головного и спинного мозга при патологии ЦНС и с получением неопровержимых доказательств о возможности управления процессами регенерации, ангиогенеза и синаптогенеза в нервной ткани ([1], с.167, 194).
Концепция раковой (мутантной) стволовой клетки, сформулированная в современной научной литературе, открыла новые горизонты в лечении онкологических болезней и позволяет по-новому рассмотреть патогенетические основы возникновения нейроонкологических заболеваний и ряда нервных болезней [2]. Целая серия открытий конца XX и начала XXI в. в области клеточной и молекулярной биологии, посвященных регуляции клеточных событий в нервной клетке (дифференцировка, апоптоз, пролиферация и т.д.), позволила с новых теоретических позиций взглянуть на проблему патогенеза целого ряда нервных болезней. Раскрыты ключевые механизмы, управляющие супрессией опухолевых генов и сигнальными процессами в нервной клетке, выявлены закономерности нарушения сигнальной системы клеточной регуляции при патологических состояниях мозга [3]. Появление новых производственных технологий для получения широкого спектра химиопрепаратов из сигнальных белков клеточной и межклеточной регуляции и понимание фундаментальных механизмов их действия привели к возможности получения уникальных экспериментальных результатов их применения на животных и человеке. Это открывает огромные перспективы в решении проблемы лечения онкологических и нервных болезней. Разработка и применение новых лекарственных средств, разработанных на базе вне- и внутриклеточных сигнальных белков, дали возможность добиться существенного прогресса в лечении ряда неизлечимых ранее онкологических заболеваний. Доказана возможность прямого воздействия сигнальных белков на раковые и здоровые стволовые клетки. Однако восторженное отношение к клиническому применению сигнальных клеточных энзимов, протеинов и антител к ним для лечения нейроонкологических и ряда неврологических болезней сегодня завершилось разочарованием и неудовлетворенностью полученными результатами. Как показали многочисленные исследования применения препаратов, разработанных на базе сигнальных белков, в терапевтических концентрациях они оказались губительны для здоровой нервной ткани человека, что резко сократило возможности их использования в клинической практике [4].
Надежды на прорыв в лечении заболеваний нервной системы, в том числе и нейроонкологической патологии, в последние 15 лет возлагались на клиническое применение СК [5]. Открытие наличия нейральных стволовых клеток во взрослом мозге дало принципиально новое понимание сущности нейрогенеза [6]. Однако успехи эмпирического и экспериментального применения клеточных технологий для лечения нервных болезней также остаются достаточно скромными, и клиническое использование СК пока ограничено и имеет целый ряд существенных недостатков ([1], с.360).
В конце 90-х годов XX в., с накоплением новых данных о характере и структуре генетических дефектов при целом ряде опухолей мозга и нервных болезней, сформировалась новая научная дисциплина - генотерапия, которая в перспективе также выглядела многообещающим научным направлением в лечении нервных болезней [4]. К сожалению, успехи и генной инженерии, и генной терапии пока остаются скромными и также не увенчались большими достижениями и окончательной победой над нервными болезнями. В настоящее время генная терапия пока технологически не может дать ощутимых результатов, несмотря на широкие возможности и перспективы ее применения в неврологии, нейрохирургии и нейроонкологии.
Возникает резонный вопрос: почему прорыв в фундаментальных областях знаний, клеточной и молекулярной биологии нервной клетки не принес аналогичного биотехнологического прорыва в клинических нейроисследованиях? Ответ на этот вопрос прост, но неоднозначен. С позиций информационного подхода ([1], с.37-58) эти противоречия могут быть объяснены нестыковкой достижений и существующих подходов, полученных на разных информационных уровнях научных исследований. Технологический прорыв в биологии произошел на субклеточном, молекулярном, атомарном уровнях и экстраполировать его результаты на организменный и тканевой уровень довольно трудно и малоперспективно. Именно этим объясняются неудачи клинического применения большого спектра современных рекомбинантных белков клеточного сигналинга семейства цитокинов и нейротрофинов, а также информационных молекул сигнальных белков межклеточного и внутриклеточного взаимодействия. Следует подчеркнуть, что молекулы сигнальных белков и антител к ним крайне нестабильны и работают в микро- и нанодиапазоне. Эффективность их применения при системном (пероральном, парентральном, интратекальном и др.) применении крайне ограничена из-за резкого снижения их концентрации в биологических жидкостях организма при разбавлении в крови, ликворе, лимфатической жидкости. Кроме того, молекулы сигнальных белков имеют очень короткий период длительности своих информационных эффектов и большие возможности воздействия на различные клетки соматических органов при циркуляции их в биологических жидкостях человека и животных [7]. Крайне низкие концентрации сигнальных белков в патологических зонах мозга при системном введении вынуждают исследователей наращивать терапевтическую концентрацию препарата в крови, которая становится токсической для здоровых нейронов, сосудов мозга и соматических органов. Это приводит к тотальному и бесконтрольному воздействию этих сигнальных белков на различных уровнях организма (паренхиматозные органы, железы внутренней секреции и т д.), что вызывает регуляторный дисбаланс функционирования клеток этих органов, сопровождаемый тяжелыми осложнениями такой терапии [4].
Известны работы и исследования, описывающие базовые подходы комплементационной генной терапии опухолей и инфекционных заболеваний, когда в организм больного вводится полноценно работающий ген. Так, создание аутологичных модифицированных Т-лимфоцитов с использованием ретровирусов со встроенными генами позволяет успешно применять генетические конструкции для коррекции иммунодефицита [4]. В роли фармацевтического препарата при подобной генной терапии выступает клонированный ген или искусственно синтезированные молекулы РНК или ДНК. Как правило, в этих исследованиях трансдукция генов в клетках осуществляется ретровирусом (лентивирусом), связанным с определенным геном.
Наиболее близким аналогом (прототипом) настоящего изобретения можно считать техническое решение, заключающееся в использовании астроцитов с целью вызывания апоптоза злокачественной глиомы (Uzzaman M, Keller G., Germano Isabelle M. In vivo Gene Delivery by embryonic stem cell-derived astrocytes for malignant gliomas. Departments of Neurosurgery (MU, IMG) and Gene and Cell Medicine(GK), Mt. Sinai School of Medicine, New York, USA. Neuro Oncol Advance Publication DOI:.1215/15228517-2008-056, публ. 1 августа 2008). В данной работе было показано, что астроциты, полученные из эмбриональных ЭСК, в определенных условиях выделяют гены, которые могут быть использованы с целью вызывания апоптоза клеток злокачественной глиомы in vitro. Было доказано, что ген TRIAL (TNF-зависимый лиганд, индуцирующий апоптоз) вызывает апоптоз в различных опухолевых клетках, в том числе глиомных. Авторы этой работы оценили апоптический эффект от применения трансгенного TRIAL, доставляемого с помощью астроцитов, полученных из эмбриональных СК, в злокачественных глиомах in vivo. Голым мышам были пересажены клетки злокачественной глиомы человека А172, сформировавшие гетеротопный ксенотрансплантат. В эти ксенотрансплантаты были затем введены полученные из эмбриональных СК астроциты, выделяющие TRIAL. Экспрессия TRIAL в ксенотрансплантатах злокачественной глиомы была подтверждена ПЦР-диагностикой с обратной транскрипцией и иммуногистохимией после внешней индукции гена. Через 48 часов после инъекции астроцитов в экспериментальной группе было отмечено значительное снижение объема опухоли - 14% после одинарной дозы астроцитов и 31% после двойной дозы. Окрашивание TUNEL выявило большое количество апоптических клеток опухоли. Через 7 дней после инъекции опухоль подверглась тяжелому некрозу. Экспрессия рецептора смерти (DR4) в экспериментальных группах была значительно выше, чем в контрольных. Авторы этой работы выдвигают предположение о том, что астроциты, полученные из ЭСК и выделяющие TRAIL, могут использоваться как векторы для доставки генов в злокачественные глиомы.
Однако необходимо отметить, что указанное известное техническое решение, как и многие другие подобные способы генотерапии, имеет серьезные ограничения и до настоящего времени не было внедрено в клиническую практику. Применение рекомбинантного вирусного вектора в генной терапии крайне опасно и по данным, представленным Киселевым В.И. [4], уже однажды привело к смерти 18-летнего пациента при проведении первой фазы клинических испытаний. Было доказано, что смерть, вызванная развитием дыхательной недостаточности, отказом почек и отмиранием коры мозга, наступила в ответ на введение генно-инженерной конструкции. Поэтому авторы настоящего изобретения категорически отказались от применения трансгенных конструкций из вирусных плазмид, ретровирусов и лентивирусов, связанных с генами для их трансдукции в патологических клетках.
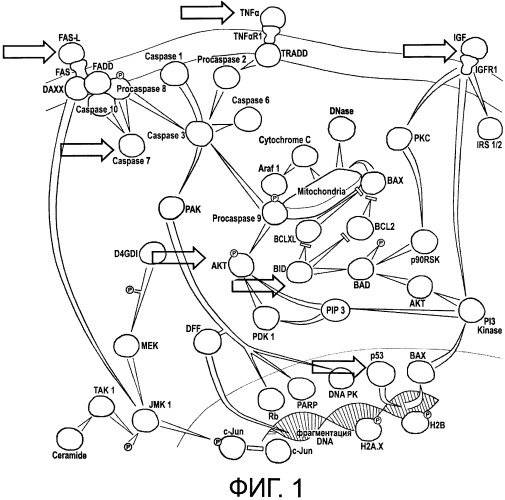
В настоящее время показано, что при большинстве нервных болезней фактор воспаления и стресса только запускает патологические механизмы в нервных клетках, но доминирующими процессами в патологической нервной ткани являются нарушенные механизмы клеточной регуляции, имеющие точный адрес своего происхождения - генетическую поломку в ядрах нервных клеток. В большинстве неврологических руководств описаны типичные генетические мутации, выявленные в нервных клетках при опухолях мозга, болезни Паркинсона, болезни Альцгеймера, синильных деменциях, боковом амиотрофическом склерозе, энцефалопатиях сосудистого и токсического генеза и целом ряде дегенеративно-атрофических заболеваний ЦНС. Выявление этих генетических поломок в настоящее время не вызывает серьезных технических проблем, если использовать современные методы геномного и протеомного анализа клеток патологического очага. Главной проблемой является интерпретация полученных результатов этих суперсовременных исследований и отсутствие реальной возможности для коррекции выявленных генетических дефектов. Применение генной терапии для коррекции конкретной молекулярной поломки методологически оправдано, но сопряжено с рядом технических и технологических трудностей современного этапа научных исследований. Решение проблемы может быть предложено не в исправлении конкретного генетического «разлома» мутантных генов (генетического дефекта) и замены поврежденного гена, а в задании нового вектора (направления) развития всего клеточного цикла патологической клетки и клеток всей патологической зоны. В этом случае, учитывая блочный характер вовлечения генов клетки в биоуправление и регуляцию, мутации генов (даже в нескольких различных локусах хромосом), приводящие к определенному клеточному циклу, не будут определяющими для жизни и развития всей клетки. Например, если исходом патогенетических процессов в нервной ткани является запуск механизма внутриклеточного апоптоза мутантной нервной СК, то очевидно, что необходимо поменять вектор всех клеточных процессов на индукцию направленной дифференцировки или направленной пролиферации, и наоборот. Это можно сделать, если использовать новый подход - перепрограммирование трансдукции (экспрессии или ингибирования) ключевых генов клетки сигнальными белками. Иллюстрацией этого положения служит работа ключевого гена опухолевой супрессии р53. Снижение экспрессии этого гена ниже нормальных величин запускает работу целого каскада генов в ядре клетки, результатом становятся антиапоптозный эффект, неоангиогенез, пролиферация и клеточное размножение (патогенетические и патофизиологические условия формирования опухоли), а повышение экспрессии р53 приводят к запуску апоптоза, нарушению ангиогенеза, нарушению клеточной миграции и остановке процессов образования новых клеток (патогенетические звенья атрофических и дегенеративных процессов в мозге). Следовательно, управление ключевыми генами может стать основой управления основными клеточными процессами в заданном (репрограммированном) исследователем направлении развития определенных физиологических и алгоритмированных процессов в клетке.
Таким образом, учитывая недостаточность существующей биотехнологической базы генной терапии и отсутствие адекватного носителя генов, в настоящее время целесообразно отказаться от разрушения или приостановки функционирования патологических нервных клеток путем исправления дефектов конкретных мутантных генов и попытаться осуществить биокоррекцию развития клеточных процессов в патологической ткани, задавая программируемый вектор направления развития определенного клеточного цикла. Сегодня созданы все теоретические предпосылки и технологические возможности для осуществления такой биокоррекции (биорегуляции). Достаточно хорошо изучены механизмы клеточного и межклеточного сигналинга, возникновения и динамики развития апоптоза, клеточной дифференцировки, пролиферации и других клеточных процессов. Расшифровано большое количество участвующих в этих процессах сигнальных белков и созданы их рекомбинантные копии и антитела, которые свободно продаются ведущими мировыми биотехнологическими компаниями, например Sigma-Aldrich Corp. (США) и Millipore Corporation (США), а также широко используются различными фармацевтическими компаниями для проведения клинических испытаний в онкологии, неврологии и нейрохирургии.
Однако до настоящего времени не известен универсальный «минибот» для транспортировки сигнальных белков к месту их действия. Современная научная литература в области молекулярных исследований предлагает рассмотреть в качестве кандидатов на эту роль различные модифицированные бактерии, генно-инженерные конструкции и самосборные атомарные нанокострукции (наноботы). Разработаны различные иммунные моноклональные самонаводящиеся антительные бинарные системы со стрептаведином и биотином и иммунолипосомальные наноконструкции, позволяющие осуществить векторный суперселективный транспорт сигнальных молекул к различным клеткам опухоли или патологической зоны [4]. Однако эффекты, достигаемые этими препаратами, очень грубые и разрушающие, поэтому эти препараты не могут претендовать на использование их для целей коррекции клеточного сигналинга и биоуправления процессами в клетке.
Таким образом, возникла необходимость в разработке нового трансферного механизма доставки сигнальной информации, который бы смог обеспечить передачу информационного сигнального воздействия на уровень генома патологической клетки, минуя клетки соматических органов и здоровые клетки мозга, интегрировать взаимодействия на различных информационных уровнях и осуществить систему биоуправления и регуляции патологическим процессом на клеточном и межклеточном уровнях. Нужны новые методология и логистика целевого трансфера сигналов к конкретным генам клеток-мишеней патологической зоны в ЦНС.
Опираясь на фундаментальные принципы теории управления систем [8], можно предположить базовые принципы и механизмы регуляции вне- и внутриклеточного биосигналинга [9]. Для этого необходимо разработать определенные алгоритмы кратковременного управляющего сигнального воздействия (экспрессия, стабилизация, ингибирование) на определенные (ключевые) гены клетки и на основании этих алгоритмов запрограммировать сигнальное управляющее воздействие на объект управления (ОУ). ОУ должен адекватно и постоянно реагировать на клеточный сигналинг. Ответ на воздействие на ОУ необходимо мониторировать и регистрировать, что позволит постоянно осуществлять его коррекцию и управление []. А мощность, периодичность и продолжительность сигналов не должны разрушать управляемую систему, которой и является клетка. Для этих целей существующие технологии иммунолипосомальных конструкций и бинарных систем не подходят, так как обладают очень «жесткими» параметрами воздействия на клетку.
В качестве управляемого «биобота» для трансфера сигналов к патологической клетке авторы настоящего изобретения рассмотрели здоровую СК человека и животных, которая по своей природе является универсальной управляющей системой, генетически запрограммированной на восстановление повреждений и регенерацию в поврежденных органах и тканях. Она обладает уникальной способностью мигрировать в зоны патологии по градиенту концентрации хемокинов и локальных провоспалительных факторов и может в полном объеме выполнить функции трансфера для необходимых сигнальных молекул. Анализ целого ряда научных фактов по функционированию СК в патологической зоне показывает, что при определенных клеточных событиях патологических клеток (например, при апоптозе) здоровая СК получает определенные сигналы от этих клеток, обрабатывает их и посылает обратные сигналы (на «выживание») поврежденным клеткам. Таким образом, СК осуществляют межклеточное и внутриклеточное биоуправление локальным саногенезом и репативными функциями клеток в ткани. В зависимости от степени повреждения патологические клетки реагируют на данные сигналы (каскад цитокинов и нейрофических и других информационных факторов, выделяемых СК) и в них индуктивно запускаются сигнальные системы, способствующие формированию необходимых регенераторных процессов.
Таким образом, основной задачей настоящего изобретения является создание такого препарата стволовых клеток с репрограммированным клеточным сигналингом, который обеспечил бы целевую доставку сигнальных веществ (т.е. сигнальных белков и фармацевтических препаратов, способных к регулированию сигнальных путей) строго в пораженную зону организма млекопитающего, а также запуск в заданное время и длительную поддержку активного сигнального межклеточного воздействия заданного терапевтического характера со стороны здоровой и хорошо управляемой СК на управляющую систему дефектной (мутантной нервной или раковой) клетки.
Решение указанной задачи достигается тем, что согласно настоящему изобретению предложен препарат стволовых клеток с репрограммированным клеточным сигналингом, содержащий базовый препарат стволовых клеток, в мембрану, и/или ядро, и/или цитоплазму которых имплантирован способный к регулированию сигнальных путей стволовых клеток и клеток патологического очага в организме млекопитающего белковый или фармацевтический препарат, предварительно инкапсулированный в наноконтейнеры, полученные из биодеградируемого материала, интактного для органелл и компартаментов стволовых клеток базового препарата и имеющего заданные сроки биодеградации в организме млекопитающего для обеспечения программируемого выхода белкового или фармацевтического препарата во внутри- или межклеточное пространство стволовых клеток и осуществления тем самым перепрограммирования сигнальной трансдукции ключевых генов стволовых клеток в требуемом терапевтическом направлении развития физиологических событий клеточного цикла непосредственно в патологической зоне органа или ткани организма.
В качестве стволовых клеток базового препарата использованы преимущественно аутологичные стволовые клетки.
Размер наноконтейнеров не превышает 100 нм.
В качестве наноконтейнеров могут быть использованы наноконтейнеры на основе биополимерного материала. В качестве биополимерного материала могут быть использованы сополимеры полилактидгликолида и/или полиоксибутиратвалерата.
В качестве наноконтейнеров могут быть использованы также наноконтейнеры на основе липосом или наноэмульсии.
Другой задачей настоящего изобретения является разработка способа получения указанного препарата стволовых клеток с репрограммированным клеточным сигналингом.
Решение указанной второй задачи достигается тем, что согласно настоящему изобретению предложен способ получения препарата стволовых клеток с репрограммированным клеточным сигналингом, включающий в себя выбор базового препарата стволовых клеток, выбор белкового или фармацевтического препарата, способного к регулированию сигнальных путей стволовых клеток и клеток патологического очага в организме млекопитающего, инкапсулирование выбранного белкового или фармацевтического препарата в наноконтейнеры из биодеградируемого материала, интактного для органелл и компартаментов стволовых клеток базового препарата и имеющего заданные сроки биодеградации в организме млекопитающего, и последующую имплантацию наноконтейнеров в мембрану, и/или ядро, и/или цитоплазму стволовых клеток базового препарата.
В качестве базового препарата выбирают преимущественно препарат с аутологичными стволовыми клетками.
Инкапсулирование можно проводить путем ультрадиспергирования смеси биополимерного материала с белковым или фармацевтическим препаратом.
Имплантацию наноконтейнеров можно проводить путем прямых внутриклеточных инъекций суспензии или эмульсии наноконтейнеров в мембрану, цитоплазму или ядро стволовых клеток базового препарата, а также путем эндоцитоза наноконтейнеров в цитоплазму стволовых клеток при экспозиции суспензии или эмульсии наноконтейнеров в базовом препарате.
Преимущественно заявленный способ получения заявленного препарата проводят в стерильных условиях или непосредственно в операционной (ex temporo), или в культуральной лаборатории.
Кроме того, согласно настоящему изобретению предложено применение заявленного препарата СК в качестве средства для внутри- и внеклеточной регуляции сигнальных путей патологических клеток при лечении заболеваний, повреждений и опухолей головного и спинного мозга, а также опухолей и метастатических поражений других органов и систем млекопитающего.
Механизм действия заявленного препарата СК с репрограммированным клеточным сигналингом обусловлен направленной миграцией в патологическую зону мозга или другого органа млекопитающего содержащихся в препарате СК с имплантированными в них сигнальными молекулами белкового или фармацевтического препарата, инкапсулированными в биодеградируемые наноконтейнеры. В результате строго заданной по времени биодеградации наноконтейнеров происходит запрограммированное высвобождение сигнальных молекул из наноконтейнеров в СК или межклеточное пространство патологической зоны и осуществляется заданное воздействие сигнальных молекул на внеклеточные и внутриклеточные сигнальные пути и трансдукцию генов с целью формирования терапевтических индуктивных клеточных процессов (инструктивного апоптоза, управляемой дифференцировки, индуктивной пролиферация и т.д.) в патологической зоне.
Теоретическим и экспериментальным обоснованием создания заявленного клеточного препарата с репрограммированным клеточным сигналингом явились собственные исследования авторов настоящего изобретения, а также убедительные экспериментальные доказательства, опубликованные в литературе [6], где показано, что СК способны мигрировать в опухоль и(или) зоны повреждения мозга по градиенту концентрации воспалительных хемокинов. Отработанные в эксперименте доказательства миграционных способностей НСК и гемопоэтических СК показали универсальность данного феномена для всех типов СК. Способности целевой миграции СК в патологические зоны мозга позволяют использовать СК в качестве универсального транспортного средства для доставки необходимых информационных и сигнальных воздействий в патологические зоны.
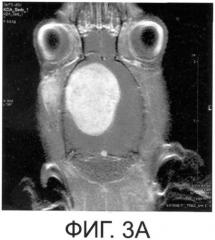
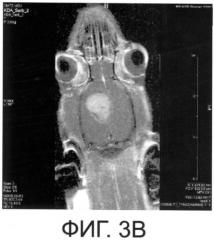
Препарат разрабатывался на экспериментальной модели опухоли мозга (глиоме С6), но в процессе создания и экспериментальном применении этого препарата открылись универсальные возможности его использования не только при патологии ЦНС, но и при заболеваниях других органов и систем человека и животных.
Необходимо отметить, что предлагаемое согласно настоящему изобретению использование здоровых СК в качестве средства доставки сигнальных веществ к пораженным зонам в организме возможно только при выполнении определенных условий, а именно:
1. В зоне патологического процесса должна быть завершена острая фаза воспаления и практически снивелировано до минимума действие доминантных локальных воспалительных и деструктивных патогенетических факторов повреждения.
2. Повреждение или патогенное воздействие не должно приводить к необратимой мутации генов в ядре пострадавших клеток.
3. Должны сохраниться возможности обеспечения функционирования микроокружения патологической клетки.
В остальных случаях патологическая клетка становится нечувствительна к управляющим сигналам здоровой СК. Более того, в научной литературе описаны случаи формирования опухолей в тканях после трансплантации в них СК из-за трансформации здоровой СК в мутантную (раковую) СК под воздействием агрессии факторов воспаления и некроза. Поэтому применение первичных и даже культивированных СК без изменения клеточного сигналинга в них вряд ли оправдано при наличии острого воспаления, аутоиммунного процесса, атрофическом процессе, опухолях и в большинстве случаев противопоказано при целом ряде нервных болезней. В этих случаях необходимо усилить природные возможности к биорегуляции и регенерации собственных СК, что возможно при перепрограммировании функциональных возможностей первичных СК на генетическом уровне.
Если руководствоваться фундаментальными принципами теории управления систем, то в соответствии с настоящим изобретением объектом управления (ОУ) становится патологически измененная мутантная клетка, а управление на себя должна взять здоровая управляемая СК. Чтобы лучше понять и спрогнозировать поведение ОУ, можно воспользоваться кибернетическим принципом математической теории колебаний, согласно которому управляющей в системе является более медленная фаза [8]. Экстраполируя математический подход к системе клеточных взаимодействий, можно утверждать, что наиболее медленной фазой в развитии цикла клетки является функционирование самой СК. Нервная СК имеет самую медленную активность биологических процессов в нейрогенезе (полный цикл деления взрослой СК составляет 21 день, а ее предшественников - 12 часов). Мутантная (например, раковая) СК при глиоме имеет еще более медленный цикл деления (28 дней), и соответственно здоровая СК по отношении к ней является управляемой и соподчиненной. Поэтому сигналы здоровой СК не являются управляющими для мутантной (раковой) СК. Именно заторможенность биологических процессов в раковой клетке делает ее малочувствительной к лучевой и химиотерапии, тогда как активно делящиеся клетки полностью отвечают на лучевую нагрузку и химиотерапевтическое воздействие. Наиболее вероятно, что мутантная СК функционирует по принципу разомкнутого управления. Сущность этого принципа состоит в том, что программа управления жестко определена задающим устройством (задающим сигналом). Управление не учитывает влияния возмущений на параметры процесса. Здоровая СК работает по принципу компенсации и принципу обратной связи. Сущность принципа компенсации заключается в возможности коррекции управляющего воздействия при отклонении от заданной величины на входе ОУ путем суммирования сигнала управляющего устройства с корректирующим воздействием, пропорциональным возмущению и компенсирующим его влияние. Принцип обратной связи базируется на том, что управляющее воздействие корректируется в зависимости от выходной величины сигнала. Если значение выходной величины отклоняется от требуемого, то происходит корректировка сигнала с целью уменьшения данного отклонения.
Таким образом, с кибернетических позиций теории управления систем становится понятна глубинная сущность неэффективности лечения нейроонкологической и нейродегенеративной патологии существующими терапевтическими подходами. К решению этих проблем можно подойти с новых методологических позиций. Классической иллюстрацией математического принципа разомкнутого управления в технике является магнитофон, который функционирует в строго заданном режиме воспроизведения звука и не реагирует ни на какие внешние воздействия. Но с помощью сигнального воздействия (реостата сопротивления, вставленного в электрическую цепь) можно замедлить или убыстрить воспроизведение звука. Трансформируя вышеизложенное на биологический язык, соответствующими доминантными сигналами можно ускорить или усилить активность управляющей мутантной СК и сделать ее управляемой в общем континууме изучаемых клеточных систем, подчинить сигналингу здоровой СК и, как следствие, повести в заданном терапевтическом направлении функционирование клеточного цикла. Более того, изменив биологическую функциональную активность раковой СК, можно сделать ее восприимчивой к стандартным режимам лучевой и химиотерапии.
В соответствии с вышеизложенным проблема разработки новых методов лечения нервных и онкологических болезней с использованием настоящего изобретения переходит в плоскость управления взаимодействием двух биологических систем: с одной стороны мутантная (раковая) СК, с другой - здоровая СК.
При решении вышеуказанной задачи, касающейся запуска и длительной поддержки активного сигнального межклеточного воздействия со стороны здоровой СК на управляющую систему дефектной клетки, необходимо обеспечить возможность постоянной генерации сигнала определенной силы внутри здоровой стволовой клетки, учитывая то, что здоровая СК, являясь генетически детерминированным биологическим объектом, способна мигрировать в зону опухоли или патологический очаг пациента. В этой связи запустить работу ключевых генов воздействием на известные сигнальные механизмы не представляет большого труда. Старт репрограммирования СК можно осуществить при химическом, физическом или интервенционном воздействии на СК молекулами сигнальных рекомбинантных белков или антител к ним in vitro перед трансплантацией СК пациенту. Эффект данного воздействия в ряде случаев будет достаточно сильным, но кратковременным и нестойким. Это может привести к разбалансировке функционирования компартаментов СК и нарушить ее миграционные и навигационные способности. Поэтому согласно настоящему изобретению предложено новое техническое решение по репрограммированию трансдукции ключевых генов соматических СК - инкапсулировать белковые и фармацевтические препараты клеточного сигналинга (т.е. препараты, способные к регулированию сигнальных путей стволовых клеток и клеток патологического очага в организме млекопитающего) в наноконтейнеры из биодеградируемого материала, интактного для органелл стволовой клетки, и имплантировать наноконтейнеры с находящимися в них препаратами клеточного сигналинга в мембрану, ядро или цитоплазму СК. Это обеспечивает целевую доставку здоровых СК в пораженную зону организма и активизацию (запуск) терапевтических индуктивных клеточных процессов, таких как апоптоз, пролиферация, дифференцировка, биоактивация клеточных процессов и т.д.) именно в этой пораженной зоне в результате разрушения биодеградируемой оболочки наноконтейнеров в заданный период времени и предотвращение за счет этого нежелательного, а во многих случаях, и опасного действиям указанных препаратов клеточного сигналинга на здоровые клетки других участков организма пациента.
Заданные временные параметры биодеградации материала наноконтейнеров позволяют информационным молекулам цитокинов и нейротрофических факторов выходить из бионейтральной оболочки наноконтейнера (нанокапсулы) в цитоплазму СК через строго определенное время после введения предложенного препарата СК пациенту и осуществлять запрограммированное воздействие сигнальных молекул на необходимые компоненты сигнальных путей и(или) гены ядра клетки, вызывая их экспрессию (индукцию) и направляя развитие клеточного цикла в заранее определенном терапевтическом направлении посредством внутриклеточных или внеклеточных сигналов.
Методология выделения ключевых (управляющих) генов основана на фундаментальных принципах теории управления систем и на результатах транскрипционно-протеомного анализа биоптата патологического участка нервной ткани данного пациента, культуры его мутантных (раковых) СК, выделенных из биоптата, и нативных мобилизованных здоровых СК пациента. Ключевыми генами должны считаться только те гены, экспрессия белков которых значительно ниже показателей нормы. Параметры нормы в каждом конкретном случае определяются на основании изучения экспрессии протеинов здоровых СК пациента при проведении их транскрипционно-протеомного анализа. Количественные показатели экспрессии белков выделенных ключевых генов мутантной (раковой) СК являются базовыми для анализа и подбора сигнальных молекул с целью выбора требуемого белкового или фармацевтического препарата и расчета их безопасной концентрации при имплантации в нативные здоровые СК пациента.
Методология выбора сигнальных молекул для репрограммирования экспрессии (индукции) ключевых генов аутологичных СК должна базироваться на следующих положениях:
1. Сигнальная молекула должна регулировать экспрессию (индукцию) тех сигнальных систем или ключевых генов здоровой СК, функционирование которых обеспечит формирование нового внутриклеточного сигнального пути, результатом чего станет образование внеклеточного или внутриклеточного сигнала, необходимого для развития событий определенного запрограммированного клеточного цикла.
2. В структуре сигнального пути определенного клеточного события сигнальная молекула должна обеспечить строгое развитие клеточных событий по заданному сценарию на разных этапах сигнального пути от ее освобождения до реализации внеклеточного ответа СК.
3. Сигнал внеклеточного ответа СК, запущенный внутриклеточной управляющей сигнальной молекулой, должен изменить биологическую активность клетки и направление ее физиологического функционирования.
При выборе сигнального препарата сигнального вещества (белкового или фармацевтического) целесообразно руководствоваться нижеперечисленными базовыми принципами репрограммирования трансдукции (экспрессии или индукции) ключевых генов здоровых СК.
Принцип разноуровневости сигнального воздействия. Сущность принципа заключается в воздействии внеклеточного сигнала здоровой СК не менее чем на три различных рецептора или сигнальных пути мутантной (раковой) СК, что позволит дублировать управляющий сигнал на внеклеточном и внутриклеточном уровнях.
Принцип одновекторности применения различных сигналов заключается в воздействии различных внеклеточных сигнал