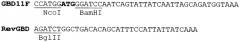Рекомбинантная белковая конструкция дсд-сп- -гал, обладающая активностью фермента термостабильной -галактозидазы (лактазы) и способностью аффинно связываться с декстраном, плазмидная днк pgd-10, определяющая биосинтез дсд-сп- -гал, и штамм-продуцент escherichia coli dh5 /pgd-10
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения белка ДСД-сп-β-ГАЛ в клетках Е.соli. Конструируют рекомбинантную плазмидную ДНК pGD-10, кодирующую химерную белковую конструкцию ДСД-сп-β-ГАЛ, содержащую декстрансвязывающий домен ДСД из микроорганизма Leuconostoc mesenteroides, который генно-инженерным путем объединен через глицин-сериновый спейсер с термостабильной бета-галактозидазой из термофильного микроорганизма Thermoanaerobacter ethanolicus. Для получения штамма Escherichia coli DH5α/pGD-10 - продуцента рекомбинантной белковой конструкции ДСД-сп-β-ГАЛ, клетки родительского штамма Escherichia coli DH5α трансформируют рекомбинантной плазмидной ДНК pGD-10. Изобретение позволяет получить белок ДСД-сп-β-ГАЛ, обладающий активностью фермента термостабильной бета-галактозидазы (лактазы) и способностью аффинно связываться с декстраном. 3 н.п. ф-лы, 4 ил.
Реферат
ВВЕДЕНИЕ
Наиболее перспективными методами рециклизации бета-галактазидов на предприятиях, а также освобождения молочных продуктов от лактозы, которая может быть аллергенной для человеческого организма, является ферментативный способ гидролиза этих соединений как растворимыми формами соответствующих ферментов, так и иммобилизованными.
Они позволяют перерабатывать сырье без образования загрязняющих аддуктов, которые требуют сложных систем очистки продукта.
Иммобилизация бета-галактозидаз на доступных сорбентах (например, на декстранах) позволяет понизить производственные затраты, в частности затраты вследствие постоянного уноса фермента из жидкой фазы и потери его активности при повышении температуры, а также позволяет повысить срок службы фермента и производительность процесса.
Для иммобилизации бета-галактозидаз как в промышленности, так и в медицине до настоящего времени используют химические способы, при этом возрастает срок службы фермента, что незначительно снижает себестоимость процесса гидролиза бета-галактозидов, по сравнению с использованием растворимых форм фермента, однако при химической иммобилизации происходит значительная инактивация фермента, при этом использующиеся химические реагенты, обладая токсичностью, загрязняют продукт и ограничивают его использование в пищевой промышленности.
Для использования в пищевой промышленности большое будущее имеют бета-галактозидазы, обладающие повышенной термостабильностью, способностью аффинно связываться с соответствующим субстратом при широком диапазоне рН. Произвести подобный ферментный препарат возможно при использовании штаммов бактерий, трансформированных плазмидной ДНК, несущей ген бета-галактозидазы с улучшенными свойствами.
Науке известен рекомбинантный белок, обладающий активностью бета-галактозидазы (UniProt № Y 08557, SEQ ID NO: 3 приложения). Известна рекомбинантная плазмида, содержащая ген соответствующей бета-галактозидазы. Получен штамм E.coli DH5α, экспрессирующий данный белок, однако в таком виде этот фермент может быть иммобиллизован только химическими методами, которые, как известно, удорожают процесс. Известен способ иммобилизации бета-галактозидазы на пористом кремнеземе (авторское свидетельство СССР 1317024 А1, класс С12 от 15.04.87 г.); способ химической иммобилизации на активированной диметилацетамидом целлюлозе (авторское свидетельство СССР 1567625 А1, класс С 11/04, 11/12 от 30.05.90 г.). Данные методы требуют высокоочищенного фермента, который можно получить лишь в результате длительной многостадийной его очистки.
Но известен способ получения слитных белков с целлюлозосвязывающими доменами для иммобилизации и очистки белков на грануллированной целлюлозе (Patent US 5137819, Kilborn, et. al., 11.08.92).
Однако производство гранулированной целлюлозы как носителя не имеет широкого распространения и сопряжено с рядом сложностей, удорожающих процесс и конечный продукт, к тому же константа диссоциации (Кд) при связывании целлюлозосвязывающего домена и гранул целлюлозы составляет 10-6-10-7.
В генбанке же аннотирована последовательность декстрансвязывающего домена (ДСД) [1, 2], который в виде автономного белка способен показывать на порядок большую прочность связывания с декстрановыми сорбентами (Кд=10-9), промышленное производство которых более широко представлено, в отличие от производства грануллированной целлюлозы.
Технический результат данного изобретения заключается в создании экспрессионной плазмиды pGD-10 с геном белка ДСД-сп-β-ГАЛ (SEQ ID NO: 1 приложения), создании самого слитного белка ДСД-сп-β-ГАЛ, обладающего, с одной стороны, бета-галактозидазной активностью, а с другой - способностью связываться с декстранами при повышенной температуре (65-75°С).
Данный технический результат достигается созданием химерного белка ДСД-сп-β-ГАЛ, содержащего декстрансвязывающий домен ДСД из - Leuconosfcoc mesenteroides, соединенный через глицин-сериновый спейсер (GSGSGSGSGSGA) с термостабильной бета-галактозидазой из термофильного микроорганизма Thermoanaerobacter Ethanolicus.
Также данный технический результат достигается созданием рекомбинантной плазмидной ДНК pGD-10 5111 п.н. (SEQ ID NO: 1 приложения), содержащей синтетический оперон с геном слитного белка ДСД-сп-β-ГАЛ, включающий ранний промотор бактериофага Т5, нуклеотидную последовательность, кодирующую белок ДСД-сп-β-ГАЛ (115-2802 п.н.) и терминатор транскрипции; ген бета-лактамазы, детерминирующий устойчивость к антибиотику ампициллину, и сайт инициации репликации типа ColE1. Таким образом, рекомбинантная плазмидная ДНК pGD-10 обеспечивает экспрессию белка ДСД-сп-β-ГАЛ в клетках E.coli.
Указанный технический результат достигается также тем, что штамм E.coli DH5a, трансформированный экспрессионным плазмидлным вектором pGD-10, является продуцентом целевого химерного белка ДСД-сп-β-ГАЛ.
На фиг.1 представлена экспрессионная плазмида pGD-10 с геном белка ДСД-сп-β-ГАЛ.
Описание процесса достижения технического результата
§1. Создание плазмидного экспрессионного вектора pGD-10
§1.1. Химический синтез олигонуклеотидов
Олигонуклеотиды были синтезированы твердофазным амидофосфитным методом с помощью синтезатора АСМ-100-2 (Новосибирск) и очищены методом электрофореза в 12% ПААГ (ЗАО «СИНТОЛ», ЗАО «Евроген»).
§1.2. Получение и клонирование гена ДСД из Leuconostoc mesenteroides
Ген декстрансвязывающего домена (ДСД) был получен благодаря ПЦР с помощью прямого и обратного праймеров (сайты рестриктаз подчеркнуты), фланкирующих генную последовательность ДСД, при этом в качестве ДНК-матрицы использовалась хромосомная ДНК Leuconostoc mesenteroides.
Праймеры:
ПЦР проводили на приборе Терцик (ДНК-технология, Россия). 25 мкл реакционной смеси содержали: 2,5 мкл Taq pol PCR buffer 10× (СибЭнзим), дНТФ в конечной концентрации 400 мкМ, 4×10-7 М каждого праймера, 1 мкл Taq pol (СибЭнзим) 5 ед. активности на реакционный объем, в качестве ДНК-матрицы использовалась хромосомная ДНК Leuconostoc mesenteroides. На реакционную смесь наслаивали 40 мкл вазелинового масла.
Параметры амплификации:
95°С - 5 мин; (94°С - 5 с, 60°С - 30 с, 72°С - 40 с)×30; 72°С - 5 мин; 10°С - хранение. Режим амплификации - точный.
Продукт амплификации размером 416 п.н. обрабатывали хлороформом, переосаждали этанолом и ресуспендировали в буфере TrisHCl 0,05 mM, рН 7,5. Для клонирования ПЦР-продукта он встраивался в коммерческий вектор pQE6 (Quageen, USA) методом лигирования полученных рестрикционных фрагментов по сайтам рестрикции Ncol, BglII/BamHI (при лигировании по одинаковым липким концам сайты BglII и BamHI исчезают). Лигирование проводилось посредством ДНК-лигазы фага Т4 при 4°С в соответствующем буфере в течение 24 часов.
Лигазной смесью трансформировали клетки Е.coli M15, которые затем отбирали на агаризованной среде LB с антибиотиками (ампициллин, канамицин). Затем плазмидная ДНК (pQEDBD) выделялась методом SDS щелочного лизиса, проверялась методом рестрикционного анализа и секвенирования на автоматическом секвенаторе.
§1.3. Получение экспрессионной плазмиды pQEDBDsp с геном ДСД из Leuconostoc mesenteroides со спейсером на С-конце.
Создание гена ДСД-(Gly-Ser)5, кодирующего белок ДСД и глицин-сериновый спейсер, необходимый для пространственного разделения различных функциональных доменов, осуществлялось в два этапа методом «праймеропосредованной прогулки», при этом происходило постепенное наращивание С-концевой спейсерной последовательности, для чего были спланированы следующие праймеры:
На первом этапе «праймеропосредованной прогулки» использовались праймеры GBD11F и RevDBD-1, на втором - GBD11F и RevDBD-2, последний спланирован внахлест с RevDBD-1. Как видно, для дальнейшего клонирования ПЦР фрагмента ДСД-(Gly-Ser)5 в бактериальный вектор pQE6 (Quageen, USA) в праймерах были спланированы сайты эндонуклеаз рестрикции NcoI и HindIII (отмечены на праймерах подчеркиванием). В качестве матрицы для проведения ПЦР использовали плазмидную ДНК pQEDBD. Реакция проводилась в автоматическом режиме на приборе Терцик (Россия) при следующих условиях:
95°С - 5 мин; (94°С - 5 с, 60°С - 30 с, 72°С - 40 с)×30; 72°С - 5 мин; 10°С - хранение. Режим амплификации - точный.
Далее по сайтам рестрикции NcoI и HindIII скорректированный ген ДСД, обладающий С-концевым спейсером, был интегрирован в бактериальный вектор pQE6 (Quageen, USA), при этом была получена экспрессионная плазмида pQEDBDsp с геном ДСД со спейсером на С-конце (SEQ ID NO: 2 приложения).
§1.4. Получение экспрессионной плазмиды pGD-10 с геном химерного белка ДСД-сп-β-ГАЛ
Плазмидная конструкция pGD-10 (Схема 0001) с геном химерного белка ДСД-сп-β-ГАЛ (SEQ ID NO: 1 приложения) была собрана посредством лигирования ранее полученных экспрессионных плазмид pQEDBDsp (с геном ДСД из Lenconostoc mesenteroides со спейсером на С-конце) и pQELacZTm (pR624) (с геном термостабильной бета-галактозидазы из термофильного микроорганизма Thermoanaerobacter Ethanolicus, любезно предоставлена Сергиенко О.В. ВНИИСБРАСХН) по рестрикционным сайтам BglII/BglI и BamHI/BglI соответственно.
Трансформацию и молекулярное субклонирование в E.coli DH5a проводили по стандартным методикам [3]. Выделение плазмидной ДНК осуществляли посредством метода SDS щелочного лизиса. Доказательство введения рекомбинантных ДНК в бактерии осуществлялось косвенным путем, на основе анализа выделенных плазмид с помощью рестрикционного скрининга. Идентичность клонированного в составе вектора pGD-10 гена ДСД-сп-β-ГАЛ была подтверждена секвенированием на автоматическом секвенаторе. В итоге была проклонирована и просеквенирована последовательность гена белка ДСД-сп-β-ГАЛ (фиг.2).
§2. Создание бактериального штамма - продуцента, обеспечивающего экспрессию белка ДСД-сп-β-ГАЛ в цитоплазме клеток Е.coli
Плазмидной ДНК pGD-10 с геном (ДСД-сп-β-ГАЛ) трансформировали клетки E.coli DH5a. Выбранный по результатам секвенирования продуцент E.coli DH5a выращивали на агаризованной среде LB, содержащей антибиотики ампициллин и налидиксовую кислоту для селекции, синтез белка индуцировали добавлением изопропил-β-D-тиогалактопиранозида (ИПТГ) в конечной концентрации 0,3 мМ, при достижении оптической плотности OD=0,9. Время индукции составляло 4,0 часа. Клеточные осадки подвергали ультразвуковой дезинтеграции, термолизу, после чего дебрис осаждали центрифугированием и собирали супернатант (растворимая фракция белка).
Уровень экспрессии целевого белка (102,3 кДа) составлял от 20 до 30% от общего клеточного белка, что показал электрофорез в 10% полиакриламидном геле относительно соответствующих контролей, в присутствии додецилсульфата натрия, также на базе термолизиса при 75°С была доказана термостабильность полученного белка.
В итоге был получен штамм, продуцирующий химерный рекомбинантный белок ДСД-сп-β-ГАЛ, растворимость которого составила порядка 80%.
§3. Изучение базовых свойств белка ДСД-сп-β-ГАЛ в лизатах клеток Е.coli
§3.1. Изучение декстрансвязывающих и ферментативных свойств белка ДСД-сп-β-ГАЛ в лизатах клеток Е.coli
Для этих целей 3 мл культуры DH5a [pGD-10] (бета-галактозидаза с ДСД) и DH5a [pQELacZTm] (термостабильная бета-галактозидаза без ДСД (LacZTm), в качестве положительного контроля) с соответствующими контролями до индукции обрабатывались по той же методике, что и в §2. Были отобраны растворимые фракции (супернатант), которые делились на две пробирки по 1,0 мл (dex(+) - с декстраном и dex(-) - без декстрана). К растворам dex(+) добавляли по 40 мг декстрана Sephadex G50, затем растворы инкубировались в течение 20 мин при 37°С, при постоянном помешивании, что необходимо было для связывания химерного белка ДСД-сп-β-ГАЛ с декстраном. Инкубированные пробы центрифугировались 5 мин при 4000 об/мин, после этого супернатанты (над декстраном) переносились в чистые пробирки (супернатант dex(+)).
Осадки же dex(+) ресуспендировались в 1 мл рабочего буфера (рН 7,4). После этого ко всем пробам добавлялся хромогенный субстрат, имеющий бета-галактозидазную связь (Xgal), в конечной концентрации 0,05 мг/мл. Реакционные смеси инкубировались 10 мин при оптимальной для термостабильной бета-галактозидазы температуре 65°С, после чего производился учет результатов. При этом в отрицательных контролях (буфер с декстраном без лизата с белком) и в супернатанте пробы ДСД-сп-β-ГАЛ dex(+) растворы остались не окрашенными, в то время как растворы в положительных контролях (супернатант пробы pQELacZTm dex(+)) и в осадках опытной пробы dex(+) изменили свой цвет со светло-желтого до сине-зеленого, что говорило о расщеплении субстрата Xgal, т.е. о наличии бета-галактозидазной ферментативной активности, а соответственно, и наличии декстрансвязывающих свойств нашего белка (см. фиг.3; фиг.4).
Таким образом, факт того, что окрашивание развивается преимущественно в осадочных опытных пробах dex(+), свидетельствует о декстрансвязывающих свойствах химерного белка ДСД-сп-β-ГАЛ. Данные свойства оценивались также и по характеру окрашивания осадков декстрана в образце dex(+) (осадок) и в положительном контроле dex(+) (осадок). Сине-зеленое окрашивание в образце белка ДСД-сп-β-ГАЛ локализуется преимущественно в области осадка декстрана, в то время как в положительном контроле, наоборот, осадок не прокрашен, а надосадочная жидкость приобрела сине-зеленый цвет. Это и отсутствие белка нужного мол. веса на 10% ПААГ в супернатанте dex(+), слитом после обработки лизата клеток с конструкцией pGD-10, декстраном, доказывает, что созданная рекомбинантная конструкция обладает декстрансвязывающими свойствами.
§3.2. Изучение бета-галактозидазной активности химерного белка ДСД-сп-β-ГАЛ в лизатах клеток DH5a [pGD-10]
Клетки с экспрессионной плазмидой pGD-10 выращивали в 4 мл среды LB до достижения оптической плотности 0,9 при λ=550, затем пробу индуцировали добавлением 4 мкл 0,3М ИПТГ, при этом время индукции составило 4 часа. Затем отбирали 500 мкл индуцированной культуры, осаждали 10 мин при 6000 об/мин и ресуспендировали в 500 мкл рабочего буфера, содержащего 50 мМ Tris-HCl; 10 мМ CaCl2, 10 мM MnCl2; 0,1 мМ β-Mercaptoethanol; pH 7,4. После этого пробу лизировали ультразвуком и избавлялись от клеточного дебриса центрифугированием в течение 10 мин при 13000 об/мин.
Далее в лизатах клеток определялась собственно бета-галактозидазная активность белка ДСД-сп-β-ГАЛ по способности гидролизовать ОНФГ (орто-нитро-фенил-β-D-галактопиранозид) с образованием галактозы и окрашенного в желтый цвет соединения 2-нитрофенола.
Для этих целей к 0,1 мл лизата добавляли 0,7 мл рабочего буфера и 0,2 мл ОНФГ (4 мг/мл), после чего реакционную смесь инкубировали 15 мин при температуре 65°С. Останавливалась реакция добавлением раствора 1М карбоната натрия.
За единицу активности принимали количество 2-нитрофенола, образующегося за 1 мин. Концентрацию 2-нитрофенола рассчитывали спектрофотометрически при λ=420 нм. Таким образом, было рассчитано, что ферментативная активность нашего белка составила 5 ед/мкл белка при 65°С и рН 7,4.
Далее, в приложении, приведен перечень биоинформационных последовательностей.
Приложение
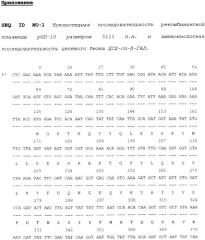
SEQ ID NO: 1 Нуклеотидная последовательность рекомбинантной плазмиды pGD-10 размером 5111 п.н. и аминокислотная последовательность целевого белка ДСД-сп-β-ГАЛ.
Список литературы
1. Suwannarangseea S., Moulisb С., Potocki-Veroneseb G., Monsanb P. / Surisa Search for a dextransucrase minimal motif involved in dextran binding, FEBS Letters, 4675-4680, - Tailand 2007.
2. Olvera С., Fernandez-Vazquez J., Ledezma-Candanoza L. / Role of the C-terminal region of dextransucrase from Leuconostoc mesenteroides IBT-PQ in cell anchoring, Microbiology, 3994-4002, - 2007.
3. Маниатис Т. Молекулярное клонирование: учебник / Т.Маниатис и др. - M.: Мир, 1984. - С.450.
1. Рекомбинантная белковая конструкция ДСД-сп-β-ГАЛ, обладающая активностью фермента термостабильной бета-галактозидазы (лактазы) и способностью аффинно связываться с декстраном, представляющая собой декстрансвязывающий домен ДСД из микроорганизма Leuconostoc mesenteroides с аминокислотной последовательностью, приведенной в виде SEQ ID NO: 2, который генно-инженерным путем объединен через глицин-сериновый спейсер (GSGSGSGSGSGA) с термостабильной бета-галактозидазой из термофильного микроорганизма Thermoanaerobacter ethanolicus с аминокислотной последовательностью, приведенной в виде SEQ ID NO: 3.
2. Плазмидная ДНК pGD-10, определяющая биосинтез белка ДСД-сп-β-ГАЛ и характеризующаяся последовательностью нуклеотидов, приведенной в виде SEQ ID NO: 1.
3. Штамм Escherichia coli DH5α/pGD-10 - продуцент рекомбинантной белковой конструкции ДСД-сп-β-ГАЛ, полученный путем трансформации клеток материнского штамма E.coli DH5α плазмидной ДНК pGD-10 по п.2.