Применение слитого конструкта тимп-гфи и способ лечения повреждений кожи для предотвращения или ингибирования образования рубца
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению слитых белков, и может быть использовано в медицине. Изобретение позволяет предотвратить образование рубца в процессе лечения повреждений кожи при использовании слитого конструкта, состоящего из аминокислотной последовательности тканевого ингибитора металлопротеиназ (ТИМП), связанного с якорем гликозилфосфатидилинозита (ГФИ). 2 н. и 8 з.п. ф-лы, 33 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области слитых конструктов (fusion constructs) и их применению для лечения рака и в регенеративной медицине. Конкретно, изобретение относится к конструктам, включающим тканевые ингибиторы металлопротеиназ (ТИМП), закрепленные (GPI-anchored) гликозилфосфатидилинозитом (ГФИ). Дополнительно, слитые конструкты по настоящему изобретению являются эффективными регенеративными средствами, полезными в области лечения ран.
Уровень техники изобретения
ТИМП в исследовании рака
Лечение рака остается важной задачей и использует различные терапевтические подходы и стратегии, предлагая различные степени успеха. Один известный подход - увеличить чувствительность раковых клеток к иммуноопосредованному лизису. Чувствительность опухолей к иммуноопосредованному лизису связывали с биологией матриксных металлопротеиназ (ММП), и определенно, с экспрессией ММП клеточной поверхностью клетки - мишени опухоли. Матриксные металлопротеиназы (ММП) ухудшают компоненты внеклеточного матрикса (ВКМ) и вовлечены в модернизацию ткани, инвазию опухоли и метастаз (Egeblad & Werb, 2002; Itoh & Nagase, 2002). Активность ММП также связана с эффективностью как перфорин/гранзим-(perforin/granzyme-), так и FAS-опосредованного апоптоза (рассмотрены в Egeblad & Werb, 2002). Показано, что активность ММП регулируется на многих уровнях, включая четыре эндогенных ингибитора, тканевые ингибиторы матриксных металлопротеиназ (ТИМП-1, -2, -3 и -4) (Bode & Maskos, 2003). Баланс в естественных условиях (in vivo) между ММП и ТИМП определяет, имеет ли место матриксная ресорбция или депонирование (Nagase & Woessner, 1999).
Эндогенные ингибиторы тканевой металлопротеиназы (ТИМП) показывают разнообразные физиологическо-биологические функции, включая замедление роста опухоли, метастаз и апоптоза. Эти разнообразные биологические активности ТИМП связывали частично со стехиометрией белковых взаимодействий ТИМП/ММП/ клеточная поверхность. Пополнение цитотоксических лимфоцитов представляет один возможный путь защиты от опухолей. Хотя цитотоксические Т лимфоциты (ЦТЛ) и естественные клетки-киллеры (ЕКК), которые проникают и узнают опухолевые клетки, идентифицированы, эффективный антиопухолевый иммунитет часто не в состоянии эффективно развиться. Эта неэффективность является одной из причин, которая предотвращает полное удаление остаточных опухолевых клеток после неполной хирургической резекции, или из-за продвинутой стадии болезни или местной неоперабельности. Этиология этого функционального дефицита цитотоксических лимфоцитов в настоящее время неясна.
В общем, антиопухолевые эффекты ЦТЛ и клеток ЕКК опосредованы либо через перфорин/гранзим-, либо Fas-опосредованные (CD95/CSD95L) апоптотические пути (Kagi и др., 1994). Перфориновый путь опосредован цитотоксинами, секретированными в течение времени узнавания целевых клеток ЦТЛ и ЕКК (Kagi и др., 1994). CD95 или Fas-рецептор смерти принадлежит регулятору семейства клеток смерти белков и имеет центральное значение в иммуноопосредованном апоптозе опухолевых клеток (Nagata, 1999). Человеческий FAS/CD95/Apo-1 является единственным трансмембранным гликопротеиновым рецептором (325 аминокислот, 45-48 kDa). Лиганд FAS (лиганд FAS, FASL, CD95L) является составным мембранным белком и является трансмембранным гликопротеином типа II. FASL является членом семейства фактора некроза опухолей (ФНО), которое включает ФНОα, α- и β-цепи лимфотоксина (LT), лиганда CD40 и лиганда CD30. Действие FAS опосредуется через FADD (домен смерти, ассоциированный с FAS)/MORTI, белок адаптера, который имеет домен смерти на С-конце и связан с цитоплазматическим доменом смерти FAS. Как найдено, много опухолей устойчивы к апоптозу, опосредованному FAS (Frost и др., 2003; рассмотрено в Igney & Krammer, 2002).
В качестве модельной системы, чтобы испытать конструкты ТИМП-ГФИ по настоящему изобретению, клеточные линии почечно-клеточного рака использовали в качестве примера. Почечно-клеточный рак (ПКР) является седьмой ведущей причиной рака. У приблизительно одной трети пациентов с ПКР есть метастатическая болезнь при представлении и до 50% рецидива после нефрэктомии (Vogelzang & Stadler, 1998). ПКР трудно лечить, и иммунологические методы лечения, такие как интерферон-альфа и интерлейкин-2 обычно более эффективны, чем химиотерапия или облучение (Vogelzang & Stadler, 1998).
Цитотоксические лимфоциты представляют потенциальный компонент в защите против опухолей, включая ПКР.
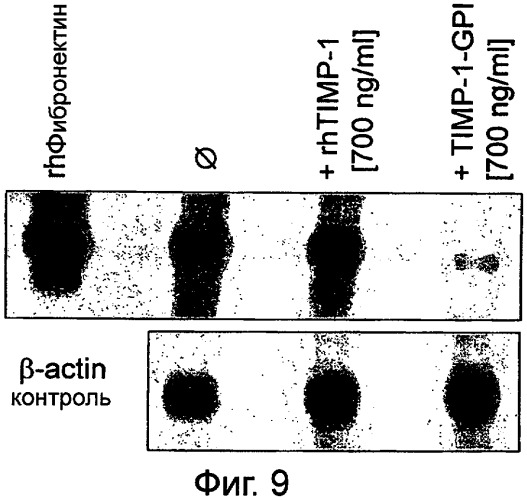
Один член семейства ТИМП, ТИМП-1, является ингибитором ММП широкого действия (Bode and Maskos, 2003). Это - растворимый белок, который может быть обнаружен на поверхности клеток только через ассоциацию с белками, связанными с поверхностью (Brew и др., 2000; Klier и др., 2001). Полная роль ТИМП-1 в биологии рака остается субъектом противоречивых сообщений (Brand, 2002). К настоящему времени признано, что ТИМП-1 играет роль в ангиогенезе, миграции клеток и пролиферации (Brand, 2002). Недавно, было показано, что белок ТИМП-1, закрепленный ГФИ, показал ярко выраженное подавление миграции эндотелиальных клеток в ответ на основной фактор роста фибробластов, основной ФРФ (bFGF), (Djafarzadeh R и др., 2004).
Обычные стратегии и подходы в терапии рака все еще страдают от проблемы, такой, что опухолевые клетки трудно удалять, как только опухоль развилась. Первичные опухоли обычно удаляются из пациента хирургией. Однако, в некоторых случаях не все области доступны для хирурга, и, таким образом, опухолевые клетки остаются в теле, где они могут развиться во вторичные опухоли. Это - результат неполной хирургической резекции первичной опухоли.
Настоящее изобретение, следовательно, обеспечивает эффективное противораковое средство и стратегию, чтобы уменьшить или смягчить пролиферацию опухолевых клеток в человеке, в особенности у пациента, который был подвергнут неполной хирургической резекции первичной опухоли. Противораковое средство по настоящему изобретению полезно для лизиса опухолевых клеток как клеточных линий в пробирке, так и в тканях в естественных условиях.
Роль ТИМП в регенеративной медицине
Настоящее изобретение, кроме того, полезно в области регенеративной медицины. Одна значительная область регенеративной медицины касается процесса заживления ран. Заживление ран относится к естественной восстановительной реакции на повреждение ткани и включает сложный каскад клеточных событий, который, в конечном счете, производит замену покрытия, воссоздание и восстановление прочности травмированной ткани. Этот процесс, обычно, включает задействование и пролиферацию различных типов клеток, выработку клеточного матрикса и увеличение иммунного надзора.
Заживление ран протекает последовательно и может быть разделено на четыре общих фазы: воспаление, грануляция, (пере-)эпителизация и реконструкция ткани. Каждая фаза процесса заживления раны регулируется специальными путями трансдукции сигнала. Во время заживления раны происходит увеличение экспрессии факторов роста и цитокинов; в частности, описано увеличение уровней ФНО, интерлейкина-1 (IL-1) и IL-6. Во время начальной фазы воспаления, которая включает эффекторные белки IL-1, ФНО-α и ЦСЖ (цереброспинальная жидкость), как макрофаги, так и нейтрофилы действуют, чтобы сформировать сгусток фибрина. Во время фазы грануляции фибробласты разрастаются, мигрируют к ране и секретируют внеклеточный матрикс (ВКМ). Эффекторные белки, вовлеченные в эту последнюю фазу, включают ММП и факторы роста: тромбоцитпроизводный, фибробластов, эпидермальный и эндотелия сосудов (соответственно PDGF, FGF, EGF и VEGF). Третья фаза в заживлении раны, переэпителизация, характеризуется разрастанием кератиноцитов, которые мигрируют в рану, а также увеличением миофибробластов, которые ответственны за сокращение раны. Результатом этой фазы, которая вовлекает эффекторные белки ММП, фактор роста кератиноцитов, трансформирующий фактор роста, фактор, стимулирующий колонии гранулоцитов/макрофагов, эпидермальный фактор роста, урокиназу и активатор плазминогена тканевого типа (соответственно ММПs, KGF, TGF, GM-CSF, EGF и uРА и tPA), является переэпителизация поверхности раны, рассечение струпа и формирование барьера. Наконец, во время реконструкции ткани фибробласты производят коллагеновый матрикс, приводящий к формированию рубцовой ткани, апоптозу фибробластов и переключению от активации к дифференцированию кератиноцитов. Известные эффекторные белки, вовлеченные в эту последнюю фазу заживления раны, включают TGF-β1, ММП и ТИМП.
Таким образом, эффекторные клетки, ответственные за большинство аспектов заживления ран, являются фибробластами и кератиноцитами и ММП, которые играют важную роль в миграции фибробластов (ММП-1, -2, -3 и -13) и кератиноцитов (ММП-1, -2, -3 и -10) (Singer & Clark, 1999) в дополнении к образованию рубцов. Каждый из ММП имеет разную специфичность по субстрату в пределах ВКМ и играет важную роль в деградации ВКМ и обновлении. Семейство ММП включает, среди прочего, коллагеназы (ММП-1, ММП-8, ММП-13, ММП-18), стромелизины (ММП-3, ММП-10, ММП-11), желатиназы (ММП-2, ММП-9), матрилизин (ММП-7), металлоэластазу (ММП-12) и ряд мембраносвязанных матричных металлопротеиназ (МТ-ММП). Поскольку функция ММП протеолитически расщепить окружающий ВКМ, баланс между этой протеазной активностью и депонированием ВКМ во время заживления раны, то есть - восстановление поврежденной ткани, должен быть оптимально выдержан. Контроль активности ММП модулируется белками ТИМП, которые производятся большинством клеток, и действуют так, чтобы ингибировать ММП в отношении 1:1. Где этот тонкий баланс между протеолитическим распадом и депонированием ВКМ нарушен, там нарушения, такие как патологическое заживление раны, могут приводить, например, к хроническим ранам, чрезмерному рубцеванию или келоидному рубцу.
Следовательно, существует потребность управлять или влиять на физиологический баланс между протеазной активностью и депонированием ВКМ во время процесса заживления раны.
В другом варианте слитого конструкта по настоящему изобретению обеспечивают эффективное регенеративное средство для лечения состояний, определяемых нарушенным балансом между протеазной активностью ММП и депонированием ВКМ, как например, в келоидных рубцах или хронических ранах, которые обычно связывают с повышенными уровнями ММП. Дополнительно, слитые конструкты по настоящему изобретению обеспечивают эффективное регенеративное средство, которое может уменьшить, минимизировать или ингибировать образование рубцов во время процесса заживления раны.
Сущность изобретения
Настоящее изобретение обеспечивает новые противоопухолевые средства и методы лечения рака.
Настоящее изобретение основано на удивительной находке, что ТИМП, закрепленный якорем ГФИ, эффективно уменьшает или ослабляет пролиферацию раковых клеток, и вызывает лизис раковых клеток в клеточных линиях в пробирке и в естественных условиях. Структурные и функциональные определяющие факторы ТИМП соединяли с якорем гликозилфосфатидилинозита (ГФИ) и, необязательно, с муцином, чтобы получить очень эффективное химиотерапевтическое средство. Этот подход использует белки ТИМП, закрепленные гликозилфосфатидилинозитом (ГФИ), для включения в поверхностные мембраны после очистки и добавления к раковым клеткам. Слияние ТИМП-ГФИ с доменом муцина далее увеличивает представление белков ТИМП на поверхностной клеточной мембране и делает слитый конструкт более эффективным в придании раковым клеткам чувствительности к иммуноопосредованной деструкции.
В следующих примерах настоящее изобретение демонстрирует, что у ТИМП есть потенциал для ингибирования роста опухолевых клеток и сокращения развития опухоли в клеточных линиях в пробирке и в тканях в естественных условиях. Соединение ТИМП с якорем ГФИ и экзогенное введение ГФИ-фиксированного ТИМП, приводит к эффективной вставке белка ТИМП в клеточные мембраны раковых клеток. Поверхностная экспрессия ГФИ-фиксированного ТИМП-1 вызывала множество биологических эффектов в линиях раковых клеток с потенциальной терапевтической значимостью, такой как стимулирование FAS-опосредованного апоптотического пути в раковых клетках. Как показано в следующих примерах, подавление пролиферации раковых клеток зависело от дозы.
Белок ГФИ-фиксированный ТИМП-1 также блокировал секрецию проММП-2 и проММП-9 и резко изменял ассоциацию разнообразных ММП поверхностью клеток. Наиболее конкретно, обычно линии опухолевых клеток, устойчивые к FAS-апоптозу, становились чувствительными к FAS/CD95-опосредованному лизису. Обработка ГФИ-ТИМП приводит к низкоуровневой регуляции антиапоптотического белка BCL2 и соответствующему увеличению проапоптотического белка ВАХ. Этот сдвиг к более высокой концентрации проапоптотических белков может быть одной из причин повышенной чувствительности FAS-опосредованного апоптоза раковых клеток, поверхность которых включает ТИМП.
Согласно вышеуказанному подходу, ГФИ-фиксированные белки ТИМП или полипептиды по настоящему изобретению, как было доказано, являются особенно полезными в терапевтических применениях при лечении остаточного рака после неполной хирургической резекции первичной опухоли, такой как рак молочной железы, остеогенная саркома, почечно-клеточный рак или злокачественные опухоли головного мозга, например глиобластома.
Кроме того, так как опухолевые клетки, включая почечно-клеточный рак (ПКР), в сущности, устойчивы к FAS-опосредованному лизису, настоящее изобретение обеспечивает эффективное средство делать опухолевые клетки, восприимчивыми к FAS-опосредованному апоптозу.
Следовательно, в первом аспекте настоящее изобретение относится к слитому конструкту (ТИМП-ГФИ или ТИМП-муцин-ГФИ), включающему аминокислотную последовательность тканевого ингибитора металлопротеиназ (ТИМП) или его биологически активного фрагмента, в котором указанный ТИМП или его биологически активный фрагмент связаны с аминокислотной последовательностью домена муцина, за которой следует аминокислотная последовательностью якоря гликозилфосфатидилинозита (ГФИ).
В предпочтительном варианте 3'-конец ТИМП связан непосредственно с последовательностью якоря ГФИ и не содержат домен муцина.
Термин "муцин" относится к семейству больших, сильно гликозилированных белков. Один класс муцинов представляет собой муцины, связанные с мембраной, из-за наличия домена, охватывающего мембрану, который способствует удержанию в плазменной мембране, в то время как другой класс муцинов секретируется на поверхностях слизистой оболочки. Гены муцина кодируют мономеры муцина, которые обычно синтезируются как палочкообразные стебли апомуцина, которые посттрансляционно модифицируются избыточным гликозилированием. Две отчетливо различных области найдены в зрелых муцинах. Одна область включает область с концевыми амино- и карбоксигруппами, которая является слабо гликозилированной, но богата остатками цистеина, которые вероятно вовлечены в установление дисульфидных связей в пределах и среди мономеров муцина. Вторая центральная область образована многократными тандемными повторами последовательностей 10-80 остатков, в которых больше половины аминокислотных остатков являются серином или треонином.
Обычно муцины секретируются как массивные скопления белков, имеющих молекулярные массы примерно 1-10 миллионов дальтон. В пределах этих скоплений мономеры связаны друг с другом, главным образом, нековалентными взаимодействиями, хотя межмолекулярные дисульфидные мостики могут также играть роль в этом процессе. По меньшей мере, различают 19 человеческих генов муцина, включая MUC1, 2, 3А, 3В, 4, 5АС, 5В, 6-9,11-13 и 15-19.
Муцин, как понимают в настоящем изобретении, предпочтительно является доменом муцина, связанным с мембраной, и включает предпочтительно аминокислотную последовательность, выбранную из группы, состоящей из MUC1, MUC3A, MUC3B, MUC4, MUC11, MUC12, MUC16, и MUC17, или его варианта или участка (вышеупомянутые муцины рассмотрены в Moniaux N. и др., 2004). В другом предпочтительном варианте применяют стебель муцина, который выделяют из связанных с поверхностью хемокина CXCL16 или фракталкина (CX3CL1).
Фракталкин является членом большого и сложного генного суперсемейства хемокинов, которое состоит преимущественно из секретированных, провоспалительных молекул. Типичная стебельная структура хемокинов частично удерживается дисульфидными мостиками между позиционно сохраняемыми остатками цистеина. Для большинства пептидов хемокина структурной особенностью семейства является распределение четырех цистеинов в молекуле, то есть характерный цистеиновый мотив: СХС, СС и С, где С представляет собой цистеин и X является любым аминокислотным остатком. Четыре различных семейства хемокинов были идентифицированы на основе наблюдений, что пептиды хемокина могут отличаться организацией остатков цистеина, расположенных около N-конца молекулы. Сам фракталкин определяет одно из семейств хемокинов и отличается структурно от других семейств хемокинов, так как цистеины N-конца фракталкина разделены тремя остатками (то есть мотив СХ3С), а также привязывается к клеточной мембране удаленным С-концом трансмембранного якоря, который включает муциноподобный домен или муциноподобный стебель. Таким образом, домены муцина и фракталкина, содержащиеся в пределах слитых конструктов по настоящему изобретению, являются подходящими для достижения улучшенной фиксации белка ТИМП в клеточной мембране.
ТИМП, как используется в настоящем изобретении, предпочтительно получают из млекопитающего; более предпочтительно из человека (четыре ТИМП рассмотрены в Mannello F. и др., 2001). Примеры белков ТИМП, которые могут использоваться в соответствии с настоящим изобретением, включают ТИМП-1, ТИМП-2, ТИМП-3 или ТИМП-4 и их соответствующие варианты в других организмах, таких как мыши, кролики, собаки, кошки, овцы и коровы.
ГФИ-якорь, как используется в настоящем изобретении, предпочтительно получают из антигена, связанного с функцией лимфоцитов (LFA-3), или его участка и включает ГФИ-сигнальную последовательность, которая опосредует ассоциацию мембран.
Настоящее изобретение также относится к молекуле нуклеиновой кислоты, такой как РНК или ДНК, включая нуклеиновокислотную последовательность, которая кодирует конструкт ГФИ-фиксированный ТИМП по изобретению.
В дальнейшем аспекте настоящего изобретения молекула нуклеиновой кислоты по изобретению содержится в экспрессионной плазмиде, векторе или клетке-хозяине для экспрессии молекулы нуклеиновой кислоты по изобретению.
Настоящее изобретение также относится к применению слитых конструктов ТИМП-ГФИ или ТИМП-муцин-ГФИ по изобретению для лечения рака, особенно остаточного рака после хирургического удаления первичной опухоли.
В дальнейшем аспекте настоящего изобретения слитые конструкты ТИМП-ГФИ или ТИМП-муцин-ГФИ по изобретению содержатся в фармацевтическом препарате или медикаменте. В дальнейшем варианте слитые конструкты ТИМП-ГФИ или ТИМП-муцин-ГФИ по изобретению обычно применяют как противораковое средство или лекарство. В предпочтительном варианте противораковые препараты по изобретению вводятся или наносятся локально на место резекции опухолевой массы у больных с "высокорисковой" опухолью с высоким риском остаточных раковых клеток и повышенным уровнем местного рецидива, и у больных, имеющих очевидную остаточную опухоль из-за продвинутой стадии болезни или местной неоперабельности. Предпочтительно, слитый конструкт вводят распылением в рану и/или инъекцией в области, которые недоступны для хирургии.
Настоящее изобретение также относится к in vivo методу для торможения пролиферации раковых клеток, включающему стадии воздействия на линию раковой клетки эффективного количества слитых конструктов ТИМП-муцин-ГФИ и ТИМП-ГФИ.
В дальнейшем варианте настоящее изобретение обеспечивает новые средства и методы для лечения состояний, определяемых нарушенным балансом между нормальной физиологической активностью ММП протеазы и депонированием ВКМ, которые приводят к патологическому заживлению раны. В одном варианте настоящее изобретение обеспечивает средства и методы, пригодные для лечения келоидных или гипертрофических рубцующихся и хронических ран, обычно связанных с повышенным уровнем ММП. Кроме того, настоящее изобретение также обеспечивает эффективные средства и методы для снижения, минимизации или ингибирования формирования рубцов во время процесса заживления раны.
Определения
Термин "ТИМП", как используется здесь, означает эндогенный тканевый ингибитор металлопротеиназ, который, как известно, вовлекается в физиологическо-биологические функции, включая ингибирование активной матриксной металлопротеиназы, регулирование активации проММП, роста клеток и модуляции ангиогенеза. Человеческое "семейство ТИМП" содержит четыре члена, ТИМП-1, ТИМП-2, ТИМП-3 и ТИМП-4. Один предпочтительный член, используемый в настоящем изобретении, ТИМП-1, является секретированным белком, который может быть обнаружен на поверхности клетки через ее взаимодействие с поверхностными белками (Bode & Maskos, 2003).
Термин " слитый конструкт " или " слитый конструкт ТИМП", как используется здесь, относится как к молекуле нуклеиновой кислоты, так и к молекуле аминокислоты, закодированной таким образом.
Изобретение конкретно относится к нуклеиновым кислотам, содержащим нуклеотидную последовательность, включающую последовательность, определенную в соответствии с номером SEQ ID NOS:l-5, или ее гомологом или ее уникальными фрагментом.
В настоящем изобретении последовательность молекулы нуклеиновой кислоты, которая кодирует образующийся белок, считается гомологичной второй молекуле нуклеиновой кислоты, если нуклеотидная последовательность первой молекулы нуклеиновой кислоты является, по меньшей мере, на приблизительно 70%, предпочтительно, по меньшей мере, на приблизительно 80%, и более предпочтительно, по меньшей мере, на приблизительно 90%, гомологичной последовательности второй молекулы нуклеиновой кислоты. Гомология между двумя нуклеиновокислотными последовательностями может быть легко определена, используя известный алгоритм BLASTN (Altschul и другие, 1990) с параметрами настройки по умолчанию. Как дальнейший пример, другой известный тест на установление гомологии двух нуклеиновокислотных последовательностей - гибридизируются ли они при нормальных условиях гибридизации, предпочтительно при строгих условиях гибридизации.
Учитывая нуклеиновокислотную последовательность, раскрытую здесь, квалифицированный человек (специалист в данной области) может легко проектировать структуры нуклеиновых кислот, имеющих специфические функции в различных применениях. Например, специалист может получить олигонуклеотиды или полинуклеотиды для использования в качестве инициаторов в методиках амплификации нуклеиновой кислоты, таких как полимеразно-цепная реакция (PCR), лигазная цепная реакция (LCR), реакция репарации цепи (RCR), PCR-проба на лигирование олигонуклеотидов (PCR-OLA) и т.п. Олигонуклеотиды, полезные в качестве зондов в исследованиях гибридизации, такой, как in situ гибридизация, могут быть получены. Известны многочисленные методы для маркировки таких зондов радиоизотопами, флуоресцентными метками, ферментами и связывающими фрагментами (например, биотином), таким образом, зонды по изобретению могут быть легко приспособлены для легкого обнаружения.
Олигонуклеотиды также могут быть разработаны и получены для других целей. Например, изобретение дает возможность разработки антисенсорных олигонуклеотидов и триплексобразующих олигонуклеотидов для применения в исследовании взаимоотношений «структура-функция». Гомологичная рекомбинация может быть осуществлена адаптацией описанной нуклеиновой кислоты для применения в качестве нацеливающего средства.
Белок, кодированный нуклеиновой кислотой по настоящему изобретению, далее включает функциональные гомологи. Белок считают функциональным гомологом другого белка для определенной функции, как описано ниже, если у гомолога есть та же самая функция, что и у другого белка. Гомолог может быть, например, фрагментом белка или заменой, дополнением или делеционным мутантом белка.
Определение того, являются ли две аминокислотные последовательности существенно гомологичными для цели настоящего изобретения, основывается на исследовании FASTA согласно Pearson & Lipman (1988). Например, аминокислотную последовательность первого белка считают гомологичной последовательности второго белка, если аминокислотная последовательность первого белка имеет, по меньшей мере, приблизительно 70% идентичность аминокислотной последовательности, предпочтительно, по меньшей мере, приблизительно 80% идентичность и более предпочтительно, по меньшей мере, приблизительно 95% идентичность последовательности второго белка.
Возможность замены одной аминокислоты в последовательности эквивалентной аминокислотой известна. Группы аминокислот, известных как эквивалентные, включают
(a) Ala (A), Ser (S), Thr (Т), Pro (Р), Gly (G);
(b) Asn (N), Asp (D), Glu (E), GIln (Q);
c) His (H), Arg(R), Lys(K);
d) Met (M), Leu (L), Ile (I), Val (V); и
(e) Phe (F), Tyr (Y), Trp (W).
Замены, дополнения и/или делеции в аминокислотных последовательностях могут быть сделаны до тех пор, пока белок, кодированный нуклеиновой кислотой по изобретению, продолжает удовлетворять функциональным критериям, описанным здесь. Аминокислотная последовательность, которая является существенно той же самой, как другая последовательность, но отличается от другой последовательности одной или более замен, добавлений и/или делеций, как полагают, является эквивалентной последовательностью.
Предпочтительно, меньше 20%, более предпочтительно меньше 10% и еще более предпочтительно меньше 5% остатков аминокислот в последовательности заменяются, добавляются или удаляются из белка, кодированного нуклеиновой кислотой по изобретению.
Термин "ММП", как используется здесь, обозначает матриксную металлопротеиназу, которая принадлежит суперсемейству ММП, как представлено, по меньшей мере, 26 внеклеточными матрикс-деградирующими металлоэндопептидазами, которые действуют во время развития ткани и дифференцирования, клеточной инфильтрации, заживления ран, и как регуляторы иммунного ответа.
Термин "ГФИ", как используется здесь, обозначает гликоинозитфосфолипиды, в частности гликозилфосфатидилинозит, как описано в Medof и другие, 1996. Эти фосфолипидоподобные якоря имеют общую структуру для закрепления на мембране независимо от функции белка. ГПИ-фиксирующие единицы составляют из линейного гликана, содержащего фосфоэтаноламин, трех остатков маннозы и неацетилированого глюкозамина, связанного с инозитфосфолипидом. Последовательность ГФИ содержит сигналы, которые направляют ГФИ фиксацию.
Термин "муцин" или "домен муцина", как используется здесь, обозначает мембраносвязанный или немембранный компонент гликопротеина. Обычно, мембраносвязанные муцины имеют гидрофобные последовательности или трансмембранные домены, ответственные за их фиксацию в двойном слое липида и, необязательно, содержат один или несколько доменов, подобных фактору Виллебрандта, которые функционируют в олигомеризации мономеров муцина и заполнении секреторных пузырьков. Термин "муцин" или "домен муцина", как используется здесь, также охватывает стебли муцина или муциноподобные домены, такие как стебли муцина, обычно находимые в хемокинах CXCL16 или фракталкине (CX3CL1).
Слитый конструкт "ТИМП-ГФИ", как используется здесь, относится к ТИМП, который непосредственно связан с последовательностью ГФИ-линкера. Слитой конструкт ТИМП-ГФИ получен заменой эндогенной концевой последовательности 3'-мРНК или кДНК ТИМП на концевую последовательность 3'-мРНК или кДНК белков естественно закрепленных якорем ГФИ (то есть последовательности, которые содержат сигналы, которые направляют фиксацию ГФИ).
"ТИМП-муцин-ГФИ" или "ТИМП-муц-ГФИ", как используется здесь, относится к ТИМП, который непосредственно слит с доменом муцина, за которым следует последовательность ГФИ-линкера. Слитый конструкт ТИМП-муцин-ГФИ разработан, как описано для ТИМП-ГФИ, но включает аминокислотную последовательность домена муцина между аминокислотными последовательностями ТИМП и ГФИ. По аналогии, "ТИМП-фракталкин-ГФИ" или "ТИМП-фрак-ГФИ" относится к ТИМП, который непосредственно слит с доменом фракталкина, за которым следует последовательность ГФИ-линкера.
Термин "ПКР" обозначает почечно-клеточный рак, который, как полагают, является прогрессирующей опухолью с ограниченными терапевтическими вариантами из-за устойчивости опухоли к современным химиотерапевтическим средствам и радиации. ПКР служит модельной системой в настоящем изобретении, чтобы показать противораковую активность ГФИ-фиксированного ТИМП. Линиями клеток модели, применяемыми в настоящем изобретении, являются клеточные линии ПКР-26 и ПКР-53, которые были созданы от пациентов со стадией I и стадией IV рака клеток.
Термин "FAS" обозначает член семейства рецепторов фактора некроза опухолей/фактора роста нервов, которое вызывает апоптоз, независимый от ФНО-α. Другие сокращения, известные в технике для FAS, являются Apol (=белок1, вызывающий апоптоз) и CD95.
Термин "регенерация" вообще относится к восстановлению целостности травмированных или иначе поврежденных тканей. Этот термин может включать процессы заживления ран, репарации ткани и другие типы восстанавливающих активностей, встречающихся в местоположении, где физиологическое поражение и последующее повреждение ткани имели место.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Семейство ТИМП и белковая инженерия клеточных поверхностей
Тканевые ингибиторы металлопротеиназ (ТИМП) известны, как главные клеточные ингибиторы подсемейства матричной металлопротеиназы (ММП), показывающие различные степени эффективности против различных членов ММП, а также различные структуры экспрессии ткани и способы регулирования. ТИМП обычно модулируют активность растворимых ММП, связанных с матриксом и ассоциированных с клетками. Все четыре ММП млекопитающих имеют много широких общих черт, но показывают отличительные структурные особенности, биохимические свойства и структуры экспрессии, которые предполагают, что каждый ТИМП имеет особую функцию в естественных условиях.
Белок ТИМП-1 является наиболее широко экспрессируемым и изучаемым членом семейства ТИМП. Другие члены семейства ТИМП включают ТИМП-2, ТИМП-3 и ТИМП-4. Белки ТИМП не только разделяют общие структурные особенности, включая ряд сохраняющих остатков цистеина, которые образуют дисульфидные мостики, существенные для естественной белковой конформации (Brew и др., 2000), но у них также есть широко перекрывающиеся биологические активности. Сохраненная N-концевая область белков ТИМП необходима для функциональных ингибирующих активностей, в то время как дивергентные С-концевые области, как думают, модулируют эффективность ингибирования и связывания средств с ММП (Maskos & Bode, 2003). Однако, кроме их способности действовать как ингибиторы ММП, различные члены семейства ТИМП могут также проявлять дополнительные биологические активности, включая регулирование пролиферации и апоптоза в дополнение к модуляции ангиогенных и воспалительных реакций.
Как было найдено, ТИМП-1 ингибирует большинство ММП (кроме ММП-2 и -14) и избирательно ингибирует ММП-8. ТИМП-1 производится и секретируется в растворимой форме множеством типов клеток и широко распределяется по всему телу. Это сильно гликозилированный белок с молекулярной массой 28,5 kDa. ТИМП-1 ингибирует активные формы ММП и комплексы с проформой ММП9. Подобно ММП9, экспрессия ТИМП-1 чувствительна ко многим факторам. Повышенный синтез ТИМП-1 вызван широким разнообразием реагентов, которые включают: бета TGF, EGF, PDGF, FGFb, РМА, все-транс-ретиновая кислота (РА), IL1 и IL11.
ТИМП-2 является 21 kDa гликопротеином, который экспрессируется многими типами клеток. Он образует нековалентный, стехиометрический комплекс как со скрытым, так и с активным ММП. ТИМП-2 показывает предпочтение ингибированию ММП-2.
ТИМП-3 обычно связывается с ВКМ и ингибирует активность ММП-1, -2, -3, -9 и -13. ТИМП-3 показывает 30% аминокислотную гомологию ТИМП-1 и 38% гомологию ТИМП-2. Как показано, ТИМП-3, вызывает отделение трансформированных клеток от ВКМ и ускоряет морфологические изменения, связанные с трансформацией клеток.
Из-за высокого сродства связывания с ВКМ ТИМП-3 уникален среди ТИМП. Как было показано, ТИМП-3 вызывает отделение трансформированных клеток от ВКМ и ускоряет морфологические изменения, связанные с трансформацией клеток.
ТИМП-3 содержит домен, связывающий глюкозаминогликан (ГАГ), включающий шесть аминокислот (Lys30, Lys26, Lys22, Lys42, Arg20, Lys45), которые, как думают, ответственны за ассоциацию с поверхностью клетки. ТИМП-3 - это единственный ТИМП, который обычно ингибирует ТАСЕ (ФНОα-превращающий фермент), другую металлопротеазу, которая выделяет растворимый ФНО, и ответственен за переработку рецептора IL-6, таким образом, играя центральную роль в процессе заживления раны.
ТИМП-4 ингибирует все известные ММП, а предпочтительно ингибирует ММП-2 и -7. ТИМП-4 показывает 37% аминокислотную идентичность ТИМП-1 и 51% гомологию ТИМП-2 и ТИМП-3. ТИМП-4 секретируется внеклеточно, в основном, в сердечной и мозговой ткани и, кажется, функционирует тканеспецифичным образом относительно внеклеточного матриксного (ВКМ) гомеостаза.
Белковая инженерия клеточных поверхностей - это потенциально сильная технология, через которую поверхностным белковым составом клеток можно управлять без генной передачи. Заменой мРНК-производной последовательности кДНК, полученной из ГФИ-фиксированного белка, который содержит сигнальный домен ГФИ для участка карбоксильного конца белка интереса можно получить слитый конструкт, который кодирует ГФИ-фиксированный белок.
Этот подход предлагает многократные преимущества перед более традиционными подходами генной передачи. Например, метод применим к клеткам, которые трудно или невозможно трансфецировать (например, первичный капиллярный эндотелий, первичные клетки-мишени и т.д.). Количество белка, добавленного на поверхность клетки, можно регулировать и количественно определять (клеточный сортер с возбуждением флуоресценции (FACS) или иммунофлуоресценция). Кроме того, белки, многократно закрепленные ГФИ, могут быть последовательно или одновременно вставлены в те же самые клетки. Через молекулярную инженерию можно экспрессировать дополнительную эпитопную метку, который помогает очищать белок, а также контролировать реагент во время экспериментов. Средство может быть введено непосредственно в опухоль или околоопухолевую область и определен эффект селективного рекрутмента лейкоцитов на рост опухоли или FAS-опосредованный апоптоз.
Слитый конструкт ТИМП для лечения рака
Прогноз злокачественных опухолей, главным образом, зависит от их клинической и патологической стадии. В то время как большинство раков (например, первичные и вторичные опухоли) могут быть полностью хирургически удалены в большинстве случаев, повторная резекция продвинутой стадии рака часто невозможна, что связано с ранним рецидивом болезни и повышенной летальностью, обусловленной болезнью.
В частности, в раке молочной железы продвинутая стадия болезни с расширенным размером опухоли (>2 см) связана с возникновением отдаленного метастаза и ограниченным выживанием. Большой объем опухоли, как также полагают, является критическим параметром для наличия остаточного рака, который представляет также высокий риск местного рецидива и распространения отдаленного метастаза. Аналогично, опухоли головного мозга, такие как глиобластома (астроцитома IV степени), являются другой мыслимой целью для наблюдения опухоли, потому что полное хирургическое удаление почти всегда невозможно и местный рецидив встречается в 95% всех случаев в течение одного года после первичной хирургии.
Чтобы решить проблему, которая связана с остаточным раком, необходимо идентифицировать новый выбор терапии рака, который особенно полезен для лечения остаточного рака после неполной хирургической резекции.
В качестве решения настоящее изобретение обеспечивает ГФИ-фиксированный ТИМП, который может быть применен локально в края резекции, чтобы привлеч