Способ повышения резистентности трансгенных растений к патогенным воздействиям
Иллюстрации
Показать всеВ растение или растительную клетку вводят и обеспечивают там экспрессию последовательности ДНК, кодирующей белок с лейцинобогащенным повторяющимся доменом (LRR) и/или киназной активностью. Экспрессия такой последовательности ДНК обеспечивает повышение резистентности трансгенных растений или растительных клеток к воздействиям патогенов. 2 н. и 16 з.п. ф-лы, 1 ил.
Реферат
Настоящее изобретение касается способа повышения резистентности к патогенным воздействиям в трансгенных растениях и/или растительных клетках, причем в растение или растительную клетку вводят и обеспечивают там экспрессию последовательности ДНК, кодирующей белок с лейцинобогащенным повторным (LRR) доменом и/или киназной активностью. Также настоящее изобретение касается применения нуклеиновых кислот, кодирующих такой белок, для создания трансгенных растений или растительных клеток с повышенной резистентностью к патогенным воздействиям. Кроме того, настоящее изобретение касается последовательностей нуклеиновых кислот, кодирующих белок, обеспечивающий повышенную резистентность к патогенным воздействиям у растений.
Болезни растений, вызываемые различными патогенными агентами, например, вирусами, бактериями и грибками, могут вызывать существенные потери урожая при разведении культурных растений, что, с одной стороны, имеет экономические следствия, но также и угрожает питанию людей. С прошлого века для воздействия на грибковые заболевания применяют химические фунгициды. Хотя применение этих веществ позволило снизить масштабы болезней растений, но до сих пор нельзя исключить, что эти соединения оказывают вредное воздействие на человека, животных и окружающую среду. Поэтому, чтобы снизить потребление обычных средств защиты растений до минимума, важно исследовать естественные механизмы защиты различных растений от патогенного воздействия различных возбудителей и целенаправленно использовать их, применяя методы генной инженерии, например, вводя внешние гены резистентности или изменяя внутреннюю экспрессию генов в растениях, для создания растений, обладающих резистентностью против патогенных воздействий.
Способов придать растениям резистентность к патогенным воздействиям, прежде всего патогенным грибкам, немного. Недостаток их частично обусловлен сложностью рассматриваемых биологических систем. Достижению резистентности против патогенных воздействий препятствует также то, что о взаимодействиях между патогенным агентом и растением известно немного. Большое количество различных патогенных агентов, развитые ими механизмы инфицирования, и развившиеся у отрядов, семейств и видов растений механизмы защиты взаимодействуют между собой сложным образом.
Патогенные грибки выработали в основном две стратегии инфицирования. Некоторые грибки проникают в ткань хозяина через устьица (например, ржавчинные грибки, виды Septoria, Fusarium) и проникают в ткань мезофилла, в то время как другие проникают через кутикулу в лежащие под ней клетки эпидермиса (например, виды Blumeria).
Инфекции, вызванные патогенными грибками, вызывают в пораженных растениях активацию защитных механизмов. Так, удалось показать, что защитные реакции против грибков, проникающих через эпидермис часто начинаются с формирования резистентности против пенетрации (формирование сосочков, утолщение клеточной стенки, главный компонент - каллусная ткань) под проникающей грибковой гифой (Elliott et al. (2002) Mol. Plant Microbe Interact. 15: 1069-77).
Защитные механизмы растений, однако, во многих случаях не обеспечивают достаточной защиты от поражения патогенными агентами.
Формирование резистентности против пенетрации патогенных агентов, механизм развития инфекции которых включает в себя проникновение в клетки эпидермиса или мезофилла, имеет большое значение как для однодольных, так и для двудольных растений. В отличие от других способов придания резистентности, этот вариант может позволить сформировать резистентность широкого спектра против облигатно-биотрофных, гемибио-трофных и некротрофных грибков.
До сих пор для создания растений, обладающих резистентностью к грибкам, часто проводили скрещивание с введением количественных признаков резистентности (QTL). Этот способ, однако, обладает тем недостатком, что нередко параллельно происходит введение нежелательных признаков. Кроме того, методы разведения, необходимые для этого, очень сложны и требуют много времени. Поэтому задача настоящего изобретения состояла в том, чтобы предложить способ повышения резистентности растений против пенетрирующих патогенных агентов.
Задачу решают посредством форм исполнения, охарактеризованных в пунктах формулы изобретения.
Следовательно, настоящее изобретение касается способа повышения резистентности к патогенным воздействиям в трансгенных растениях и/или растительных клетках, причем в растение или растительную клетку вводят и обеспечивают там экспрессию последовательности ДНК, кодирующей белок, который сообщает повышенную резистентность к патогенам, предпочтительно - повышенную резистентность к патогенным грибкам.
В рамках анализа TIGS (Transient Induced Gene Silencing, преходящего вызванного "молчания" генов), проведенного на ячмене по методу Schweizer et al. (2001), было обнаружено, что "молчание" гена RNR8, опосредованное dsRNAi (интерференцией двухцепочечной РНК), повышает восприимчивость растения к патогенному грибку Blumeria graminis, и, следовательно, ген RNR8 играет роль в придании растениям ячменя резистентности к патогенам.
RNR8 относится к семейству белков, содержащих лейцинобогащенные повторы (LRR) с доменом киназы или активностью киназы. Белки, принадлежащие к этому семейству, играют важную роль в различных клеточных процесса, как то: регуляция развития эндосперма и пыльцы (Li and Wurtzel (1998) Plant Mol. Biol. 37: 749-761; Muschietti et al. (1998) Plant Cell 10: 319-330), регуляции развития меристемы и цветка (Torii et al. (1996) Plant Cell 8: 735-746; dark et al. (1997) Cell 89: 575-585; Kim et al. (2000) Plant Sci. 152: 17-26) и в росте побегов, вызванном гиббереллином (van der Knapp et al. (1999) Plant Physiol. 120: 559-569). Домены LRR включают в себя от 2 до 45 повторений аминокислотной последовательности, в состав которой входят от 20 до 30 аминокислот, и обычно сворачивается, принимая форму подковы.
В отношении другого члена этого семейства, ОsХа21 из риса, удалось показать, что он сообщает резистентность в отношении патогенных бактерий Xanthomonas oryzae (Song et al. (1995) Science 270(5243): 1804-1806). Белок согласно изобретению гомологичен белку OsXa21 по последовательностям лишь в очень незначительной степени, примерно на 23%.
Белки согласно изобретению обеспечивают повышение резистентности растений к патогенным воздействиям, предпочтительно - резистентности к патогенным грибкам. Предпочтительно они отличаются тем, что либо содержат лейцинобогащенные повторы (LRR), либо обладают активностью киназы, особо предпочтительно, чтобы белки согласно изобретению обладали обоими признаками. В настоящее время предполагают (не фиксируясь, однако, этой гипотезой), что за сообщение резистентности против патогенных воздействий отвечает либо активность киназы, либо домен LRR, либо оба эти признака вместе. В целях простоты изложения ниже используют понятие "белок согласно изобретению".
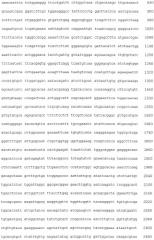
Последовательность нуклеиновых кислот, которую вводят в растение или в растительную клетку при реализации способа согласно изобретению, и которая кодирует белок согласно изобретению, выбирают из группы, которую образуют:
i) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, соответствующие кодирующим последовательностям SEQ ID NO 1 или их фрагментам,
ii) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, кодирующие белок с последовательностью аминокислот, приведенной под SEQ ID NO 2, или ее фрагментами,
iii) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, идентичные кодирующим последовательностям SEQ ID NO 1 по меньшей мере на 60% и/или
iv) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, гибридизирующиеся с комплементарной нитью нуклеотидной последовательности от i) до iii) в обязательных условиях.
"Резистентность" означает воспрепятствование, исключение, снижение или ослабление симптомов заболевания растения, развивающихся вследствие поражения патогенным агентом. Симптомы могут быть различного рода, предпочтительно к ним, однако, относятся те, что прямым или косвенным образом ведут к снижению качества растения, количества урожая, пригодности к использованию в пищу или корм, либо же осложняют посев, выращивание, сбор урожая или обработку собранного урожая.
В предпочтительной форме исполнения происходит ослабление, снижение проявления или предотвращение следующих симптомов: образования пустул и скопления спор на поверхности пораженных тканей, мацерации тканей, распространяющегося некроза ткани, накопления микотоксинов, например, из Fusarium graminearum или F.culmorum.
"Повышенная резистентность к патогенным воздействиям" означает, что защитные механизмы определенного растения или в некоторой части растения, например, в органе, ткани, клетке или органелле, благодаря применению способа согласно изобретению при прочих равных условиях (например, климатических условиях, условиях выращивания, типе патогенного воздействия и т.д.) обладают повышенной по сравнению с подходящим контролем, например, с диким типом растения ("исходным растением", "контрольным растением"), резистентностью к одному или более патогенным воздействиям. Предпочтительно, чтобы в растении по меньшей мере эпидермис и/или ткань мезофилла или органы, имеющие эпидермис и/или ткань мезофилла, обладали повышенной резистентностью к патогенным воздействиям. В качестве примера можно указать повышение резистентности в листьях.
В одной из форм исполнения повышают резистентность в нижней цветковой чешуе (lemma), верхней цветковой чешуе (palea) или колосковой чешуе (плева, glume).
Повышенная резистентность предпочтительно выражается в снижении проявлений болезненных симптомов, причем к симптомам - помимо вышеупомянутых поражений - также относятся эффективность проникновения патогенного агента в растение или растительную клетку или эффективность пролиферации патогенного агента в таковых или на таковых. При этом предпочтительно ослабление болезненных симптомов по сравнению с контрольным растением по меньшей мере на 10% или по меньшей мере на 20%, особо предпочтительно - по меньшей мере на 40% или 60%, чрезвычайно предпочтительно - по меньшей мере на 70% или 80%, а наиболее предпочтительно - по меньшей мере на 90% или 95%.
В рамках изобретения "патоген" в рамках изобретения означает организмы, взаимодействие которых с растением ведут к вышеописанным болезненным симптомам, в частности, под "патогеном" подразумевают организмы из царства грибов. При этом предпочтительно, чтобы патоген представлял собой патогенный агент, проникающий в клетки эпидермиса или мезофилла, особо предпочтительно - патоген, входящие в растения через устьица, а затем проникающие в клетки мезофилла. При этом предпочтительно упомянуть организмы отделов Ascomycota и Basidomycota. Особо предпочтительны при этом семейства Blumeriaceae, Pucciniaceae, Mycosphaerellaceae и Hypocreaceae.
Особо предпочтительны организмы тех семейств, которые принадлежат к родам Blumeria, Puccinia, Fusarium или Mycosphaerella.
Крайне предпочтительны виды Blumeria graminis, Puccinia triticina, Puccinia striiformis, Mycosphaerella graminicola, Stagonospora nodorum, Fusarium graminearum, Fusarium culmorum, Fusarium avenaceum, Fusarium poae и Microdochium nivale.
В особо предпочтительных формах исполнения способ согласно изобретению ведет к следующим видам резистентности:
- ячменя против патогена Puccinia graminis f.sp. hordei (стеблевая ржавчина ячменя, barley stem rust),
- пшеницы против патогенов Fusarium graminearum, Fusarium avenaceum, Fusarium culmorum, Puccinia graminis f.sp. tritici (стеблевая ржавчина пшеницы, wheat stem rust), Puccinia recondita f.sp. tritici, Puccinia striiformis, Septoria nodorum, Septoria tritici и/или Septoria avenae,
- кукурузы против патогенов Fusarium moniliforme var. subglutinans, Puccinia sorghi и/или Puccinia polysora,
- сорго против патогенов Puccinia purpurea, Fusarium moniliforme, Fusarium graminearum и/или Fusarium oxysporum,
- сои против патогена Phakopsora pachyrhizi и/или Phakopsora meibromae.
Равным образом предметом изобретения является изолированная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, выбранную из группы, которую образуют:
i) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, соответствующие кодирующим последовательностям SEQ ID NO 1 или их фрагментам,
ii) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, кодирующие белок с последовательностью аминокислот, приведенной под SEQ ID NO 2, или ее фрагментами,
iii) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, идентичные кодирующим последовательностям SEQ ID NO 1 по меньшей мере на 60% и/или
iv) Последовательности нуклеиновых кислот, в состав которых входят последовательности нуклеотидов, гибридизирующиеся с комплементарной нитью нуклеотидной последовательности от i) до iii) в обязательных условиях,
кодирующие белок, который сообщает растениям повышенную резистентность к патогенам, предпочтительно - повышенную резистентность к патогенным грибкам.
Понятие "нуклеиновая кислота (молекула нуклеиновой кислоты)", в том смысле, в котором его здесь применяют, в предпочтительной форме исполнения включает в себя расположенную на 3'- и на 5'-конце кодирующего участка гена и не прошедшую трансляцию последовательность: по меньшей мере 500, предпочтительно 200, особо предпочтительно 100 нуклеотидов вверх от 5'-конца кодирующего участка и по меньшей мере 100, предпочтительно 50, особо предпочтительно 20 нуклеотидов вниз от 3'-конца кодирующего участка гена.
"Изолированную" молекулу нуклеиновой кислоты отделяют от других молекул нуклеиновой кислоты, имеющихся в естественном источнике нуклеиновых кислот. Предпочтительно, чтобы "изолированная" нуклеиновая кислота не содержала последовательностей, естественным образом фланкирующих нуклеиновые кислоты в геномной ДНК организма, из которого происходит нуклеиновая кислота (например, последовательности, находящиеся на 5'- и 3'-концах нуклеиновой кислоты). В различных формах исполнения изолированная молекула может содержать, например, менее чем 5 тысяч пар оснований (тыс. п.о., kb), 4 тыс. п.о., 3 тыс. п.о., 2 тыс. п.о., 1 тыс. п.о., 0,5 тыс. п.о. или 0,1 тыс. п.о. нуклеотидных последовательностей, естественным образом фланкирующих нуклеиновые кислоты в геномной ДНК организма, из которого происходит нуклеиновая кислота. Все упомянутые здесь молекулы нуклеиновых кислот могут представлять собой, например, РНК, ДНК или кДНК.
Применяемые при реализации способа молекулы нуклеиновых кислот, например, молекула нуклеиновой кислоты с последовательностью нуклеотидов SEQ ID NO 1 или ее частью, можно изолировать, применяя стандартные технологии молекулярной биологии и предоставленную здесь информацию о последовательностях. Кроме того, с помощью алгоритмов сравнения, которые представлены, например, на странице Национального центра биотехнологической информации (NCBI) http://www.ncbi.nlm.nih.gov, определить, например, гомологичную последовательность или гомологичные консервированные участки последовательностей на уровне ДНК или аминокислот. Основные части этой последовательности или всю гомологичную последовательность можно, применяя стандартные методики гибридизации (как описано, например, в Sambrook et al., см. выше), использовать для изоляции прочих полезных для реализации способа последовательностей нуклеиновых кислот из других организмов путем скрининга банков кДНК и/или генома. Кроме того, молекулу нуклеиновой кислоты, содержащую всю последовательность, соответствующую SEQ ID NO 1, или ее часть, можно выделить с помощью полимеразной цепной реакции, причем для этого применяют олигонуклеотидный праймер на основе приведенных здесь последовательностей или их частей (например, молекулу нуклеиновой кислоты, содержащую всю последовательность или ее часть, можно выделить с применением олигонуклеотидного праймера, созданного на основе такой же последовательности). Например, из клеток можно выделить иРНК (например, методом экстракции с гуанидинтиоцианатом по Chirgwin et al. (1979) Biochemistry 18: 5294-5299), а на ее основе с помощью обратной транскриптазы (например, обратной транскриптазы вируса лейкемии мышей (MLV) Молони, распространяется Gibco/BRL, Bethesda, MD или обратной транскриптазы вируса миелобластоза птиц (AMV), распространяется Seikagaku Amerika, Inc., St. Petersburg, FL) синтезировать кДНК. Синтетические олигонуклеотидные праймеры для амплификации с помощью полимеразной цепной реакции можно создать на основе последовательности нуклеиновой кислоты, представленной в SEQ ID NO 1, или с помощью последовательности аминокислот, представленной в SEQ ID NO 2. Нуклеиновую кислоту согласно изобретению можно подвергнуть амплификации с применением кДНК или, в качестве альтернативы - геномной ДНК в качестве матрицы и надлежащего олигонуклеотидного праймера посредством стандартных технологий амплификации ПЦР. Амплифицированную таким образом нуклеиновую кислоту можно клонировать с созданием подходящего вектора и охарактеризовать с помощью анализа последовательностей ДНК (секвенирования). Олигонуклеотиды, соответствующие последовательности нуклеотидов, кодирующей белок согласно изобретению, можно синтезировать с помощью стандартных способов синтеза, например, с помощью автоматического устройства синтеза ДНК.
Под понятием "идентичности последовательностей" двух нуклеиновых кислот подразумевают идентичность последовательностей нуклеиновых кислот в каждом случае по всей длине последовательности, в предпочтительной форме исполнения - по всей длине экспрессируемой последовательности, еще более предпочтительно - по кодирующей последовательности (предпочтительно CDS), которую рассчитывают с помощью программного алгоритма GAP (Wisconsin Package Version 10.0, University of Wisconsin, Genetics Computer Group (GCG), Madison, USA; Altschul et al. (1997) Nucleic Acids Res. 25: 3389ff), задавая следующие параметры:
значимость пробела (Gap Weight): 50
значимость длины (Length Weight): 3
среднее соответствие: 10
среднее несоответствий: 0.
Например, последовательность, гомологичная последовательности нуклеиновой кислоты с SEQ ID NO 1 по меньшей мере на 80%, при сравнении с последовательностью SEQ ID NO 1 с использованием вышеуказанного программного алгоритма с приведенными выше параметрами демонстрирует гомологичность, составляющую по меньшей мере 80%.
В одной из форм исполнения настоящее изобретение касается последовательностей нуклеиновых кислот, демонстрирующих идентичность последовательности, приведенной под SEQ ID NO 1, составляющую по меньшей мере 60%, предпочтительно - по меньшей мере 65, 70, 75 или 80%, особо предпочтительно - по меньшей мере 82, 84, 86, 88 или 90%, а наиболее предпочтительно - по меньшей мере 92, 94, 96, 98 или 99%.
Под "идентичностью двух белков" подразумевают идентичность аминокислот на определенном участке белка, предпочтительно - по всей длине белка, в особенности - идентичность, которую рассчитывают сравнением с применением программного обеспечения, например, программного пакета Lasergene производства фирмы DNA Star Inc., Madison, Wisconsin (США), используя методику CLUSTAL (Higgins et al. (1989) Comput. Appl. Biosci. 5(2): 151). Гомологию также можно рассчитывать с применением программного пакета Lasergene производства фирмы DNA Star Inc., Madison, Wisconsin (США), используя методику CLUSTAL (Higgins et al. (1989) Comput. Appl. Biosci. 5(2): 151).
Предпочтительно под "идентичностью двух белков" подразумевают идентичность аминокислотных последовательностей, предпочтительно - в каждом случае по всей длине последовательности, которую рассчитывают путем сравнения с помощью программного алгоритма GAP (Wisconsin Package Version 10.0, University of Wisconsin, Genetics Computer Group (GCG), Madison, USA), задавая следующие параметры:
значимость пробела (Gap Weight): 8
значимость длины (Length Weight): 2
среднее соответствие: 2,912
среднее несоответствий: -2,003.
"Стандартные условия гибридизации" следует понимать в широком смысле, в зависимости от применения это означает обязательные или менее обязательные условия гибридизации. В числе прочего такие условия гибридизации описаны у Sambrook and Russell, Molecular Cloning - A Laboratory Manual, 3. Auflage, Cold Spring Harbor Laboratory Press, 2001) или в Current Protocols in Molecular Biology, John Wiley &Sons, N.Y. (1989), 6.3.1-6.3.6..
Специалист выбирает условия гибридизации, позволяющие ему различать специфическую и неспецифическую гибридизацию.
Например, условия на этапе отмывки можно выбирать из условий меньшей строгости (примерно с 2Х SSC (Na-цитратный буфер) при 50°С) и таковыми высокой строгости (примерно 0.2Х SSC при 50°С, предпочтительно при 65°С) (20Х SSC: 0,3 М цитрата натрия, 3 М NaCl, pH 7,0). Кроме того, во время этапа отмывки можно повышать температуру: от менее строгих условий - примерно при 22°С - до более строгих условий, примерно при 65°С. Оба параметра - концентрацию соли и температуру - можно варьировать одновременно или по отдельности, причем в каждом случае другой параметр поддерживают на постоянном уровне. Во время гибридизации можно также применять денатурирующие агенты, как, например, формамид или ДСН. В присутствии 50% формамида гибридизацию предпочтительно проводить при 42°С. Ниже приведены примеры условий для гибридизации и этапа отмывки:
(1) Условия гибридизации можно, например, выбирать из нижеследующих вариантов условий:
а) 4Х SSC при 65°С,
b) 6X SSC при 45°С,
c) 6X SSC, 100 мкг/мл денатурированной фрагментированной ДНК из рыбьих молок при 68°С,
d) 6X SSC, 0,5% ДСН 100 мкг/мл денатурированной фрагментированной ДНК из рыбьих молок при 68°С,
e) 6X SSC, 0,5% ДСН 100 мкг/мл денатурированной фрагментированной ДНК из рыбьих молок, 50% формамида при 42°С,
f) 50% формамида, 4Х SSC при 42°С,
g) 50% (об./об.) формамида, 0,1% бычьего сывороточного альбумина, 0,1% фиколла, 0,1% поливинилпирролидона, 50 мМ натриево-фосфатного буфера, рН 6,5, 750 мМ NaCl, 75 мМ цитрата натрия при 42°С,
h) 2X или 4Х SSC при 50°С (нестрогие условия),
i) от 30 до 40% формамида, 2X или 4Х SSC при 42°С (нестрогие условия).
j) 500 мМ натриево-фосфатного буфера, рН 7,2, 7% ДСН (додецилсульфат натрия) (г/об.), 1 мМ ЭДТА, 10 мкг/мл одночепочечной ДНК, 0,5% БСА (г/об.) (Church and Gilbert (1984) Proc. Natl. Acad. Sci. U.S.A. 81(7): 1991-1995).
(2) Условия отмывки можно, например, выбирать из нижеследующих вариантов условий:
a) 0,015 М NaCl/0,0015 М цитрата натрия/0,1% ДСН при 50°С,
b) 0,1 Х SCC при 65°С,
c) 0,1Х SSC, 0,5% ДСН при 68°С,
d) 0,1Х SSC, 0,5% ДСН, 50% формамида при 42°С,
e) 0,2Х SSC, 0,1% ДСН при 42°С,
f) 2X SSC при 65°С (нестрогие условия).
В одном из вариантов исполнения условия гибридизации выбирают следующим образом.
Выбирают буфер гибридизации, содержащий формамид, NaCl и ПЭГ 6000. Присутствие формамида в буфере гибридизации дестабилизирует двухцепочечные молекулы нуклеиновых кислот, благодаря чему температуру гибридизации можно понизить до 42°С, не снижая этим строгость условий. Применение соли в буфере гибридизации повышает степень ренатурации дуплекса или эффективность гибридизации. Хотя ПЭГ повышает вязкость раствора, что оказывает отрицательное влияние на степень ренатурации, но благодаря присутствию в растворе полимера возрастает концентрация зонда в оставшейся среде, что повышает степень гибридизации. Состав буфера следующий:
| Буферный раствор гибридизации | |
| 250 мМ буферный раствор на основе фосфата натрия рН 7,2 | |
| 11 мМ ЭДТА | |
| 17% ДСН (г/об.) | |
| 250 мМ NaCl | |
| 10 мкг/мл одноцепочечной ДНК | |
| 5% полиэтиленгликоля (ПЭГ) 6000 | |
| 40% формамида |
Гибридизацию проводят в течение ночи при 42°С. Фильтры отмывают на следующее утро трижды 3х, используя 2×SSC и 0,1% ДСН - по 10 минут.
Последовательности нуклеиновых кислот, отличающиеся от последовательности, приведенной под SEQ ID NO 1, можно получить, осуществляя в последовательности нуклеотидов SEQ ID NO 1 замещение, добавление или делеции нуклеотидов так, чтобы возникали белки, в которых по сравнению с последовательностью, приведенной под номером SEQ ID NO 2, имеют место замещение, добавление или делеция одной или нескольких аминокислот. Мутации можно вводить в последовательность SEQ идент. №1 посредством стандартных методик, например, мутагенеза, специфичного по положению, и мутагенеза, опосредованного ПЦР. Предпочтительно осуществлять консервативные замещения аминокислот в одном или нескольких предсказанных остатках несущественных аминокислот, т.е. остатков аминокислот, не влияющих на активность киназы и/или на домен LRR. При "консервативном замещении аминокислот" остаток аминокислоты заменяют на остаток аминокислоты со схожей боковой цепью. В этой области работы определены семейства аминокислотных остатков со схожими боковыми цепями. К этим семействам относятся аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота и глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан). Таким образом, в белке, применяемом согласно изобретению, предпочтительно заменять предсказанный несущественный аминокислотный остаток на другой аминокислотный остаток из того же семейства по признаку боковых цепей. В качестве альтернативы при другой форме исполнения мутаций можно случайным образом вводить мутации по всей длине или части длины последовательности, кодирующей белок согласно изобретению, например, проверяя их с точки зрения способности сообщать резистентность к патогенным воздействиям.
Под понятием "фрагменты ДНК" в том смысле, в котором его применяют здесь, подразумевают части ДНК, кодирующие белок согласно изобретению, биологическая активность которых состоит в том, чтобы обеспечивать повышение резистентности к патогенным воздействиям. Предпочтительно, чтобы фрагменты ДНК кодировали белок с активностью киназы или с доменом LRR, особо предпочтительно - с обоими признаками, причем чтобы белки, кодируемые фрагментами ДНК, в основном обладали той же активностью киназы и/или имели тот же домен LRR, что и белки, кодируемые полноценной последовательностью ДНК, и чтобы с помощью этих фрагментов можно было добиться повышения резистентности трансгенных растений к патогенным воздействиям согласно изобретению.
Под понятием "фрагменты белка" в том смысле, в котором его применяют здесь, подразумевают части белка, биологическая активность которых состоит в том, чтобы обеспечивать повышение резистентности к патогенным воздействиям (предпочтительно - резистентности к патогенным грибкам) у растений. Предпочтительно, чтобы фрагменты белка обладали активностью киназы или содержали домен LRR, особо предпочтительно - обладали бы обоими признаками, причем чтобы фрагменты белка в основном обладали той же активностью киназы и/или имели тот же домен LRR, что и белки, имеющие полную длину, и чтобы с помощью этих фрагментов можно было добиться повышения резистентности трансгенных растений к патогенным воздействиям согласно изобретению.
Под "в основном одинаковой ферментативной активностью" применяемого в способе согласно изобретению белка с киназной активностью подразумевают, что ферментативная активность составляет по сравнению с ферментами, кодируемыми последовательностью с номером SEQ ID NO 1 или ее производными, по меньшей мере, 50%, предпочтительно - по меньшей мере, 60%, особо предпочтительно - по меньшей мере, 70%, в частности предпочтительно - по меньшей мере, 80%, а наиболее предпочтительно - по меньшей мере 90%. Таким образом, белки с активностью киназы, имеющие в основном одинаковую ферментативную активность, также пригодны для формирования повышенной резистентности трансгенных растений к патогенным воздействиям.
Киназную активность белков можно определить простыми методами, которые известны специалисту и которые обозначают как количественный анализ киназы (Kinase-assay). Для этого, например, подлежащий исследованию белок, который очищают, например, иммунопреципитацией, инкубируют в подходящем буферном растворе с АТФ, снабженным радиоактивной меткой, в качестве донора фосфата и надлежащим субстратом, а затем отделяют субстрат с помощью полиакриламидного геля с ДСН. Если белок обладает активностью киназы, то субстрат получает метку фосфата (в свою очередь, имеющего радиоактивную метку), а радиоактивность можно обнаружить и количественно определить с помощью соответствующих методик.
Повышения резистентности к патогенным воздействиям согласно изобретению можно также добиться, изменяя экспрессию эндогенного, собственного белка растения, который соответствует белку согласно изобретению. Таким образом, это собственный белок растения, сообщающий повышение резистентности к патогенным воздействиям и предпочтительно обладающий активностью киназы или доменом LRR, а особо предпочтительно - обоими признаками. Это изменение экспрессии белка можно обеспечить, например, изменяя последовательность промоторной ДНК гена, кодирующего белок. Такое изменение, имеющее следствием измененный, предпочтительно - повышенный уровень экспрессии эндогенного гена согласно изобретению, можно осуществить путем делеции или инсерции последовательностей ДНК. Изменение промоторной последовательности эндогенных генов согласно изобретению, как правило, ведет к количественному изменению экспрессии гена и, таким образом, например, к изменению регистрируемой в клетке или в растениях активности киназы (если белок обладает киназной активностью). Изменение промоторной последовательности эндогенного гена согласно изобретению может также вести к изменению в клетке количества белка с доменом LRR.
Еще одна возможность для повышения активности и содержания эндогенных белков согласно изобретению состоит в том, чтобы регуляторными средствами повысить активность факторов транскрипции, участвующих в транскрипции эндогенных генов, например, повышенной экспрессией. Способы повышения экспрессии факторов транскрипции известны специалисту, а также изложены в рамках настоящего изобретения для белков согласно изобретению.
Кроме того, повышенной экспрессии эндогенного гена согласно изобретению можно также добиться, вызывая взаимодействие с промотором таких генов регуляторного белка, не встречающегося в исходном (неизмененном) организме. Такой регулятор может представлять собой химерный белок, состоящий из домена связывания ДНК и домена активатора транскрипции, как это описано, например, в международной заявке WO 96/06166.
"Трансгенный" в отношении, например, последовательности нуклеиновых кислот, кассеты экспрессии или вектора, содержащих указанную последовательность нуклеиновых кислот, или организма, преобразованного указанной последовательностью нуклеиновых кислот, кассетой экспрессии или вектора, означает все возникшие с помощью генно-инженерных методик конструкции или организмы, в которых либо
a) последовательность нуклеиновых кислот RNR8, или
b) генетическая контрольная последовательность, например, промотор, функционально связанная с последовательностью нуклеиновых кислот RNR8, или
с) (а) и (b)
находятся не в своем естественном генетическом окружении или были изменены генно-инженерными методами, причем к примерам изменения относятся замещение, добавление, делеция или инсерция одного или нескольких нуклеотидных остатков. "Естественное генетическое окружение" означает естественный хромосомный локус в организме происхождения или наличие в геномной библиотеке. В случае геномной библиотеки естественное генетическое окружение последовательности нуклеиновых кислот предпочтительно, по меньшей мере, частично сохранено. Окружение фланкирует последовательность нуклеиновых кислот, по меньшей мере, с одной стороны, а длина его последовательности составляет, по меньшей мере, 50 пар оснований (bp), предпочтительно, по меньшей мере, 500 bp, особо предпочтительно, по меньшей мере, 1000 bp, крайне предпочтительно - по меньшей мере, 5000 пар оснований. Природную кассету экспрессии - например, встречающееся в природе сочетание промотора RNR8 с соответствующим геном RNR8 - превращается в трансгенную кассету экспрессии, если ее изменяют иными, нежели природные, синтетическими ("искусственными") способами, например, мутагенезом. Соответствующие способы описаны (патент США US 5565350; международная заявка WO 00/15815).
В рамках изобретения "введение" означает все способы, пригодные для того, чтобы ввести последовательность нуклеиновых кислот RNR8 прямым или непрямым образом в растение или в клетку, компартмент, ткань, орган или зародыш такового, либо же сформировать ее там. Введение может вести к временному (преходящему) или постоянному (стабильному) присутствию последовательности нуклеиновых кислот RNR8.
Под "введением" подразумевают, например, такие способы как трансфекция, трансдукция или трансформация.
Введение кассеты экспрессии согласно изобретению в организм или его клетки, ткани, органы, части или зародыш (предпочтительно в растения или растительные клетки, ткани, органы, части или зародыш) целесообразно осуществлять с применением векторов, содержащих кассеты экспрессии. Кассету экспрессии можно вводить в вектор (например, в плазмиду) через надлежащий участок рестрикции. Полученную плазмиду сначала вводят в клетки E.coli. Клетки E.coli, корректно прошедшие трансформацию, отбирают, выращивают и получают рекомбинантную плазмиду с помощью знакомых специалисту методов. Для проверки этапа клонирования можно использовать рестрикционный анализ и секвенирование.
Векторы могут представлять собой, например, плазмиды, космиды, фаги, вирусы или же агробактерии. В предпочтительной форме исполнения введение кассеты экспрессии осуществляют с помощью плазмидных векторов. Предпочтительны такие векторы, которые дают возможность стабильно интегрировать кассету экспрессии в геном хозяина.
Создание измененного организма (или измененной клетки) требует введения соответствующих молекул ДНК в соответствующую клетку хозяина, а затем образования соответствующих РНК и белков посредством экспрессии гена.
Имеется множество методов, позволяющих осуществить этот процесс, называемый трансформацией или трансдукцией либо же трансфекцией (Keown et al. (1990) Methods in Enzymology 185: 527-537). Так, в качестве примера, ДНК или РНК можно ввести непосредственно - посредством микроинъекции или бомбардировки микрочастицами, покрытыми ДНК. Также возможно повысить проницаемость [стенок] клетки (пермебилизация), например, с помощью полиэтиленгликоля, так что ДНК может проникнуть в клетку путем диффузии. Также можно ввести ДНК в клетку путем слияния протопластов с другими объектами, содержащими ДНК, например, миниклетками, клетками, лизосомами или липосомами. Еще один подходящий метод введения ДНК - это электропорация, при которой с помощью электрического импульса вызывают обратимую пермеабилизацию клетки. Описания соответствующих методик имеются (например, в Bilang et al. (1991) Gene 100: 247-250; Scheid et al. (1991) Mol. Gen. Genet. 228: 104-112; Guerche et al. (1987) Plant Science 52: 111-116; Neuhause et al. (1987) Theor. Appl. Genet. 75: 30-36; Klein et al. (1987) Nature 327: 70-73; Howell et al. (1980) Science 208: 1265; Horsch et al. (1985) Science 227: 1229-1231; DeBlock et al. (1989) Plant Physiology 91: 694-701; Methods for Plant Molecular Biology (Weissbach and Weissbach, eds.) Academic Press Inc. (1988); and Methods in Plant Molecular Biology (Schuler and Zielinski, eds.) Academic Press Inc. (1989)).
При этом в растениях описанные методы трансформации и регенерации растений из растительных тканей или растительных клеток используют для преходящей или стабильной трансформации. Подходящие методы - это прежде всего трансформация протопластов путем индуцированного полиэтиленгликолем поглощения ДНК, биолистический способ с генетической пушкой, так называемая "бомбардировка частицами", электропорация, инкубация сухих эмбрионов в содержащем ДНК растворе и микроинъекция.
Помимо использования этих "прямых" методик трансформации, можно также провести трансформацию с помощью бактериальной инфекции посредством Agrobacterium tumefaciens или Agrobacterium rhizogenes. Методики описаны, например, Horsch et al. (1985) Science 225: 1229f.
Если применяют агробактерии, то кассету экспрессии необходимо интегрировать в специальные плазмиды, которые представляют собой либо промежуточный вектор (английское название: shuttle or intermediate vector), либо бинарный вектор. Если для трансформации используют Ti- или Ri-плазмиду, то по крайней мере правая граница, а в большинстве случаев, однако, как правая, так и левая границы Т-ДНК Ti- или Ri-плазмиды соединены с подлежащей вводу кассетой экспрессии в качестве фла