Сополимеры гетероцепных алифатических поли-n-оксидов, вакцинирующие и лекарственные средства на их основе
Иллюстрации
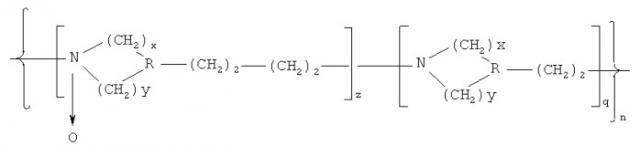
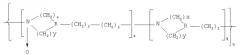
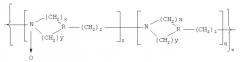
Показать всеИзобретение относится к новым высокомолекулярным соединениям, обладающим биологической активностью. Сополимеры гетероцепных алифатических поли-N-оксидов описываются общей формулой (I):
где R=N, СН; х=2-4; у=0, 2; n=10-1000; q=(0,1-0,9)n; z=(0,1-0,9)n. Сополимеры обладают антиоксидантным действием, терапевтическим действием в качестве детоксиканта и иммуномодулирующего агента. Сополимеры формулы (I) могут быть использованы в качестве иммуномодулирующего носителя для получения вакцинирующего средства и в качестве носителя лекарственных веществ для получения лекарственных средств. Сополимеры гетероцепных алифатических поли-N-оксидов представляют собой новый класс соединений, обладающих широким спектром фармакологического и вакцинирующего действия, направленных на повышение безопасности в применении, а также на повышение технологичности, экономичности и экологической безопасности производства лекарственных препаратов. 5 н. и 15 з.п. ф-лы, 2 ил., 13 табл.
Реферат
Изобретение относится к области синтеза новых высокомолекулярных химических соединений, обладающих биологической активностью, и может быть использовано при производстве высокоэффективных фармакологических препаратов и вакцин.
Известны синтетические полимеры, обладающие физиологической активностью, например, гомо- и сополимеры акриловой и метакриловой кислот, сополимеры N-винилпирролидона с акриловой и кротоновой кислотами, акролеином, виниламином, малеиновым ангидридом и другими виниловыми мономерами (Полимеры в медицине, перевод с англ. под ред. Плате Н.А., М., 1969, стр.38-76). Известны также некоторые водорастворимые производные карбоцепных полимеров (Платэ Н.А., Васильев А.Е., «Физиологически активные полимеры», М., Химия, 1986, стр.12-204; «Полимеры медицинского назначения», под ред. Сэноо Маноу, пер. с яп., M., 1981, 248 стр.), содержащие азот в боковой цепи макромолекулы, такие, как поливинилпиридины или поливинилтриазолы. Все вышеупомянутые соединения токсичны и не находят широкого применения в качестве фармакологических препаратов. Кроме того, карбоцепные полимеры не распадаются в организме на низкомолекулярные соединения, накапливаются и вызывают нежелательные побочные эффекты.
Наиболее близкими соединениями по биологическому действию и химической сущности к описываемому изобретению являются производные поли 1,4-этиленпиперазина (патент РФ №2073031, МКИ C08G 73/02, опубл. 1997 г.). Известные соединения характеризуются широким спектром фармакологического действия и успешно находят применение в качестве носителей вакцинных антигенов или лекарственных препаратов, а также в комплексной терапии заболеваний, сопровождающихся иммунодефицитными состояниями. В то же время наличие ионогенных групп в этих соединениях уменьшают скорость деструкции и выведения их из организма, что ограничивает их применение для внутривенного введения в качестве детоксиканта при необходимости быстрого выведении высокотоксичных соединений. Кроме того, технология получения известных соединений предполагает многоэтапный процесс, связанный с высоким расходом дорогостоящих химических реактивов, требующий значительных энергетических мощностей и трудовых затрат.
Технический результат настоящего изобретения состоит в создании нового класса соединений, обладающих широким спектром фармакологического и вакцинирующего действия, обладающих выраженными антиоксидантными и детоксикациоными свойствами и безопасных в применении, а также в повышении технологичности, экономичности и экологической безопасности производства лекарственных препаратов.
Указанный технический результат достигается соединениями, представляющими собой сополимеры гетероцепных алифатических поли-N-оксидов общей формулы (I):
где R=N, CH;
х=2-4; y=0, 2; n=10-1000; q=(0,1-0,9)n; z=(0,1-0,9)n,
обладающими фармакологической активностью.
является сополимером триэтилендиамина и N-оксида триэтилендиамина.
Сополимер формулы 1 обладает антиоксидантным действием.
Сополимер формулы 1 обладает терапевтическим действием и может представлять собой детоксикант.
Сополимер формулы 1 обладает терапевтическим действием и может представлять собой иммуномодулирующий агент.
Сополимер формулы 1 может быть иммуноадъювантом.
Сополимер формулы 1 может быть иммуномодулирующим носителем антигена или носителем лекарственного вещества.
Указанный технический результат достигается также тем, что вакцинирующее средство, включающее антиген и иммуномодулирующий носитель, содержит в качестве иммуномодулирующего носителя сополимер формулы 1.
При этом вакцинирующее средство может представлять собой конъюгат антигена с сополимером по п. 1 при наличии в структуре антигена реакционноспособных функциональных групп.
Вакцинирующее средство может представлять собой соединение, полученное в результате реакции комплексообразования антигена с сополимером формулы 1.
Вакцинирующее средство может представлять собой композицию, полученную в результате смешивания антигена с сополимером формулы 1.
Указанный технический результат достигается также тем, что вакцина против гепатита «А» и гепатита «В» характеризуется тем, что она содержит вакцинный препарат, включающий одновременно АГ ВГА и HBsAg или вакцинные препараты против гепатита А и против гепатита В и сополимер гетероцепных алифатических поли-N-оксидов по п.1.
При этом вакцина против гепатита «А» и гепатита «В» может содержать в качестве АГ ВГА антигены, полученные из штамма ЛБА-86 вируса гепатита А в культуре перевиваемых клеток 4647, а содержание компонентов в дозе составляет
| АГ ВГА | 40-60 ИФА ед. |
| HbsAg | 2,5-20 мкг |
| СП-МО | 0,1-10 мг |
Указанный технический результат достигается также тем, что вакцинная композиция, включающая вакцинный препарат и иммуноадъювант, содержит в качестве иммуноадъюванта сополимер по п.1.
Указанный технический результат достигается также тем, что лекарственное средство, включающее лекарственное вещество и носитель, содержит в качестве носителя сополимер формулы 1.
Лекарственное средство может представлять собой конъюгат лекарственного вещества с сополимером формулы 1 при наличии в структуре лекарственного вещества реакционноспособных функциональных групп.
Лекарственное средство может представлять собой соединение, полученное в результате реакции комплексообразования лекарственного вещества с сополимером формулы 1.
Лекарственное средство может представлять собой фармацевтическую композицию, полученную в результате смешивания лекарственного вещества с сополимером формулы 1.
Сополимеры гетероцепных алифатических поли-N-оксидов в соответствии с формулой 1 (СП-NO) обладают фармакологическим действием и, прежде всего, проявляют выраженные антиоксидантные и детоксикационные свойства, иммуномодулируюшую, антивирусную и антибактериальную активности, биогенны, поскольку являются аналогами продуктов естественного окислительного метаболизма природных гетероцепных полиаминов и применимы для создания безопасных для живого организма лекарственных препаратов.
СП-NO биодеструктируют в организме на олигомерные и низкомолекулярные соединения и полностью выводятся из организма. Благодаря собственной физиологической активности на основе соединений в соответствии с изобретением могут быть созданы высокоэффективные безбалластные фармакологические системы. Наличие свободных реакционноспособных третичных атомов азота в описываемом соединении открывает широкие возможности их модификации для введения новых реакционноспособных групп в боковую цепь СП-NO с последующим использованием их в качестве носителей для конъюгированных вакцин, ферментов, различных лекарственных препаратов. Получение конъюгированных соединений на основе СП-NO возможно только при наличии реакционноспособных групп у вакцинных антигенов, ферментов, лекарственных препаратов.
Описываемые сополимеры характеризуются уникальной адсорбционной способностью, которая обусловлена совокупностью физико-химических свойств этих соединений, а именно:
- широкий диапазон молекулярных масс, включая высокие молекулярные массы;
- наличие множества слабо заряженных N-оксидных групп в основной цепи макромолекулы и, как следствие, способность образования равновесных электростатических комплексов с другими молекулами;
- высокая полярность (дипольный момент N-O-связи составляет около 5 Д, что почти на порядок превышает дипольный момент других связей), обеспечивающая образование стабильных электростатических макромолекулярных комплексов;
- образование хелатных комплексов с металлами и, как следствие, эффективная защита клеточных мембран.
СП-NO имеют в структуре N-оксидные группы. С химической точки зрения N-оксидные соединения отличаются от других соединений самой высокой полярностью (дипольный момент N-оксида около 5 Д, в то время как дипольный момент исходного полиамина 0,65 Д). Этим обусловлена их уникальная способность сорбировать различные токсические соединения, металлы и др., а затем выводить их из организма. Именно высокой адсорбционной способностью и полимерной природой обусловлены выраженные детоксикационные свойства этих соединений.
Благодаря этим свойствам описываемые соединения адсорбируют различные токсические вещества, в том числе металлы, продукты метаболизма и др., а затем выводят их из организма. Именно адсорбционной способностью и полимерной природой обусловлены выраженные детоксикационные и мембранопротекторные свойства этих соединений.
По своим детоксикационным свойствам сополимеры в соответствии с изобретением в сотни раз превосходят детоксикационные свойства известных соединений того же назначения, таких как гемодез, альбумин, декстран и др. Вместе с тем описываемые сополимеры обладают заметными иммуномодулирующими свойствами - коэффициент стимуляции варьирует в пределах 3÷7.
При создании вакцинирующих и лечебных препаратов нового поколения высокомолекулярный иммуностимулятор - носитель антигенов и аллергенов СП-NO обеспечивает большую стабильность антигенов, усиление иммуногенности при снижении прививочной дозы антигенов, более эффективное формирование иммунологической памяти к антигенам и повышение профилактической эффективности вакцины, а также высокий уровень безопасности вакцины. Модификация антигенов различной природы высокомолекулярным иммуностимулятором СП-NO позволяет усилить иммуногенную активность. Присоединение СП-NO к аллергенам приводит к снижению аллергенной активности, повышению безопасности препарата и уменьшению риска возникновения осложнений при введении их в сенсибилизированный организм. Связывание аллергенов с СП-NO дает возможность значительно усилить иммунный ответ, стимулировать высокий уровень выработки аллерген-специфических IgG-антител, обеспечивающих защиту больных аллергией при попадании аллергенсодержащих веществ в его организм.
В качестве носителей других фармакологически активных соединений СП-NO могут быть использованы путем их ковалентного связывания, при этом ковалентное связывание достигается введением химически высокореакционных групп.
Оценка иммуногенных и протективных свойств полученных конъюгатов СП-NO с различными антигенами и в том числе с гемагглютинином вируса гриппа (ГА), проводились изучением реакций иммунной системы и организма в целом на экспериментальных животных.
Обнаружено, что при введении конъюгата ГА-СП-NO в организм животного у него индуцируется заметный антительный ответ при однократном введении конъюгата. В ответ на повторное введение развивается вторичный, более интенсивный ответ, максимум достигается через 10-15 дней, он более продолжительный, удерживается на очень высоких значениях даже через 3 месяца после иммунизации. В опытах на животных показана высокая иммуногенность конъюгата в реакции торможения гемагглютинации РТГА. В тесте блокирования размножения живого вируса в куриных эмбрионах выявлена прямая вируснейтрализующая активность образующихся антител. По этим тестам конъюгат не уступает цельновирионной референс-вакцине. При проведении анализа изотипов антител установлено, что образуются антитела IgM, IgA, главным образом IgG, но не IgE. Инициируется формирование иммунной памяти, что говорит о вовлечении Т-клеток в ответ на введение конъюгата, идет накопление Т-хелперов. Что очень важно, индуцируется интенсивное формирование вирус-специфических Т-киллеров.
Производные СП-NO обладают широким спектром фармакологической активности, высокой биодоступностью, способностью к выведению из организма, безопасностью применения.
СП-NO в широком диапазоне доз активирует макрофагальное звено, гуморальный иммунный ответ, обладает антиинфекционной и противоопухолевой активностью, повышает резистентность клеточных мембран к цитотоксическому действию и снижает токсичность лекарственных препаратов при совместном введении.
СП-NO получают в результате химического синтеза путем частичного окисления третичного азота основной цепи макромолекулы исходного алифатического полиамина, содержащего азот в основной цепи в слабокислых водных, водно-спиртовых или спиртовых растворах. В качестве окислителя могут быть использованы перекись водорода и другие органические или неорганические перекиси или гидроперекиси, соли кислородсодержащих галогенокислот, озон, или кислород, полученный электролизом воды.
Синтез проводят при температуре 20 ÷40°С. Растворитель и избыток перекиси удаляют методом ультрафильтрации, затем проводят лиофильное высушивание.
Идентификацию и анализ структуры полученных СП-NO и его производных проводят с помощью методов физико-химического анализа: ЯМР-, ПМР-, ИК-спектроскопии, УФ-спектроскопии. Молекулярно-массовые характеристики получают с использованием хроматографического комплекса, в состав которого входит высокоэффективный жидкостный хроматограф с 4 детекторами - УФ-спектрофотометрия, рефрактометрия, малоугловое лазерное светорассеяние, флуоресцентная спектроскопия.
При получении конъюгатов и комплексов СП-NO с белками и гликопротеидами различной природы, имеющими первичную аминогруппу или карбоксильную группу, в качестве белкового компонента данной реакции могут быть использованы:
- при получении вакцинирующих препаратов - антигенные комплексы, выделяемые из возбудителя гепатита А, В, С, туберкулеза, сибирской язвы, холеры, брюшного тифа, коклюша, дифтерии, столбняка, пиогенных инфекций;
- при получении лекарственных препаратов пролонгированного действия с повышенным уровнем безопасности и эффективности - эритропоэтины, цитокины, интерфероны, ферменты, цитостатики, антибиотики, гормоны, витамины;
- при получении средств специфической иммунотерапии - аллергены и аллергоиды, выделяемые из пыльцы растений и трав, домашней пыли, пищевых продуктов и др.
В каждом конкретном случае варьируются условия проведения реакции - соотношение компонентов, pH, температура проведения реакции, продолжительность процесса, концентрация реагентов в реакционной смеси, что влияет на выход и состав получаемого препарата.
Для использования СП-NO как носителя различных фармакологически активных соединений могут быть применены методы связывания комплексообразованием за счет многоточечных электростатических взаимодействий компонентов или ковалентное связывание.
Если антигены - индивидуальные соединения с известным химическим строением и структурой - Ви-антиген, гемагглютинин, ферменты и т.д., целесообразно выбирать ковалентное связывание. Если это смесь различных веществ, предпочтительно осуществлять связывание комплексообразованием, в том числе с использованием полимер-антиген-металлических комплексов.
В случае разноименно заряженных соединений комплексообразование в определенных условиях происходит с высокими скоростью и выходом. В случае одноименно заряженных компонентов предпочтительны методы получения с образованием полимер-антиген-металлических комплексов. Например, в конкретном случае с использованием в качестве аллергоида пыльцы тимофеевки или березы, которые не является индивидуальным соединением. При связывании аллергоида с СП-NO оба соединения имеют слабый отрицательный заряд, т.е. заряжены одноименно. В этом случае выбирают реакцию комплексообразования с использованием полимер-металлических комплексов.
Основными критериями при этом являются безопасность, эффективность и технологичность процессов синтеза соединений и получения фармакологических препаратов.
Сравнение различных методов связывания выявило преимущества именно образования тройных полимер-антиген-металлических комплексов. Технологичность исключительно высокая - на фоне предварительного комплексообразования двух соединений добавляют расчетное количество соли меди с образованием «скрепок» между молекулами, что обуславливает устойчивость комплекса при физиологических условиях.
Образование тройных полимер-металлических комплексов на основе СП-NO и ионов переходных металлов и антигенов или аллергенов оказалось одним из оптимальных способов, при котором достаточно прочное связывание антигена и полимерного носителя не сопровождается изменением их химической структуры и, как следствие этого, спектра биологического действия компонентов, не приводит к появлению токсичных побочных продуктов реакции и имеет ряд технологических преимуществ, т.к. способ получения тройных полимер-металлических комплексов прост, технологичен, протекает в одну стадию в мягких условиях и со 100% выходом.
В создаваемых вакцинных или фармацевтических композициях иммуномодулирующее, антиинфекционное и противовоспалительное действие обусловлено сочетанием физиологической активности СП-NO с активностью компонентов.
Представленные ниже примеры иллюстрируют возможность получения сополимеров в соответствии с настоящим изобретением и результаты изучения их свойств
В нижеследующих примерах 1-5 приведены примеры синтеза конкретных СП-NO; примеры 6-13 иллюстрируют изучение фармакологических свойств СП-NO; в примерах 14-20 представлена возможность получения конъюгатов и комплексов производных СП-NO с различными физиологически активными компонентами, приводящие к образованию вакцинных и фармацевтических композиций на их основе.
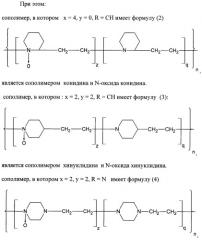
В примерах 1-3 показаны варианты синтеза СП-NO при использовании трех исходных гетероцепных алифатических полиаминов, соответственно поли-1,2-конидина СП-NO-1, поли-1,4-хинуклидин CII-NO-2, поли-1,4-триэтилендиамин СП-NO-3.
Пример 1. Синтез сополимера конидина и N-оксида конидина (СП-NO-1-1).
Для синтеза сополимера используют гетероцепный алифатический полиамин поли-1,2-конидин.
10 г исходного полиамина с ММ 70000 Д растворяют в 300 мл 96%-ного этилового спирта. Раствор охлаждают до температуры 4÷6°С и при одновременном перемешивании добавляют 20 мл 30%-ной перекиси водорода. Реакцию окисления полиамина проводят в течение 10 часов, после чего часть растворителя удаляют в вакууме и добавляют 300 мл воды. Удаление непрореагировавшей перекиси водорода проводят с помощью ультрафильтрационной установки «Пеликон». Полученный раствор сополимера конидина и N-оксида конидина концентрируют и высушивают на лиофилизационой установке. После высушивания выход целевого продукта составляет 99%, n=620, q=0,35n, z=0,65n.
Данные элементного анализа:
Вычислено, %: С 66,3; Н 10,24; N11,20.
Получено, %: С 66,4; Н 10,31; N 11,22.
Характеристическая полоса соединения, полученная в результате анализа методом ИК-спектрометрии
составляет 960 см-1 и 1130 см-1.
Пример 2. Синтез сополимера 1,4-хинуклидин и N-оксида 1,4-хинуклидина (СП-NO-2-1).
Поли-1,4-хинуклидин с ММ 75000 Д 10 г растворяют в 150 мл 0,1N уксусной кислоты. При охлаждении (4°С) и размешивании добавляют 10 мл 30%-ной перекиси водорода. Раствор выдерживают в этих условиях 24 часа. Затем раствор подвергают ультрафильтрации для удаления избытка перекиси водорода и уксусной кислоты. Водный раствор сополимера высушивают лиофилизацией.
Характеристическая полоса соединения, полученная в результате анализа методом ИК-спектрометрии, составляет 960 см-1 и 1130 см-1.
Выход продукта 100%: n=650, q=0,2n, z=0,8n.
Пример 3. Синтез сополимера 1,4-триэтилендиамина и N-оксида триэтилендиамина (СП-NO-3-1).
10 г исходного полиамина поли-1,4-триэтилендиамина с ММ 80000 Д растворяют в 400 мл уксусной кислоты при pH 5. После растворения полиамина при перемешивании и охлаждении (4-6°С) добавляют 20 мл 30%-ной перекиси водорода. Реакцию проводят в течение 35 часов. После завершения реакции полученный раствор очищают от избытка непрореагировавших компонентов с использованием метода ультрафильтрационной очистки, затем подвергают лиофильному высушиванию. После высушивания выход целевого продукта с характеристиками: n=700, q=0,25n, z=0,75n составляет 100%.
В таблице 1 приведены характеристики (n, q, z и MM) сополимеров конидина и N-оксида конидина (СП-NO-1-1, СП-NO-1-2, СП-NO-1-3), сополимеров 1,4-хинуклидин и N-оксида 1,4-хинуклидина (СП-NO-2-1, СП-NO-2-2, СП-NO-2-3) и сополимеров 1,4-триэтилендиамина и N-оксида триэтилендиамина (СП-NO-3-1, СП-NO-3-2, СП-NO-3-3), полученных по методикам, описанным в примерах, соответственно, 1, 2, и 3 с варьирующимися соотношениями исходных компонентов и параметров реакции.
Пример 4. Изучение фармакокинетики различных видов СП-NO, имеющих радиоактивную метку С13.
Исследование фармакокинетики меченого СП-МО проводят по стандартным методикам при внутримышечном введении лекарственной формы с СП-NO в дозе 20 мг/кг (0,75 МБк/кг) крысам.
Наблюдения за животными показали отсутствие тканевой комуляции препарата. Обнаружена гетерогенность в распределении СП-NO в органах и тканях у самцов и самок. Выведение СП-NO происходит преимущественно в две фазы. Период полувыведения быстрой фазы - 1,5 часа, медленной - 84 часа.
Результаты исследования фармакокинетики СП-NO-1-1, СП-NO-2-1 и Cn-NO-3-1, представленные в таблице 2, показывают, что СП-NO быстро всасывается в системный кровоток и достигает максимальной концентрации уже через 30-50 мин. Период полураспределения составляет около 0,5 часа, период полуэлиминации - 20-46 часов, а среднее время пребывания препарата в организме - порядка 40 часов.
Пример 5. Изучение антиоксидантных свойств СП-NO.
Способность СП-NO подавлять образование активных форм кислорода (АФК) оценивают в системе взаимодействия перекиси водорода с пероксидазой хрена (Reanal). При этом регистрацию образования супероксидных анион-радикалов осуществляют с помощью хемилюминесценции по интенсивности окисления люминола продуктами указанной реакции. Анализ хемилюминесценции проводят на 36-канальной установке «Люфицер-Б» при температуре 37°С.
Предварительно приготавливают среду взаимодействия в составе: физиологический раствор, забуференный фосфатами (pH 7.2÷7,4), люминол (Sigma Chemikal Co. в конечной концентрации 0.6×10-1 М) и взаимодействующие реагенты - перекись водорода (в концентрации до 0,005% и пероксидаза хрена (в конечной концентрации 1 мкг/мл).
Указанное соотношение реагентов обеспечивает сохранение интенсивной хемилюминесценции на уровне 300000 имп/сек на протяжении 40 минут. Готовую смесь размещают в объеме по 500 мкл в пробирках хемилюминографа и регистрируют уровень свечения в течение 5 мин. Затем в соответствующую пробирку добавляют исследуемые вещества (СП-NO-1-1, СП-NO-2-1, СП-NO-3-1, СП-NO-3-2) в объеме 10 мкл. Диапазон исследуемых концентраций составляет от 25 до 250 мкг/мл. При такой процедуре имело место дозозависимое гашение сигнала на 10-90% от исходного уровня. Измерения прекращают по перемещении кривой хемилюминесценции на плато (через 15-20 минут). Для каждой концентрации внесенного вещества высчитывают площадь под кривой и соотносили ее с таковой для контрольных пробирок с физраствором.
Результаты выражают в процентах подавления свободно-радикальной реакции для каждой концентрации исследуемых веществ. Для сравнения антирадикальной активности различных образцов вычисляют концентрацию, при которой происходит подавление активности 50% свободных радикалов.
Данные, представленные на графиках фиг.1, свидетельствуют о том, что добавление в систему радикальной реакции всех исследуемых образцов СП-NO в концентрации 15 мкг/мл приводит к подавлению уровня радикальной реакции в значительно большей степени (на 50%) по сравнению с известным соединением (референс препаратом) в той же дозе (на 30%), что подтверждает высокие антиоксидантные свойства описываемого соединения.
Пример 6. Изучение детоксикационных свойств СП-NO.
Оценку защитных свойств СП-NO проводят на модели острой токсичности.
В исследованиях используют белых мышей - гибридов (модель CBA×C57BL/6F1) массой 18-20 г.
Готовят 0,04%-ные растворы применяемого в экспериментальных исследованиях токсичного для мышей вещества природного происхождения - МРМ с добавлением и без СП-NO в соотношении 1:1 и 1:5. Исследуемые соединения вводят животным однократно, внутрибрюшинно в объеме 0,25 и 0,5 мл соответственно дозам. Животным контрольной группы вводят по 0,5мл физиологического раствора. Наблюдения за животными проводят в течение 21 суток.
Данные, представленные в таблице 3, иллюстрируют защитные свойства СП-NO.
Пример 7. Изучение антидотных свойств СП-NO.
Исследования проводят in vivo при остром отравлении CuSO4. Препараты вводят 7-ми группам животных, из которых животным первой группы вводят физраствор, животным 2-4 групп только CuSO4 в смертельных для животных дозах (мг/кг): 12,5; 25,0 и 50,0, а животным 5-7 групп вводят аналогичные дозы CuSO4 в сочетании с аналогичными дозами СП-NO-3-1.
Результаты исследований, представленные в таблице 4, свидетельствуют о выраженном антидотном действии СП-NO.
При этом установлено, что одновременное введение СП-NO-3-1 в дозе 12,5 мг/кг и выше с тремя смертельными дозами CuSO4 не только защищает животных от гибели, но и предотвращает развитие симптомов интоксикации.
Пример 8. Оценка защитных свойств СП-NO на модели гемолиза эритроцитов.
Исследования проводили на модели кварцевого (SiO2) гемолиза эритроцитов с использованием международного стандарта кварцевой пыли DQ-12 дисперсностью меньше 3 мкм по методу A.David (1976). Кровь человека брали с гепарином, эритроциты трижды промывали в 10-кратном объеме бесцветного раствора Хенкса с последующим центрифугированием при 3000 об/мин в течение 10 мин. Эритроцитарную взвесь ресупендировали до 4%-ной концентрации (10 эритроцитов в 1 мл). Все исследования проводили в 3-5 параллельных пробах. Образцы SiO2 и эритроцитов отбирали при постоянном перемешивании на магнитной мешалке.
1 мл 4%-ной взвеси эритроцитов смешивали с 1 мл исследуемого препарата, добавляли 1 мл 0,3% (3 мг/мл) взвеси SiO2 и инкубировали в течение одного часа при температуре 37°С, осторожно встряхивая пробы через каждые 5 минут. После инкубации во все пробы добавляли по 7 мл буфера, центрифугировали и надосадочную жидкость фотометрировали на СФ-26 при 540 нм. Результаты гемолиза выражали в процентах, принимая за 100% содержание гемоглобина в пробах 1 мл 4%-ной суспензии эритроцитов с 9 мл дистиллированной воды. Защитный эффект исследуемых препаратов рассчитывали по формуле и выражали в процентах:
где
Е540 К sio2 - экстинкция контрольных образцов - в пробирке «вода-кремний-эритроциты»;
Е540 опыт - экстинкция опытных образцов - в пробирке «препарат в буфере-кремний-эритроциты».
Представленные в таблице 5 данные показывают, что двуокись кремния обладает выраженными гемолитическими свойствами. 3 мг SiO2 в течение часа инкубации вызывает гемолиз 87,4% эритроцитов. Инкубация эритроцитов с SiO2 в присутствии 50 мкг СП-NO-3-2 практически полностью защищает эритроциты от гемолиза.
Свойство СП-NO защищать эритроциты от гемолиза сравнивали с высокомолекулярными плазмозамещающими растворами поливинилпирролидона (гемодез), декстрана (полиглюкин) и альбумина. В качестве буфера использовали бесцветный раствор Хенкса.
Поливинилпирролидон и альбумин также обладают защитивши свойствами, но выраженный эффект достигается только в высоких дозах. При этом препарат не деструктирует, может накапливаться в организме и вызывать нежелательные побочные эффекты.
Данные, представленные в таблице 5, убедительно свидетельствуют о выраженных свойствах СП-NO как детоксиканта и об их преимуществах по сравнению с признанными детоксикантами.
Пример 9. Изучение иммуномодулирующей активности СП-NO
Иммуномодулирующую активность СП-NO оценивали по их способности стимулировать антителообразование к эритроцитам барана или антигенам белковой природы (В-субъединица холерного токсина, столбнячный анатоксин) у экспериментальных мышей-гибридов первого поколения, полученных при скрещивании мышей линий СВА и C57BL (модель CBA×C57BL/6F1) путем определения числа антителообразующих клеток (АОК) в селезенке мышей через 4-7 дней после совместного их введения. Постановка опыта согласно общепринятому методу Ерне. Количество АОК в селезенке мышей определяют методом локального гемолиза в агаре. Титры антител, образующихся в ответ на введение белковых антигенов, определяют методом иммуноферментного анализа. Иммуномодулирующую эффективность СП-NO оценивают по отношению числа АОК, образующихся при совместном введении антигенов и СП-NO к числу АОК в группе контрольных животных. Доз варьируется от 1 до 1000 мг/кг на мышь при внутрибрюшинном и подкожном введении.
В таблице 6 приведены значения коэффициента стимуляции в зависимости от конкретного соединения и дозы введения (доза варьировалась от 1 до 1000 мг/мышь при внутрибрюшинном и подкожном введении). Индекс стимуляции иммунного ответа составляет величину от 3 до 7, т.е. сопоставим с известным стандартным токсическим стимулятором - полиакриловой кислотой (ПАК). Эксперименты показали, что существует зависимость величины коэффициента стимуляции от дозы и от состава СП-NO.
Результаты исследования свидетельствуют о высокой иммуномодулирующей активности СП-NO, которая проявляется в широком интервале доз при различных способах введения.
Пример 10. Получение противотуберкулезной вакцины посредством комплексообразования антигенного комплекса, выделяемого из тритонового экстракта микобактерий БЦЖ с СП-NO. Оценка протективных свойств полученного препарата в эксперименте на животных.
Получен и изучен ряд образцов противотуберкулезного вакцинирующего препарата с оптимизированным соотношением антигена и СП-NO-3-1.
В качестве антигена был выбран антигенный комплекс (АК), состоящий из гликопептидов, выделяемых из тритонового экстракта клеточных стенок микобактерий БЦЖ.
Согласно паспортным данным на антиген содержание белка в 1 мг сухого вещества АК составляет 50,2 мкг. Определение белка проводят по Бредфорду.
При получении образцов вакцинирующего препарата исходили из ориентировочных доз по антигену - 100 мкг и 50 мкг АК на мышь, доза по белку соответственно составляла 5 мкг и 2,5 мкг на мышь. Доза СП-NO-3-1 была выбрана на основе ранее полученных результатов и составляла 1000 мкг на мышь. Для получения вакцинирующих препаратов использовали соединение СП-NO-3-1. При определении соотношения компонентов в составе препарата расчеты производились на содержание основного вещества СП-NO-3-1.
Реакцию комплексообразования осуществляют следующим образом.
500 мг СП-NO-3-1 растворяют в 10 мл 0,05 М фосфатного буфера pH 5,8. При температуре 2-4°С добавляют 100 мг раствора АК в 2 мл того же буфера. При данном значении pH макромолекулы полимерного носителя и антигенов заряжены противоположно.
Реакцию комплексообразования проводят медленным введением раствора антигенов в раствор СП-NO-3-1, не допуская выпадения осадка. Повышение растворимости антигенного комплекса в воде осуществляют за счет его комплексообразования с СП-NO. В одном из вариантов (Препарат 1) добавляют раствор фармацевтической композиции СП-NO к антигенному комплексу при постоянном перемешивании и контроле pH. В другом варианте (Препарат 2) проводят объединение растворов антигена и СП-NO при постоянном перемешивании, охлаждении и контроле pH.
После проведения синтеза растворы препаратов подвергают лиофильному высушиванию и контролю.
Определение содержания белка и анализ проводят методами флуоресцентной спектроскопии и электрофореза в полиакриламидном геле (ПААГ). Характеристики двух препаратов, полученных по описываемой методике, приведены в таблице 7.
Протективную активность синтезированных препаратов 1 и 2 оценивают по двум показателям - по высеваемости микобактерий из легких и селезенки зараженных мышей, а также по срокам выживания животных после заражения.
Для иммунизации мышей использованы 3 препарата:
Препарат 1 содержит на 1 дозу 5 мкг антигена и 500 мкг СП-NO;
Препарат 2 содержит на 1 дозу 2.5 мкг антигена и 500 мкг СП-NO;
Препарат 3 содержит на 1 дозу 500 мкг СП-NO.
Мышей иммунизируют препаратами 1, 2 и 3 подкожно в 1 точку в объеме 0,2 мл дважды с интервалом в 2 недели. В качестве положительного контроля используют животных, получивших 1 инъекцию БЦЖ (Prague 106). В качестве негативного контроля используют невакцинированных животных.
Через 5 недель после второй иммунизации подопытных животных всех групп заражают летальной дозой Mycobacterium tuberculosis H37Rv (5×106 KOE).
Высеваемость микобактерий из органов определяют через 3 недели после введения летальной дозы микобактерий. По результатам, приведенным в таблице 8, наблюдается снижение числа КОЕ в легких и селезенке мышей, вакцинированных препаратами, по сравнению с числом KOE в 4 контрольной группе животных, получивших инъекцию летальной дозы микобактерий.
По выживаемости экспериментальных животных наиболее эффективным представляется Препарат 2. Этот препарат оказывает защитное действие от летальной дозы микобактерий у 57% животных к 70 дню наблюдения, однако препарат был несколько менее эффективен, чем БЦЖ. Двукратное введение животным Препаратов 1 и 2 на 16 дней удлиняет время жизни летально зараженных мышей.
Данные, представленные в таблице 9, показывают эффективность полученных вакцин по выживаемости.
Таким образом, по полученным данным наибольшим протективным эффектом обладал препарат, в котором содержание белка (в составе АК) и СП-NO составляет соответственно 5 мкг и 500 мкг. Его эффект был достоверно выше, чем в случае других использованных препаратов.
Пример 11. Получение конъюгатов СП-NO с белками и гликопротеидами различной природы, имеющими первичную аминогруппу в боковой цепи.
При получении конъюгатов и комплексов СП-NO с белками и гликопротеидами различной природы, имеющими первичную аминогруппу или карбоксильную группу, в качестве белкового компонента данной реакции могут быть использованы:
- при получении вакцинирующих препаратов - антигенные комплексы, выделяемые из возбудителя гепатита А, В, С, туберкулеза, сибирской язвы, холеры, брюшного тифа, коклюша, дифтерии, столбняка, пиогенных инфекций;
- при получении лекарственных препаратов пролонгированного действия с повышенным уровнем безопасности и эффективности - эритропоэтины, цитокины, интерфероны, ферменты, цитостатики, антибиотики, гормоны, витамины;
- при получении средств специфической иммунотерапии - аллергены и аллергоиды, выделяемые из пыльцы растений и трав, домашней пыли, пищевых продуктов и др.
В каждом конкретном случае варьируются условия проведения реакции - соотношение компонентов, pH, температура проведения реакции, продолжительность процесса, концентрация реагентов в реакционной смеси, что влияет на выход и состав получаемого препарата.
Метод получения конъюгатов СП-NO с белками в общем виде имеет следующую последовательность действий: 10 мг СП-NO, полученного согласно описанным выше примерам, растворяют в 1 мл воды. К раствору добавляют 5 мг бромацетилгидразида и смесь перемешивают в течение 3 часов при температуре 30°С. Затем в реакционную смесь добавляют раствор 3 мг белка в 0,01М фосфатном буфере pH 8,2. Реакцию конъюгации проводят при температуре 2-4°С в течение 20 час. После завершения реакции реакционную смесь подвергают очистке методом ультрафильтрации, целевой продукт выделяют лиофильным высушиванием.
Пример 12. Получение конъюгатов СП-NO с антигенами полисахаридной природы (ПС-АГ) с целью получения вакцинирующих соединений, обладающих повышенной иммуногенностью и защитным эффектом против инфекций.
Получение конъюгатов СП-NO с антигенами полисахаридной природы (ПС-АГ) показано на примере капсульного Ви-полисахарида, обладающего протективной активностью против инфекции, вызываемой Salmonella typhi.
Конъюгаты ПС-АГ с СП-NO получают по методу, описанному в примере 11, путем образования ковалентной связи между карбоксильной группой остатков N,O-ацетилгалактуроновой кислоты ПС-АГ и гидразидной группой активированных производных СП-NO, с использованием конденсирующего агента 1-этил-3-(3-диметиламинопропил) карбодиимида (ЭДК). Реакцию конденсации ПС-АГ с гидразидным производным полиоксидония СП-NO проводят в водно-солевых растворах (0,2-0,35 М NaCl) при весово