Биотрансплантат для коррекции дефектов мягких тканей (варианты), способ получения биотрансплантата (варианты) и способ коррекции дефектов мягких тканей
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой биотрансплантат для коррекции дефектов мягких тканей, характеризующийся тем, что он представляет собой суспензию, содержащую аутологичную культуру фибробластов в 0,9% растворе хлорида натрия в концентрации 0,6-3,0×106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемой биосовместимой биодеградируемой измельченной до размера 100-200 мкм бесклеточной матрице в растворе фармацевтически приемлемого биосовместимого биодеградируемого препарата гиалуроновой кислоты, при этом объемное соотношение аутологичной культуры фибробластов, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно, а в качестве фармацевтически приемлемой биосовместимой биодеградируемой бесклеточной матрицы используют препарат «Сайметра», представляющий собой переработанную донорскую кожу человека, лишенную клеток и структурных иммуноспецифических белков, основу которого составляет коллаген и эластин, представленный в виде инъекционной формы. Изобретение обеспечивает значительное снижение количества инъецируемых клеток, повышение их жизнеспособности и обеспечение длительного сохранения импланта в поврежденной ткани. 7 н. и 12 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к медицине и касается лекарственных средств для коррекции дефектов мягких тканей, а именно к биотрансплантатам для коррекции дефектов мягких тканей, к способам получения таких биотрансплантатов, а также к способам коррекции дефектов любых мягких тканей, содержащих фибробласты или фибробластподобные клетки. Изобретение может быть использовано в реконструктивной и пластической хирургии, дерматологии, терапевтической косметологии - коррекции локальных дефектов, дистрофических и возрастных нарушений, требующих восстановления объема мягких тканей, в хирургической отоларингологии - пластике голосовых связок, в урологии - лечении недержания мочи, в стоматологии - лечении заболеваний пародонта, в комбустиологии - лечении обширных глубоких ожогов, в эндокринологии - лечении диабетической язвы стопы и подошвы, то есть для регенерации тканей, которые претерпели дегенеративные изменения в результате патологических нарушений или функционального расстройства в организме.
В настоящее время в медицине широко используются различные имплантационные препараты, созданные на основе компонентов, синтезируемых фибробластами [Hruza G.J.Arch. Facial Plast. Surg. Vol 6, Nov/Dec 2004].
Материалы, в состав которых входит коллаген, в медицине используют уже более 100 лет. Так, в терапевтической косметологии для коррекции морщин, рубцов постакне, контурной пластики известно применение коллагеновых препаратов на основе бычьего коллагена, например Zyderm, Zyplast; Inamed Aesthetics, Santa Barbara, Calif.
Однако бычий коллаген - это чужеродный белок и у значительного числа пациентов (до 10%) наблюдаются аллергические реакции как местного, так и системного действия.
Более предпочтительным в этом отношении препаратом, лишенным вышеуказанных недостатков является «АллоДерм», производимый компанией «ЛайфЦелл», США. Это переработанная донорская кожа человека, лишенная клеток и структурных иммуноспецифических белков. Основу материала составляют коллаген и эластин. Инъекционная форма «АллоДерм» имеет коммерческое название «Сайметра» и представляет собой матрицу, измельченную до размера 100-200 мкм. Препарат получил широкое распространение для лечения ожоговых поражений, в хирургической отоларингологии, общей хирургии, пластической хирургии, нейрохирургии, хирургической стоматологии, урологии, дерматокосметологии.
В настоящее время широкое распространение в медицине, в частности в дерматокосметологии, получили устойчивые гиалуроновые кислоты неживотного происхождения. Это гликозаминогликаны, полученные биотехнологическим путем, не вызывающие иммунного ответа со стороны организма - реципиента, обладающие выраженными гидрофильными свойствами, то есть способностью удерживать воду [Минимально инвазивная косметическая хирургия лица. Под ред. Дж.Нимату III, Р.Хога, Москва, 2007].
Однако экзогенная гиалуроновая кислота довольно быстро выводится из места введения, что является недостатком данной группы препаратов.
В ряде экспериментальных исследований in vivo было продемонстрировано выраженное стимулирующее влияние факторов роста, продуцируемых фибробластами на ускорение процессов ангиогенеза, усиление процессов пролиферации эндотелиоцитов капилляров и крупных сосудов, стимуляция пролиферации гладкомышечных клеток и перицитов, усиление дифференциации миоцитов, усиление остеогенетического процесса, стимуляция регенерации хрящевой ткани, усиление митогенеза периодонтальной связки [Alberts et al., Molecular Biology of the Cell, 2nd ed., 1992, Tran-Hung L et al., J Dent Res 85(9): 819-823, 2006].
Известен способ доставки живых фибробластов к месту дефекта ткани на микросферах [Патент РФ №2277423, МПК A61K 35/28], в котором показано, что фибробласты являются субстратзависимыми клетками и в суспензии находятся в состоянии стресса.
Однако, при таком способе доставки, функционирование микросфер с интегрированными на них фибробластами не достаточно эффективно, что не позволяет обеспечить длительное сохранение имплантата в поврежденной ткани.
Известны способы восстановления дефектов мягких тканей путем трансплантации аутологичных дермальных фибробластов в суспензии [Патент РФ №2281776, МПК A61K 35/36] и [Патент США №5660850, НКИ 424/426, МПК A61F 2/02]. Известны также смеси аллогенных фибробластов, полученных из пуповины новорожденного и аутологичных фибробластов из кожи собственно пациента [Патент РФ №2308957, МПК A61K 35/36].
Недостатком этих технических решений является высокое количество и низкая жизнеспособность инъецируемых фибробластов, а также недостаточно длительное сохранение имплантата в поврежденной ткани.
Известен способ применения клеток на носителе в пародонтологии [Патент РФ №2210352, МПК A61K 6/00], где используют постнатальные дермальные фибробласты, интегрированные на носитель - синтетический гидроксиапатит.
Недостатком этого способа является необходимость хирургического вмешательства для внесения трансплантируемого материала, что вызывает значительную травматизацию тканей, а также риск инкапсулирования имплантов фиброзной тканью.
Известен способ иммобилизации клеточной суспензии аттестованного диплоидного штамма или коллагеновых микроносителей с выращенным клеточным монослоем в гель полиэтиленоксида [Патент РФ №2189223, МПК A61K 9/10].
Ограниченное применение данного средства для лечения глубоких кожных дефектов нанесением его на ожоговые поверхности является существенным недостатком данного изобретения.
Известен способ коррекции дефектов мягких тканей посредством одновременного введения аутологичных фибробластов с различными формами коллагена и гликозаминогликанов [Патент США №6878383, НКИ 424/422, МПК A61F 13/00].
В этом способе используются коллагены любого типа и гликозаминогликаны, поперечно-сшитые с помощью, например, глютаральдегида. Ограничением этого способа является то, что при биодеградации зкзогеного коллагена может высвобождаться мономерный глютаральдегид в ткани и жидкости организма, который будет оказывать цитотоксическое действие на фибробласты и вызывать развитие непредвиденных побочных эффектов.
Известен способ получения гибридных матричных имплантатов и эксплантатов [Патент РФ №2201765, МПК A61K 39/00], в состав которых входит матричный материал, образованный фибриллами нерастворимого коллагена и расположенными в нем множеством клеток млекопитающих и множеством микросфер, состоящих из различных веществ.
Недостатком данного изобретения является использование нерастворимого коллагена.
Задачей настоящего изобретения является создание высокоэффективного биотрансплантата для коррекции дефектов мягких тканей, разработка способа его получения и способа коррекции дефектов мягких тканей, универсальных для соединительной ткани всех органов с устойчиво высоким терапевтическим эффектом.
Техническим результатом настоящего изобретения является значительное снижение количества инъецируемых клеток, повышение их жизнеспособности и обеспечение длительного сохранения имплантата в поврежденной ткани.
Предложена группа изобретений, объединенных общим изобретательским замыслом.
Для решения поставленной задачи биотрансплантат для коррекции дефектов мягких тканей характеризуется тем, что он представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 0,6-3,0×106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемой биосовместимой биодеградируемой измельченной до размера 100-200 мкм бесклеточной матрице в растворе фармацевтически приемлемого биосовместимого биодеградируемого препарата гиалуроновой кислоты.
В частном варианте объемное соотношение суспензии культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты составляет 4:1:1 соответственно.
Для решения поставленной задачи способ получения биотрансплантата для коррекции дефектов мягких тканей характеризуется тем, что биоптат промывают растворами антибиотиков и антимикотика в среде ДМЕМ и переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина и коллагеназы II типа, инкубацию биоптата проводят при 37°C 16-17 часов, полученный клеточный осадок ресуспендируют в среде для культивирования ДМЕМ, 10-20% ЭТС, 40 мкг/мл гентамицина, высевают и культивируют в течение 2-3 недель до получения первичной культуры, затем клетки трипсинизируют и культивируют до наращивания необходимого количества, после чего среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду ДМЕМ 90% и 10% аутологичной сыворотки и выдерживают 8-14 часов при 37°C, после культивирования клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия в концентрации 0,6-3,0×106 в 1 мл биотрансплантата, интегрируют на фармацевтически приемлемой биосовместимой биодеградируемой измельченной до размера 100-200 мкм бесклеточной матрице и культивируют для адгезии фибробластподобных клеток 1-2 часа при 37°C, после чего соединяют с фармацевтически приемлемым биосовместимым биодеградируемым препаратом гиалуроновой кислоты.
Для решения поставленной задачи также предложен биотрансплантат для коррекции дефектов мягких тканей, характеризующийся тем, что он представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 0,6-4,2×106 в 1 мл биотрансплантата, интегрированных на фармацевтически приемлемой биосовместимой биодеградируемой измельченной до размера 100-200 мкм бесклеточной матрице.
В частном варианте объемное соотношение суспензии культуры клеток и бесклеточной матрицы составляет 5:1 соответственно.
Для решения поставленной задачи также предложен способ получения биотрансплантата для коррекции дефектов мягких тканей, характеризующийся тем, что биоптат промывают растворами антибиотиков и антимикотика в среде ДМЕМ и переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина и коллагеназы II типа, инкубацию биоптата проводят при 37°C 16-17 часов, полученный клеточный осадок ресуспендируют в среде для культивирования ДМЕМ, 10-20% ЭТС, 40 мкг/мл гентамицина, высевают и культивируют в течение 2-3 недель до получения первичной культуры, затем клетки трипсинизируют и культивируют до наращивания необходимого количества, после чего среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду ДМЕМ 90% и 10% аутологичной сыворотки и выдерживают 8-14 часов при 37°С, после культивирования клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия в концентрации 0,6-4,2×106 в 1 мл биотрансплантата, затем суспензию клеток интегрируют на фармацевтически приемлемой биосовместимой биодеградируемой измельченной до размера 100-200 мкм бесклеточной матрице и культивируют для адгезии фибробластподобных клеток 1-2 часа при 37°С.
Для решения поставленной задачи также предложен биотрансплантат для коррекции дефектов мягких тканей, характеризующийся тем, что он представляет собой суспензию, содержащую культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в 0,9% растворе хлорида натрия в концентрации 0,6-5,5×106 в 1 мл биотрансплантата в растворе фармацевтически приемлемого биосовместимого биодеградируемого препарата гиалуроновой кислоты или препарата коллагена.
В частном варианте объемное соотношение суспензии культуры клеток и препарата гиалуроновой кислоты или препарата коллагена составляет 5:1 соответственно.
Для решения поставленной задачи также предложен способ получения биотрансплантата для коррекции дефектов мягких тканей, характеризующийся тем, что биоптат промывают растворами антибиотиков и антимикотика в среде ДМЕМ и переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина и коллагеназы II типа, инкубацию биоптата проводят при 37°С 16-17 часов, полученный клеточный осадок ресуспендируют в среде для культивирования ДМЕМ, 10-20% ЭТС, 40 мкг/мл гентамицина, высевают и культивируют в течение 2-3 недель до получения первичной культуры, затем клетки трипсинизируют и культивируют до наращивания необходимого количества, после чего среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду ДМЕМ 90% и 10% аутологичной сыворотки и выдерживают 8-14 часов при 37°С, после культивирования клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия в концентрации 0,6-5,5×106 в 1 мл биотрансплантата, после чего соединяют с фармацевтически приемлемым биосовместимым биодеградируемым препаратом гиалуроновой кислоты или препаратом коллагена.
Для решения поставленной задачи способ коррекции дефектов мягких тканей характеризуется тем, что биотрансплантат, представляющий собой суспензию культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток в количестве 3,6-60×106 клеток на курс лечения, вводят в область дефекта инъекционным путем двукратно с интервалом 3-6 недель.
В частном варианте в качестве фармацевтически приемлемой биосовместимой биодеградируемой бесклеточной матрицы используют препарат «Сайметра».
В другом частном варианте биотрансплантат содержит суспензию культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток, выделенных из ткани органа, соответствующего поврежденному.
В другом частном варианте биотрансплантат содержит суспензию культуры аутологичных или аллогенных фибробластов, или фибробластоподобных клеток, выделенных из кожи, или слизистой оболочки, или крайней плоти, или пуповины новорожденного, или костного мозга, или жировой ткани, или пульпы зуба.
Изобретение иллюстрируется следующими чертежами.
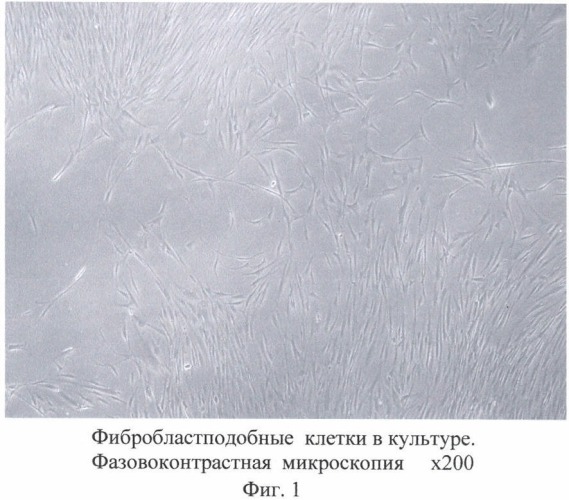
На Фиг.1 представлены фибробластподобные клетки в культуре. Фазово-контрастная микроскопия х200.
На Фиг.2 представлены колониеобразующие единицы фибробластов (КОЕ-Ф).
На Фиг.3 представлен Western-blott анализ тотальных клеточнах лизатов на содержание коллагена I типа в культурах фибробластов из различных источников.
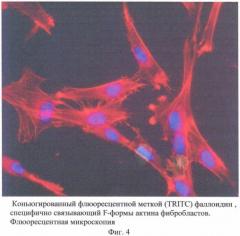
На Фиг.4 представлен конъюгированный флюоресцентной меткой (TRITC) фаллоидин, специфично связывающий F-формы актина фибробластов. Флюоресцентная микроскопия.
На Фиг.5а представлена интактная кожная матрица «Сайметра» без фибробластоподобных клеток. Фазово-контрастная микроскопия х200.
На Фиг.5б представлена кожная матрица «Сайметра» с интегрированными фибробластподобными клетками. Фазово-контрастная микроскопия х200.
Создание условий, способствующих повышению жизнеспособности инъецируемых клеток, позволяет повысить эффективность действия биотрансплантатов, снизить количество инъецируемых клеток и эффективно оперировать количеством живых инъецируемых клеток в зависимости от размеров повреждения. После трансплантации биотрансплантата фибробласты или фибробластподобные клетки постепенно мигрируют с матрицы и благодаря своим синтетическим функциям (синтез волокон, гликозаминогликанов, ферментов, цитокинов, факторов роста) способствуют восстановлению поврежденных тканей.
Использование в биотрансплантате бесклеточной матрицы «Сайметра» (Фиг.5а) или любой другой фармацевтически приемлемой биодеградируемой биосовместимой матрицы в качестве носителя позволяет повысить жизнеспособность инъецируемых фибробластов, оптимизировать их доставку в место дефекта и обеспечить синтез физиологически необходимого уровня компонентов межклеточного матрикса.
Для повышения жизнеспособности клеток большую роль играет создание такого биотрансплантата, который максимально бы соответствовал физиологическим условиям, в которых находится фибробласт, а именно - густая сеть межклеточного матрикса, состоящего преимущественно из волокон и основного вещества - гликозаминогликанов, в частности гиалуроновой кислоты.
По этой причине целесообразным является создание биотрансплантата, содержащего фармацевтически приемлемые препараты биосовместимой биодеградируемой измельченной бесклеточной матрицы с интегрированными на ней фибробластподобными клетками (Фиг.5б), включающей волокна (коллагена, эластина) и гиалуроновую кислоту, которая, имея консистенцию геля, позволяет имплантированным клеткам оставаться локализованными в определенном месте, в частности в месте дефекта ткани.
Указанные в изобретении соотношения используемых компонентов - культуры клеток, бесклеточной матрицы и препарата гиалуроновой кислоты или препарата коллагена - позволяют получить биотрансплантат с консистенцией, удобной для инъецирования и наряду с выраженным клиническим эффектом обеспечивают малотравматичность и простоту инъецирования.
Предложенный в изобретении способ введения биотрансплантата двукратно с интервалом в 3-6 недель в зависимости от размеров дефекта мягких тканей позволяет также снизить травматичность способа, обеспечить полную реабилитацию тканей после трансплантации и создать оптимальный временной интервал для приживления клеток.
После успешно проведенного культивирования часть выведенной культуры фибробластподобных клеток подвергают криоконсервированию после 1-го пассажа в среде для криозаморозки: 50% ДМЕМ, 40% ЭТС, 10% ДМСО («Merk») в количестве 1×106/мл, где в жидком азоте они могут храниться бессрочно. Запас криоконсервированных клеток дает возможность создать мастер-банк, что позволяет проводить процедуры в определенно назначенное время.
Тестирование клеток на биобезопасность проводят следующим образом.
После 1-го пассажа образец культуры фибробластподобных клеток исследуют на исключение вирусной и бактериальной инфекции, проводят кариотипирование.
Наличие вирусной и бактериальной инфекции являются абсолютным противопоказанием к дальнейшему культивированию и хранению клеток. Все процедуры по получению клеточных биотрансплантатов проводят в условиях GMP, GTP, GLP.
Для характеризации полученных клеток определяют их фенотип, проводят фазово-контрастную микроскопию (Фиг.1), выполняют тест на КОКф (колониеобразующие единицы фибробластов (Фиг.2), проводят специфическое окрашивание клеток на F - актин (Фиг.4) и Western-blott анализ клеточных лизатов на экспрессию коллагена I типа (Фиг.3).
Выделение первичных культур фибробластов или фибробластподобных клеток.
Первичные культуры фибробластов или фибробластподобных клеток получают стандартными методами (A Culture of Animal Cells., Freshney J. 3rd edition, Wiley Liss Inc., New York 1994) с небольшими модификациями.
У пациентов берут биопсийный материал из-за ушной раковины, или со слизистой оболочки ротовой полости, или крайней плоти, или пуповины новорожденного. Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/м, амфотерицин B 25 мкг/мл) в среде ДМЕМ. После промывки биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и 400-500 мкг/мл коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°C, 16-17 часов. Среду с коллагеназой предварительно стерильно фильтруют. После инкубации полученную клеточную взвесь промывают в фосфатно-солевом буфере («ПанЭко») pH 7,4-7,5 путем центрифугирования при 400g 10 минут. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т - 25 “Nunc”). Флаконы помещают в CO2-инкубатор (37°C, 5% CO2) и культивируют в течение 2-3 недель до получения первичной культуры. В качестве сыворотки используют как ЭТС, так и тестированную сыворотку пуповинной крови человека, так и аутологичную сыворотку крови пациента. Оптимальная концентрация сыворотки 10-20%. Более высокие концентрации сыворотки стимулируют быструю пролиферацию фибробластов. Концентрацию глюкозы в среде ДМЕМ варьируют от 1 до 4,5 г на 1 литр среды. Для культивирования фибробластов и фибробластподобных клеток используют также бессывороточную среду, например бессывороточную полную ростовую среду для культивирования фибробластов (Fibroblast Basal Medium, BioWhittaker Inc., USA) или иные аналогичные бессывороточные среды для культивирования фибробластподобных клеток. Перед использованием ЭТС проводят тестирование каждого лота ЭТС на колониеобразующие единицы фибробластов (КОЕ-Ф) и отбирают лоты только с высокой эффективностью колониеобразования. Культивирование проводят в чашках Петри, эксплантируя от 100 до 200 клеток в 10 мл полной ростовой среды. После 14 дней культивирования клетки снимают раствором трипсина - ЭДТА («ПанЭко») и переносят в новый (Т-75 «Nunc») культуральный флакон с питательной средой. Клетки инкубируют в течение недели в CO2 инкубаторе (37°C, 5% CO2). Каждые 48-72 часа производят смену питательной среды. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-150, либо Т-175 «Nunc») культуральный флакон. Культуральные флаконы Т-150, Т-175 обладает емкостью, позволяющей снимать 7-15×106 клеток. В дальнейшем клетки переносят в фабрики Т-500 «Nunc» с тройным дном, после 7 дней культивирования с такого матраса снимают 20-30×106 клеток. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки или на среду с 10% аутологичной сывороткой пациента. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°C. Инкубация клеток на среде, не содержащей сыворотки, позволит избавиться от чужеродных белков, содержащихся в ЭТС. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций. Затем клетки соединяют с фармацевтически приемлемым носителем, препаратом «Сайметра» и препаратом гиалуроновой кислоты, или препаратом «Сайметра», или препаратом гиалуроновой кислоты, или коллагеном. Объем готового биотрансплантата подбирают для каждого пациента индивидуально.
Выделение фибробластподобных клеток из костного мозга.
Выделение фибробластподобных клеток из костного мозга проводят по стандартной методике [Metod in molecular biology. Basic Cell Culture Protocols, Helgason C.D., Miller C.L., 3 ed, New Jersey, 2005].
Аспират костного мозга донора (10-15 мл) выделяют из крыла подвздошной кости, используя гепарин как антикоагулянт у пациента под местной анестезией. Суспензию костномозговых клеток разводят в эквивалентном объеме фосфатно-солевого буфера Дульбекко +2% ЭТС. В 50 мл коническую пробирку («Nunc»), содержащую 15 мл раствора фиколла с плотностью 1,077 г/см3 («ПанЭко»), осторожно наслаивают 20 мл разведенного пунктата костного мозга. Затем полученную смесь центрифугируют при 330g 25 мин. Интерфазное мононуклеарное кольцо осторожно отбирают 5 мл пипеткой в 50-мл пробирки. Омывают с 5-кратным объемом фосфатно-солевого буфера, двухкратно при 330g 10 мин. Клетки подсчитывают в камере Горяева. Клеточную суспензию в количестве 1×107/мл ресуспендируют в культуральной среде α - MEM (Invitrogen) с 20% ЭТС (лот сыворотки отбирают, как описано выше) и антибиотиками (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл). 10 мл клеточной суспензии высевают в культуральный флакон 25 см2 («Nunc») при 37°C и 5% CO2, и инкубируют 14 дней, получая таким образом первичную клеточную культуру. Для дальнейшей экспансии клетки пассируют в количестве 3000-5000 кл/см2 в культуральные матрасы («Nunc») с большей посевной площадью. По мере роста и достижения 90% конфлюэнтного слоя клетки снимают раствором 0,25% трипсин-ЭДТА и рассеивают в культуральные фабрики.
Выделение фибробластподобных клеток из жировой ткани.
Выделение фибробластподобных клеток из жировой ткани проводят по стандартной методике [Zak Р.А., Tissue Engineering vol. 7, №2, 2001] с небольшими модификациями.
Образцы жировой ткани получают посредством липосакции. Жировую ткань измельчают и подвергают ферментативной обработке коллагеназой I типа (200 ед/мл, Sigma) в среде DMEM, содержащей 100 ед/мл пенициллина и 100 ед/мл стрептомицина при соотношении ткани и среды 1:1 и инкубируют при 37°C в течение часа с постоянным покачиванием/перемешиванием. По окончании инкубации образец смешивают с культуральной средой DMEM, содержащей 10% ЭТС и фильтруют через 100 мкм нейлоновый фильтр. Профильтрованную суспензию центрифугируют при 200g 5-7 минут. Полученный осадок обрабатывают лизирующим буфером (154 mM NH4Cl, 10 mM KHCO3, 0,1 mM EDTA) в течение 5 минут при 37°C для лизиса эритроцитов, после чего клеточную суспензию центрифугируют при 400g 7 минут. Клеточный осадок (1×106 /см2) ресуспендируют в культуральной среде, описанной выше, высевают в культуральный флакон и инкубируют в CO2 инкубаторе (37°C, 5% CO2). Смену среды проводят каждые 3-4 дня. По мере роста и достижения 80-90% конфлюэнтного монослоя клеточную суспензию снимают 0,25% трипсин-ЭДТА.
Выделение фибробластподобных клеток из пульпы зуба.
Выделение фибробластподобных клеток из пульпы зуба проводят по оригинально разработанной методике.
Клетки получают из молочных зубов детей или удаленных третьих моляров взрослых. Зубы трехкратно промывают средой DMEM, содержащей 200 мкг/мл гентамицина, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина. Затем зуб переносят во флакон с 10 мл среды DMEM, содержащей 10% ЭТС, 40 мкг/мл гентамицина и 400-500 мкг/мл коллагеназы II типа. Инкубацию ведут при 37°C, 17 час. Затем клеточную суспензию центрифугируют и осадок ресуспендируют в 5 мл культуральной среды DMEM, содержащей 20% ЭТС, 40 мкг/мл гентамицина. Культивирование проводят в CO2 инкубаторе (37°C, 5% CO2) в течение 2-х недель до образования монослоя. Дальнейшее культивирование и пассирование клеток проводят в среде DMEM с 15% ЭТС, 40 мкг/мл гентамицина. Среду меняют каждые 3-4 дня. По мере роста и достижения 80-90% конфлюэнтного монослоя клеточную суспензию снимают 0,25% трипсин - ЭДТА.
Для иллюстрации изобретения приведены следующие примеры.
Пример 1.
Доброволец В. 50 лет, пол мужской.
При осмотре кожи лица обнаружено: наличие глубоких морщин на лбу, наличие выраженных, глубоких носогубных складок.
Диагноз: возрастные изменения кожи лица.
Коррекция проблемных зон кожи была проведена заявленным способом с использованием биотрансплантата, состоящего из аутологичной культуры фибробластов, интегрированных на матрице фармацевтически приемлемого препарата «Сайметра» в фармацевтически приемлемом препарате гиалуроновой кислоты IALSystem.
Для этого у добровольца из заушной области был взят биоптат кожи диаметром 0,4 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин B 25 мкг/мл) в среде ДМЕМ. После промывки биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°C, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т-25 “Nunc”). Флаконы помещают в CO2-инкубатор (37°C, 5% CO2) и культивируют в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-175 «Nunc») культуральный флакон. В дальнейшем клетки переносят в фабрики Т-500 («Nunc») с тройным дном, после 7 дней культивирования с такого матраса можно снять 20-30×106 клеток. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°C. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций в количестве 15×106 в 4 мл.
Для регидратации препарата «Сайметра» используют 0,9% раствор хлорида натрия для инъекций. Регидратацию проводят по алгоритму компании «ЛайфЦелл». Клеточную суспензию в 4 мл 0,9% раствора хлорида натрия для инъекций смешивают осторожным пипетированием с 1 мл препарата «Сайметра» и инкубируют гибридный имплант для адгезии фибробластподобных клеток 2 часа при 37°C. Затем 5 мл импланта смешивают с 1 мл препарата гиалуроновой кислоты - «IAL System» с получением биотрансплантата.
Биотрансплантат в количестве 15×106 клеток двукратно с интервалом 3 недели инъецируют в средний слой дермы кожи лба и носогубных складок туннельным способом. Вкол производят интрадермально посредством инсулиновой иглы 25,4 мм, 27 G параллельно ходу морщины или поперек с интервалом 8-10 мм, на вколе производят введение 0,05 мл препарата.
Перед инъекциями поверхность кожи обрабатывают 0,5% раствором хлоргексидина, затем проводят местную анестезию 5% кремом Эмла.
Наблюдения за клиническими результатами проводят посредством фотографирования пациента до, после и через 6 месяцев после курса лечения.
Результаты оценивают по сравнительному анализу до и после пересадки фибробластов, а также по данным визуального наблюдения. Через 6 месяцев после проведения курса лечения наблюдали уменьшение глубины и значительное сглаживание морщин в области лба, значительное уменьшение выраженности и глубины носогубных складок.
Пример 2.
Доброволец А. 47 лет, пол женский.
При осмотре кожи лица обнаружено: снижение тургора кожи в области щек и подбородка, изменение контура лица, наличие мелких морщин на лбу, вокруг глаз, наличие выраженных носогубных складок.
Диагноз: возрастные изменения кожи лица.
Коррекция проблемных зон кожи была проведена заявленным способом с использованием биотрансплантата, состоящего из аутологичной культуры фибробластов, интегрированных на матрице фармацевтически приемлемого препарата «Сайметра».
Для этого у добровольца из заушной области был взят биоптат кожи диаметром 0,5 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин B 25 мкг/мл) в среде ДМЕМ. После промывки биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°C, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т-25 “Nunc”). Флаконы помещают в CO2-инкубатор (37°C, 5% CO2) и культивируют в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-175 «Nunc») культуральный флакон. В дальнейшем клетки переносят в фабрики Т-500 («Nunc») с тройным дном, после 7 дней культивирования с такого матраса можно снять 20-30×106 клеток. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°C. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций в концентрации 20×106 в 5 мл.
Для регидратации препарата «Сайметра» используют 1 мл 0,9% раствор хлорида натрия для инъекций. Регидратацию проводят по алгоритму компании «ЛайфЦелл». Клеточную суспензию в растворе 0,9% растворе хлорида натрия для инъекций смешивают осторожным пипетированием с 1 мл препарата «Сайметра» и инкубируют гибридный имплант для адгезии фибробластподобных клеток 2 часа при 37°C с получением биотрансплантата.
Биотрансплантат в количестве 20×106 клеток двукратно с интервалом 3 недели инъецируют в средний слой дермы кожи лба и носогубных складок туннельным способом. Вкол производят интрадермально посредством инсулиновой иглы 25,4 мм, 27 G параллельно ходу морщины или поперек с интервалом 8-10 мм, на вколе производят введение 0,05 мл препарата.
Перед инъекциями поверхность кожи обрабатывают 0,5% раствором хлоргексидина, затем проводят местную анестезию 5% кремом Эмла.
Наблюдения за клиническими результатами проводят посредством фотографирования пациента до, после и через 6 месяцев после курса лечения.
Результаты оценивают по сравнительному анализу до и после пересадки фибробластов, а также по данным визуального наблюдения.
Через месяц после завершения курса лечения кожи отмечали улучшение состояния кожи, уменьшение глубины морщин, улучшение цвета и контура лица, которое усиливалось со временем и сохранялось на протяжении всего срока наблюдения. Через 6 месяцев после проведения курса лечения наблюдали улучшение тургора кожи, цвета и контура лица; наблюдали сглаживание морщин, уменьшение выраженности и глубины носогубных складок.
Пример 3.
Доброволец В. 47 лет, пол мужской.
При осмотре кожи лица обнаружено: обезвоживание кожи и снижение ее тургора, наличие морщин вокруг глаз, на щеках, в области лба.
Диагноз: возрастные изменения кожи лица.
Коррекция проблемных зон кожи была проведена заявленным способом с использованием биотрансплантата, состоящего из аутологичной культуры фибробластов в фармацевтически приемлемом препарате гиалуроновой кислоты TEOSYAL Meso.
Для этого у добровольца из заушной области был взят биоптат кожи диаметром 0,3 мм.
Перед получением первичной клеточной культуры биоптат промывают растворами антибиотиков и антимикотика (пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, гентамицин 200 мкг/мл, амфотерицин B 25 мкг/мл) в среде ДМЕМ. После промывки биоптат переносят в среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), 40 мкг/мл гентамицина и коллагеназы II типа («Sigma»). Инкубацию биоптата проводят при 37°C, 16-17 часов. Полученный клеточный осадок ресуспендируют в среде для культивирования - ДМЕМ, 10-20% ЭТС («ПанЭко»), 40 мкг/мл гентамицина и высевают в культуральные флаконы (Т-25 “Nunc”). Флаконы помещают в CO2-инкубатор (37°C, 5% CO2) и культивируют в течение 2 недель до получения первичной культуры. По мере роста и достижения субконфлюэнтного слоя клетки трипсинизируют и переносят в новый большей площадью (Т-75, Т-175 «Nunc») культуральный флакон. В дальнейшем клетки переносят в фабрики Т-500 («Nunc») с тройным дном, после 7 дней культивирования с такого матраса можно снять 20-30×106 клеток. При достижении субконфлюэнтного монослоя среду с 10-20% ЭТС заменяют на среду без сыворотки. До снятия клеток и получения готовой суспензии клетки выдерживают не менее 8-14 часов при 37°C. В конце инкубации клетки собирают с помощью 0,25% трипсин - ЭДТА, отмывают трехкратно путем центрифугирования - ресуспендирования и суспендируют в 0,9% растворе хлорида натрия для инъекций в количестве 30×106 в 5 мл. Затем клетки соединяют с 1 мл фармацевтически приемлемым носителем гиалуроновой кислоты - TEOSYAL Meso с получением биотрансплантата.
Биотрансплантат в количестве 30×106 клеток двукратно с интервалом 3 недели инъецируют в средний слой дермы туннельным способом по всему лицу и папулами в области глаз. Вкол производят интрадермально посредством инсулиновой иглы 25,4 мм, 30 G параллельно ходу морщины или поперек с интервалом 8-10 мм, на вколе производят введение 0,05 мл препарата; в случае сниженного тонуса кожи и мелких морщин биотрансплантат вводят папуллами в проблемную зону: вколы производят на глубину 2 мм по параллельным линиям с интервалом 5-8 мм.
Перед инъекциями поверхность кожи обрабатывают 0,5% раствором хлоргексидина, затем проводят местную анестезию 5% кремом Эмла.
Наблюдения за клиническими результатами проводят посредством фотографирования пациента до, после и через 6 месяцев после курса лечения.
Результаты оценивают по сравнительному анализу до и после пересадки фибробластов, а также по данным визуального наблюдения.
Через неделю после завершения курса отмечали улучшение состояния кожи, которое усиливалось со врем