Способ стимуляции противоопухолевой активности цитотоксических эффекторов иммунной системы
Иллюстрации
Показать всеИзобретение относится к иммунологии, онкологии и биотехнологии и может быть использовано для стимуляции противоопухолевой активности цитотоксических эффекторов иммунной системы. Для этого в организм опухоленосителя вводят рекомбинантные протеины, содержащие мини-антитело к опухолеспецифическим антигенам и молекулу БТШ70. Изобретение позволяет активировать противоопухолевый иммунный ответ, связанный с активацией NK-клеток, за счет направленной доставки к поверхности опухолевых клеток молекул БТШ70. 4 ил.
Реферат
Изобретение относится к области иммунологии, онкологии и биотехнологии и может быть использовано в медицине для стимуляции противоопухолевой активности цитотоксических эффекторов иммунной системы.
Поиск новых подходов к иммунотерапии рака, несмотря на огромное число исследований в этой области, по-прежнему остается актуальной задачей. Хорошо известно, что одна из причин появления и развития в организме злокачественных новообразований связана с отсутствием на поверхности опухолевых клеток антигенов, активирующих цитотоксические эффекторы иммунной системы, осуществляющие элиминацию трансформированных клеток. В связи с этим, одним из перспективных подходов к противоопухолевой иммунотерапии является направленная модификация поверхности опухолевых клеток молекулярными структурами, которые распознаются клетками-киллерами и индуцируют их цитолитическую реакцию. В последние годы было показано, что к числу таких структур относятся белки теплового шока с молекулярной массой 70 кДа (БТШ70). В частности, было установлено, что присутствие БТШ70 на поверхности клеток-мишеней существенно активирует цитотоксические функции NK-клеток и TCR-гамма-дельта Т-лимфоцитов, основных противоопухолевых эффекторов системы врожденного иммунитета. Направленная доставка подобных цитолитических маркеров на поверхность клеток опухолевой ткани может осуществляться с помощью рекомбинантных мини-антител к опухолеспецифическим антигенам, в частности антител к HER2/neu-антигену, экспрессирующемся на поверхности широкого спектра злокачественных новообразований (Slamon DJ, et al. Science, 1989, v.244, p.707-712).
Семейство белков теплового шока (БТШ, HSP-heat shock protein) включает в себя широкий спектр высококонсервативных внутриклеточных протеинов, характеризующихся как гетерогенностью физико-химических свойств, так и разнообразием функций. БТШ экспрессируются в клетках всех типов, причем уровень этой экспрессии увеличивается во много раз под действием различных повреждающих агентов. Увеличение внутриклеточного содержания БТШ является универсальной защитной реакцией клеток, связанной с уникальной способностью данных белков предотвращать индуцированную стрессом агрегацию внутриклеточных протеинов, их денатурацию, обеспечивать репарацию частично поврежденных протеинов или их корректную утилизацию в случае необратимых повреждений. Перечисленные функции, а также участие в процессах фолдинга вновь синтезируемых полипептидов и транспорта внутриклеточных протеинов, относят к так называемым «шаперонным» свойствам конститутивного пула БТШ, экспрессирущихся в клетках в нормальных физиологических условиях, в отсутствии стресса (Craig, et al. Cell, 1994, v.78, p.365-372). Однако локализация БТШ не ограничивается внутриклеточным пространством. В большой серии работ было зарегистрировано присутствие этих протеинов на клеточной поверхности. Так, поверхностные БТШ обнаружены на плазматической мембране нормальных (Ishiyama, et al. Clin. Exp.Immunol., 1996, v.106, p.351-356) и опухолевых клеток (Ferrarini, et al. Int. J. Cancer, 1992, v.51, p.613-619), вирус-инфицированных лимфоцитов (Di Cesare, et al. Immunology, 1992, v.76, p.341-343) и Т-клеток, погибающих по программе апоптоза (Poccia, et al. Immunology, 1996, v.88, p.6-12). В этих работах показано, что на клеточной поверхности экспрессируются БТШ с различной молекулярной массой, однако наиболее типичны для поверхностной локализации БТШ с молекулярной массой 70 кДа (БТШ70). Феномен необычной поверхностной экспрессии БТШ описан не только для клеток, культивируемых in vitro, но и для клеток различных тканей, полученных от пациентов (Hantschel et al. Cell Stress Chaperones, 2000, v.5, p.438-442).
Функции БТШ, экспонированных на клеточной поверхности, практически не изучены. Вместе с тем, было высказано обоснованное предположение об иммунологической значимости этих поверхностных протеинов, заключающееся в том, что их появление на плазматической мембране может служить сигналом для иммунной системы, активирующим цитотоксические эффекторы и обеспечивающим элиминацию инфицированных, трансформированных и поврежденных клеток (Multhoff, et al. Biol. Chem., 1998, v.379, p.295-300). Это обстоятельство позволяет рассматривать БТШ как поверхностные маркеры, вовлеченные в систему иммунологического надзора. Действительно, в настоящее время хорошо известно, что различные субпопуляции Т-лимфоцитов и NK-клеток способны распознавать высоко-консервативные детерминанты различных БТШ. В частности, мембранные HSP70 и Grp75 могут распознаваться Т-клетками нерестриктированно по молекулам главного комплекса гистосовместимости (Breloer, et al. J. Immunol., 1999, v.162, p.3141), а индуцируемая форма HSP70 - HSP72 нерестриктированно разпознается NK-клетками (Multhoff, et al. Blood, 1995, v.86, p.1374). Поверхностные БТШ опухолевых клеток привлекают NK-клетки, количество которых в опухолях, экспрессирующих эти протеины на своей поверхности, может увеличиваться в 500 раз (Hightower, et al. Cell Stress Chaperones, 1997, v.2, p.1-11). Имеющиеся литературные данные свидетельствуют об МНС I класса нерестриктированном распознавании in vitro БТШ72 человеческими NK-клетками на поверхности клеток эритролейкемической линии К562 и человеческой саркомы, подвергнутых тепловому шоку (Multhoff, et al. Int. J. Hyperthermia, 1997, v. 13, p.39). В ряде работ было продемонстрировано, что БТШ70 можно отнести к опухолеассоциированным антигенам, распознаваемым различными типами Т-лимфоцитов: CD4- CD8- (Tamura, et al. J. Immunol., 1993, v.151, p.5516-5524), αβ (Menoret, et al. J. Immunol., 1995, v.155, p.740-747), γδ (Wei, et al. Cancer Res., 1996, v.56, p.1104-1110), и естественными киллерами (NK-клетками) (Multhoff, et al. J. Immunol., 1997, v.158, p.4341-4350). Зарегистрированное в этих работах распознавание как конститутивной, так и индуцируемой форм БТШ70, МНС-рестриктированными и нерестриктированными Т-лимфоцитами свидетельствует о важной роли поверхностных БТШ70 в противоопухолевых иммунных реакциях. Основываясь на этом, была предложена модель иммунологического надзора, в которой указанные лимфоциты обеспечивают первую линию защиты от инфекционных агентов, несущих на своей поверхности БТШ, защиты от вирус-инфицированных и трансформированных клеток, а также от поврежденных аутологичных клеток (Multhoff, et al. Biol. Chem., 1998, v. 379, p.295-300).
Однако, несмотря на то, что БТШ70 относят к опухолеспецифическим антигенам, экспрессия этих протеинов на раковых клетках in vivo наблюдается весьма редко, поэтому направленная доставка в злокачественные новообразования БТШ70 с целью привлечения и активации цитотоксических эффекторов иммунной системы является новым перспективным направлением противоопухолевой иммунотерапии. Указанная направленная доставка БТШ70 в опухолевые ткани может осуществляться с помощью генно-инженерных конструкций, включающих в себя как цитолитический маркер - рекомбинантную форму белка теплового шока, так и фрагмент, обеспечивающий связывание данной молекулярной конструкции с поверхностью опухолевых клеток - рекомбинантное мини-антитело к опухолеспецифическим антигенам, в частности, мини-антитело к HER2/neu-антигену, экспрессирующемуся на поверхности широкого спектра злокачественных новообразований.
Известны способы активации противоопухолевого иммунного ответа с помощью БТШ70, основанные на стимулирующем влиянии экзогенных БТШ70 на антигенпредставляющее звено иммунной системы (на дендритные клетки), усиливающем противоопухолевый адаптивный иммунный ответ (Srivastava РК. Methods, 1997, v.12, p.165-171; Castelli С, et al., Cancer Immunol Immunother., 2004, v.53, p.227-233; Zhang H, Huang W. Cell Stress Chaperones, 2006, v.11, p.216-226), или на прямом активирующем воздействии растворимой формы экзогенных БТШ70 на NK-клетки, цитотоксические эффекторы врожденного иммунитета (Multhoff G. Handb Exp Pharmacol., 2006, v.172, p.279-304; Sherman M, Multhoff G. Ann N Y Acad Sci., 2007, v.1113, p.192-201).
Наиболее близкий к заявляемому способу описан в Multhoff G., Int J Hyperthermia (2009), v.25, 169-175. Авторы указанного подхода предлагают использовать для усиления противоопухолевого иммунного ответа активацию клеток-эффекторов иммунной системы с помощью введения в организм экзогенных БТШ70 или фрагментов этих молекул, обладающих способностью активировать цитотоксическую активность NK-клеток (Multhoff G., Int J Hyperthermia, 2009, v.25, 169-175). Однако наряду с остальными известными методами использования экзогенных БТШ70 для стимуляции противоопухолевого иммунного ответа, такой подход не обеспечивает направленную доставку этих молекул в опухолевые ткани, необходимую для селективного маркирования злокачественных клеток, как мишеней для элиминации цитотоксическими эффекторами иммунной системы.
Изобретение решает задачу стимуляции противоопухолевого иммунного ответа с помощью селективного маркирования поверхности злокачественных клеток экзогенными молекулами БТШ70, привлекающими и активирующими цитотоксические эффекторы иммунной системы.
Поставленная задача решается за счет направленной доставки рекомбинантных БТШ70 в опухолевые ткани с помощью рекомбинантных мини-антител (в частности, анти-НЕR2/neu-мини-антител, белок 4D5 scFv), обладающих высокой константой взаимодействия с опухолеспецифическими антигенами (в частности, с HER2/neu). Совмещение функции селективного связывания с злокачественными клетками и функции активации противоопухолевых цитотоксических клеток иммунной системы обеспечивается специально сконструированными белками, содержащими оба указанных компонента - «нацеливающего» (мини-антитело) и эффекторного (БТШ70).
Установлено, что указанные рекомбинантные конструкции взаимодействуют с высокой константой связывания с поверхностью клеток карциномы молочной железы человека ВТ-474, гиперэкспрессирующих HER-2/neu-антиген. Продемонстрировано, что внесение этого препарата в культуру клеток ВТ-474 вызывает значительное увеличение цитотоксического эффекта NK-клеток периферической крови человека по отношению к данным клеткам-мишеням.
Сущность способа заключается во введении в организм опухоленосителя с помощью внутривенных инъекций описанного выше рекомбинантного белка, содержащего «нацеливающую» (мини-антитело) и эффекторную (БТШ70) составляющие (например, HSP70-4D5 scFv) для селективного связывания этого препарата с поверхностными антигенами опухолевой ткани (например, HER-2/neu-антигена), которое приводит к активации цитотоксических эффекторов врожденной иммунной системы, и к обусловленной этим элиминации опухолевых клеток, экспонирующим на своей поверхности БТШ70, т.е. к противоопухолевой иммунной реакции организма.
Используя белковые конструкции, содержащие мини-антитела, направленные к различным опухолеспецифическим поверхностным структурам, указанный способ можно применять для лечения широкого спектра онкологических заболеваний, характеризующихся экспрессией на поверхности злокачественных новообразований опухолеспецифических антигенов, к которым получены моноклональные антитела.
Изобретение иллюстрируют графические материалы:
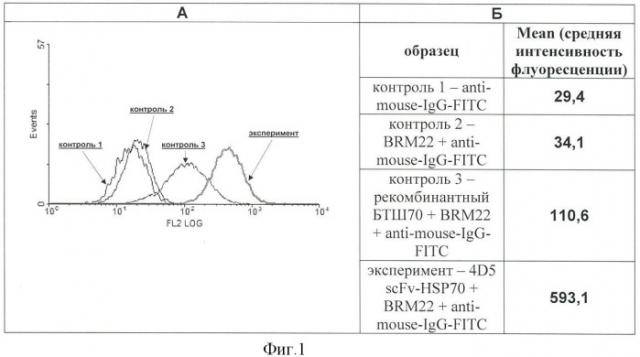
Фигура 1. Проточно-цитометрический анализ эффективности связывания рекомбинантного белка «4D5 scFv-HSP70» с поверхностью клеток ВТ-474, гиперэкспрессирующих опухолеспецифический антиген HER2/neu.
Клетки инкубируют с белком 4D5 scFv-HSP70, затем образцы окрашивают по стандартной методике первыми (BRM22) и вторыми антителами (anti-mouse-IgG), меченными флуорохромом FITC.
А - гистограммы, зарегистрированные при проточно-цитометрическом анализе контрольных и экспериментального образцов клеток.
На гистограммах: ось X - интенсивность флуоресценции, ось Y - количество событий.
Контроль 1 - anti-mouse-IgG-FITC; контроль 2 - BRM22+anti-mouse-IgG-FITC; контроль 3 - рекомбинантный БТШ70+BRM22+anti-mouse-IgG-FITC; эксперимент - 4D5 scFv-HSP70+BRM22+anti-mouse-IgG-FITC.
Б - величина средней интенсивности флуоресценции, зарегистрированная для проанализированных образцов клеток.
Фигура 2. Проточно-цитометрический анализ связывания рекомбинантного белка «4D5 scFv-HSP70» с поверхностью клеток НЕК-293, не характеризующихся экспрессией HER2/neu-антигена.
Клетки НЕК-293 инкубируют с белком 4D5 scFv-HSP70, затем образцы окрашивают по стандартной методике первыми (BRM22) и вторыми антителами (anti-mouse-IgG), меченными флуорохромом FITC.
А - гистограммы, зарегистрированные при проточно-цитометрическом анализе контрольных и экспериментального образцов клеток.
На гистограммах: ось X - интенсивность флуоресценции, ось Y - количество событий.
Контроль 1 - anti-mouse-IgG-FITC; контроль 2 - BRM22+anti-mouse-IgG-FITC; эксперимент - 4D5 scFv-HSP70+BRM22+anti-mouse-IgG-FITC.
Б - величина средней интенсивности флуоресценции, зарегистрированная для проанализированных образцов клеток.
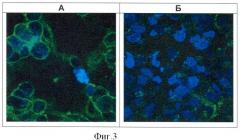
Фигура 3. Визуализация связывания рекомбинантного белка «4D5 scFv-HSP70» с поверхностью клеток ВТ-474, гиперэкспрессирующих опухолеспецифический антиген HER2/neu.
Клетки инкубируют с белком 4D5 scFv-HSP70, затем образцы окрашивают по стандартной методике первыми (BRM22) и вторыми антителами (anti-mouse-IgG), меченными флуорохромом Alexa Fluor 488. Ядра клеток окрашены флуорохромом DAPI (А). Контрольный образец клеток окрашен только вторыми антителами и флуорохромом DAPI (Б).
Визуализацию проводят на лазерном конфокальном микроскопе ECLIPSE ТЕ2000-Е ("Nikon", Япония). Увеличение 100х.
Фигура 4. Влияние на цитолитическую активность NK-клеток человека обработки клеток-мишеней ВТ-474, гиперэкспрессирующих опухолеспецифический антиген HER2/neu, белком 4D5 scFv-HSP70.
Условия обработки клеток-мишеней: I - контроль (без обработки); II - рекомбинантный БТШ70; III - 4D5 scFv-БТШ70.
Изобретение иллюстрируют примеры.
Пример 1.
Получение рекомбинантного белка 4D5 scFv-БТШ70.
Результаты, иллюстрирующие обоснованность и эффективность заявляемого способа, получены с использованием экспрессированного и выделенного нами из бактериальной культуры генно-инженерного рекомбинантного протеина 4D5 scFv-HSP70, содержащего молекулу белка теплового шока (HSP70) и мини-антитело 4D5 scFv к опухолеспецифическому поверхностному антигену HER2/neu, экспрессирующимся многими разновидностями злокачественных новообразований, в частности клетками карциномы молочной железы человека ВТ-474.
Для экспрессии заданного белка в бактериальной культуре нами была изготовлена плазмида pET23_ScFv4D5_HSP70, кодирующая белок слияния: одноцепочечное мини-антитело 4D5 и белок HSP70. Фрагмент ДНК, кодирующий белок HSP70, получали при помощи ПЦР с праймерами: 5'-TACTAGGCGCGCCGATACTAGTGGCGCCTCCAAG-3' и 5'-ATCGTCAAGCTTACTAATCTACCTCCTCAATGGTG-3', в качестве матрицы использовали плазмиду, содержащую ген, кодирующий белок HSP70. Полученный ПЦР продукт клонировали по сайтам эндонуклеаз рестрикции AscI и HindIII в плазмиду pET23_ScFv4D5, содержащую ген, кодирующий одноцепочечное мини-антитело, 4D5 под контролем промотера Т7 РНК-полимеразы, что обеспечивает высокий уровень экспрессии целевого гена в бактериальной системе.
Для получения рекомбинантного белка 4D5 scFv-БТШ70 использовали плазмиду pET23_ScFv4D5 со вставкой генов, кодирующих соответствующие белки и линкерный участок. Для экспрессии белков использовали бактериальную систему на основе Е.coli. Для определения оптимальных условий продукции белка клетки выращивали в различных условиях: комбинации трех температурных режимов - 25, 30, 37°C, различных концентраций ИПТГ - 0,7 и 0,35 мМ и времени инкубации после добавления индуктора в культуру - 4 и 14 часов. Наибольший выход белка наблюдали в следующих пробах: 14 ч, 25°C, 0,35 мМ IPTG; 14 ч, 30°C, 0,35 мМ IPTG; 14 ч, 30°C, 0,7 мМ IPTG; 14 ч, 37°C, 0,7 мМ IPTG. В этих пробах определили соотношение белка в растворимой и нерастворимой фракциях. Для экспрессии белка были выбраны следующие условия: 30°C, 0,7 мМ IPTG, время инкубации - 14 ч.
В плазмиду pET23_ScFv4D5 заложена последовательность, кодирующая 6 гистидиновых остатков, что дает возможность использовать никель-аффинную хроматографию для выделения наработанного белка из бактериальных культур. В ходе работы были опробованы различные методы выделения белков с использованием Ni-аффинной хроматографии. При выделении в нативных условиях выход белка получался невысоким, по-видимому, из-за экранирования гистидиновых остатков другими участками белковой молекулы. В итоге был выбран метод выделения и очистки в денатурирующих условиях. Клетки E.coli лизировали буфером с 8М мочевиной. Лизат инкубировали с уравновешенным Ni-агарозным сорбентом, затем наносили на колонку и элюировали связавшийся белок с помощью кислого буфера (рН 4, 5).
Концентрацию белка определяли спектрофотометрически по оптической плотности раствора при 280 нм. Образцы элюата с максимальным количеством белка объединяли и использовали в дальнейшей работе. Выделение проводили в денатурирующих условиях, при которых нарушается вторичная и третичная структура белка, а значит, теряется его активность. Удаление мочевины из раствора белка и рефолдинг осуществляли с помощью диализа против буфера на основе MOPS.
Для определения специфичности полученного белка был проведен иммуноблоттинг с коммерческими антителами к БТШ70 - BRM22 (Sigma, USA). Результаты блоттинга подтвердили, что полученные нами белки распознаются антителами к БТШ70 человека. Выход сконструированного белка составил 1 мг на 100 мл накопительной культуры 1 мг.
Пример 2.
Специфическое связывание рекомбинантного белка 4D5 scFv-HSP70 с поверхностью опухолевых клеток, экспрессирующих опухолеспецифический антиген HER2/neu.
В экспериментах использовали клетки карциномы молочной железы человека ВТ-474, характеризующиеся высоким уровнем экспрессии опухолеспецифического поверхностного антигена HER2/neu. Клетки ВТ-474 культивировались в 6-луночных планшетах ("Nunk", USA) и в культуральных флаконах (25 см2, "Costar", USA) в питательной среде RPMI 1640 ("Flow Laboratories", U.K.), содержащей 10% фетальной сыворотки плода теленка (FCS), 50 мкг/мл стрептомицина и 50 мкг/мл пенициллина («Биосинтез», Россия) в 5% СО2 при +37°C. При пересеве исходная концентрация клеток составляла 1,5×106 кл./мл, пересев проводился через 3 суток, при этом клетки нарастали до 4×106 кл./мл. ВТ-474 являются адгезионными клетками, прикрепляющимися к подложке флаконов в процессе культивирования, поэтому их снимали с подложки для пересева и для экспериментального анализа раствором Версена, но без применения трипсина, способного повредить мембраносвязанные рецепторы.
В качестве контроля использовали клетки линии НЕК-293 - клетки эмбриональной почки, не характеризующиеся экспрессией HER2/neu на своей поверхности. Клетки культивировали в 6-луночных планшетах (Nunk, USA) и в культуральных флаконах (25 см2, Costar, USA) в питательной среде DMEM-F12 (Flow Laboratories, U.K.), содержащей 10% фетальной сыворотки (FCS), 50 мкг/мл стрептомицина и 50 мкг/мл пенициллина (Биосинтез, Россия) в 5% CO2 при +37°С. При пересеве исходная концентрация клеток составляла 4×105 кл./мл, пересев проводят через 2 суток, при этом клетки нарастали до 3×106 кл./мл.
Доставка БТШ70 к клеточной поверхности в составе белка 4D5 scFv-HSP70, представляющего собой сплавленные рекомбинантные анти-HER2/neu-мини-антитело (белок 4D5 scFv) и БТШ70 (HSP70).
Для обработки клеток белком 4D5 scFv-HSP70 их снимали с подложки флакона для культивирования и переводили в фосфатно-солевой буфер (ПанЭко, Россия) с добавлением солей (2,5 мМ СаСl2, 2,5 мМ MgSO4, 0,1% NaN3) и 1% FCS из расчета 250 тыс. клеток на образец. Далее клетки инкубировали с белком 4D5 scFv-HSP70 (50 мкг/мл) на ледяной бане 40 минут, после чего их дважды отмывали приготовленным фосфатным буфером.
Для оценки эффективности адресной доставки БТШ70 к поверхности клеток-мишеней использовали метод проточной лазерной цитофлуориметрии. Окрашивание образцов клеток проводили по стандартной методике (Darzynkiewicz Z., et al. Cytometry, 1992, v.13, p.795-808). Эта процедура включала в себя инкубацию клеточной суспензии (45 мин при +4°C) с первыми антителами (связывающимися с БТШ70). Затем клетки дважды отмывали и инкубировали (45 мин при +4°C) со вторыми флуорохром-мечеными антителами, связывающихся с молекулами первых антител. После заключительной двукратной отмывки образцов проводили их измерение на проточном цитофлуориметре. В работе использовали антитела к БТШ70 BRM22 ("Sigma", USA) в концентрации 10 мкг/мл и вторые антитела - anti-mouse IgG-FITC ("Sigma", USA). Измерения проводили на проточном лазерном цитофлуориметре FACScan ("Becton Dickinson", USA). В каждом образце анализировали не менее 5000 клеток. Статистический анализ проводили с использованием компьютерной программы "WinMDI" для обработки гистограмм, полученных во время цитофлуориметрического анализа.
Результаты анализа на проточном цитофлуориметре представлены в виде гистограмм. На чертеже присутствуют результаты измерения интенсивности флуоресценции клеток опытного образца и контрольных образцов. Отражены контроли на неспецифическое связывание вторых, флуорохром-меченных антител с клеточной поверхностью, на взаимодействие первых антител BRM22 с поверхностью клеток, необработанных экзогенными протеинами (для проверки возможного присутствия на плазматической мембране эндогенных БТШ70), и с поверхностью клеток, обработанных рекомбинантными БТШ70 (для проверки возможного самостоятельного связывания этих протеинов с клеточной поверхностью, не обусловленного мини-антителами к антигену HER2/neu.
Цитофлуориметрический анализ выявил высокий уровень флуоресценции клеток ВТ-474, обработанных белком 4D5 scFv-HSP70, что свидетельствует о эффективном связывании этих рекомбинантных протеинов с клеточной поверхностью (Фигура 1). Полученные данные говорят также о способности рекомбинантного БТШ70 самостоятельно взаимодействовать с клеточной мембраной, на что указывает смещение пика гистограммы соответствующего контрольного образца (на Фигуре 1 он обозначен контроль 3) по сравнению с контролем на неспецифическое связывание вторых антител (контроль 1) и с контролем на присутствие на клеточной поверхности эндогенных БТШ70 (контроль 2) в область повышенного уровня флуоресценции. Это можно объяснить тем, что БТШ70 способен взаимодействовать как с билипидным слоем мембраны за счет своих структурных особенностей, так и с поверхностными белками (Multhoff G., Hightower L. Cell stress chaperones, 1996, v.1, p.167-176).
Связывание белка 4D5 scFv-HSP70 с поверхностью клеток ВТ-474 является специфическим, обусловленным взаимодействием анти-HER2/neu-мини-антител с соответствующим поверхностным антигеном. Об этом свидетельствуют результаты цитофлуориметрических измерений в опытах с клетками линии НЕК-293 - клетки эмбриональной почки, не экспрессирующими HER2/neu-антиген на своей поверхности. Данные цитофлуориметрического анализа показывают отсутствие заметного связывания белка 4D5 scFv-HSP70 с клетками этой линии (Фигура 2). Незначительный сдвиг вправо гистограммы, соответствующей опытному образцу (эксперимент), по сравнению с контрольными, можно объяснить взаимодействием БТШ70, входящим в состав белка 4D5 scFv-HSP70, с мембранными структурами этих клеток.
Очевидно, что привлечение и активация цитотоксической активности эффекторов иммунной системы поверхностными БТШ70 возможна лишь при достаточной плотности этих молекул на поверхности опухолевых клеток. Обеспечение высокой концентрации БТШ70, обусловленной адресной доставкой этих молекул на поверхность опухолевых клеток ВТ-474 белком 4D5 scFv-HSP70, иллюстрирует визуализация результата такой адресной доставки, проведенная с помощью лазерной конфокальной микроскопии. Для визуализации поверхностных БТШ70 клетки ВТ-474 после обработки белком 4D5 scFv-HSP70 окрашивают по стандартной методике с использованием вторых антител, конъюгированных с флуорохромом Alexa Fluor 488 ("Molecular Probes", USA). Затем на стекло с клетками наносят каплю специальной полимеризующейся гелеобразной среды Mowioll, сохраняющей морфологию клеток и предохраняющей флуорохром от выгорания ("Biomeda", USA), накрывают покровным стеклом и оставляют в темноте до микроскопического анализа. Фотографирование клеток проводят на конфокальном микроскопе ECLIPSE ТЕ2000-Е ("Nikon", Japan). Анализ полученных фотографий продемонстрировал высокую плотность поверхностной локализации БТШ70 на клетках ВТ-474, обработанных белком 4D5 scFv-HSP70 (Фигура 3).
Пример 3.
Оценка влияния обработки опухолевых клеток карциномы ВТ-474 белком 4D5 scFv-HSP70 на цитотоксическую активность NK-клеток человека.
В экспериментах использовали NK-клетки человека, выделенные из периферической крови доноров, и клеточную линию карциномы молочной железы человека ВТ-474, гиперэкспрессирующую HER2/neu-антиген.
Периферическую кровь здоровых доноров получали в отделении переливания крови Российского Онкологического Научного Центра РАМН. Выделение мононуклеаров проводили по стандартной методике (Лимфоциты. Методы. Под ред. Дж. Клауса. Пер. с англ. М.: Мир, 1990) с использованием раствора фиколла плотностью 1,077-1,078 г/см3 и фосфатного солевого буфера (далее PBS), рН 7,2-7,4 (KH2PO4 - 1.7 mM, Na2HPO4 - 5.2 mМ, NaCl - 150 mМ), приготовленного на деионизированной воде, полученной на фильтрах фирмы Millipore (Ирландия). Раствор фиколла подслаивали на дно пробирки, содержащей кровь либо лейкоцитарную массу, разбавленную в 2-4 раза PBS. После этого проводили центрифугирование образцов крови при 400 g в течение 20 мин при комнатной температуре. В результате центрифугирования фракция мононуклеаров периферической крови накапливается в интерфазе - на границе, разделяющей клеточную суспензию и раствор фиколла. Для выделения фракции мононуклеаров оставшийся над раствором фиколла супернатант удаляли, а интерфазу переносили в новую пробирку и разбавляли эту клеточную суспензию не менее чем четырехкратным избытком PBS с последующим тщательным перемешиванием. Полученный образец мононуклеаров центрифугировали 15 мин при 400 g, затем еще два раза по 10 мин при 200 g, для удаления примеси тромбоцитов.
Для изоляции NK-клеток из полученных образцов мононуклеары, после выделения на градиенте фиколла, подвергали магнитной сепарации с использованием набора для сепарации NK-клеток (MACS NK cell isolation kit II, Miltenyi Biotec, Германия). В соответствии с рекомендациями производителя популяцию мононуклеаров обрабатывали коктейлем антител, конъюгированных с биотином, против CD3, CD4, CD14, CD15, CD19, CD36, CD123 и гликофорина А, то есть против маркеров, которые в совокупности несут все клетки периферической крови, кроме натуральных киллеров. После инкубации с антителами к суспензии клеток добавляли магнитные микрочастицы с ковалентно пришитыми антителами к биотину. При этом все клетки, покрытые антителами, связываются с магнитными микрочастицами, а NK-клетки остаются несвязанными. Приготовленные таким образом клеточные образцы наносили на колонку LD, заполненную ферромагнитными частицами и закрепленную в магните-держателе. После прохождения суспензии клеток через колонку ее промывали 3-кратно тремя милилитрами PBS, содержащим FCS (0,5% по объему) и 2 мМ ЭДТА. По окончании магнитной сепарации клетки переводили в питательную среду на основе RPMI-1640 с добавлением 2 мМ L-глутамина, раствора пенициллина и стрептомицина и инактивированной прогреванием при+56°С в течение 1 ч FCS (10% по объему) обозначаемую далее как полная питательная среда. В результате описанной процедуры магнитной сепарации содержание NK-клеток в полученных образцах увеличивается до 90-98% от всех мононуклеаров, содержащихся в выделенной клеточной суспензии.
В качестве метода оценки цитотоксичности, опосредованной NK-клетками, использовали нерадиоактивный цитотоксический тест CytoTox96 (Promega, США), основанный на количественном определении выхода лактатдегидрогеназы (ЛДГ) из клеток-мишеней, обусловленного цитолитическим действием естественных киллеров на опухолевые клетки. Концентрацию ЛДГ в супернатанте измеряли с помощью ферментативной реакции, сопровождающейся превращением соли тетразолия (INT) в фотометрически регистрируемую синюю форму формазана:
NAD++лактат→ЛДГ→пируват+NADH
NADH+INT→диафораза (акцептор электронов)→NAD++формазан
Цитотоксический тест проводили в плоскодонном 96-луночном планшете в культуральной среде, содержащей 2% FCS. В качестве мишеней использовали клетки линии ВТ-474 (15×103 кл./образец), внесенные в лунки за 4 часа до эксперимента с последующей их обработкой белком 4D5 scFv-HSP70. Контролями служили лунки, не обработанные этим белком или проинкубированные с рекомбинантным БТШ70. После внесения в лунки рекомбинантных протеинов (10 мкг/мл) и последующей инкубации клеток-мишеней в их присутствии (30 минут при 4°C) планшеты подвергали центрифугированию, сбрасыванию и замене культуральной среды на свежую с целью удаления из лунок не связавшихся белков. Каждая экспериментальная точка повторялась в трех репликах. NK-клетки вносят в лунки в соотношении 7:1 к клеткам-мишеням. Затем их осаждали центрифугированием и помещали планшеты в CO2-инкубатор в нормальные физиологические условия на 3 часа. В часть лунок за 45 мин до окончания инкубации добавляли лизирующий буфер. После окончания культивирования клеток-мишеней в присутствии цитотоксических эффекторов планшеты центрифугировали и переносили супернатант (50 мкл из каждой лунки) в другой плоскодонный 96-луночный планшет, в лунки которого добавляли субстратную смесь, содержащую лактат, диафоразу, NAD+ и соли тетразолия. Описанная выше ферментативная реакция проходила в процессе инкубации планшета в течение 30 мин при комнатной температуре в темноте. По окончании срока инкубации реакцию блокировали путем добавления в лунки раствора уксусной кислоты. Помимо ЛДГ в экспериментальных лунках, содержащих смесь эффекторов и мишеней (ЭМ), оценивали фоновое содержание ЛДГ в культуральной среде (С), спонтанный выход ЛДГ как из клеток-мишеней (М), так и из эффекторных клеток (Э), а также максимальный выход ЛДГ из клеток-мишеней при их полном лизисе (Мmах). Оптическую плотность измеряли с помощью многоканального фотометра на длине волны 490 нм. Процент специфического лизиса клеток мишеней (СЛ) оценивали с помощью формулы
СЛ(%)=[(ЭМ-Э)-М+C]/[Mmax-М]×100.
В результате установлено, что адресная доставка молекул БТШ70 к поверхности опухолевых клеток значительно увеличивает противоопухолевый цитолитический эффект NK-клеток. В частности, приведенные на Фигуре 4 данные свидетельствуют о превышении более чем в пять раз по сравнению с контролем уровня ЛДГ в лунках, где клетки-мишени были обработаны белком 4D5 scFv-HSP70 (повышение внеклеточной концентрации ЛДГ в этой тест-системе прямо пропорционально уровню цитолитического эффекта NK-клеток). В то же время, примерно двукратное усиление цитотоксического действия NK-клеток наблюдается и в лунках с клетками-мишенями, проинкубированными с рекомбинантными БТШ70, не имеющими «нацеливающего» модуля (анти-НER2/neu-мини-антитело) в своем составе (Фигура 4). Это объясняется уже продемонстрированной в примере 1 способностью экзогенных БТШ70 самостоятельно связываться с поверхностью опухолевых клеток и тем самым приводить к усилению противоопухолевой цитолитической реакции NK-клеток.
Способ стимуляции противоопухолевой активности цитотоксических эффекторов иммунной системы путем направленной доставки к поверхности опухолевых клеток молекул БТШ70, привлекающих и активирующих NK-клетки, с использованием введения в организм опухоленосителя рекомбинантных протеинов, содержащих мини-антитело, к опухолеспецифическим антигенам и молекулу БТШ70.