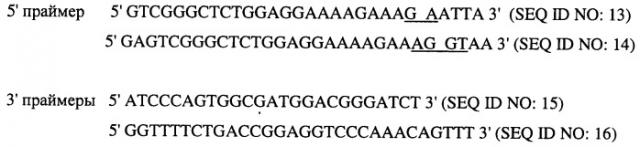Лечение опухолей, экспрессирующих мутантные рецепторы egf
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для определения антител к рецептору эпидермального фактора роста (EGFR), снижающих или предупреждающих передачу сигнала интактными EGFR или EGFRvIII. Способы по изобретению включают (а) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим EGFR дикого типа, (b) контактирование кандидата антитела с белком EGFR или его фрагментом, имеющим мутантный EGFR сравнение связывания кандидата антитела с белком EGFR или его фрагментом, на стадии (а) со связыванием кандидата антитела с белком EGFR или его фрагментом на стадии (b), причем антитело, связывающееся с EGFR на стадии (а), а не на стадии (b), идентифицируется как антитело анти-EGFR, которое снижает или предупреждает передачу сигнала интактными EGFR или EGFRvIII. Использование изобретений позволяет идентифицировать антитела, ингибирующие сигнальную трансдукцию интактным EGFR. 3 н. и 16 з.п. ф-лы, 9 ил., 3 табл.
Реферат
Предпосылки создания изобретения
В целом изобретение относится к способам лечения опухолей, которые экспрессируют мутантные формы рецептора эпидермального фактора роста (EGFR).
Рак по-прежнему представляет собой в значительной мере нерешенную проблему. При многих типах рака, в особенности в случае солидных опухолей, EGFR аберрантно экспрессируется и участвует в патогенезе рака.
Ген EGFR является клеточным гомологом онкогена erb В, первоначально идентифицированного в вирусах эритробластоза птиц. EGFRvIII представляет собой вариантом EGFR, который присутствует во многих типах рака. EGFRvIII является конститутивно активной формой рецептора, образующегося в результате делеции аминокислотной последовательности из 267 аминокислот во внеклеточном домене.
Для лечения опухолей, "запускаемых" EGFR, применяют две стратегии: моноклональные антитела и родственные белки, которые связываются с внеклеточным доменом, и малые молекулы, которые связываются с внутриклеточным киназным доменом EGFR. Эффективность моноклональных антител частично вызвана ингибированием передачи сигнала рецептора, а частично - иммунологическим действием антител на опухоль, таким как антителозависимая клеточно-опосредованная цитотоксичность (ADCC). Кроме того, терапевтические моноклональные антитела могут также влиять на интернализацию и стабильность рецептора. Очевидно, ингибирование передачи сигнала важно для противоопухолевого эффекта лекарства на основе антител, в то время как антитела, которые обычно узнают опухолеспецифические антигены, обычно неэффективны.
Хотя некоторые антитела против EGFR испытаны и применяются в качестве противораковых лекарств, в настоящее время отсутствует четкая корреляция между реакцией пациента на конкретное антитело против EGFR и экспрессией конкретного мутантного или дикого типа EGFR. Таким образом, необходимы противораковые лекарства, которые могут специфически ингибировать передачу сигнала EGFRvIII и родственных мутантных форм EGFR в раковых клетках, экспрессирующих EGFRvIII.
Сущность изобретения
В целом изобретение относится к открытию, что антитела, распознающие определенные эпитопы в EGFR, применимы для ингибирования сигнальной трансдукции при использовании как интактного EGFR, так и вариантов EGFR, конкретно, делеционных вариантов EGFR, таких как EGFRvIII.
Авторы изобретения нашли эпитоп антитела против EGFR EMD72000. Этот эпитоп включает аминокислоты Ser460/Gly461 и соседние аминокислоты на поверхности EGFR. Также обнаружено, что связывание с этим эпитопом в EGFRvIII с помощью EMD72000 и других антител, распознающих тот же самый эпитоп, блокирует димеризацию EGFRvIII со второй молекулой EGFR, такой как интактный EGFR или вторая молекула EGFRvIII. В этом состоит их отличие от антител, таких как 13А9 и других, которые связываются с EGFRvIII способом, который пространственно не запрещает EGFRvIII принимать конформацию, способную (компетентную) к димеризации. Установлено также, что EMD72000 может ингибировать передачу рецепторного сигнала как EGFRvIII, так и EGFR.
Таким образом, предлагается EMD72000 и другие антитела, которые связываются с эпитопом Ser460/Gly461 или которые способны блокировать передачу рецепторного сигнала как EGFR, так и EGFRvIII, применять для лечения раковых заболеваний, при которых экспрессируется EGFRvIII, или вероятность его экспрессии высока.
В целом изобретение включает методы лечения раковых заболеваний, при которых могут экспрессироваться EGFR варианты с делецией во внеклеточном домене. Методы обычно включают стадии первой оценки вероятности того, что данный тип рака у субъекта экспрессирует делегированный EGFR вариант, а затем лечение субъекта антителом по изобретению. Лечение таким антителом, предпочтительно, осуществляют тогда, когда считают вероятность экспрессии делегированного варианта EGFR при рассматриваемом раковом заболевании высоким.
В первом аспекте изобретение включает способ лечения, предупреждения или стабилизации ракового заболевания у нуждающегося в этом субъекта, этот способ включает стадии (а) определение, действительно эта раковая опухоль экспрессирует EGFRvIII, и (б) введение субъекту с диагностированным раковым заболеванием, при котором экспрессируется EGFRvIII, антитела, которое узнает эпитоп Ser460/Gly461 человеческого EGFR, причем антитело вводят в течение такого времени и в таком количестве, которые достаточны для лечения, предупреждения или стабилизации ракового заболевания у субъекта.
В предпочтительных вариантах данного аспекта изобретения антитело включает аминокислотную последовательность вариабельной области тяжелой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:9, или аминокислотную последовательность вариабельной области легкой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:3. Желательно, антитело включает аминокислотную последовательность вариабельной области, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO:3 и 9. Или же, или помимо этого, можно использовать антитело, которое распознает эпитоп, содержащий аминокислоты 452, 454, 457, 462 или 463, или аминокислоты, находящиеся внутри последовательностей, примерно, от 406 до 413 или, примерно, от 314 до 337 EGFR. Неограничивающие примеры антител, применимых в данном аспекте изобретения, включают EMD72000, mAb528, h- R3, mAb 425 и антигенсвязывающие фрагменты любого из вышеперечисленных антител. Включают также гуманизированные, DeImmunized™ (деиммунизированные), модифицированные (например, для повышения стабильности или для снижения иммуногенности у людей, когда это целесообразно) или химерные производные любого из вышеуказанных антител. V-области антител по изобретению можно также использовать по отношению к слитым белкам, одноцепочечным Fv фрагментам, Fab фрагментам и другим конструкциям, полученным методом генетической инженерии.
В дополнительных предпочтительных вариантах изобретения антитело снижает или предупреждает передачу сигнала (например, превращение в активную конформацию, интернализация рецептора, димеризация рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата) интактным EGFR или EGFRvIII. Желательно, передача сигнала ослабляется, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более.
В другом аспекте изобретение включает способ лечения, предупреждения или стабилизации рака у нуждающегося в этом субъекта, который включает стадии (а) определение, действительно эта раковая опухоль экспрессирует EGFRvIII, и (б) введение субъекту с диагностированным раковым заболеванием, при котором экспрессируется EGFRvIII, антитела, которое связывает EGFRvIII и снижает или ингибирует передачу сигнала от рецептора EGFRvIII, причем антитело вводят в течение такого времени и в таком количестве, которые достаточны для лечения, предупреждения или стабилизации ракового заболевания у субъекта. Желательно, чтобы антитело связывалось с эпитопом, содержащим аминокислоты 452, 454, 457, 462 или 463, аминокислоты Ser460/Gly461 человеческого EGFR, аминокислоты 406-413 человеческого EGFR, аминокислоты 314-337 человеческого EGFR, или связываться с сайтом на домене 3 EGFR, который предотвращает переход домена 2 в конформацию, обеспечивающую передачу сигнала.
В предпочтительных вариантах данного аспекта изобретения антитело включает аминокислотную последовательность вариабельной области тяжелой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:9, или аминокислотную последовательность вариабельной области легкой цепи, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO:3. Желательно, антитело включает аминокислотную последовательность вариабельной области, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO:3 и 9. Неограничивающие примеры антител, применимых в данном аспекте изобретения, включают EMD72000, mAb528, h- R3, mAb 425 и антигенсвязывающие фрагменты, гуманизированные или химерные производные любого из любого из вышеперечисленных антител. Включают также гуманизированные, DeImmunized™ (деиммунизированные), модифицированные (например, для повышения стабильности или для снижения иммуногенности у людей, когда это целесообразно) или химерные производные любого из вышеуказанных антител. V-области антител по изобретению можно также использовать по отношению к слитым белкам, одноцепочечным Fv фрагментам, Fab фрагментам и другим конструкциям, полученным методом генетической инженерии.
Передача сигнала от рецептора (рецепторного сигнала) EGFR включает превращение (переход) в активную конформацию, интернализацию рецептора, димеризацию рецептора, аутофосфорилирование рецептора и фосфорилирование субстрата. Желательно, передача сигнала ослабляется, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более.
Неограничивающие примеры раковых заболеваний, которые можно лечить или предупреждать, используя способы по изобретению, включают раковые заболевания по данному описанию и, в частности, глиобластому, медуллобластому, рак молочной железы, рак яичника и карциному простаты. В одном примере субъектом является субъект с предраковым поражением, которое, по определению, экспрессирует EGFRvIII, и способ применяется для предупреждения рака у субъекта.
Определение, действительно ли раковая опухоль экспрессирует EGFRvIII, можно проводить различными методами. В одном примере тип рака у субъекта сопоставляют с известным коэффициентом (в процентах) экспрессии EGFRvIII для этого типа рака в популяции для определения коэффициента (в процентах) правдоподобия экспрессии EGFRvIII раковой опухолью. Раковое заболевание с процентом правдоподобия, по меньшей мере, 57%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более является предпочтительным для способов по изобретению.
В другом примере от субъекта получают биологический образец и используют для определения присутствия EGFRvIII полипептида. Если в биологическом образце обнаруживают EGFRvIII, считают, что раковая опухоль экспрессирует EGFRvIII. Предпочтительно, для обнаружения EGFRvIII полипептида применяют EGFRvIII-связывающий полипептид (например, антитело) или антисыворотку, которая специфически распознает новую пептидную связь с EGFRvIII. Например, можно использовать антитело MR1-1.
Еще в одном примере от субъекта получают биологический образец и используют для определения присутствия EGFRvIII нуклеиновой кислоты. Если в биологическом образце детектируют EGFRvIII нуклеиновую кислоту, считают, что раковая опухоль экспрессирует EGFRvIII. В уровне техники известны различные способы обнаружения нуклеиновых кислот в биологическом образце, некоторые из них включены в данное описание. Например, нуклеиновую кислоту, которая гибридизуется с новой пептидной связью мРНК EGFRvIII, или ее соответствующей кДНК, можно использовать в качестве зонда для обнаружения EGFRvIII нуклеиновой кислоты методами Саузерн-блоттинга, Нозерн-блоттинга или на основе защиты РНК-азы. Нуклеиновую кислоту, которая гибридизуется с EGFRvIII, можно также использовать в качестве праймера для обнаружения мРНК EGFRvIII или соответствующей ей кДНК в анализах на основе амплификации, таких как ПЦР, OT(RT)-ПЦР, или количественная полимеразная цепная реакция в реальном времени. Помимо этого, нуклеиновые кислоты, которые гибридизуются с EGFR, можно также применять в качестве зондов или праймеров и можно детектировать исходя из разницы в размерах между детектируемой ДНК или мРНК EGFR и ДНК или мРНК EGFRvIII, причем на присутствие EGFRvIII указывает более короткая или быстрее мигрирующая полоса.
В изобретении также раскрываются белковые комплексы, которые включают V области антитела и участки EGFR. Одним из предпочтительных вариантов изобретения является комплекс между EMD72000 и EGFRvIII. Такой комплекс EMD72000/EGFRvIII может находиться на поверхности культивированной клетки или на поверхности клеток больного раком.
Под "EGFR" или "интактным EGFR" понимают любой зрелый полноразмерный рецептор эпидермального фактора роста млекопитающего, включая человеческие и нечеловеческие формы. Включающий 1186 аминокислот человеческий EGFR описан в Ullrich et al., Nature 309:418-425 (1984)) и GenBank Регистрационный No. AAH94761.
Под "EGFRvIII" понимают вариант EGFR, в котором делегированы экзоны 2-7, в результате получают делецию 267 аминокислот в рамке считывания во внеклеточном домене EGFR. EGFRvIII известен как мутант типа III, дельта-EGFR, EGFRde2-7 и AEGFR и описан в патентах США No. 6455498, 6127126, 5981725, 5814317, 5710010, 5401828 и 5212290. Обычно белок EGFRvIII начинается со следующей аминокислотной последовательности: Leu Glu Glu Lys Lys Gly Asn Tyr Val Val Thr Asp His (SEQ ID NO:18), а далее идет остаток зрелого EGFR. Конкретно, присутствуют первые пять аминокислот зрелого EGFR (Leu Glu Glu Lys Lys (SEQ ID NO:19)), затем идет остаток глицина из гибридного кодона вследствие альтернативного сплайсинга, а затем идет последовательность зрелого EGFR, начиная с нуклеотида 274. Экспрессия EGFRvIII может являться результатом хромосомной делеции, а также аберрантного альтернативного сплайсинга. См. Sugawa et al., Proc. Natl. Acad. Set 87:8602-8606 (1990).
Под "EGFRvIII новым пептидным связыванием (связью, сочленением)" понимают следующую аминокислотную последовательность Leu Glu Glu Lys Lys Gly Asn Tyr Val Val Thr Asp His (SEQ ID NO:18), которую продолжает остаток зрелого EGFR, где последовательность Leu Glu Glu Lys Lys (SEQ ID NO:19) образуется из экзона 1 EGFR, Gly представляет собой новую аминокислоту, получающуюся из нового кодона, образованного на границе сплайсинга между экзоном 1 и экзоном 8, а Asn-Туг-Val-Val-Thr-Asp-His (SEQ ID NO:20) и соответствующие аминокислоты взяты из экзона 8 EGFR.
Под "делегированным EGFR вариантом (вариантом с делецией)" понимают делегированный вариант EGFR, в котором отсутствует (пропущен) участок внеклеточного домена, так что EGFR передача сигнала становится, по меньшей мере, частично независимой от лиганда.
Под "антителом" понимают иммуноглобулиновый белок (или белки, как в случае поликлонального антитела), или его производное, натуральный или синтетический, способный связываться с антигеном. Термин также включает моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные, по меньшей мере, из двух интактных антител, фрагменты антител и гетероантитела, которые состоят из двух или более антител, или из фрагментов с различной специфичностью связывания, которые связаны друг с другом. Производные, подпадающие под этот термин, включают антитела, имеющие модифицированную последовательность, но сохраняющие способность специфически связываться с антигеном, включая интерспецифические (межвидовые гибридные), биспецифические, химерные, гуманизированные антитела, и иммуноконъюгаты, полученные в результате конъюгации антитела с дополнительной молекулой (например, цитотоксической молекулой), примеры которых даны в опубликованной заявке РСТ No. WO 2004/032960. Антитело может быть моноклональным или поликлональным и может находиться в различных средах, включая, но без ограничения, сыворотку или супернатант, или в чистом виде. По данному описанию антитела можно получать любым известным методом, включая сбор с культуры клеток нативных В лимфоцитов, гибридомы, системы рекомбинантной экспрессии, фаговый дисплей и т.п. Методы получения моноклональных антител известны в уровне техники и включают метод гибридом, описанный Kohler and Milstein (Nature 256, 495 (1975)) и в "Monoclonal Antibody Technology, The Production and Characterization of Rodent and Human Hybridomas" (Burdon et al., Eds, Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13, Elsevier Science Publishers, Amsterdam (1985)), или их можно получать хорошо известными методами рекомбинантной ДНК (см., например, патент США 4816567). Моноклональные антитела можно также выделять с помощью фаг-дисплейных библиотек методами, описанными, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol Biol, 222:58, 1-597 (1991). Методы получения поликлональных антител известны специалистам в данной области техники. Например, поликлональные антитела можно получать, иммунизируя кроликов или других животных инъекцией антигена с последующими бустер-инъекциями через соответствующие интервалы. У животных берут кровь и анализируют сыворотку в сравнении с очищенным белком, обычно методом ELISA или с помощью биоанализа, основанного на способности блокировать действие соответствующего гена. При использовании птиц различных видов, например кур, индюшек и т.п., антитело можно выделять из яичного желтка. Методы получения химерных и гуманизированных антител также известны в уровне техники. Например, методы получения химерных антител включают методы, представленные в данном описании. Гуманизированные моноклональные антитела можно получать методами, описанными в Международной патентной заявке WO 87/02671; Европейских патентах ЕР 184187; ЕР 171496; ЕР 173494; Международной патентной заявке WO 86/01533; Патентах США No. 4816567, 4816397, 5585089, 5225539, 6331415; Европейском патенте ЕР 125023; Better et al., Science 240:1041-1043 (1988); Liu et al., Proc Natl Acad Sci. U.S.A. 84:3439-3443 (1987); Liu et al., J Immunol 139:3521-3526 (1987); Sun et al., Proc Natl Acad Sci. U.S.A. 84:214-218 (1987); Nishimura et al., Cancer Res. 47:999-1005 (1987); Wood. et al., Nature 314:446-449 (1985); Shaw et al., J Natl Cancer Inst. 80:1553-1559 (1988); Morrison Science 229:1202-1207 (1985); Oi et al., Biotechniques 4:214 (1986); Jones et al., Nature 321:552-525 (1986); Verhoeyan et al., Science 239:1534 (1988); Beidler et al., J Immunol. 141:4053-4060 (1988); Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); и Verhoeyen et al., Science 239:1534-1536 (1988).
Под "антисывороткой" понимают сыворотку крови человека или животных, содержащую иммуноглобулины, специфические к одному или более антигенов. Примеры антисыворотки EGFRvIII известны в уровне техники, например, описаны в Kallio et al., Br. J. Cancer 89:1266-1269 (2003).
"Фрагмент антитела" или "фрагмент белка антитела" относится к участку антитела (например, Fv), способному связываться с антигеном. Фрагменты, подпадающие по этот термин по данному описанию, включают фрагменты, образующиеся при расщеплении (гидролизе) различными пептидазами, такие как Fab, Fab' и F(ab)'2 фрагменты, фрагменты, образующиеся при химической диссоциации, химическом расщеплении и методами рекомбинантной ДНК. Типические рекомбинантные фрагменты, полученные, например, методом фагового дисплея, включают одноцепочечные фрагменты Fab и scFv ("одноцепочечную вариабельную область"). Производные, охватываемые данным термином, включают производные с модифицированной последовательностью, включая межвидовые гибридные, химерные и гуманизированные антитела, но сохраняющие способность связывать антиген.
Под "вариабельной областью" или "вариабельным доменом" понимают участок тяжелой или легкой цепи антитела, имеющий аминокислотную последовательность, значительно отличающуюся среди антител и использующуюся при связывании и для специфичности каждого конкретного антитела к его конкрентному антигену. Вариабельность сосредоточена в "гипервариабельных областях" или "области, определяющие комплементарность" (CDR), в вариабельных доменах как легкой, так и тяжелой цепи. Области между CDR являются более высококонсервативными и называются каркасными областями (FR). Вариабельные области каждой нативной тяжелой и легкой цепи содержат четыре FR (FR1-FR4), принимающие, в основном, конфигурацию β-складки, связанные гипервариабельными областями, которые образуют петли, связывающие, а в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости FR участками и вместе с гипервариабельными областями другой цепи участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC). Термин "гипервариабельная область" или "CDR" по данному описанию относится к аминокислотным остаткам антитела, отвечающим за связывание с антигеном. Желательно, чтобы антитела, применимые в способах изобретения, были практически идентичны, по меньшей мере, части вариабельного домена (тяжелой цепи, легкой цепи или обеих) EMD72000.
Под "практически (в значительной степени) идентичной" понимают нуклеотидную, белковую или аминокислотную последовательность, которая, по меньшей мере, на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична другой нуклеотидной, белковой или аминокислотной последовательности. Выражение "практическая (в значительной степени) идентичность" может применяться в отношении последовательностей различных типов и различной протяженности (длины), таких как полноразмерная последовательность, последовательности эпитопов или иммуногенных пептидов, функциональных доменов, вариабельных областей антител, кодирующие и/или регуляторные последовательности, экзоны, интроны, промоторы и геномные последовательности. Уровень идентичности (в процентах) двух полипептидных или нуклеотидных последовательностей определяют различными способами, известными специалисту в данной области техники, например, применяя общедоступную компьютерную программу, такую как алгоритм (выравнивание) Смита-Ватермана (Smith and Waterman J. Mol. Biol 147:195-7, 1981); программу "BestFit" (Smith and Waterman, Advances in Applied Mathematics, 482-489, 1981), включенную в GeneMatcher Plus™, Schwarz and Dayhof "Atlas of Protein Sequence and Structure," Dayhof, M.O., Ed pp 353-358, 1979; программу BLAST (Basic Local Alignment Search Tool; (Altschul, S. F., W. Gish, et al., J. Mol. Biol. 215:403-410, 1990). BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL, или программу Megalign (DNASTAR). Кроме того, специалисты в данной области техники могут определить соответствующие параметры для определения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по длине сравниваемых последовательностей. Обычно для белков длина сравниваемых последовательностей составляет, по меньшей мере, 10 аминокислот, предпочтительно, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 175, 200, 210, 220, 230, 240, 250 аминокислот или более, вплоть до полной длины белка. Для нуклеиновых кислот длина сравниваемых последовательностей составляет, по меньшей мере, 25, 50, 100, 125, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750 нуклеотидов или более, вплоть до полной длины нуклеотидной молекулы. Понятно, что при определении идентичности с эпитопом протяженность белка, применяемого для сравнения, будет намного короче, например, 5, 7, 10, 12, 15 или 20 или более аминокислот, вплоть до полной длины эпитопа. Понятно, что для определения идентичности последовательностей путем сравнения последовательности ДНК с последовательностью РНК нуклеотид тимин эквивалентен нуклеотиду урацилу. Консервативные замены обычно включают замены внутри следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин.
Под "эпитопом" понимают область на макромолекуле, которая распознается (узнается) антителом. Обычно эпитоп находится в короткой области первичной последовательности белка и имеет длину около 5-12 аминокислот, но он также может представлять собой область вторичной структуры. Предпочтительные эпитопы по изобретению включают Ser460/Gly461 эпитоп человеческого EGFR; аминокислоты 406-413 человеческого EGFR; аминокислоты 314-337 человеческого EGFR; и любой эпитоп в домене 3, который находится на поверхности взаимодействия домена 3' с аминокислотами 274-310. Включается также эпитоп на не-человеческом EGFR, эквивалентный любому из вышеуказанных эпитопов, и этот эпитоп можно определить выравниванием не-человеческого EGFR с человеческим EGFR для определения эквивалентных остатков в не-человеческом EGFR. Антитела, которые связываются с предпочтительными эпитопами, можно определить известными в уровне техники методами анализа. В одном примере связывание возможного (подходящего, кандидата) антитела с интактным EGFR с серином и глицином в положениях 460 и 461 соответственно можно сравнивать со связыванием возможного (подходящего, кандидата) антитела с мутантным EGFR, у которого аминокислоты в этих положениях заменены на другие аминокислоты, например, на аминокислоты с аминокислотной цепью большего размера. Предполагаемое антитело (кандидат), которое связывает EGFR дикого типа, но не мутантный EGFR, в данном анализе идентифицируется как антитело, которое связывает эпитоп Ser460/Gly461.
Под "Ser460/Gly461 эпитопом" понимают область на поверхности EGFR, которая включает аминокислоты Ser460 и Gly461 и, необязательно, включает соседние аминокислоты в пределах 10-15 ангстрем от Ser460 и Gly461. Говорят, что антитело связывается с Ser460/Gly461 эпитопом, если связывание антитела разрывается при введении в положения 460 и/или 461 мутаций, которые обычно не нарушают (не разрывают) структуру EGFR. Например, если антитело связывается с человеческим EGFR, но не связывается с человеческим EGFR, в котором в "человеческой" последовательности в положениях 460 и 461 имеются замены на аминокислоты мышиной последовательности пролин и аспарагин, то говорят, что антитело связывается с Ser460/Gly461 эпитопом. Аналогично, если антитело связывается с человеческим EGFR, но не связывается с человеческим EGFR, в котором в "человеческой" последовательности Ser460 заменен на аминокислоту, такую как аланин, фенилаланин, пролин, треонин, тирозин или аспарагиновая кислота, или в которой Gly461 заменен, например, на лейцин, то говорят, что антитело связывается с Ser460/Gly461 эпитопом.
Под термином "рак", "раковое заболевание" понимают доброкачественное или злокачественное новообразование или доброкачественную или злокачественную опухоль, вызванное(ую) аномальным и неконтролируемым делением клеток. Примеры раковых заболеваний включают, но без ограничения, лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинскую лимфому), макроглобулинемию Вальденстрома, болезнь тяжелых цепей и солидные опухоли, такие как саркомы и карциномы (например, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак простаты, плоскоклеточный рак, базальноклеточный рак, аденокарцинома, рак потовых желез, рак сальных желез, папиллярная карцинома (папиллярный рак), папиллярные аденокарциномы, цистаденокарциномы, медуллярная карцинома, бронхогенную карциному, почечно-клеточный рак (гипернефрома), гепатому, карциному желчного протока, опухоль Вильмса, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, шваннома, менингиома, меланома, нейробластома и ретинобластома). Желательно, чтобы способы по изобретению применялись для лечения рака, который характеризуется экспрессией EGFRvIII.
Под "предраковым поражением" понимают морфологически идентифицируемое поражение, из которого, как предполагают, в значительном числе случаев развивается злокачественная опухоль.
Под "противораковой терапией" ("противораковым лечением)" понимают любую терапию (лечение), направленную на предупреждение, замедление, прекращение или инверсию развития (роста) предракового поражения, рака или метастазов рака. Обычно противораковая терапия уменьшает (ослабляет) или обращает (инвертирует) любой из признаков, который определяет раковую клетку (см. Hanahan et al., Cell 100:57-60, 2000). Наиболее часто лечение рака нацелено на раковые клетки, замедляя, прекращая, обращая или снижая инвазивную способность или снижая способность раковой клетки выживать. Противораковая терапия включает, без ограничения, хирургическую операцию, лучевую терапию (радиотерапию), биотерапию, иммунотерапию, химиотерапию или комбинацию этих видов лечения.
Под "лечением, стабилизацией или предупреждением рака" понимают действия, приводящие к снижению размера опухоли, замедлению или предупреждению увеличения размеров опухоли, увеличению периода безрецидивной выживаемости между исчезновением опухоли и ее повторным появлением, предупреждение первичного или последующего появления опухоли или уменьшение побочного симптома, обусловленного опухолью. В одном предпочтительном варианте изобретения число раковых клеток после лечения, по меньшей мере, на 20, 40, 60, 80 или 100% ниже, чем начальное число раковых клеток, определяемое любым стандартным методом анализа. Предпочтительно, уменьшение числа раковых клеток в результате лечения (введения лекарственного препарата) по изобретению, по меньшей мере, в 2, 5, 10, 20 или 50 раз больше, чем уменьшение числа нераковых клеток. Еще в одном предпочтительном варианте изобретения число раковых клеток после проведения терапии, по меньшей мере, в 2, 5, 10, 20 или 50 раз меньше числа раковых клеток после введения плацебо или контрольного носителя. Предпочтительно, способы по настоящему изобретению уменьшают размер опухоли, определяемый стандартными методами, на 20, 40, 60, 80 или на 100%. Предпочтительно, по меньшей мере, у 20, 40, 60, 80, 90 или 95% пролеченных субъектов наблюдается полная ремиссия, при которой исчезают все признаки рака. Предпочтительно, рак не появляется снова или появляется снова, по меньшей мере, через 5, 10, 15 или 20 лет. В другом предпочтительном варианте изобретения продолжительность жизни после обнаружения рака и проведения терапии по изобретению, по меньшей мере, на 20, 40, 60, 80, 100, 200 или даже 500% больше, чем (i) средняя продолжительность дальнейшей жизни (существования) непролеченного пациента или (ii) средняя продолжительность дальнейшей жизни пациента, пролеченного другим лекарством.
Под "образцом" понимают жидкость из организма (например, мочу, кровь. сыворотку, плазму или цереброспинальную жидкость), ткань (например, биоптат ткани) или клетку, в которой обычно обнаруживается EGFR.
Под "субъектом" понимают млекопитающее, включая, но без ограничения, человека или отличного от человека млекопитающего, такого как крупный рогатый скот, лошади, собаки, овцы и козы или кошки.
Под "коэффициентом правдоподобия (в процентах)" понимают процент вероятности. В настоящем изобретении коэффициент правдоподобия того, что раковые клетки экспрессируют EGFRvIII, можно определить, сравнивая тип рака у субъекта с клиническими исследованиями или опубликованными сообщениями, в которых указывается коэффициент правдоподобия того, что обнаруженный тип раковых клеток экспрессирует EGFRvIII. Для методов по изобретению предпочтительно, чтобы коэффициент правдоподобия (в процентах) того, что раковые клетки экспрессируют EGFRvIII, был равен 57%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более.
Под "передачей сигнала рецептора" понимают любую из биологических активностей, ассоциированных с EGFR или его мутантами или производными (например, EGFRvIII), которые приводят к активации клеточных событий или путей клеток. Примеры биологических активностей включают переход (конверсию) в активную конформацию, димеризацию рецептора (гомодимер или гетеродимер), аутофосфорилирование рецептора (например, по остаткам Tyr 992, 1068, 1086, 1148 или 1173 человеческого EGFR), фосфорилирование субстрата и связывание субстрата. Субстраты EGFR известны в уровне техники и включают Gab1, Shc, EPS8, EPS15 и любые полипептиды, которые включают аминокислотную последовательность EEEEYFELV (SEQ ID NO:17). Такие активности можно измерять (определять) аналитическими методами, известными в уровне техники или представленными в данном описании, эти методы включают киназные анализы, иммуноанализы связывания рецептора с субстратом, анализ конформации рецептора на основании структуры и анализы интернализации рецепторов.
Под "снижением (понижением, уменьшением, ослаблением)" понимают способность вызывать общее снижение, предпочтительно, на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более. Например, в одном варианте изобретения антитела по изобретению, применимые в методах лечения, вызывают уменьшение (ослабление) передачи сигнала рецептора EGFRvIII или как EGFRvIII, так и EGFR, по меньшей мере, на 20%.
Другие признаки и преимущества изобретения будут понятны из нижеприведенного описания его предпочтительных вариантов и из п.п. формулы изобретения.
Краткое описание Фигур
На ФИГУРЕ 1 схематически показано взаимопревращение интактного EGF рецептора в его не передающее сигнал мономерное состояние и передающее сигнал димерное состояние, в котором он связывается с лигандом, таким как EGF. В верхней части Фигуры показаны внеклеточные EGFR домены, тогда как в нижней части Фигуры показаны внеклеточные домены, включая киназный домен (горизонтальные полосы) и прилегающую C-концевую область, которая фосфорилизуются при димеризации. На левой половине Фигуры показан свободный эпидермальный фактор роста (EGF; косые полосы) и не связанный с лигандом EGFR. Характеристикой не связанного с лигандом EGFR является то, что удлиняющий сегмент (расширение) Домена 2 взаимодействует с C-концом, проксимальной (ближайшей) к мембране областью Домена 4, так что димеризационные поверхности как в Домене 2, так и в Домене 4 спрятаны, углублены. Справа на Фигуре показан EGFR в димерном, связанном с лигандом состоянии. В этой конфигурации лиганд, такой как EGF или TGFα, взаимодействует с Доменом 1 и Доменом 3 EGFR, тогда как Домен 2 и Домен 4 осуществляют димеризационные контакты. Взаимопревращение активного и неактивного состояний EGFR включает "масштабное" вращение вокруг места соединения Доменов 2 и 3. В результате димеризации внутриклеточные киназные домены сближаются друг с другом и сближаются сайтами фосфорилирования тирозина субстрата.
На ФИГУРЕ 2 показано выравнивание вариабельных областей легких цепей (SEQ ID NO:1-6) и тяжелых цепей (SEQ ID NO:7-12) антитела против EGFR. 425 (SEQ ID NO:2 и 8, для легкой цепи и тяжелой цепи соответственно) представляет собой оригинальное (исходное) мышиное моноклональное антитело, из которого образовано антитело EMD72000. EMD72000 (SEQ ID NO:3 и 9, для легкой цепи и тяжелой цепи соответственно) содержит мутации в каркасе вариабельных областей 425 для повышения сходства с человеческими вариабельными областями. H-R3 (SEQ ID NO:1 и 7, для легкой цепи и тяжелой цепи соответственно) представляет собой независимо выделенное антитело, которое связывается с EGFR и описано в патенте США No. 6506883. 225 (SEQ ID NO:4 и 10, для легкой цепи и тяжелой цепи соответственно) представляет собой мышиное моноклональное антитело, которое связывается с эпитопом, отличным от эпитопа 425/EMD72000. Cur6 (SEQ ID NO:5 и 11, для легкой цепи и тяжелой цепи соответственно) и Cur63 (SEQ ID NO:6 и 12, для легкой цепи и тяжелой цепи соответственно) представляют собой дополнительные антитела против EGFR и описаны в опубликованной патентной заявке США No. 20050100546.
На ФИГУРЕ 3 показаны результаты FACS анализов в процессе выделения мутантных EGFR, с которыми не связывается EMD72000, при использовании клеток дрожжей. На левом чертеже показана популяция клеток дрожжей, экспрессирующих мутагенизированный EGFR и эпитопную метку, к которым добавлены меченный флуоресцентной меткой EMD72000 и меченное другой флуоресцентной меткой распознающее эпитопную метку антитело. На этом чертеже показаны клетки, прошедшие четыре цикла селекции на утрату связывания EMD72000. На оси Y представлено связывание EMD72000, тогда как на оси Х показано связывание антитела, распознающего эпитопную метку. Скопление пятен внизу слева изображает клетки, которые утратили плазмиду, экспрессирующую EGFR. Скопление (кластер) пятен ближе к центру рисунка представляет собой клетки, с которыми как EMD72000, так и антитело, узнающее эпитопную метку, связаны примерно в равном соотношении. Пятна, заключенные в трапецию, представляют собой клетки, которые, по-видимому, сохраняют связывание антитела, узнающего эпитопную метку, но утратили связывание с EMD72000.
На чертеже справа показан FACS анализ дрожжевых клеток из популяции, взятой из трапеции на левом чертеже. На этом правом чертеже показаны клетки дрожжей, к которым добавлены флуоресцентно меченное антитело 225 и узнающее эпитопную метку антитело, меченное иной флуоресцентной меткой. На этом правом рисунке показана популяция, прошедшая два цикла селекции на сохранение связывания антитела 225. На оси Y представлено связывание 225, тогда как на оси Х показано связывание антитела, распознающего эпитопную метку. Скопление пятен внизу слева опять же изо