Внутримолекулярные соединения триглицеридов жирных кислот
Иллюстрации
Показать всеИзобретение относится к продукту, используемому в шоколаде, маргарине или шортенинге, полученному плавлением смеси компонентов (а) и (b), где компонент (а) содержит триглицерид динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты и (b) содержит триглицерид 1,3-динасыщенных длинноцепочечных жирных кислот и 2-мононенасыщенной длинноцепочечной жирной кислоты, причем длина связи, определенная рентгенодифракцией, измеренная у продукта, составляет 65 Å или более, причем среднецепочечная жирная кислота(ы) имеет от 6 до 12 атомов углерода, и длинноцепочечная жирная кислота(ы) имеет от 14 до 24 атомов углерода. Благодаря образованию внутримолекулярных соединений жиры и масла содержат большое количество симметричных триглицеридов, таких как какао-масло, и содержат среднецепочечные жирные кислоты, не образующие отдельные кристаллы, и, кроме того, могут придавать продукту гладкую текстуру и предотвращать помутнение. 7 з.п. ф-лы, 9 ил., 17 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к внутримолекулярным соединениям, по меньшей мере, двух типов триглицеридов жирных кислот, имеющих различные молекулярные структуры, и содержащим их пищевым продуктам. Внутримолекулярные соединения также называются кристаллическими соединениями.
Уровень техники, предшествующий изобретению
Обычно используются два типа триглицеридов жирных кислот, имеющих различные молекулярные структуры, способных образовывать внутримолекулярные соединения, и свойства полученных таким образом внутримолекулярных соединений, часто применяют методики с использованием таких триглицеридов, применяя их при получении таких пищевых продуктов, как шоколад, маргарин и шортенинг (не патентная литература 1 и 2, патентная литература 1-15). Однако все эти технологии относятся к внутримолекулярным соединениям, которые получают комбинацией триглицерида, относящегося к типу St-U-St, и триглицерида, относящегося к типу U-St-U, (ST: насыщенные жирные кислоты, U: ненасыщенные жирные кислоты).
С другой стороны, известно, что комбинация триглицерида, относящегося к типу St-U-St, и триглицерида, относящегося к типу St-St-St (ST: насыщенные жирные кислоты, U: ненасыщенные жирные кислоты), такая как триглицерид типа РОР (олеодипальметин) (1,3-дипальмитоил-2-олеоилглицерин) и триглицерид типа РРР (трипальмитин) (не патентная литература 2); и какао-масло и заменитель какао-масла (CBS, твердый лауриновый жир и жирное масло) не могут образовывать внутримолекулярные соединения и не имеют совместимости, и, кроме того, каждый триглицерид независимо кристаллизуется с образованием эвтектических кристаллов.
А именно, до настоящего времени комбинация триглицерида, относящегося к типу St-U-St, и триглицерида, относящегося к типу St-St-St (ST: насыщенные жирные кислоты, U: ненасыщенные жирные кислоты), не способна образовывать внутримолекулярные соединения, и поэтому не могут быть получены пищевые продукты, содержащие эти внутримолекулярные соединения, полученные из этих двух типов триглицеридов жирных кислот, имеющих различные молекулярные структуры, используя их свойства.
Кроме того, в последние годы часто практикуется изменение типа(ов) жирных кислот, входящих в состав триглицерида, или изменялись их положения для изменения свойств жиров и масел, то есть триглицеридов. Например, в патентной литературе 16 описывается, что триглицерид 1,3-ди(S)-2-моно(Х) типа (SXS), где насыщенная жирная кислота(ы) (X), имеющая 12 или менее атомов углерода, связанная по второму положению, и насыщенная жирная кислота(ы) (S), имеющая 16 или более атомов углерода, связанная по первому и третьему положениям, используется в качестве агента для предотвращения помутнения жира, и такой триглицерид получают реакцией переэтерификации с использованием 1,3-специфической липазы. Также патентная литература 17 описывает, что триглицериды, где одна из входящих в состав жирных кислот, представляет собой насыщенную жирную кислоту с 12 или менее атомами углерода, и оставшиеся две жирные кислоты представляют собой насыщенные жирные кислоты с 16 или более атомами углерода, получают переэтерификацией натуральных жиров и масел; и они используются в качестве агента, препятствующего крошливости, в какао-масле, пальмовом масле и т.п.
Кроме того, в патентной литературе 18 описываются триглицеридные композиции, содержащие: триглицерид 1,3-ди(S)-2-моно(Х) типа (SXS), где каприловая кислота (Х), связанная по второму положению, и пальмитиновые кислоты или стеариновые кислоты (S), связанные по первому и третьему положениям; и триглицерид 1-моно(Х)ди(S) типа (SSX), где каприловая кислота (Х), связанная по первому или третьему положениям, и пальмитиновые кислоты или стеариновые кислоты (S), связанные по второму и третьему положениям, или первому и второму положениям, используются в качестве агентов для предотвращения помутнения жира и диспергируются в шоколаде.
Также в патентной литературе 19 описывается способ получения симметричных триглицеридов, у которых в первом и третьем положениях находятся среднецепочечные жирные кислоты, и в sn-втором положении находится длинноцепочечная жирная кислота, и пригодность (возможность использования) полученных таким образом симметричных триглицеридов, у которых в sn-первом и третьем положениях находятся октановые кислоты, и в sn-втором положении находится стеариновая кислота, в качестве заменителей масла в шоколаде.
Несмотря на приведенные выше документы, описывающие получение внутримолекулярных соединений и использование их свойств, ниже приведен полный список документов.
[Не патентная литература 1] Journal of Oleo Science, Vol. 42, № 3, P 184 (1993)
[Не патентная литература 2] Journal of the Japanese Society for Synchrotron Radiation Research (hosyako), Vol. 11, № 3, P 208 (1998)
[Патентная литература 1] Japanese Patent №3464646
[Патентная литература 2] Japanese Patent Unexamined Publication №2002-69484
[Патентная литература 3] Japanese Patent Unexamined Publication №2003-213291
[Патентная литература 4] Japanese Patent Unexamined Publication №2002-121584
[Патентная литература 5] Japanese Patent Unexamined Publication №2004-285193
[Патентная литература 6] Japanese Patent Unexamined Publication №2003-304807
[Патентная литература 7] Japanese Patent Unexamined Publication №2003-213289
[Патентная литература 8] Japanese Patent Unexamined Publication №2004-89006
[Патентная литература 9] Japanese Patent Unexamined Publication №2004-305048
[Патентная литература 10] Japanese Patent Unexamined Publication №2003-213287
[Патентная литература 11] Japanese Patent Unexamined Publication №2003-210107
[Патентная литература 12] Japanese Patent Unexamined Publication №2003-169601
[Патентная литература 13] Japanese Patent Unexamined Publication №2003-169600
[Патентная литература 14] Japanese Patent Unexamined Publication №2003-284491
[Патентная литература 15] Japanese Patent Unexamined Publication № Hei 4-135453
[Патентная литература 16] Japanese Patent Unexamined Publication № Hei 4-75593
[Патентная литература 17] Japanese Patent Unexamined Publication № Hei 5-311190
[Патентная литература 18] Japanese Patent № 3146589
[Патентная литература 19] WO 2005/5586
Описание изобретения
Объектом настоящего изобретения являются внутримолекулярные соединения триглицеридов жирных кислот.
Другим объектом настоящего изобретения являются пищевые продукты, содержащие внутримолекулярные соединения.
Настоящее изобретение выполнено на основе определения с помощью рентгенодифракции неизвестных ранее длин связей внутримолекулярных соединений, полученных плавлением смеси двух типов триглицеридов жирных кислот, обладающих специфической структурой.
Настоящее изобретение относится к внутримолекулярному соединению (а) триглицериду динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты и (b) триглицериду 1,3-динасыщенных длинноцепочечных жирных кислот и 2-мононенасыщенной длинноцепочечной жирной кислоты, длина связей которых, оцененная рентгенодифракцией, составила 65 Å или более.
Краткое описание чертежей
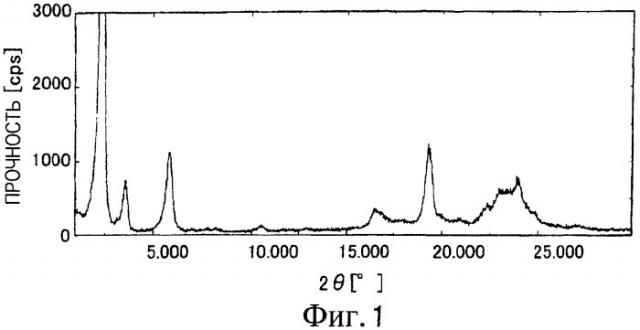
На Фиг.1 показана дифрактограмма рентгенодифракции внутримолекулярного соединения I-T по настоящему изобретению.
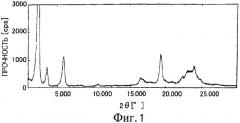
На Фиг.2 показана дифрактограмма рентгенодифракции внутримолекулярного соединения I-N по настоящему изобретению.
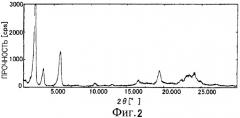
На Фиг.3 показана дифрактограмма рентгенодифракции внутримолекулярного соединения I-S по настоящему изобретению.
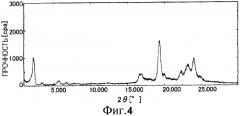
На Фиг.4 показана дифрактограмма рентгенодифракции внутримолекулярного соединения II по настоящему изобретению.
На Фиг.5 показана дифрактограмма рентгенодифракции внутримолекулярного соединения III по настоящему изобретению.
На Фиг.6 показана дифрактограмма рентгенодифракции внутримолекулярного соединения IV по настоящему изобретению.
На Фиг.7 показана дифрактограмма рентгенодифракции продукта 1 по настоящему изобретению.
На Фиг.8 показана дифрактограмма рентгенодифракции продукта 2 по настоящему изобретению.
На Фиг.9 показана дифрактограмма рентгенодифракции продукта 3 по настоящему изобретению.
Предпочтительные варианты воплощения настоящего изобретения
Триглицериды динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (а) по настоящему изобретению, предпочтительно имеют среднецепочечные жирные кислоты с 6-12 атомами углерода, более предпочтительно с 6-10 атомами углерода и наиболее предпочтительно с 8-10 атомами углерода. В частности, предпочтительными являются октановая кислота и декановая кислота. Кроме того, из этих длинноцепочечных жирных кислот предпочтительными являются кислоты с 14-24 атомами углерода и более предпочтительно с 16-22 атомами углерода. В частности, предпочтительными являются длинноцепочечные жирные кислоты с 16-18 атомами углерода, и они включают пальмитиновую кислоту и стеариновую кислоту. Эти жирные кислоты могут иметь неразветвленную цепь или разветвленную цепь, предпочтительными являются кислоты с неразветвленной цепью.
Предпочтительными триглицеридами динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты, применяемыми в качестве компонента (а) по настоящему изобретению, являются 1,3-динасыщенные среднецепочечные жирные кислоты и 2-мононасыщенная длинноцепочечная жирная кислота.
Две среднецепочечных жирных кислоты составляют триглицериды динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (а), могут быть одинаковыми или различными, но предпочтительно они являются одинаковыми.
Триглицериды динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (а) по настоящему изобретению, предпочтительно представляют собой 8S8 триглицериды, у которых первое и третье положения представлены октановой кислотой, и второе положение представлено стеариновой кислотой; 88S триглицериды, у которых первое и второе положения представлены октановой кислотой, и третье положение представлено стеариновой кислотой; и S88 триглицериды, у которых первое положение представлено стеариновой кислотой, и второе и третье положения представлены октановой кислотой.
Триглицериды динасыщенных среднецепочечных жирных кислот и мононасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (а) по настоящему изобретению, могут быть легко получены, например, переэтерификацией природных жиров и масел, в частности переэтерификацией липазой. В том числе симметричные триглицериды, у которых первое и третье положения представлены среднецепочечными жирными кислотами и sn-второе положение представлено длинноцепочечной жирной кислотой, предпочтительно получены способом, описанным в WO2005/5586. Более конкретно, способ предпочтительно включает стадии случайной переэтерификации триглицеридов среднецепочечной жирной кислоты и триглицеридов длинноцепочечной жирной кислоты ферментами или химическими катализаторами в первой реакции с получением продуктов реакции, содержащих триглицериды, имеющие среднецепочечные жирные кислоты и длинноцепочечные жирные кислоты, как составляющие жирные кислоты; переэтерификацию продуктов реакции и моноэфира спирта среднецепочечных жирных кислот в sn-1-м, 3-м положениях специфическими ферментами во второй реакции; и удаление (части или всех) моноэфиров спирта среднецепочечных жирных кислот и длинноцепочечных жирных кислот из реакционного вещества, полученного второй реакцией с получением симметричных триглицеридов, у которых первое и третье положения представлены среднецепочечными жирными кислотами, и sn-второе положение представлено длинноцепочечной жирной кислотой.
Триглицериды 1,3-динасыщенных длинноцепочечных жирных кислот и 2-мононасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (b) по настоящему изобретению, предпочтительно имеют длинноцепочечные жирные кислоты с 14-24 атомами углерода и более предпочтительно с 16-22 атомами углерода. В частности, предпочтительными являются длинноцепочечные жирные кислоты с 16-18 атомами углерода, включающие пальмитиновую кислоту и стеариновую кислоту. Эти ненасыщенные жирные кислоты могут составлять компонент (b), включая те, которые имеют одну или более двойную связь в молекулах, и предпочтительными являются те, которые имеют одну двойную связь в молекулах. А именно, предпочтительными являются олеиновая кислота, линолевая кислота и линоленовая кислота, наиболее предпочтительной является олеиновая кислота. Эти жирные кислоты могут иметь неразветвленную цепь или разветвленную цепь, предпочтительными являются кислоты с неразветвленной цепью.
Триглицериды 1,3-динасыщенных длинноцепочечных жирных кислот и 2-мононенасыщенной длинноцепочечной жирной кислоты, применяемые в качестве компонента (b) по настоящему изобретению, предпочтительно представляют собой POP триглицериды, у которых первое и третье положения представлены пальмитиновой кислотой, и второе положение представлено олеиновой кислотой (1,3-дипальмитоил-2-олеоил глицерин); триглицериды POS, у которых первое и третье положения представлены пальмитиновой кислотой и стеариновой кислотой, и второе положение представлено олеиновой кислотой (2-олеоил пальмитоил стеароил глицерин); и SOS триглицериды, у которых первое и третье положения представлены стеариновой кислотой, и второе положение представлено олеиновой кислотой (1,3-дистеароил-2-олеоил глицерин).
В качестве триглицеридов 1,3-динасыщенных длинноцепочечных жирных кислот и 2-мононенасыщенной длинноцепочечной жирной кислоты, применяемых в качестве компонента (b) по настоящему изобретению, могут быть использованы, например, один из встречающихся в природе компонентов, такой как какао-масло, масло салового дерева, масло ши, масло ореха бассия, масло из косточек манго, масло кокум, стеарин из семян хлопка, пальмовое масло или фракционированные из них масла. Симметричные триглицериды могут быть получены липазой (см. ссылку Japanese Patent Unexamined Publication № Sho 55-71797 или Japanese Patent Unexamined Publication № Sho 62-155048 в качестве примеров).
В частности, предпочтительными являются жиры и масла, содержащие большие количества симметричных триглицеридов, таких как POP, POS и SOS, и предпочтительными являются какао-масло, стеарин салового дерева, стеарин ши, масло ореха бассия, масло из косточек манго, масло кокум и пальмовое масло средней фракции (PMF). В случае использования этих жиров и масел общее содержание триглицеридов типа POP (1,3-дипальмитоил-2-олеоил глицерин), триглицеридов типа POS (2-олеоил пальмитоил стеароил глицерин) и триглицеридов типа SOS (1,3-дистеароил-2-олеоил глицерин) предпочтительно составляет 70 мас.% или более и наиболее предпочтительно 80 мас.% или более.
Внутримолекулярные соединения по настоящему изобретению могут быть получены при плавлении смеси компонентов триглицеридов (а) и (b) нагреванием их вплоть до от 50 до 60°С. При смешивании компонентов триглицеридов (а) и (b) может быть использован органический растворитель(и). В таком случае массовое соотношение компонент (а)/компонент (b) предпочтительно составляет от 5/95 до 95/5 по массе, более предпочтительно от 20/80 до 80/20 по массе и наиболее предпочтительно от 30/70 до 70/30 по массе. С другой стороны, молярное соотношение компонент (а)/компонент (b) предпочтительно составляет около 1/1.
Предпочтительные органические растворители включают такие кетоны, как ацетон и метилэтил кетон; такие углеводороды, как гексан и петролейный эфир; такие ароматические углеводороды, как бензол и толуол; такие спирты, как метанол, этанол и пропанол; гидроспирты; и такие простые эфиры, как простой диэтиловый эфир; такие эфиры, как этил ацетат. Приемлемы любые органические растворители, если они растворяют триглицериды в точке их кипения или ниже, и точка их плавления находится ниже температуры застывания. Предпочтительными являются ацетон, гексан, спирты и гидроспирты, и наиболее предпочтительным является ацетон.
Длины связей внутримолекулярных соединений по настоящему изобретению могут быть рассчитаны по параметру d (Å, межплоскостное расстояние), пик соответствует расстоянию с индексом Миллера (001), который наблюдается при около 2θ=от 0 до 10° при использовании рентенодифрактометра (длина волны рентгеновского луча: λ=1,5405 Å). Внутримолекулярные соединения по настоящему изобретению предпочтительно имеют длину связи 70 Å или более, более предпочтительно от 70 до 85 Å и наиболее предпочтительно от 74 до 82 Å. Для сравнения, в 100% какао-масле пик (002) отражений длины связи 64 Å, наблюдаемый при около 2θ=2,8°, который на поверхности его (004) наблюдается при около 2θ=5,5°.
Внутримолекулярные соединения по настоящему соединению могут быть применены в качестве компонентов пищевых продуктов, таких как жир и как жирные масла. Например, они могут быть применены как жир или жирное масло в качестве компонентов шоколада, маргарина, шортенинга и т.п. Конкретные варианты применения маргарина или шортенинга включают применение их для теста, при обваливании, в креме, в наполнителе для сэндвичей, нанесения покрытия распылением, жарки, но не ограничиваются только этим. Используемый здесь термин «шоколад», приведенный в описании настоящего изобретения, включает все виды шоколада, и жира, и жирных масел пищевых продуктов, подвергшихся технологической обработке, но не ограничивается теми, которые приведены в описании.
Согласно настоящему изобретению оно относится к внутримолекулярным соединениям жиров и масел, которые не были известны до настоящего момента. Эти внутримолекулярные соединения могут быть применены как часть жиров и масел, входящих в состав пищевых продуктов. Благодаря образованию внутримолекулярных соединений жиры и масла содержат большое количество симметричных триглицеридов, таких как какао-масло и те, которые содержат среднецепочечные жирные кислоты, не образующие отдельные кристаллы, и, кроме того, могут придавать продукту гладкую текстуру и предотвращать помутнение.
Эти внутримолекулярные соединения могут быть применены как часть жиров и масел, которые входят в состав маргарина или шортенинга. Благодаря образованию внутримолекулярных соединений возможно предотвращать постепенное отверждение, и, кроме того, имеется преимущество, заключающееся в отсутствии многократного осаждения кристаллов и отсутствии необходимости консервации.
Следующие Примеры дополнительно иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Пример получения 1 (Получение порошкообразной липазы)
Низкомолекулярные компоненты были отделены с помощью УФ-устройства (SIP-0013, произведенного Asahi Kasei Corporation) от жидкой липазы, полученной из Rhizomucor miehei, произведенной Novozymes Japan Limited (торговая марка: Palatase20000L), где липазу растворяют и диспергируют в водном растворе с получением водного раствора 1, содержащего липазу (с концентрацией сухого вещества 20,1 мас.%). Более конкретно, проводят УФ-фильтрацию жидкой липазы (Palatase20000L) при охлаждении на льду до концентрации 1/2 объема и вводят туда такое же количество 0,01М буфера фосфорной кислоты рН 7. Те же операции УФ-фильтрации и введения буфера фосфорной кислоты были проведены дважды с получением раствора. Затем проводили дополнительную УФ-фильтрацию раствора и полученный таким образом концентрированный раствор липазы рассматривали как водный раствор 1, содержащий липазу.
20 мл молока (Koiwai Milk Oishisa-shitate, произведенного Koiwai Dairy Products Co., Ltd: концентрация сухих веществ 12,9 мас.%) вводили в 20 мл водного раствора 1, содержащего липазу. рН полученного таким образом раствора регулируют до от рН 6,8 до 6,9 водным раствором гидроксида натрия.
Объемное соотношение концентрированного раствора липазы (= водный раствор 1, содержащий липазу): молоко составило 1:1, и содержание сухих веществ молока составило 0,64-кратное превышение содержания сухих веществ в водном растворе 1, содержащем липазу.
Раствор был высушен с применением распылительной сушки в распылительной сушилке (SD-1000, произведенной Tokyo Rikakikai Co., Ltd.) при условиях: с температурой на входе 130°С, параметрами воздушного потока от 0,7 до 1,1 м3/мин и давлении распылительной сушки от 11 до 12 кПа с получением порошкообразной липазы. Частицы порошкообразной липазы имели сферическую форму, 90 мас.% или более порошкообразной липазы имели диаметр от 1 до 100 мкм, и средний диаметр частиц составил 7,6 мкм. Диаметр частиц измеряли с использованием анализатора гранулометрического распределения (LA-500) HORIBA, Ltd.
При этом концентрацию сухих веществ в водном растворе, содержащем липазу, и сухих веществ молока измеряли следующим методом.
Концентрации были измерены как % брикс с использованием анализатора содержания сахара (BRX-242, произведенного C.I.S. Corporation).
Пример получения 2 (Получение MLCT A (8S8))
5 г липазы QLM (Meito Sangyo Co., Ltd.) ввели 700 г подсолнечного масла с высоким содержанием олеиновой кислоты (торговая марка Olein-Rich, произведенного Showa Sangyo Co., Ltd.) и 300 г трикаприлина (торговая марка Tricaprylin, произведенного Sigma Aldrich Japan) в 2000 мл реакционную емкость. Затем проводили реакцию при непрерывном перемешивании смеси мешалкой при температуре 50°С в течение 2 часов. Оставшиеся ферменты были удалены фильтрацией с получением 980 г продуктов реакции.
4900 г этилового эфира октановой кислоты (торговая марка Octanoic Acid Ethyl, произведенная Inoue Perfumery Co., Ltd.) и 120 г порошкообразного фермента, полученного по примеру 1, 980 г продуктов реакции ввели в 10 л реакционную емкость. Затем проводили ферментную реакцию при непрерывном перемешивании мешалкой при температуре 40°С в течение 26 часов с получением 5600 г продуктов реакции. По окончании реакции этиловый эфир октановой кислоты, этиловый эфир олеиновой кислоты и трикаприлин удаляли из продуктов реакции с применением молекулярно-дистилляционного аппарата центробежного типа (произведенного NIPPON SHARYO, LTD.) с получением 300 г вещества, содержащего триглицерид.
300 г вещества, содержащего триглицерид, помещали в реактор, для проведения реакции в него вводили 900 мг никелевого катализатора и подавали водород под давлением 0,3 МПа. Затем вещество нагревали до 180° и перемешивали в течение 5 часов. По окончании гидрогенизации под избыточным давлением катализатор удаляли с получением 300 г триацилглицеридов, содержащих среднецепочечные и длинноцепочечные жирные кислоты (MLCT) A (8S8).
Пример получения 3 (Получение MLCT B (10S10))
5 г 1,3-дидеканоил-2-линолеил глицерина (произведенного Osaka Synthetic Chemical Laboratories, Inc.) растворяли в 100 мл этанола. 2,5 г 10% угля с нанесенным палладием (Wako Pure Chemical Industries, Ltd.) вводили туда же и проводили реакцию в атмосфере водорода при температуре 40°С в течение 3 часов. По окончании фильтрации с удалением угля с нанесенным палладием и этанола получали 3,5 г MLCT В.
Пример получения 4 (Получение MLCT С (88S))
230 г олеиновой кислоты (торговая марка: EXTRA OS-85, произведенная NOF Corporation) и 69 г порошкообразного фермента, полученного по примеру 1, вводили в 2070 г трикаприлина (торговая марка: Tricaprylin, произведенного Sigma Aldrich Japan) в 5000 мл реакционной емкости. Затем проводили ферментную реакцию при непрерывном перемешивании смеси мешалкой при температуре 40°С в течение 136 часов. Оставшиеся ферменты были удалены фильтрацией с получением 2250 г продуктов реакции. По окончании реакции октановую кислоту, олеиновую кислоту и трикаприлин удаляли из продуктов реакции с применением молекулярно-дистилляционного аппарата центробежного типа (произведенного NIPPON SHARYO, LTD.) с получением 270 г вещества, содержащего триглицерид.
270 г вещества, содержащего триглицерид, помещали в реактор, для проведения реакции в него вводили 810 мг никелевого катализатора и подавали водород под давлением 0,3 МПа. Затем вещество нагревали до 180° и перемешивали в течение 5 часов. По окончании гидрогенизации под избыточным давлением катализатор удаляли с получением 270 г MLCT С (88S).
Пример получения 5 (Получение MLCT D (смесь 88S/8S8))
5 г липазы QLM (Meito Sangyo Co., Ltd.) ввели в 400 г подсолнечного масла с высоким содержанием олеиновой кислоты (торговая марка Olein-Rich, произведенного Showa Sangyo Co., Ltd.) и 600 г трикаприлина (торговая марка: Tricaprylin, произведенного Sigma Aldrich Japan) в 2000 мл реакционной емкости. Затем проводили реакцию при непрерывном перемешивании смеси мешалкой при температуре 40°С в течение 2 часов. Оставшиеся ферменты были удалены фильтрацией с получением 980 г продуктов реакции.
По окончании реакции были получены 400 г дистиллированного компонента из прореагировавшего масла с применением молекулярно-дистилляционного аппарата центробежного типа (произведенного NIPPON SHARYO, LTD.) при температуре 240°С и давлении 1 Па.
400 г полученного таким образом вещества, содержащего триглицерид, помещали в реактор, для проведения реакции в него вводили 1200 мг никелевого катализатора и подавали водород под давлением 0,3 МПа. Затем вещество нагревали до 180° и перемешивали в течение 5 часов. По окончании гидрогенизации под избыточным давлением катализатор удаляли с получением 400 г MLCT D (смесь 88S/8S8).
В Таблицах 1 и 2 приведены результаты анализа GLC триглицеридных композиций MLCT, полученных в примерах получения 2-5. При этом соотношение позиционных изомеров: (88S+S88)/8S8 определяли, исходя из того факта, что соотношение позиционных изомеров вещества, содержащего триглицерид, не изменялось при гидрообработке во время проведения анализа дистиллированного компонента перед гидрообработкой или ВЭЖХ (на Ag ионной колонке). Соотношение MLCT B, содержащего декановую кислоту в качестве основного компонента, определяли следующим образом.
| Таблица 1 | |||||
| Композиция (мас.%) | 888 | 88Р+Р88+8Р8 | 88S+S88 | 8S8 | 8SS+SS8+S8S |
| MLCT A | 0 | 0,2 | 3,6 | 95,3 | 0,9 |
| MLCT C | 6,0 | 2,9 | 85,3 | 2,2 | 3,6 |
| MLCT D | 0,8 | 3,8 | 60,2 | 32,4 | 2,8 |
| Таблица 2 | |||
| Композиция (мас.%) | 1010S+S1010 | 10S10 | Другое |
| MLCT В | 2,9 | 95,2 | 1,8 |
В Таблицах 888 указывает, что первое, второе и третье положения глицерина представлены эфирами октановых кислот; 88Р указывает, что sn-1 и sn-2 положения глицерина представлены эфирами октановой кислоты, и sn-3 положение глицерина представлено эфиром пальмитиновой кислоты; и 10S10 указывает, что sn-1 и sn-3 положения глицерина представлены эфирами декановой кислоты, и sn-2 положение глицерина представлено эфиром стеариновой кислоты.
Пример 1 (Получение внутримолекулярного соединения I из MLCT A (8S8) и какао-масла)
MLCT А (8S8) и какао-масло (торговая марка: D Cocoa Butter, произведенное Daito Cacaо Co., Ltd.) смешивали в массовом соотношении 39,5:60,5, выдерживали при температуре 50°С в течение 30 минут и выдерживали при температуре 33°С в течение 30 минут. Затем смесь выдерживали при температуре 5°С в течение 2 часов и темперировали ее с получением внутримолекулярного соединения I-T, имеющего длину связи 75 Å. Аналогично, MLCT A и какао-масло смешивали в массовом соотношении 39,5:60,5, выдерживали при температуре 50°С в течение 30 минут и выдерживали при температуре 5°С в течение 2 часов с получением внутримолекулярного соединения I-N, имеющего длину связи 75 Å.
MLCT A, какао-масло и ацетон смешивали в массовых соотношениях 39,5:60,5:500, перегревали вплоть до 50°С с получением ацетонового раствора. Затем раствор охлаждали на льду, осажденные кристаллы фильтровали и высушивали с получением внутримолекулярного соединения I-S, имеющего длину связи 75 Å.
Пример 2 (Получение внутримолекулярного соединения II из MLCT B (10S10) и какао-масла)
MLCT В (10S10) и какао-масло (торговая марка: D Cocoa Butter, произведенное Daito Cacaо Co., Ltd.) смешивали в массовом соотношении 41,2:58,5, выдерживали при температуре 50°С в течение 30 минут и выдерживали при температуре 5°С в течение 2 часов с получением внутримолекулярного соединения II, с длиной связи 77 Å.
Пример 3 (Получение внутримолекулярного соединения III из MLCT C (88S) и какао-масла)
MLCT С (88S) и какао-масло (торговая марка: D Cocoa Butter, произведенное Daito Cacaо Co., Ltd.) смешивали в массовом соотношении 42,6:57,4, выдерживали при температуре 50°С в течение 30 минут и выдерживали при температуре 5°С в течение 2 часов с получением внутримолекулярного соединения III с длиной связи 75 Å.
Пример 4 (Получение внутримолекулярного соединения IV из MLCT D (88S/8S8) и какао-масла)
MLCT D (88S/8S8) и какао-масло (торговая марка: D Cocoa Butter, произведенное Daito Cacaо Co., Ltd.) смешивали в массовом соотношении 41,0:59,0, выдерживали при температуре 50°С в течение 30 минут и выдерживали при температуре 5°С в течение 2 часов с получением внутримолекулярного соединения IV с длиной связи 75 Å.
В Таблице 3 приведены результаты анализа GLC триглицеридных композиций (мас.%), использованного какао-масла (торговая марка: D Cocoa Butter, произведенное Daito Cacaо Co., Ltd.).
| Таблица 3 | ||||
| Композиции (мас.%) | POP | POS | SOS | Другие |
| Какао-масло | 16,7 | 38,5 | 26,0 | 18,8 |
Во внутримолекулярных соединениях I-T, I-N, I-S и II-IV, полученных в Примерах 1-4, образование внутримолекулярных соединений подтверждено рентгенодифракцией. Условия измерений приведены как следующее.
Устройство для измерения: RINT 2100 Ultima +, произведенное Rigaku Corporation X-ray: Cu K- α 1 40 кВ/40 мA λ=1,5405.
Гониометр: Ultima+ Horizontal Goniometer Type I.
На Фиг.1-6 показаны результаты рентгенодифракции (дифрактограммы) внутримолекулярных соединений I-T, I-N, I-S и II-IV, полученных в Примерах 1-4, и в Таблицах 4-9 приведены данные их измерений.
| Таблица 4 (Внутримолекулярное соединение I-T) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,380 | 37,0899 | 3714 |
| 3,520 | 25,0800 | 331 |
| 5,840 | 15,1209 | 595 |
| 6,980 | 12,6536 | 17 |
| 7,760 | 11,3834 | 21 |
| 8,180 | 10,7998 | 24 |
| 10,520 | 8,4023 | 41 |
| 12,900 | 6,8569 | 25 |
| 16,460 | 5,3810 | 107 |
| 16,860 | 5,2543 | 58 |
| 19,30 | 4,5952 | 559 |
| 20,960 | 4,2348 | 25 |
| 22,340 | 3,9762 | 66 |
| 22,900 | 3,8803 | 96 |
| 23,90 | 3,7201 | 169 |
| 24,840 | 3,5814 | 33 |
| 26,880 | 3,3141 | 20 |
| 27,120 | 3,2853 | 23 |
| 28,080 | 3,1751 | 17 |
| 29,740 | 3,0016 | 51 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 75 Å при 2θ=2,380°, пик соответствует (003) отражению при 2θ=3,520°, пик соответствует (005) отражению при 2θ=5,840°, и пик соответствует (006) отражению при 2θ=2,380°.
| Таблица 5 (Внутримолекулярное соединение I-N) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,500 | 35,3099 | 1965 |
| 3,640 | 24,2534 | 325 |
| 5,920 | 14,9167 | 702 |
| 7,060 | 12,5104 | 21 |
| 8,340 | 10,5930 | 17 |
| 10,580 | 8,3547 | 62 |
| 13,000 | 6,8044 | 34 |
| 16,540 | 5,3552 | 76 |
| 17,620 | 5,0293 | 15 |
| 19,400 | 4,5717 | 259 |
| 20,860 | 4,2549 | 20 |
| 21,220 | 4,1835 | 18 |
| 21,900 | 4,0551 | 32 |
| 22,240 | 3,9939 | 51 |
| 22,920 | 3,8769 | 66 |
| 23,060 | 3,8537 | 63 |
| 24,060 | 3,6957 | 120 |
| 24,960 | 3,5645 | 36 |
| 27,000 | 3,2996 | 27 |
| 28,020 | 3,1818 | 15 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 74 Å при 2θ=2,500°, пик соответствует (003) отражению при 2θ=3,640°, пик соответствует s (005) отражению при 2θ=5,920°, пик соответствует (006) отражению при 2θ=7,060°, пик соответствует (007) отражению при 2θ=8,340°, и пик соответствует (009) отражению при 2θ=10,580°.
| Таблица 6 (Внутримолекулярное соединение I-S) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,260 | 39,0590 | 1967 |
| 3,420 | 25,8131 | 147 |
| 5,720 | 15,4378 | 260 |
| 10,540 | 8,3864 | 16 |
| 16,420 | 5,3941 | 122 |
| 16,760 | 5,2854 | 56 |
| 17,980 | 4,9294 | 29 |
| 19,260 | 4,6046 | 631 |
| 19,920 | 4,4535 | 36 |
| 22,180 | 4,0046 | 45 |
| 22,540 | 3,9414 | 57 |
| 22,760 | 3,9038 | 74 |
| 23,320 | 3,8113 | 51 |
| 23,760 | 3,7417 | 129 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 77 Å при 2θ=2,260°, пик соответствует (003) отражению при 2θ=3,420°, и пик соответствует (005) отражению при 2θ=5,720°.
При сравнении внутримолекулярного соединения I-T с внутримолекулярными соединениями I-N и I-S их дифрактограммы оказались подобными, при этом параметр d варьировался, кроме того, представляется, что они аналогичны/похожи.
| Таблица 7 (Внутримолекулярное соединение II) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,300 | 38,3798 | 476 |
| 3,440 | 25,6631 | 42 |
| 5,660 | 15,6013 | 70 |
| 6,700 | 13,1818 | 40 |
| 7,780 | 11,3542 | 17 |
| 8,240 | 10,7213 | 18 |
| 10,140 | 8,7163 | 17 |
| 12,340 | 7,1668 | 25 |
| 16,560 | 5,3810 | 136 |
| 16,860 | 5,2543 | 130 |
| 17,420 | 5,0866 | 22 |
| 18,200 | 4,2203 | 27 |
| 19,320 | 4,5904 | 824 |
| 19,960 | 4,4447 | 51 |
| 20,660 | 4,2956 | 17 |
| 22,240 | 3,9939 | 127 |
| 23,220 | 3,8275 | 179 |
| 23,980 | 3,7079 | 335 |
| 24,720 | 3,5985 | 34 |
| 24,980 | 3,5617 | 53 |
| 27,220 | 3,2734 | 16 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 77 Å при 2θ=2,300°, пик соответствует (003) отражению при 2θ=3,440°, пик соответствует s (005) отражению при 2θ=5,660°, и пик соответствует (006) отражению при 2θ=6,700°.
| Таблица 8 (Внутримолекулярное соединение III) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,340 | 37,7239 | 1262 |
| 3,500 | 25,2233 | 96 |
| 3,960 | 22,2943 | 38 |
| 5,740 | 15,3841 | 188 |
| 10,160 | 8,6992 | 19 |
| 10,420 | 8,4827 | 21 |
| 14,520 | 6,0953 | 16 |
| 15,260 | 5,8014 | 15 |
| 16,920 | 5,2358 | 33 |
| 17,280 | 5,1275 | 26 |
| 17,820 | 4,9733 | 23 |
| 20,460 | 4,3372 | 278 |
| 21,600 | 4,1108 | 132 |
| 23,020 | 3,8603 | 35 |
| 23,680 | 3,7542 | 289 |
| 25,740 | 3,4582 | 36 |
| 26,560 | 3,3533 | 21 |
| 28,120 | 3,1707 | 17 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 75 Å при 2θ=2,340°, пик соответствует (003) отражению при 2θ=3,500°, и пик соответствует (005) отражению при 2θ=5,740°.
| Таблица 9 (Внутримолекулярное соединение IV) | ||
| 2θ (°) | Показатель d (Å) | Прочность (cps) |
| 2,380 | 37,0899 | 1401 |
| 3,580 | 24,6598 | 67 |
| 5,840 | 15,1209 | 150 |
| 10,540 | 8,3864 | 25 |
| 16,520 | 5,3616 | 51 |
| 19,440 | 4,5624 | 211 |
| 20,420 | 4,3456 | 141 |
| 20,600 | 4,3080 | 160 |
| 21,360 | 4,1564 | 21 |
| 21,640 | 4,1033 | 31 |
| 22,980 | 3,8669 | 36 |
| 23,680 | 3,7542 | 179 |
| 25,040 | 3,5533 | 18 |
| 25,760 | 3,5456 | 30 |
Можно видеть, что пик соответствует (002) отражению параметра длины связи 75 Å при 2θ=2,380°, пик соответствует (003) отражению при 2θ=3,580°, и пик соответствует (005) отражению при 2θ=5,840°.
В Таблице 10 приведены параметры длин связей двух жиров и масел, образующих внутримолекулярные соединения, таких как какао-масло и MLCT. Пики указывают параметры длин связей жиров и масел, которые не были видны при рентгенодифракции приведенных выше внутримолекулярных соединений, и, кроме того, показано образование внутримолекулярных соединений.
| Таблица 10 Какао-масло и MLCT | ||
| Жиры и масла | Параметр длины связи (Å) | Структура цепи |
| Какао-масло IV | 45 | 2CL |
| V | 63 | 3CL |
| MLCT A | 46 | 3CL |
| MLCT B | 45 | 3CL |
| MLCT C | 48 | 3CL |
Пример 5 (Получение шоколада, содержащего внутримолекулярные соединения по настоящему изобретению).
Шоколад получали согласно рецептуре, приведенной в Таблице 11. Проводили темперирование как контроля, так и продукта 1-Т и затем их отливали в форму и охлаждали в течение 30 минут при 5°С. В отношении продукта 1-N температура шоколадного продукта составила 40°С, затем охлаждали при температуре 5°С в течение 30 минут без темперирования и отливки. Полученный шоколад хранили при температуре 20°С в течение недели и проводили оценку разжевываемости, блеска и способности таять во рту.
| Таблица 11 Рецептура шоколада (мас.%) | |||
| Контроль | Продукт (1-T по настоящему изобретению) | Продукт (1-N по настоящему изобретению) | |
| Сахарная пудра | 50,6 | 50,6 | 50,6 |
| Какао масса | 36,0 | 36,0 |