N-(2-тиазолил)амидные производные в качестве ингибиторов gsk-3
Иллюстрации
Показать всеИзобретение относится к применению N-(2-тиазолил)амидных производных формулы (I)
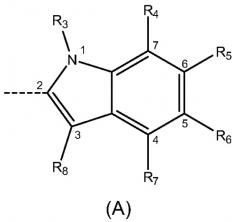
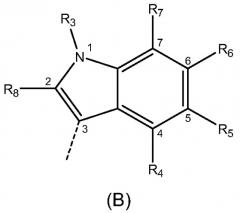
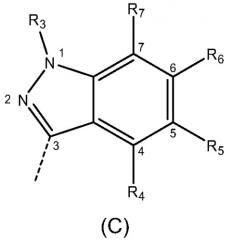
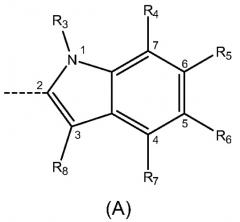
где R1 и R2 независимо выбраны из Н, -NO2, галогена и С1-С6алкила с линейной цепью, где по меньшей мере один из R1 и R2 отличен от Н; m равно 0, 1, 2 или 3; X выбран из группы, состоящей из индола формулы (А), связанного в положении 2, индола формулы (В), связанного в положении 3, и индазола формулы (С), связанного в положении 3:
где R3 выбран из Н и C1-С6алкила с линейной цепью; R4, R5, R6 и R7 независимо выбраны из Н и C1-С6алкоксигруппы; R8 выбран из Н и C1-С6алкила или его любых фармацетически приемлемых солей для получения лекарственного препарата для лечения или профилактики заболевания или состояния, опосредуемого GSK-3, особенно нейродегенеративных заболеваний, таких как болезнь Альцгеймера или инсулиннезависимый сахарный диабет. Изобретение также относится к соединению формулы (I), фармацевтической композиции на его основе и к способу его получения. 5 н. и 25 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к применению N-(2-тиазолил)амидных производных для лечения и/или профилактики заболевания, в которое вовлечена гликогенсинтаза-киназа-3 (GSK-3), в частности, нейродегенеративных заболеваний, таких как болезнь Альцгеймера или инсулиннезависимый сахарный диабет. Кроме того, предоставлены новые ингибиторы GSK-3, способ получения таких соединений и фармацевтические композиции, содержащие их.
В последние годы поиск новых терапевтических средств значительно облегчается лучшим пониманием структуры ферментов и других биомолекул, ассоциированных с рассматриваемыми заболеваниями. Протеинкиназы представляют собой один из важных классов ферментов, которые являются объектом широких исследований. Многие заболевания ассоциированы с аномальными клеточными реакциями, запускаемыми явлениями, опосредуемыми протеинкиназами. Такие заболевания включают аутоиммунные заболевания, воспалительные заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания, аллергии и астму, болезнь Альцгеймера или гормональные заболевания. Соответственно, в медицинской химии предпринимаются значительные усилия в поисках ингибиторов протеинкиназ, которые являются эффективными терапевтическими агентами.
Гликогенсинтаза-киназа-3 (GSK-3) представляет собой серин/треониновую протеинкиназу, состоящую из α- и β-изоформ, каждую из которых кодирует отдельный ген (Coghlan et al., Chemistry & Biology, 7, 793-803 (2000); Kim and Kimmel, Curr. Opinion Genetics Dev., 10, 508-514 (2000)). Треонин/сериновая киназа (гликогенсинтаза-киназа-3, GSK-3) играет ключевую роль в различных связанных с рецепторами сигнальных путях (Doble, BW, Woodgett, JR J Cell Sci. 2003, 116:1175-1186). Нарушение регуляции в этих путях считается критическим явлением в развитии нескольких распространенных расстройств у людей, таких как диабет типа II (Kaidanovich O, Eldar-Finkelman H, Expert Opin. Ther. Targets, 2002, 6:555-561 ), болезнь Альцгеймера (Grimes CA, Jope RS, Prog. Neurobiol. 2001, 65:391-426), расстройства ЦНС, такие как маниакально-депрессивное расстройство и нейродегенеративные заболевания и хронические воспалительные заболевания (Hoeflich KP, Luo J, Rubie EA, Tsao MS, Jin O, Woodgett J, Nature 2000, 406:86-90). Эти заболевания могут быть вызваны или являются результатом аномальной деятельности определенных клеточных сигнальных путей, в которых GSK-3 играет определенную роль.
Было обнаружено, что GSK-3 фосфорилирует и модулирует активность ряда регуляторных белков. Такие белки включают гликогенсинтазу, которая является лимитирующим скорость ферментом, необходимым для синтеза гликогена, ассоциированный с микротрубочками tau-белок, β-катенин фактор транскрипции генов, e1F2B фактор инициации трансляции, а также АТР-цитратлиазу, аксин, фактор теплового шока 1, c-Jun, c-Myc, c-Myb, CREB и CEPBα. Такое разнообразие белков-мишеней свидетельствует о вовлеченности GSK-3 во многие аспекты клеточного метаболизма, пролиферации, дифференцировки и развития.
В настоящее время ингибирование GSK-3 может представлять реальную стратегию в разработке новых медицинских препаратов для лечения таких заболеваний (Martinez A, Castro A, Dorronsoro I, Alonso M, Med. Res. Rev., 2002, 22:373-384) посредством инсулиновой мимикрии, дефосфорилирования tau-белка и процессинга амилоида или модуляции транскрипции соответственно.
Нейротоксический эффект растворимых или нерастворимых β-амилоидных пептидов (Аβ) является характеристической церебральной патологией у пациентов с болезнью Альцгеймера (БА). Исследования, проведенные как in vitro, так и in vivo, свидетельствуют о том, что Аβ-пептиды индуцируют снижение эффективности сигнального пути Wnt и этот механизм, по-видимому, опосредуется дестабилизацией эндогенных уровней β-катенина (Activation of Wnt signaling rescues neurodegeneration and behavioural impairments induced by beta-amyloid fibrils, de Ferrari et al, MoI. Psychiatry. 2003;8(2): 195-208). На клеточных моделях БА и ее животных экспериментальных моделях активация сигнального пути Wnt литием или лигандами Wnt снижает нейротоксический эффект Аβ путем восстановления нормальных уровней β-катенина и экспрессии определенных жизненно важных генов-мишеней Wnt, таких как bcl-2. Расстройства в компонентах пути Wnt могли бы запустить некоторые явления, которые могут привести к началу и развитию БА (Signal transduction during amyloid-beta-peptide neurotoxicity: role in Alzheimer disease, Fuentealba et al., Brain Res. Rev. 2004;47(1-3):275-89).
Присутствие нейрофибриллярных клубков в нейронах коры головного мозга является другим аномальным явлением, которое наблюдается в головном мозге пациентов с БА, и сверхфосфорилированный белок tau, по-видимому, является главным компонентом этих отложений в нейронах (Neurofibrillary tangles of Alzheimer disease share antigenic determinants with the axonal microtubule-associated protein tau, Wood JG et al., Proc. Natl. Acad. Sci. USA. 1986; 83(11):4040-3). Tau является группой из шести белковых изоформ, связанных с микротрубочками, которые модулируют функции таких клеточных структур в аксональных компартментах нейронов. Различные киназы, связанные с микротрубочками, могут фосфорилировать tau; однако наибольший вклад в образование нейрофибриллярных клубков вносят эффекты, производимые GSK3β и cdk5 (Phosphorylation of human tau protein by microtubule-associated kinases: GSK3β and cdkδ are key participants, Flaherty et al., J. Neurosci. Res. 2000; 62:463-472). Действительно, активность GSK-3, по-видимому, инициирует объединение волокон, образующих нейрофибриллярные клубки (Glycogen synthase kinase 3 alteration in Alzheimer disease is related to neurofibrillary tangle formation, Baum et al., MoI. Chem. Neuropathol. 1996;29 (2-3):253-61). Таким образом, фосфорилирование белка tau является еще одной ключевой ролью GSK-3, влияющей на патологию при БА.
Факты, относящиеся к физиологическим явлениям при БА, подтверждают, что GSK-3 может быть важной мишенью при лечении данного заболевания, не только благодаря ее модулированию в пути Wnt, но и в связи с ее влиянием на образование нейрофибриллярных клубков Аβ.
Еще одним патологическим состоянием, в механизм которого вовлечен сигнальный путь Wnt, является болезнь Паркинсона. Физиологическими признаками этого заболевания являются уменьшение числа нейронов, продуцирующих дофамин, хотя причины этого явления до конца не известны. Белки Wnt играют важную роль в процессе дифференцировки этих нервных клеток. Нормализация уровней β-катенина ингибиторами GSK-3 ведет к усилению дифференцировки дофаминергических нейронов (GSK-3beta inhibition/beta-catenin stabilization in ventral midbrain precursors increases differentiation into dopamine neurons, Castelo-Branco et al., J Cell Sci. 2004; 117(Pt 24):5731-7).
GSK-3 также играет важную роль в модулировании клеточного действия инсулина посредством фосфорилирования гликогенсинтазы, фермента, катализирующего конденсацию мономеров глюкозы с образованием гликогена. Фосфорилирование гликогенсинтазы, осуществляемое GSK-3 и другими киназами, ведет к ее инактивации, и это явление ослабляет эффект инсулина в клетках. Действительно, несколько селективных ингибиторов GSK-3 показали себя миметиками действия инсулина на моделях in vitro и in vivo (Insulin mimetic action of synthetic phosphorylated peptide inhibitors of glycogen synthase kinase-3, Plotkin et al., Pharmacol Exp Ther. 2003; 305(3):974-80). Согласно этим экспериментальным результатам ингибирование GSK-3 может оказывать терапевтический эффект при лечении резистентности к инсулину и диабета типа 2.
В соответствии с вышеизложенным ингибиторы GSK-3 являются потенциальными лекарственными средствами для лечения болезни Альцгеймера, болезни Паркинсона, диабета и некоторых других заболеваний.
Tau представляет собой семейство белков, главной ролью которых в клетке является повышение стабильности микротрубочек. Микротрубочки являются главным компонентом цитоскелета, важной клеточной органеллы, особенно для нейронов. Главной ролью цитоскелета в нейронах является обеспечение структурной поддержки для образования аксональных и соматодендритных компартментов, которые являются частью нейрональной сети, необходимой для правильного функционирования ЦНС. Цитоскелет является критическим элементом для выживания нейронов, и многие нейрональные и нейродегенеративные заболевания характеризуются его аномалиями. Поэтому tau и другие белки, относящиеся к структуре цитоскелета, могут быть перспективными мишенями при лечении многих нейрональных и нейродегенеративных заболеваний.
Изоформы tau-белка являются результатом альтернативного сплайсинга мРНК одного гена, который дает шесть различных пептидных цепей с молекулярными массами от 50 до 79 кДа. Белки tau интенсивно экспрессированы в центральной и периферической нервной системе; их особенно много в аксонах нейронов, где они участвуют в организации и обеспечении целостности синаптических связей в ЦНС.
Некоторые исследования (Brandt & Lee, J Biol. Chem. 1993, 268, 3414-3419 и Trinczek et al., Mol. Biol. Cell. 1995, 6, 1887-1902) продемонстрировали, что tau-белок способен стимулировать нуклеацию, рост и сборку микротрубочек. Эти функции tau-белка регулируются процессами фосфорилирования/дефосфорилирования, которые осуществляются на многих сайтах его пептидной цепи. Многие киназы способны фосфорилировать эти сайты in vitro, хотя делать это in vivo может лишь их меньшее число. В нормальных физиологических условиях существует баланс между фосфорилированным и дефосфорилированным tau-белком, который регулирует его связывание с микротрубочками и с другими белками. Однако некоторые патологические явления могут нарушать этот баланс, элиминируя взаимодействия между tau-белком и микротрубочками и разъединяя собранные элементы цитоскелета. Фосфорилирование других сайтов tau-белка индуцирует увеличение взаимодействия типа tau-tau и последующее образование олигомеров tau-белка, которые, в конце концов, агрегируются в нейрофибриллярные клубки (NFT). Все такие изменения провоцируют разрушение транспортной системы микротрубочек вдоль аксонов к синапсам, вызывая нарушение нейрональных функций и, возможно, смерть клеток.
Таким образом, расстройство регуляции tau-белка считается признаком многих неврологических заболеваний, широко известных как таупатии, которые характеризуются аномальным накоплением тау-филаментов в мозге. Некоторыми важными таупатиями являются, наряду с другими, болезнь Альцгеймера, синдром Герстманна-Штройслера-Шейнкера, болезнь Пика, боковой амиотрофический склероз (БАС), болезнь Крейтцфельда-Якоба, синдром Дауна или церебральная амилоидная ангиопатия, обусловленная прионовыми белками.
Работа многих современных исследователей сфокусирована на взаимосвязи между нарушением регуляции tau-белков и накоплением амилоидных бляшек, другим главным патологическим признаком болезни Альцгеймера. Некоторые авторы (Price et al., Annu. Rev. Genet, 1998, 32, 461-493 и Selkoe, Trends Cell Biol. 1998, 8, 447-453) полагают, что амилоидная патология предшествует патологии tau-белков, хотя соответствующий механизм пока не нашел объяснения. Полагают, что отложение фибриллярного бета-амилоида индуцирует фосфорилирование tau-белка, которое затем вызывает дегенерацию нейронов.
В свете современного уровня данной области и принимая во внимание, что фермент GSK-3, а также tau-белок, непосредственно вовлечены в патологические механизмы ряда важных заболеваний и расстройств у людей, особенно нейрональных и нейродегенеративных расстройств, имеется необходимость обнаружения эффективных ингибиторов указанного фермента и фосфорилирования tau-белка для получения эффективных медицинских препаратов для лечения таких заболеваний и расстройств.
Настоящее изобретение предоставляет семейство соединений, а именно N-(2-тиазолил)амидных производных, определяемых формулой (I), как подробно описано ниже, проявляющих ингибирующий эффект в отношении GSK-3. Поэтому они могут быть полезными для лечения заболеваний и патологических состояний, в которых GSK-3 играет определенную роль, особенно нейрональных и нейродегенеративных заболеваний и состояний. Многие из таких соединений дополнительно демонстрируют ингибирующий эффект в отношении фосфорилирования tau-белка, который также играет важную роль во многих нейродегенеративных заболеваниях, и поэтому соединения формулы (I) могут даже исполнять двойную роль при лечении и предупреждении нейрональных и нейродегенеративных заболеваний.
Соответственно, в первом аспекте настоящее изобретение обеспечивает применение соединения формулы (I):
где
R1 и R2 независимо выбраны из H, -NO2, галогена, -NH2, -CF3, C1-C6алкила с линейной цепью и -CN;
m равно 0, 1, 2, 3, 4, 5 или 6,
X выбран из группы, состоящей из:
индола формулы (A), связанного в положении 2:
индола формулы (B), связанного в положении 3:
и
индазола формулы (C), связанного в положении 3:
где
R3 выбран из H и C1-C6алкила с линейной цепью;
R4, R5, R6 и R7 независимо выбраны из H, C1-C6алкила, C1-C6алкоксигруппы и галогена;
R8 выбран из H и C1-C6алкила,
или его любых фармацевтически приемлемых солей, сольватов и пролекарств для получения лекарственного препарата для лечения или профилактики заболевания или патологического состояния, опосредуемого GSK-3.
Соединения формулы (I) можно использовать в биологических исследованиях, в которых нужно модулировать активность GSK-3. Поэтому в другом аспекте данное изобретение относится к применению соединения формулы (I), как определено выше, или любой его соли или сольвата в качестве реактива для модулирования GSK-3 в биологических исследованиях, предпочтительно в качестве реактива для ингибирования активности GSK-3.
Следующий аспект данного изобретения относится к способу лечения заболевания, в механизм которого вовлечена GSK-3, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения общей формулы (I) или его фармацевтической композиции.
Дополнительным аспектом изобретения является новое соединение формулы (I):
где
R1 и R2 независимо выбраны из H, -NO2, галогена, -NH2, -CF3, и -CN;
при условии, что по меньшей мере один из R1 и R2 отличен от H;
m равно 0, 1, 2, 3, 4, 5 или 6,
X выбран из группы, состоящей из:
индола формулы (A), связанного в положении 2:
индола формулы (B), связанного в положении 3:
и
индазола формулы (C), связанного в положении 3:
где
R3 выбран из H и C1-C6алкила с линейной цепью;
R4, R5, R6 и R7 независимо выбраны из H, C1-C6алкила, C1-C6алкоксигруппы и галогена;
R8 выбран из H и C1-C6алкила,
или его любые фармацевтически приемлемые соли, сольваты и пролекарства.
Согласно следующему аспекту настоящее изобретение относится к новому соединению формулы (I) для применения в качестве лекарственного препарата.
Дальнейшим аспектом настоящего изобретения является фармацевтическая композиция, содержащая по меньшей мере одно новое соединение формулы (I) или его любую фармацевтически приемлемую соль, пролекарство или сольват и фармацевтически приемлемый носитель, адъювант или наполнитель.
И наконец, еще один аспект изобретения относится к способу получения нового соединения формулы (I).
В приведенном выше определении соединений формулы (I) следующие термины имеют значения, указанные ниже:
«C1-C6алкил» означает линейный или разветвленный радикал углеводородной цепи, состоящий из атомов углерода и водорода, не содержащий ненасыщенности, имеющий от одного до шести атомов углерода, и который присоединен к остальной части молекулы одинарной связью, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д.
«С1-С6алкил с линейной цепью» означает линейный радикал углеводородной цепи, состоящий из атомов углерода и водорода, не содержащий ненасыщенности, имеющий от одного до шести атомов углерода, и который присоединен к остальной части молекулы одинарной связью, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д.
«C1-C6алкоксигруппа» означает радикал формулы -ORа, где Rа является «С1-С6алкильным» радикалом, определенным выше, например метоксигруппа, этоксигруппа, пропоксигруппа и т.д.
«Галоген» означает хлор, бром, фтор или йод в качестве заместителя.
В первом аспекте настоящее изобретение обеспечивает применение соединения формулы (I):
где
R1 и R2 независимо выбраны из H, -NO2, галогена, -NH2, -CF3, C1-C6алкила с линейной цепью и -CN;
m равно 0, 1, 2, 3, 4, 5 или 6,
X выбран из группы, состоящей из:
индола формулы (A), связанного в положении 2:
индола формулы (B), связанного в положении 3:
и
индазола формулы (C), связанного в положении 3:
где
R3 выбран из H и C1-C6алкила с линейной цепью;
R4, R5, R6 и R7 независимо выбраны из H, C1-C6алкила, C1-C6алкоксигруппы и галогена;
R8 выбран из H и C1-C6алкила,
или его любых фармацевтически приемлемых солей, сольватов и пролекарств для получения лекарственного препарата для лечения или профилактики заболевания или состояния, опосредуемого GSK-3.
Предпочтительными соединениями, используемыми в настоящем изобретении, являются такие, где Х является индолом формулы (А) или (В), как определено выше, связанным в положениях 2 или 3. Следующими предпочтительными соединениями являются такие, где Х является индазолом формулы (С), как описано выше, связанным в положении 3.
Другими используемыми предпочтительными соединениями являются такие, где по меньшей мере один из R1 и R2 отличен от Н.
Другими используемыми более предпочтительными соединениями являются такие, где один из R1 и R2 является Н.
Предпочтительно один из R1 или R2 является NO2 или галогеном. Так, более предпочтительными соединениями являются такие, где один из R1 и R2 является NO2 и другой является Н. Еще более предпочтительными соединениями являются такие, где R1 является NO2 и R2 является Н.
В дальнейшем предпочтительном варианте осуществления R3 выбран из H и метила.
Дальнейшими предпочтительными соединениями являются такие, где R4-R7 независимо выбраны из C1-C6алкоксигруппы и H. Предпочтительно все R4-R7 являются Н.
Соединения, где R8 выбран из H и метила, также являются предпочтительными.
Предпочтительно m выбрано из 0, 1, 2 или 3, причем m, равное 0, означает, что амидная группа прямо связана с Х через карбонильную группу.
Согласно предпочтительному варианту осуществления соединение формулы (I), используемое в настоящем изобретении, выбрано из следующих соединений:
или их любых фармацевтически приемлемых солей, сольватов и пролекарств.
В рамках настоящего изобретения заболевание или состояние, опосредуемое GSK-3, означает любое заболевание или состояние, в которое вовлечена GSK-3, предпочтительно любое заболевание или состояние, требующее ингибирования GSK-3. Такие заболевания или состояния включают, но не ограничиваются ими, любое заболевание или состояние, выбранное из диабета, состояний, связанных с диабетом, хронических нейродегенеративных состояний, включая деменции, такие как болезнь Альцгеймера, болезнь Паркинсона, прогрессирующий супрануклеарный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, боксерский паркинсонизм, гуамский комплекс паркинсонизм-деменция, болезнь Пика, синдром Герстманна-Штройслера-Шейнкера, болезнь Крейтцфельда-Якоба, церебральная амилоидная ангиопатия, обусловленная прионовыми белками, кортикобазальная дегенерация, лобно-височная деменция, болезнь Гентингтона, деменция, связанная со СПИДом, боковой амиотрофический склероз, рассеянный склероз и нейротравматические заболевания, такие как острый инсульт, эпилепсия, расстройства настроения, такие как депрессия, шизофрения и биполярные расстройства, маниакально-депрессивное расстройство, стимулирование функционального восстановления после инсульта, церебральное кровотечение (например, обусловленное церебральной амилоидной ангиопатией), выпадение волос, ожирение, атеросклеротическое сердечно-сосудистое заболевание, гипертензия, синдром поликистозного яичника, синдром Х, ишемия, повреждение мозга, особенно травматическое повреждение мозга, рак, лейкопения, синдром Дауна, деменция с тельцами Леви, воспаление, хронические воспалительные заболевания, рак и гиперпролиферативные заболевания, такие как гиперплазии и иммунодефицит.
В предпочтительном варианте осуществления заболевание или состояние выбраны из прогрессирующего супрануклеарного паралича, болезни Пика, кортикобазальной дегенерации, лобно-височной деменции, болезни Гентингтона, бокового амиотрофического склероза, рассеянного склероза и нейротравматических заболеваний, таких как острый инсульт, эпилепсии, расстройств настроения, таких как депрессия, шизофрении и биполярных расстройств, маниакально-депрессивного расстройства, стимулирования функционального восстановления после инсульта, церебрального кровотечения (например, обусловленного церебральной амилоидной ангиопатией), ожирения, синдрома Х, ишемии, повреждения мозга, особенно травматического повреждения мозга, синдрома Дауна, деменции с тельцами Леви, воспаления, хронических воспалительных заболеваний, рака и гиперпролиферативных заболеваний, таких как гиперплазии. Более предпочтительны заболевания или состояния, выбранные из болезни Альцгеймера, диабета, болезни Паркинсона, эпилепсии и расстройств настроения. Еще более предпочтительны заболевания или состояния, выбранные из болезни Альцгеймера, болезни Паркинсона, эпилепсии и расстройств настроения.
Если не указано иначе, предполагается, что соединения формулы (I), используемые в настоящем изобретении, также включают соединения, которые различаются только присутствием одного или более изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением того, что водород заменен дейтерием или тритием, или углерод заменен углеродом, обогащенным 13C или 14C, или используется азот, обогащенный 15N; все такие соединения входят в объем данного изобретения.
Термин «фармацевтически приемлемые соли, сольваты или пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которое после введения реципиенту способно предоставить (прямо или опосредованно) соединение, описанное выше. Однако следует признать, что соли, не являющиеся фармацевтически приемлемыми, также включены в объем данного изобретения, поскольку их можно использовать для получения фармацевтически приемлемых солей. Соли, пролекарства и производные можно получить способами, известными в данной области.
Например, фармацевтически приемлемые соли соединений формулы (I) синтезируют из исходного соединения, содержащего основную или кислотную группу, традиционными химическими способами. Обычно такие соли получают взаимодействием свободных кислотных или основных форм данных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в их смеси. Обычно предпочтительны такие неводные среды, как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры кислотно-аддитивных солей включают кислотно-аддитивные соли минеральных кислот, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и кислотно-аддитивные соли органических кислот, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры основно-аддитивных солей включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и органические соли, такие как, например, соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина, глюкамина и основных аминокислот.
Особо предпочтительными производными являются такие, которые повышают биодоступность соединений данного изобретения, когда такие соединения вводят пациенту (например, давая возможность перорально вводимому соединению более быстро всасываться в кровь), или такие, которые повышают доставку исходного соединения к биологическому компартменту (например, в мозг или лимфатическую систему) относительно исходных видов.
Соединения формулы (I), используемые в данном изобретении, могут быть в кристаллической форме в виде свободных соединений или в форме сольватов (например, гидратов), и предполагается, что обе формы входят в объем настоящего изобретения. Способы сольватации общеизвестны в данной области. Приемлемые сольваты являются фармацевтически приемлемыми сольватами. В конкретном варианте осуществления сольватом является гидрат.
Соединения формулы (I) или их соли или сольваты преимущественно представлены в фармацевтически приемлемой или по существу чистой форме. Фармацевтически приемлемой формой считают, среди прочего, такую, которая имеет фармацевтически приемлемую степень чистоты, исключая нормальные фармацевтические добавки, такие как разбавители и носители, и включая материал, не рассматриваемый как токсичный при нормальном уровне дозирования. Степень чистоты для лекарственных веществ предпочтительно составляет выше 50%, более предпочтительно выше 70%, наиболее предпочтительно выше 90%. В предпочтительном варианте осуществления она составляет выше 95% для соединения формулы (I) или его солей, сольватов или пролекарств.
Соединения, используемые в данном изобретении и представленные вышеописанной формулой (I), могут включать энантиомеры, в зависимости от присутствия хиральных центров, или изомеры, в зависимости от присутствия кратных связей (например, Z, E). Отдельные изомеры, энантиомеры и диастереоизомеры и их смеси входят в объем настоящего изобретения.
Соединения формулы (I) могут быть использованы в биологических исследованиях, при которых нужно модулировать активность GSK-3. Поэтому в другом аспекте изобретение относится к применению соединения формулы (I), определенной выше, в качестве реактива для модулирования GSK-3 в биологических исследованиях, предпочтительно, в качестве реактива для ингибирования активности GSK-3.
Дальнейший аспект изобретения относится к способу лечения или предупреждения заболевания, расстройства или состояния, в которое вовлечена GSK-3, где указанный способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения общей формулы (I) или любой его соли или сольвата или его фармацевтической композиции.
Другой аспект изобретения относится к новому соединению формулы (I):
где
R1 и R2 независимо выбраны из H, -NO2, галогена, -NH2, -CF3, и -CN;
при условии, что по меньшей мере один из R1 и R2 отличен от Н;
m является целым числом от 0 до 6,
X выбран из группы, состоящей из:
индола формулы (А), связанного в положении 2:
индола формулы (В), связанного в положении 3:
и
индазола формулы (С), связанного в положении 3:
где
R3 выбран из H и C1-C6алкила с линейной цепью;
R4, R5, R6 и R7 независимо выбраны из H, C1-C6алкила, C1-C6алкоксигруппы и галогена;
R8 выбран из H и C1-C6алкила,
или к его любым фармацевтически приемлемым солям, сольватам и пролекарствам.
Предпочтительными соединениями, используемыми в настоящем изобретении, являются такие, где Х является индолом формулы (А) или (В), как определено выше, связанным в положениях 2 или 3. Следующими предпочтительными соединениями являются такие, где Х является индазолом формулы (С), как описано выше, связанным в положении 3.
Другими предпочтительными соединениями являются такие, где один из R1 и R2 является Н.
Предпочтительно один из R1 или R2 является -NO2 или галогеном. Так, более предпочтительными соединениями являются такие, где один из R1 и R2 является -NO2 и другой является Н. Еще более предпочтительными соединениями являются такие, где R1 является -NO2 и R2 является Н.
В следующем предпочтительном варианте осуществления R3 выбран из H и метила.
Дальнейшими предпочтительными соединениями являются такие, где R4-R7 независимо выбраны из C1-C6алкоксигруппы и H. Предпочтительно все R4-R7 являются Н.
Соединения, где R8 выбран из H и метила, также являются предпочтительными.
Предпочтительно m выбран из 0, 1, 2 или 3, причем m, равный 0, означает, что амидная группа прямо связана с Х через карбонильную группу.
Согласно предпочтительному варианту осуществления соединение формулы (I) выбрано из следующих соединений:
или их любых фармацевтически приемлемых солей, сольватов и пролекарств.
Если не указано иначе, также предполагается, что новые соединения формулы (I) включают соединения, которые различаются только присутствием одного или более изотопно обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением того, что водород заменен дейтерием или тритием, или углерод заменен углеродом, обогащенным 13C или 14C, или используется азот, обогащенный 15N; все такие соединения входят в объем данного изобретения.
Термин «фармацевтически приемлемые соли, сольваты или пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату или любому другому соединению, которое после введения реципиенту способно предоставить (прямо или опосредованно) соединение, описанное выше. Однако следует отметить, что соли, не являющиеся фармацевтически приемлемыми, также включены в объем данного изобретения, поскольку их можно использовать для получения фармацевтически приемлемых солей. Соли, пролекарства и производные можно получить способами, известными в данной области.
Например, фармацевтически приемлемые соли новых соединений формулы (I) синтезируют из исходного соединения, содержащего основную или кислотную группу, традиционными химическими способами. Обычно такие соли получают взаимодействием свободных кислых или основных форм данных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в их смеси. Обычно предпочтительны такие неводные среды, как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры кислотно-аддитивных солей включают кислотно-аддитивные соли минеральных кислот, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и кислотно-аддитивные соли органических кислот, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры основно-аддитивных солей включают неорганические соли, такие как, например, соли натрия, калия, кальция, аммония, магния, алюминия и лития, и органические соли, такие как, например, соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина, глюкамина и основных аминокислот.
Особо предпочтительными производными являются такие, которые повышают биодоступность соединений данного изобретения, когда такие новые соединения вводят пациенту (например, давая возможность перорально вводимому соединению более быстро всасываться в кровь), или такие, которые повышают доставку исходного соединения к биологическому компартменту (например, в мозг или лимфатическую систему) относительно исходных видов.
Новые соединения формулы (I) могут быть в кристаллической форме в виде свободных соединений или в форме сольватов (например, гидратов), и предполагается, что обе формы входят в объем настоящего изобретения. Способы сольватации общеизвестны в данной области. Приемлемые сольваты являются фармацевтически приемлемыми сольватами. В конкретном варианте осуществления сольватом является гидрат.
Новые соединения формулы (I) или их соли или сольваты преимущественно представлены в фармацевтически приемлемой или по существу чистой форме. Фармацевтически приемлемой формой считают, наряду с прочим, такую, которая имеет фармацевтически приемлемую степень чистоты, исключая нормальные фармацевтические добавки, такие как разбавители и носители, и включая материал, не рассматриваемый как токсичный при нормальных уровнях дозирования. Степень чистоты для лекарственных веществ предпочтительно составляет выше 50%, более предпочтительно выше 70%, наиболее предпочтительно выше 90%. В предпочтительном варианте осуществления она составляет выше 95% для соединения формулы (I) или его солей, сольватов или пролекарств.
Новые соединения, представленные вышеописанной формулой (I), могут включать энантиомеры, в зависимости от присутствия хиральных центров, или изомеры, в зависимости от присутствия кратных связей (например, Z, E). Отдельные изомеры, энантиомеры и диастереоизомеры и их смеси входят в объем настоящего изобретения.
Кроме того, настоящее изобретение предоставляет фармацевтические композиции, содержащие по меньшей мере одно новое соединение формулы (I) настоящего изобретения или его фармацевтически приемлемые соли, пролекарства или стереомеры с фармацевтически приемлемым носителем, адъювантом или наполнителем для введения пациенту.
Примеры фармацевтических композиций включают любую твердую (таблетки, пилюли, капсулы, гранулы и т.п.) или жидкую (растворы, суспензии или эмульсии) композицию для перорального, местного или парентерального применения.
В предпочтительном варианте осуществления фармацевтическая композиция представлена в пероральной форме. Подходящими дозированными формами для перорального введения могут быть таблетки и капсулы, которые могут содержать традиционные эксципиенты, известные в данной области, такие как связующие, например сироп, камедь акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; лубриканты для таблетирования, например стеарат магния; дезинтегранты, например крахмал, поливинилпирролидон, натрийгликолаткрахмал или микрокристаллическую целлюлозу; или фармацевтически приемлемые увлажнители, такие как лаурилсульфат натрия.
Твердые пероральные композиции можно получить традиционными способами смешивания, наполнения или таблетирования. Для распределения активного агента по всему объему в композициях с большими количествами наполнителей можно использовать повторные операции смешивания. Такие операции традиционны в данной области. Например, таблетки можно получить влажной или сухой грануляцией, и, необязательно, на них можно нанести покрытие способами, хорошо известными в нормальной фармацевтической практике, в частности, для нанесения киш