Способы разрушения клеток с использованием эффекторных функций анти-epha4 антител
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложен способ лечения или профилактики злокачественной опухоли, клетки которой экспрессируют EphA4. Способ включает введение анти-EphA4 антитела, где антитело имеет IgG1 человека, включает VH и VL области, каждая из которых содержит по три соответствующих CDR. Описана фармацевтическая композиция на основе антитела для применения в указанном способе. Предложенные изобретения могут найти применение в терапии рака поджелудочной железы. 2 н. и 9 з.п. ф-лы, 2 ил., 1 табл.
Реферат
По настоящей заявке испрашивается приоритет предварительной заявки США No. 60/777794, поданной 28 февраля 2006, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
Область техники
Настоящее изобретение относится к способам разрушения клеток с использованием эффекторной функции анти-EphA4 антител и к композициям, в которых они используются.
Уровень техники
Рак поджелудочной железы имеет самый высокий показатель смертности среди злокачественных новообразований, и продолжительность жизни пациентов в 4% составляет 5 лет. Каждый год приблизительно у 28000 пациентов диагностируют рак поджелудочной железы, и почти все пациенты умирают от этого заболевания. (Greenlee, R. T., et al., (2001) CA Cancer J Clin, 51:15-36). Неблагоприятный прогноз этого заболевания связан с трудностями ранней диагностики и слабой отвечаемости на существующие в настоящее время способы лечения (Greenlee, R. T., et al., (2001) CA Cancer J Clin, 51:15-36, Klinkenbijl, J. H., et al., (1999) Ann Surg, 230: 776-82; обсуждение 782-4.). В частности, в настоящее время отсутствуют идентифицированные опухолевые маркеры, которые позволяют проводить надежный скрининг на ранней, потенциально излечимой стадии заболевания.
В исследовании, направленном на выяснение механизмов канцерогенеза, был обнаружен целый ряд подходящих молекул-мишеней для разработки противоопухолевых средств. Например, было показано, что ингибитор фарнезилтрансферазы (FTI) является эффективным при лечении Ras-зависимых опухолей на животных моделях (Sun J et al., (1998) Oncogene, 16:1467-73.). Это фармацевтическое средство было разработано для ингибирования путей передачи сигналов факторов роста, относящихся к Ras, которые зависят от посттранкрипционного фарнезилирования. Клинические испытания у людей с применением противоопухолевых средств в сочетании с анти-HER2 моноклональным антителом, трастузумабом для получения антагонистического действия в отношении прото-онкогена HER2/neu, показали успешное улучшение клинического ответа и улучшение общего коэффициента выживаемости у пациентов с раком груди. Ингибитор тирозинкиназы STI-571 представляет собой ингибитор, который селективно дезактивирует слитый белок bcr-ab1. Это фармацевтическое средство было разработано для лечения хронического миелолейкоза, при котором значительную роль в трансформации лейкоцитов играет постоянная активация тирозинкиназы bcr-ab1. Такие фармацевтические средства предназначены для подавления канцерогенной активности специфических генных продуктов (Molina MA, et al., (2000) Cancer Res, 16:4744-9). Таким образом, потенциальными мишенями для разработки новых противоопухолевых средств в основном являются генные продукты с активированной экспрессией злокачественных клеток.
Другая терапевтическая стратегия включает применение антител, которые связываются со злокачественными клетками. Ниже представлены некоторые характерные подходы, использующиеся при лечении злокачественных заболеваний антителами:
терапия Missile: в этом подходе фармацевтическое средство связывают с антителом, которое специфически связывается со злокачественными клетками, тем самым давая возможность этому средству специфически воздействовать на злокачественные клетки. Такое нацеленное распределение позволяет интенсивно воздействовать на злокачественные клетки даже тем средствам, которые оказывают серьезные побочные эффекты. Кроме фармацевтических средств, также были описаны подходы, когда с антителом связывают предшественников фармацевтических средств, ферменты, которые метаболизируют эти предшественники до активной формы, и так далее.
Применение антител, которые нацеливают функциональные молекулы: в этом подходе ингибируется связывание факторов роста и злокачественных клеток благодаря использованию, например, антител, которые связываются с рецепторами факторов роста или факторами роста. Пролиферация некоторых злокачественных клеток в значительной степени зависит от факторов роста. Например, известно, что некоторые типы рака зависят от эпителиального фактора роста (EGF) или фактора роста эндотелия сосудов (VEGF) для роста клеток. Для таких типов рака можно предположить, что ингибирование связывания факторов роста и злокачественных клеток будет иметь терапевтический эффект.
Цитотоксичность антител: антитела, которые связываются с определенными видами антигенов, могут быть цитотоксичными для злокачественных клеток. С такими типами антител молекула антитела сама обладает непосредственным противоопухолевым действием. Антитела, которые демонстрируют цитотоксичность в отношении злокачественных клеток, привлекают внимание в качестве препаратов антител, как предполагается, будут иметь высокую противоопухолевую эффективность.
Описание изобретения
Авторами настоящего изобретения ранее была представлена информация о том, что EphA4 является геном, связанным с раком поджелудочной железы, экспрессия которого активирована в злокачественных клетках поджелудочной железы. См. WO2004/031412, приведенную в качестве ссылки в полном объеме. Кроме того, авторы представили сведения о том, что siРНК против EphA4 супрессирует пролиферацию клеток поджелудочной железы. См. WO2005/083086, приведенную в качестве ссылки в полном объеме. В настоящей заявке авторы изобретения исследовали антитела, способные индуцировать цитотоксичность, уделяя большое внимание генам, таким как EphA4, которые проявляют повышенную экспрессию в злокачественных клетках. Результаты показали, что сильная цитотоксичность может быть индуцирована в клетках, экспрессирующих EphA4, если эти клетки контактируют с анти-EphA4 антителами, таким образом, было создано настоящее изобретение.
В частности, настоящее изобретение относится к следующим фармацевтическим композициям или способам:
[1] фармацевтической композиции для разрушения клеток, экспрессирующих EphA4, эта композиция содержит в качестве активного ингредиента анти-EphA4 антитело, которое обладает эффекторной функцией антитела;
[2] фармацевтической композиции по пункту [1], при этом клетка, экспрессирующая EphA4, представляет собой злокачественную клетку поджелудочной железы;
[3] фармацевтической композиции по пункту [1], в которой анти-EphA4 антитело представляет собой моноклональное антитело;
[4] фармацевтической композиции по пункту [1], в которой эффекторная функция антитела представляет собой либо антитело-зависимую цитотоксичность, либо комплемент-зависимую цитотоксичность, либо и то, и другое;
[5] фармацевтической композиции по пункту [1], в которой антитело состоит из цепи VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркаса, аминокислотная последовательность каждой CDR в каждой цепи VH и VL выбрана из группы, состоящей из:
VHCDR1 человека: ELSMH (SEQ ID NO:10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO:11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO:12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO:15),
VL CDR2 человека: SNNQRPS (SEQ ID NO:16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO:17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO:20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO:21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO:22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO:24),
VL CDR2 человека: DNNKRPS (SEQ ID NO:25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO:26);
[6] композиции по пункту [5], где VH человека соответствует аминокислотной последовательности SEQ ID NO:27 или 29, а VL человека соответствует аминокислотной последовательности SEQ ID NO:28 или 30;
[7] композиции по пункту [5], где антитело дополнительно включает Fc домен IgG1 человека;
[8] антителу, состоящему из цепи VH и VL, каждая цепь VH и VL содержит аминокислотные последовательности CDR, обозначенные как CDR1, CDR2 и CDR3, разделенные аминокислотными последовательностями каркаса, аминокислотная последовательность каждой CDR в каждой цепи VH и VL выбрана из группы, состоящей из:
VH CDR1 человека: ELSMH (SEQ ID NO:10),
VH CDR2 человека: GFDPEDGETIYAQKFQG (SEQ ID NO:11),
VH CDR3 человека: AQPFHWGDDAFDI (SEQ ID NO:12),
VL CDR1 человека: SGSSSNIGSNTVN (SEQ ID NO:15),
VL CDR2 человека: SNNQRPS (SEQ ID NO:16),
VL CDR3 человека: AAWDDSLNGPV (SEQ ID NO:17); и
VH CDR1 человека: SNSAAWN (SEQ ID NO:20),
VH CDR2 человека: RTYYRSKWYNDYAVSVKS (SEQ ID NO:21),
VH CDR3 человека: DSLRSFDY (SEQ ID NO:22),
VL CDR1 человека: SGSSSNIGNNYVS (SEQ ID NO:24),
VL CDR2 человека: DNNKRPS (SEQ ID NO:25),
VL CDR3 человека: GTWDSSLSAVV (SEQ ID NO:26);
[9] антителу по пункту [8], в котором VH человека соответствует аминокислотной последовательности SEQ ID NO:27 или 29, а VL человека соответствует аминокислотной последовательности SEQ ID NO:28 или 30;
[10] антителу по пункту [8], дополнительно включающему Fc домен IgG1 человека;
[11] выделенному полинуклеотиду, кодирующему антитело по пункту [8];
[12] вектору, содержащему полинуклеотид по пункту [11];
[13] выделенной клетке-хозяину, содержащей вектор по пункту [12];
[14] способу получения антитела, включающему стадии культивирования клетки-хозяина по пункту [13], так, чтобы экспрессировался полинуклеотид, и восстановления антитела из культуры клетки-хозяина;
[15] фармацевтической композиции для разрушения клеток, экспрессирующих EphA4, содержащей полинуклеотид по пункту [11], или вектору, содержащему полинуклеотид;
[16] способу разрушения клеток, экспрессирующих EphA4, включающему стадии:
а) контактирования клеток, экспрессирующих EphA4, с анти-EphA4 антителом, и
b) разрушения клеток, экспрессирующих EphA4, под действием эффекторной функции антитела, связавшегося с клеткой;
[17] иммуногенной композиции для индукции антитела, которое обладает эффекторной функцией в отношении клеток, экспрессирующих EphA4, содержащей в качестве активного ингредиента EphA4 его иммунологически активный фрагмент или ДНК, которая может экспрессировать EphA4, или его иммунологически активный фрагмент;
[18] способу индукции антитела, которое обладает эффекторной функцией в отношении клетки, экспрессирующей EphA4, включающему стадию введения EphA4, его иммунологически активного фрагмента или клетки, или ДНК, которая экспрессирует EphA4, или его иммунологически активный фрагмент; и
[19] способу лечения или профилактики рака поджелудочной железы у пациента, включающему стадию введения указанному пациенту фармацевтически эффективного количества анти-EphA4 антитела, или его иммунологически активного фрагмента, при этом антитело обладает эффекторной функцией антитела.
Настоящее изобретение относится к фармацевтическим композициям для разрушения клеток, экспрессирующих EphA4, за счет эффекторной функции антитела, содержащим в качестве активного ингредиента анти-EphA4 антитело. Настоящее изобретение также относится к применению анти-EphA4 антитела для получения фармацевтических композиций для разрушения клеток, экспрессирующих EphA4, с использованием эффекторной функции анти-EphA4 антитела. Фармацевтические композиции по настоящему изобретению состоят из анти-EphA4 антител и фармацевтически приемлемых носителей.
Авторы настоящего изобретения использовали микрочипы кДНК для анализа генной экспрессии злокачественных клеток предстательной железы или поджелудочной железы, а нормальные клетки получали у пациентов с раком предстательной железы или поджелудочной железы. Затем был идентифицирован ряд генов, экспрессия которых специфически повышена в злокачественных клетках поджелудочной железы. Среди этих генов с измененной экспрессией в злокачественных клетках поджелудочной железы, один из генов, ген рецептора Eph A4 (обозначенный как «EphA4»), кодирующий цитоплазматический мембранный белок с низким уровнем экспрессии в основных органах, был выбран в качестве кандидатного гена-мишени для лечения рака поджелудочной железы (Nakamura T, et al., (2004) Oncogene. 2004 Mar 25;23(13):2385-400). Выбирая гены с пониженным уровнем экспрессии в основных органах, предполагалось, что можно будет избежать опасности побочных эффектов. Было подтверждено, что из белков, кодируемых генами, выбранными таким образом, анти-EphA4 антитела обладают эффекторной функцией в отношении клеток, экспрессирующих EphA4.
Данные, полученные авторами настоящего изобретения, показывают, что в усиленной экспрессионной системе, EphA4, меченный c-myc-His, был локализован в цитоплазматической мембране, что подтвердилось при иммунофлуоресцентной микроскопии. Ген EphA4 кодирует аминокислотную последовательность, которая, как предполагали, функционирует как сигнальный пептид на его N-конце. Как указано выше, было отмечено, что этот белок преимущественно локализован на цитоплазматической мембране, и, следовательно, было сделано предположение, что он является трансмембранным белком. Кроме того, пониженный уровень экспрессии этого гена в основных органах и его повышенная экспрессия в злокачественных клетках поджелудочной железы определили EphA4 в качестве подходящего клинического маркера и терапевтической мишени.
Условия, необходимые для разрушения злокачественных клеток с помощью эффекторной функции, например, включают следующее:
- экспрессию большого числа молекул антигена на поверхности мембраны злокачественных клеток,
- одинаковое распределение антигенов в злокачественной ткани,
- задержку связывания антигенов с антителами на клеточной поверхности в течение длительного времени.
Более конкретно, например, антигены, распознаваемые антителами, должны экспрессироваться на поверхности клеточной мембраны. Кроме того, предпочтительно, чтобы соотношение антиген-положительных клеток было на максимально высоком уровне в клетках, формирующих злокачественные ткани. В идеале, все злокачественные клетки являются антиген-положительными. В тех случаях, когда антиген-положительные и отрицательные клетки перемешаны в популяции злокачественных клеток, клинический терапевтический эффект антител, специфичных к ним, будет значительно снижен.
В основном, если на клеточной поверхности экспрессируется максимально возможное число молекул, то можно ожидать эффективные эффекторные функции. Также важно, чтобы антитело, связанное с таким антигеном, не проникало в клетки. Некоторые рецепторы проникают в клетки (эндоцитоз) после связывания с лигандом. Аналогично, антитела, связанные с антигенами клеточной поверхности также могут проникать в клетки. Этот феномен, посредством которого антитела, связанные с антигенами клеточной поверхности, проникают в клетку, называется интернализацией. При интернализации константная область антитела (Fc) проникает в клетку. Однако клетки или молекулы, необходимые для осуществления эффекторной функции, остаются снаружи антиген-экспрессирующей клетки. Таким образом, интернализация ингибирует эффекторную функцию антитела. Следовательно, если желательно использовать эффекторную функцию антитела, то важно подобрать антиген, который приведет к ограничению интернализации антитела. Авторы настоящего изобретения впервые обнаружили, что EphA4 является антигеном-мишенью, обладающим этим свойством.
Единственное и множественное число в настоящей заявке используется взаимозаменяемо и обозначает «по меньшей мере одно», если не указано иного.
«Выделенный» или «очищенный» полипептид представляет собой полипептид, по существу свободный от клеточного материала, например углеводов, липидов или других загрязняющих белков источника клеток или ткани, из которых этот белок получен, и/или, по существу, свободен от химических предшественников или других химических веществ при химическом синтезе. Термин «по существу свободный от клеточного материала» охватывает препараты полипептида, в которых этот полипептид отделен от клеточных компонентов клеток, из которых он выделен или получен рекомбинантным путем. Следовательно, полипептид, который по существу свободен от клеточного материала, включает препараты полипептида, содержащие примерно меньше 30%, 20%, 10% или 5% (от сухой массы) гетерогенного белка (также обозначенного в настоящем описании как «загрязняющий белок»). В тех случаях, когда полипептид получен рекомбинантным путем, он также предпочтительно по существу свободен от клеточной среды, которая содержит препараты полипептида вместе с культуральной средой, составляющей примерно меньше 20%, 10% или 5% от объема белкового препарата. В тех случаях, когда полипептид получают химическим синтезом, он предпочтительно по существу свободен от химических предшественников или других химических веществ, включает препараты полипептида с химическими предшественниками или другими химическими веществами, участвующими в синтезе этого белка, составляющими примерно меньше 30%, 20%, 10%, 5% (от сухой массы) объема белкового препарата. Конкретный препарат белка содержит выделенный или очищенный полипептид, может быть подтвержден, например, при появлении одиночной полосы при электрофорезе белкового препарата в полиакриламидном геле с додецилсульфатом натрия (SDS) и окрашивании этого геля Кумасси бриллиантовым синим. В предпочтительном варианте осуществления антитела по настоящему изобретению или их фрагменты являются выделенными или очищенными.
«Выделенная» или «очищенная» молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновой кислоты, которые находятся в природном источнике этой молекулы нуклеиновой кислоты. «Выделенная» или «очищенная» молекула нуклеиновой кислоты, например молекула кДНК, может быть по существу свободной от другого клеточного материала, или культуральной среды, при получении рекомбинантными технологиями, или по существу свободной от химических предшественников или других химических веществ при синтезе химическим путем. В предпочтительном варианте осуществления молекулы нуклеиновой кислоты, кодирующие антитела по настоящему изобретению или их фрагменты, являются выделенными или очищенными.
«Антитела» и «иммуноглобулины» представляют собой гликопротеины, имеющие одинаковые структурные характеристики. Несмотря на то, что антитела обладают специфичностью связывания в отношении определенного антигена, иммуноглобулины включают как антитела, так и другие антителоподобные молекулы, для которых антигенная специфичность не была определена. Низкий уровень продукции полипептидов последнего вида, например, отмечен в лимфатической системе и высокий уровень - в миеломах.
«Нативные антитела и иммуноглобулины» обычно представляют собой гетеротетрамерные гликопротеины размером примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью посредством одной ковалентной дисульфидной связи, хотя число дисульфидных связей между тяжелыми цепями различных типов иммуноглобулинов может изменяться. Между цепями каждой тяжелой и легкой цепи на равном расстоянии друг от друга также расположены дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов (CH). Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце (CL); константный домен легкой цепи совпадает с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи совпадает с вариабельным доменом тяжелой цепи. Считается, что некоторые аминокислотные остатки образуют поверхность взаимодействия между вариабельными доменами легкой и тяжелой цепи (Chothia et al., (1985) J Mol Biol.; 186:651-63; Novotny и Haber, (1985) Proc Natl Acad Sci USA.; 82:4592-6).
Термин «вариабельный» обозначает, что последовательности некоторых частей вариабельных доменов значительно различаются у различных антител, и, следовательно, предполагается, что они вовлечены в связывание и специфичность каждого конкретного антитела в отношении конкретного антигена. Однако вариабельность в вариабельных доменах антител распределена неравномерно. Скорее она главным образом сконцентрирована в трех сегментах, называемых «областями, определяющими комплементарность» (также известных как «CDR») или гипервариабельных областях вариабельных доменов как легкой, так и тяжелой цепи. Наиболее консервативные части вариабельных доменов называются каркасной областью (FR). Каждый вариабельный домен нативной тяжелой и легкой цепи включает четыре каркасные области, главным образом принимающие β-складчатую конфигурацию, соединенные тремя CDR, которые образуют петли, соединяющие, и в некоторых случаях, образующие часть β-складчатой структуры. CDR каждой цепи удерживаются вместе в непосредственной близости каркасными областями и с CDR другой цепи вносят вклад в образование трехмерного антиген-связывающего сайта антитела (Kabat et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md.). Константные домены напрямую не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, например опосредуют участие антитела в антитело-зависимой цитотоксичности.
Папаин расщепляет антитело на два идентичных антиген-связывающих фрагмента, называемых «Fab» фрагментами, каждый с одним антиген-связывающим сайтом, и остаточный «Fc» фрагмент. Обработка пепсином дает F(ab')2 фрагмент, который имеет два антиген-связывающих сайта. «Fv» представляет собой минимальный фрагмент антитела, который содержит полный антиген-распознающий и связывающий сайт. Эта область обычно состоит из димера вариабельного домена одной тяжелой и одной легкой цепи, находящихся в прочной нековалентной связи. В такой конфигурации три CDR каждого вариабельного домена взаимодействуют с определенным антиген-связывающим сайтом на поверхности димера VH-VL. Совместно, шесть CDR обеспечивают антиген-связывающую специфичность антитела. Однако, даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь связывающий сайт.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH-1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab наличием нескольких дополнительных остатков на карбоксильном конце CH-1 домена тяжелой цепи, включая один или несколько цистеинов шарнирной области антитела. Fab'-SH в настоящем описании является обозначением Fab', в котором остаток (остатки) цистеина константных доменов несут свободную тиольную группу. Фрагменты F(ab')2 антитела исходно были получены как части Fab' фрагментов, которые имеют между собой шарнирные цистеины. Другие химические соединения фрагментов антитела также известны из уровня техники.
«Легкие цепи» антител (иммуноглобулинов) любого позвоночного можно отнести к одному из двух четко различимых типов, называемых κ (каппа) и λ (лямбда) соответственно, на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена тяжелых цепей иммуноглобулины можно отнести к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них дополнительно можно разделить на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов известны из уровня техники.
Термин «моноклональное антитело», используемое в настоящей заявке, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела в этой популяции являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минимальных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Более того, в отличие от обычных (поликлональных) препаратов антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Кроме специфичности, моноклональные антитела предпочтительны тем, что могут синтезироваться гибридомной культурой, не загрязненной другими иммуноглобулинами. Следовательно, определение «моноклональное» указывает на характер антитела, полученного по существу из гомогенной популяции антител, и не должно рассматриваться как требование получения антитела каким-то конкретным способом. Например, моноклональные антитела по настоящему изобретению могут быть получены методом гибридом, впервые описанным Kohler и Milstein, (1975) Nature.; 256:495-7, или могут быть получены методами рекомбинантных ДНК (Cabilly et al., (1984) Proc Natl Acad Sci USA.; 81:3273-7).
Описанные в настоящем документе моноклональные антитела, в частности, включают в себя «химерные» антитела или иммуноглобулины, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих из конкретных видов или принадлежащих конкретному классу или подклассу антител, а остальная цепь(и) идентична или гомологична соответствующим последовательностям антител, происходящих из других видов, или принадлежащим другим классам или подклассам антител, а также фрагменты таких антител, при условии, что они обладают желательной биологической активностью (Cabilly et al., supra; Morrison et al., (1984) Proc Natl Acad Sci USA.; 81:6851-5). Наиболее распространенные химерные антитела или иммуноглобулины состоят из фрагментов антитела человека и крысы/мыши, в основном константной области антитела человека и вариабельных областей антитела мыши.
«Гуманизированные» формы антител, не являющихся антителами человека (например, крысы или мыши), представляют собой особые химерные иммуноглобулины, иммуноглобулиновые цепи и фрагменты которых содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося иммуноглобулином человека. Такие фрагменты также включают Fv, Fab, Fab', F(ab')2, и другие антиген-связывающие субпоследовательности антител. Главным образом, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки области, определяющей комплементарность (CDR) реципиентного антитела, заменены остатками CDR видов, не являющихся человеком (донорное антитело), например мыши, крысы или кролика, обладающими желаемой специфичностью, аффинностью и функциональной активностью. В некоторых случаях Fv остатки каркасной области иммуноглобулина человека могут быть заменены соответствующими остатками, не принадлежащими человеку. В контексте настоящего изобретения, только несколько, два или, предпочтительно, один остаток каркасной области (областей) в гуманизированном антителе заменен остатками, не принадлежащими человеку. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются ни в реципиентном антителе, ни в последовательностях введенной CDR или каркасной области. Эти модификации обычно вводят для дополнительной очистки и оптимизации функции антитела. В основном, гуманизированное антитело включает по существу все по меньшей мере из одного и, обычно, двух, вариабельных доменов, в которых все или по существу все CDR соответствуют областям иммуноглобулина, не принадлежащего человеку, и все или по существу все каркасные области представляют собой области консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело в оптимальном случае также включает по меньшей мере часть константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Дополнительное подробное описание представлено в статье Jones et al., (1986) Nature.; 321:522-5; Riechmann et al., (1988) Nature.; 332:323-7; Presta, (1992) Curr Opin Struct Biol. 2:593-6.
«Одноцепочечные Fv» или «sFv» фрагменты антител состоят из VH и VL доменов антитела, при этом домены находятся в одной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно включает полипептидный линкер между VH и VL доменами, который обеспечивает образование желаемой трехмерной структуры sFv, необходимой для связывания с антигеном. Был описан ряд способов определения химических структур для преобразования природно соединенных, но разделенных химически легкой и тяжелой полипептидных цепей из V области антитела в sFv молекулу, которая будет укладываться в трехмерную структуру, по существу сходную со структурой антиген-связывающего сайта (патент США № 5091513, 5132405 и 4946778; Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenberg and Moore eds., Springer-Verlag, New York, pp. 269-315(1994)).
Fc-область (фрагмент, кристаллизуемый) указанный выше, происходит из каркасной части «Y» антитела и состоит из двух тяжелых цепей, которые обеспечивают от двух до трех константных доменов каждый (в зависимости от класса антитела). Fc связывается с различными клеточными рецепторами и белками комплемента. Таким образом, она опосредует различные физиологические эффекты антител (опсонизацию, клеточный лизис, дегрануляцию тучных клеток, базофилов и эозинофилов и другие процессы).
Некоторые клетки (например, тучные клетки и фагоциты) на своей поверхности имеют специфические рецепторы для связывания с антителами. Эти рецепторы называются Fc-рецепторами и, как предполагает название, взаимодействуют с Fc-областью некоторых антител (например, IgA, IgG, IgE). Взаимодействие конкретного антитела с Fc-рецептором на конкретной клетке запускает эффекторную функцию клетки (например, фагоцитоз у фагоцитов, дегрануляцию у тучных клеток), что, в конечном счете, приведет к разрушению чужеродного микроорганизма. Fc-рецепторы являются изотип-специфичными, что обеспечивает иммунной системе большую гибкость, так как в различных ситуациях необходимы только определенные иммунные механизмы для ответа на антигены. Соответственно в контексте настоящего изобретения термин «эффекторная функция» относится к цитотоксичности, при которой вовлечены Fc-области антител. Альтернативно, эффекторную функцию также можно объяснить как роль, которая определяет биологическую активность, запускаемую распознаванием антигена антителом. Например, функции, которые запускают эффект, посредством которого Fc-области антител, связанные с антигенами, разрушают клетки, экспрессирующие эти антигены, также можно отнести к эффекторной функции антитела. В настоящей заявке предпочтительными клетками-мишенями являются злокачественные клетки.
Как правило, связывание антитела с антигеном не имеет непосредственного биологического эффекта. Существенные биологические эффекты скорее являются следствием вторичных «эффекторных функций» антител. Иммуноглобулины опосредуют целый ряд таких эффекторных функций. Обычно способность осуществлять конкретную эффекторную функцию требует, чтобы антитело связалось со своим антигеном. Однако не каждый иммуноглобулин будет опосредовать эффекторные функции. Примеры известных эффекторных функций антител включают антитело-зависимую клеточную цитотоксичность (ADCC), комплемент-зависимую цитотоксичность (CDC) и нейтрализующую активность. Каждая функция описана ниже.
Антитело-зависимая клеточная цитотоксичность (ADCC).
Эффекторные функции клетки, осуществляемые Fc-областями различных антител строго зависят от класса антител. Существуют клетки, которые содержат Fc-рецепторы, специфичные к Fc-области иммуноглобулина классов IgG, IgE или IgA. Каждая Fc-область антител классов IgG, IgE и IgA связывается со специфическим Fc-рецептором, и клетки, которые экспрессируют соответствующий Fc-рецептор, распознают и связывают антитела, связанные с мембранами клетки или т.д. В результате, например, клетки, которые имеют Fc-рецепторы, активируются, и осуществляют внутриклеточный транспорт антитела.
Например, антитело класса IgG распознается Fc-рецепторами на T-клетках, NK клетках, нейтрофилах и макрофагах. Эти клетки связываются с Fc-областью антител класса IgG, активируются под их действием и проявляют цитотоксичность в отношении клеток, с которыми эти антитела связались. Клетки, такие как T-клетки, NK клетки, нейтрофилы, макрофаги, которые приобретают цитотоксичность благодаря эффекторной функции антитела, называются эффекторными клетками. В частности, антитела класса IgG активируют эффекторные клетки посредством Fc-рецепторов этих клеток, а затем уничтожают клетки-мишени, с которыми связаны вариабельные области этих антител. Этот процесс называется антитело-зависимой клеточной цитотоксичностью (ADCC). ADCC можно разделить по типу эффекторных клеток, следующим образом:
ADMC: IgG-зависимая макрофагальная цитотоксичность, и
ADCC: IgG-зависимая NK-клеточная цитотоксичность.
Настоящее изобретение не ограничено типами эффекторых клеток, определяющими ADCC. Другими словами, в настоящем изобретении ADCC также включает ADMC, при которой эффекторными клетками являются макрофаги.
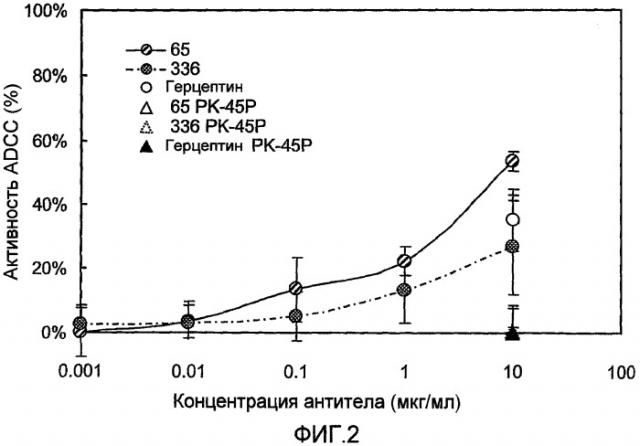
Известно, что антитело-зависимая ADCC является важным механизмом в совокупности противоопухолевых эффектов, в частности в способах лечения злокачественных заболеваний с использованием антител (Clynes RA, et al., (2000) Nature Med., 6: 443-6.). Например, сообщалось о прямой зависимости между терапевтическим эффектом химерных антител против CD20 антитела и ADCC (Cartron G, et al., (2002) Blood, 99: 754-8.). Следовательно, в контексте настоящего изобретения ADCC также является чрезвычайно важной среди других эффекторных функций антител.
ADCC является ключевой эффекторной функцией для клинической эффективности моноклональных антител, в частности в области лечения злокачественных заболеваний. Например, считается, что ADCC является важным механизмом противоопухолевых эффектов ритуксана, герцептина и тому подобное, клиническое применение которых уже началось. Ритуксан и герцептин являются известными терапевтическими средствами для лечения неходжкинской лимфомы и метастазирующего рака груди соответственно.
В настоящее время механизм ADCC-опосредованной цитотоксичности в общих чертах можно объяснить следующим образом: эффекторные клетки, которые связываются с клетками-мишенями посредством антител, расположенных на клеточной поверхности, по-видимому индуцируют апоптоз клетки-мишени путем передачи нескольких коротких сигналов смерти клеткам-мишеням. Более конкретно, ADCC опосредуется в первую очередь через ряд близкородственных Fcγ-рецепторов как с активирующими, так и ингибирующими функциями. В любом случае антитела, которые индуцируют цитотоксичность эффекторными клетками, в контексте настоящего изобретения относятся к антителам, которые обладают эффекторной функцией.
Для оценки активности ADCC молекулы, представляющей интерес, можно провести in vitro анализ ADCC, например, описанный в патенте США № 5500362 или 5821337.
Альтернативно или дополнительно, активность ADCC молекулы, представляющей интерес, можно оценить in vivo, например, на животной модели, например, описанной в статье Clynes et al., (1998) Proc Natl Acad Sci USA.; 95:652-56.
Комплемент-зависимая цитотоксичность (CDC).
Известно, что Fc-области иммуноглобулинов, связанные с антигенами, активируют пути комплемента. Также было обнаружено, что путь активации может отличаться в зависимости от класса иммуноглобулина. Например, антитела IgM и IgG человека активируют классический путь. С другой стороны, IgA, IgD и IgE не активируют этот путь, а именно функция активации комплемента ограничена антителами класса IgM и IgG. В частности, функция лизиса клеток, с которыми связаны вариабельные области антитела, называется комплемент-зависимой цитотоксичностью (CDC).
Активированный комплемент формирует, с помощью множества реакций, C5b-9 мембраноатакующий комплекс (MAC), обладающий мембраноразрушающей активностью. Предположительно MAC, образующийся таким образом, разрушает вирусные частицы и клеточные мембраны, независимо от эффекторных клеток. MAC-опосредованная цитотоксичность основана на следующем механизме. MAC обладает сильной аффинностью связывания клеточных мембран. MAC, связанный с клеточной мембраной, открывает пору в мембране, облегчая поступление воды в клетку и выход ее из клетки. В результате клеточная мембрана дестабилизируется или изменяется осмотическое давление, и клетка разрушается. Цитотоксичность вследствие активированного комплемента распространяется только на мембрану, близкую к антителу, которое связано с антигеном. По этой причине MAC-опосредованная цитотоксичность зависит от специфичности антитела. ADCC и CDC могут проявлять цитотоксичность независимо друг от друга. Однако, на практике, эти типы цитотоксичности могут действовать сообща в живых организмах.
Для оценки CDC активности молекулы, представляющей интерес, можно прове