Днк-аптамеры, ингибирующие тромбин, и способ стабилизации их структуры
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины. Предложен способ стабилизации структуры ДНК-аптамеров, связывающих тромбин, а также стабилизированные таким способом ДНК-аптамеры. Представленный способ предусматривает формирование дополнительной системы стэкинг - взаимодействий с помощью гетероциклов или их аналогов посредством увеличения поверхности ароматической системы гетероциклов или их аналогов, вследствие применения методов определения третичной структуры или молекулярного моделирования с подтверждением факта образования контакта ароматической системы гетероциклических оснований или их аналогов с квартетом G - квадруплекса, который прилежит к латеральной петле. Представленный способ позволяет повысить эффективность сборки антитромбиновых ДНК-аптамеров и повысить стабильность их структуры при физиологических условиях. 7 н.п. ф-лы, 7 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии и медицины, а конкретно - к способу стабилизации антитромбиновых ДНК-аптамеров и получению новых стабильных антитромбиновых ДНК-аптамеров, обладающих антикоагулянтными свойствами и антитромботической активностью, которые могут служить основой для разработки лекарственных антикоагулянтных и антитромботических препаратов.
Уровень техники
Тромбин это фермент класса гидролаз, важнейший компонент системы свертывания крови человека и животных. В крови присутствует в виде неактивного предшественника протромбина и активируется протромбиназой (активным тромбопластином). По химической природе тромбин - гликопротеид с молекулярной массой около 40000; содержит около 5% углеводов. Тромбин относится к классу сериновых протеиназ (трипсин и др.). Молекула тромбина состоит из двух полипептидных цепей, соединенных дисульфидной связью: А-цепи и Б-цепи, которая имеет активный центр фермента и углеводный компонент. Тромбин существует в нескольких активных формах, которые различаются строением Б-цепи. Основная функция тромбина - превращение фибриногена в фибрин. Тромбин гидролизует четыре аргинил-глициновые связи в молекуле фибриногена; при этом отщепляются четыре пептида и образуется фибрин-мономер, который далее агрегирует в сгусток фибрина, являющийся основой тромба. Реакциями ограниченного протеолиза с участием тромбина сопровождается также активация фактора XIII (фибрин-стабилизирующий фактор) и факторов V и VIII, принимающих участие в реакциях внутреннего механизма свертывания крови. При участии тромбина происходит агрегация тромбоцитов, а также сжатие (ретракция) кровяного сгустка. Показано, что относительный избыток тромбина в организме рефлекторно активирует т.н. противосвертывающую систему, при этом в кровоток поступают гепарин и активатор плазминогена, которые участвуют в поддержании жидкого состояния крови.
Тромбин инактивируется диизопропилфторфосфатом, блокирующим гидроксильную группу серина, входящего в активный центр, и другими ингибиторами, характерными для группы сериновых протеиназ. В крови тромбин инактивируется антитромбинами плазмы: а2-макроглобулином, антитромбином III и (или) гепарином. Специфический неплазменный ингибитор тромбина - полипептид гирудин, содержащийся в слюнных железах медицинской пиявки.
В последние годы был разработан новый тип ингибиторов тромбина - ДНК-аптамеры.
Аптамерами называют небольшие молекулы нуклеиновых кислот, которые могут выполнять функции высокоспецифичных рецепторов любых мишеней - от целых клеток до низкомолекулярных органических соединений. Олигонуклеотидные аптамеры с требуемыми свойствами выделяют из библиотек случайных последовательностей методами селекции in vitro (SELEX), используя их способность специфически взаимодействовать с соответствующими иммобилизованными мишенями/лигандами.
Так, одним из первых ДНК-аптамеров, ингибирующих тромбин, был найден Schultze Р et al. "Three-dimensional solution structure of the thrombin-binding DNA aptamer d(GGTTGGTGTGGTTGG)", J. Mol. Biol. 1994 Feb 4; 235(5): 1532-47. ДНК-олигонуклеотид dGGTTGGTGTGGTTGG, тромбинсвязывающий аптамер, специфически связывается с тромбином и подавляет активность фермента в цепи реакций, приводящих к свертыванию крови. Пространственная структура этого тромбинсвязывающего аптамера может стать основой для разработки улучшенных ингибиторов тромбина с аналогичными структурными мотивами.
В публикации Nagatoishi (Nagatoishi S. et al., "Circular dichroism spectra demonstrate formation of the thrombin-binding DNA aptamer G-quadruplex under stabilizing-cation-deficient conditions", Biochem Biophys Res Commun. 2007 Jan 19;352(3):812-7. Epub 2006 Nov 27) описан антитромбиновый аптамер, имеющий G-квадруплексную структуру.
Gatto В. (Gatto В. et al., "Nucleic acid aptamers based on the G-quadruplex structure: therapeutic and diagnostic potential", Curr Med Chem. 2009;16(10): 1248-65) описывает G-квадруплексный антитромбиновый аптамер, а также проводит обзор современных знаний об аптамерах на основе G-квадруплексных структур, а также оценку их диагностического и лечебного потенциала (как биотехнологических препаратов) для обнаружения и лечения тяжелых патологий, в том числе сосудистых, раковых и вирусных заболеваний.
Кроме того, для тромбина получены аптамерные ДНК, биомедицинские свойства которых описаны, например, в ряде публикаций:
1. IE 920561 A1 (GILEAD SCIENCES) от 26.08.1992 года, в котором описан аптамерный олигонуклеотид, который специфически связывается с тромбином, и имеющий последовательность нуклеотидов GGXTGG, где X - это Т, A, U, dU или G, в частности содержит нуклеотидную последовательность GGTTGGTGTGGTTGG.
2. US 2005176940 A1 (UNISEARH LTD) от 11.09.2005 года, в котором описан аптамерный олигонуклеотид, который специфически связывается с тромбином, и имеющий последовательность нуклеотидов GGTMGGXGGTTGG, где М - это А или Т, а X представляет собой последовательность от 2 до 5 любых нуклеотидов или их модификаций.
3. Griffin L.C. et al., "In vivo anticoagulant properties of a novel nucleotide-based thrombin inhibitor and demonstration of regional anticoagulation in extracorporeal circuits", Blood. 1993 Jun 15; 81(12):3271-6, описывает аптамерный олигонуклеотид, имеющий последовательность GGTTGGTGTGGTTGG.
Однако общим недостатком, присущим ДНК-аптамерам, связываюпщмся с тромбином, является их низкая стабильность in vivo.
Аптамерная ДНК dGGTTGGTGTGGTTGG (15TGT), специфически связывающая тромбин, впервые была получена методом SELEX (Bock L.C., Griffin L.C., Latham J.A., Vermaas E.H., Toole J.J.Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 1992 Feb 6; 355(6360):564-6). 15TGT - 15-звенный тромбин - связывающий ДНК-аптамер был способен ингибировать тромбин. В отличие от широко применяемых в настоящее время ингибиторов тромбина, таких как гепарин, 15TGT обладает низкой иммуногенностью и малым временем жизни в организме, он является перспективным объектом для получения лекарственных препаратов. 15TGT имеет внутримолекулярную т.н. G-квадруплексную структуру, образуемую двумя находящимися в стэкинге G-квартетами, соединенными одной TGT-петлей и двумя ТТ-петлями.
Стэкинг-взаимодействия (по природе являются ван-дер-Ваальсовыми пи-электронными гидрофобными взаимодействиями) приводят к тому, что плоские ароматические системы гетероциклических оснований самоупорядочиваются в структуры типа стопки с межплоскостным расстоянием 3,4-3,8 ангстрема. При этом происходит полное или частичное перекрывание плоскостей оснований.
G-квартеты, составляющие 15TGT, состоят из четырех гуанинов, объединенных нековалентно с помощью хугстиновских водородных связей. Объединение двух G-квартетов называется G-квадруплексом. G-квадруплексы могут образовываться из двух или четырех молекул ДНК, давая межмолекулярные комплексы. G-квадруплексы имеют характеристический спектр кругового дихроизма.
Антитромбиновый аптамер 15TGT является минимальным мономолекулярным квадруплексом. В растворе 15TGT теряет структуру квадруплекса уже при 250С, что гораздо ниже физиологических температур.
Известно, что ионы калия стабилизируют структуру G-квадруплекса; полная сборка структуры реализуется при высоких концентрациях ионов калия, в то время как физиологическая концентрация низка и, как правило, составляет всего 5 миллимолей/литр (5 мМ).
Таким образом, технической задачей настоящего изобретения является разработка новых способов стабилизации структуры антитромбиновых ДНК-аптамеров за счет самой структуры, а также способов дизайна стабильных структур аптамеров и их получения.
Техническая задача решается путем поиска структурных факторов стабилизации G-квадруплексов антитромбиновых ДНК-аптамеров методами молекулярного моделирования и их реализации в конкретных пространственных структурах. На основе выявленных факторов проводится рациональный дизайн модифицированных аптамеров, способных эффективно связываться с тромбином. Проводится прямой химический синтез модифицированных стабильных структур, сравнивается их эффективность ингибирования тромбина по сравнению с известными аптамерами.
Технический результат заявляемой группы изобретений состоит в повышении эффективности сборки антитромбиновых ДНК-аптамеров и повышении стабильности их структуры при физиологических условиях. Факторы, определяющие положительные эффекты для стабилизации антитромбиновых ДНК-аптамеров могут быть использованы для других G-квадруплексных структур, в том числе для аптамеров к другим мишеням и для теломерных структур.
Патент описывает разработку и построение динамических моделей пространственных структур ДНК-аптамеров со следующей первичной структурой:
- Одномодульный усиленный ДНК - аптамер (DTI-G84) NxGGGTTGGGTGTGGGNTGGGNy.
- Одномодульный усиленный ДНК - аптамер (DTI-A6) NxGTAGGTTGGTGNGGNTGGGGCNy.
- Двухмодульный ДНК - аптамер с модификацией петли (DTI-P91) NxGTAGGTTGGTGGGGNTGGRRCNx.
- Двухквадруплексный ДНК - аптамер (DTI-33) GGTTGGTGTGGNTGG-Tx-GGTTGGTGTGGNTGG.
- Четырехмодульный ДЕК - аптамер (DTT-r91) TNxGTAGGTTGGTGGGGNTGGRRCNxAGNyGTAGGTTGGTGGGGNTGGRRCNyC.
- Четырехмодульный ДНК - аптамер (DTI-Fx7) NxCTAGGTTGGATGGGNTGGTGNzGTAGGTTGGATGGGNTGGTCNy.
где N обозначает любой нуклеотид, выбранный из А, С, Т, G; нижние индексы x, y,z обозначают любое число нуклеотидов, не равных между собой; Тx обозначает «x» последовательных остатков; Т, R обозначает нуклеотид с пуриновым основанием.
Соответствующие олигодезоксирибонуклеотиды были синтезированы стандартным твердофазным синтезом. Для всех аптамеров определено связывание и ингибирование тромбина.
Краткое описание чертежей
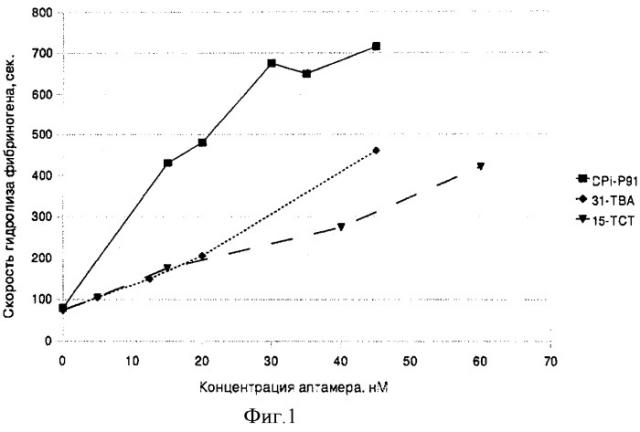
Фиг.1. Зависимость тромбинового времени от концентрации аптамера в плазме человека. 31TGT - аптамер сравнения, описанный в литературе (А novel method of screening thrombin-inhibiting DNA aptamers using an evolution-mimicking algorithm. Ikebukuro K., Okumura Y., Sumikura K., Karube I Nucleic Acids Res. 2005 Jul 7; 33(12):e108.), 15TCT - производное стандартного аптамера 15TGT, дестабилизированного согласно патентуемым принципам. DPI-P91 - аптамер, стабилизированный согласно патентуемым принципам.
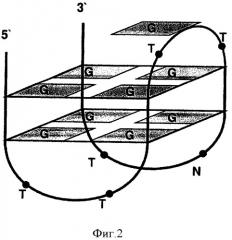
Фиг.2. Схематическое изображение пространственной структуры описанного в литературе минимального G-квадруплекса, взаимодействующего с тромбином. Гетероциклические основания G1, G6, G10, G15 образуют верхний квартет квадруплекса. Гетероциклическое основание G8 находится в стэкинге с верхним квартетом.
Фиг.3. Компьютерная модель пространственной структуры аптамера DPI-Р91, стабилизированной согласно патентуемым принципам. Основания G7 и G8 предлагаемой структуры и новые G и А, выделено черным, создают большую поверхность стэкинг-взаимодействия с верхним квартетом.
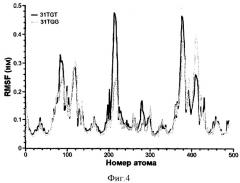
Фиг.4. Подвижность атомов (флуктуации) в пространственной структуре аптамеров по данным компьютерной молекулярной динамики двух антитромбиновых аптамеров. Серым цветом показаны данные для патентуемого аптамера, стабилизированного согласно патентуемым принципам. Черным цветом показаны данные для аптамера сравнения найденного Ikebukuro и коллегами.
Фиг.5. Схематическое изображение пространственной структуры предлагаемых вариантов G-квадруплексов, которые взаимодействуют с тромбином, и которые стабилизированы согласно патентуемым принципам. А) схематическое изображение аптамера DTI-A6. Б) схематическое изображение аптамера DTI-G8. В) схематическое изображение аптамера DTI-33. Г) схематическое изображение аптамера DTI-P91. Д) схематическое изображение аптамера DTI-r9L Е) схематическое изображение аптамера DTI-Fx7.
Сущность изобретения
По предварительным данным рентгеноструктурного анализа комплекса аптамера с тромбином со стороны аптамера в комплексе участвуют латеральные петли ТТ, конформация которых определяется структурой G-квадруплекса. В связи с этим любое воздействие или модификация, которое приводит в стабилизации структуры квадруплекса, влияет на взаимодействие петель с тромбином. Заявитель установил, что увеличение стэкинг-взаимодействия с верхним квартетом, вызывает улучшение тромбин-связывающих свойств аптамера за счет стабилизации квадруплекса. Стабилизация квадруплекса может происходить по двум причинам. Во-первых, за счет увеличения стэкинг-взаимодействий как таковых, включая эффект экранирования от воды гетероциклических оснований верхнего квартета. Во-вторых, эти стэкинг-взаимодействия ограничивают подвижность иона, фиксируя и стабилизируя его в центре квадруплекса.
Сначала рассмотрим подробнее вторую причину. Кроме описанных стэкинг-взаимодействий стерические препятствия для миграции иона могут определяться химическими группами достаточного размера, соотносимого с размером квартета в 10 ангстрем. Такие блокирующие группы могут быть ковалентно или нековалентно связаны с верхней петлей (T7-G8-T9 в случае 15TGT), замыкающей верхний квартет (G1-G6-G10-G15). Альтернативным или дополнительным расположением блокирующей группы может быть ковалентное или нековалентное соединение с 5'- или 3'- концами олигонуклеотида. Таким образом, суть действия блокирующей группы сводится к стерическому запрету миграции катиона через плоскость верхнего квартета в среду.
Если вернуться к первой причине стабилизации квадруплекса, то она определяется эффективностью стэкинг-взаимодействий с верхним квартетом. Кроме блокирования катиона внутри квадруплекса можно стабилизировать структуру увеличением эффективности стэкинг-взаимодействий с верхним квартетом. Это может быть сделано как добавлением нуклеотидов или других химических групп, способных к стэкинг-взаимодействиям, с 5'- или 3'-конца, так и просто химической модификацией концевых нуклеотидов. Все это приводит к формированию гидрофобного ядра молекулы аптамера и запрета доступа молекул воды как конкурентов водородных связей нуклеотидов верхнего квартета. Изоляция водородных связей квартетов от доступа воды может увеличить эффективную энергию сборки до 20 ккал/моль.
Подробное описание предпочтительных вариантов осуществления
В следующих примерах излагаются предпочтительные материалы и способы по настоящему изобретению.
Пример 1
Компьютерное моделирование молекулярной динамики (МД) позволяет детально изучить факторы, влияющие на стабильность структуры или флуктуации атомов в структуре биополимеров.
На сегодняшний момент известно два варианта статических структур аптамера 15ТВА - данные ядерного магнитного резонанса (ЯМР) и рентгеноструктурного анализа (РСА). В результате симуляции МД ЯМР-модель 15ТВА не претерпела существенных изменений. Напротив, РСА-модель 15ТВА изменила свою начальную конформацию - пространственная структура G-квадруплекса приобрела шатровую геометрию, несвойственную G-квартетным структурам.
Несмотря на то, что петли G-квадруплексных структур очень сложно моделировать МД с помощью современных компьютерных силовых полей, в ЯМР-модели центральная петля TGT и боковые петли ТТ конечной динамической структуры очень мало отличаются от структуры, полученной по данным ЯМР-спектроскопии. Этот позитивный результат позволяет перейти к построению динамически стабильных моделей различных вариантов структуры 15TGT методами МД.
Вариант антитромбинового аптамера, полученный Ikebukuro К et al., ингибировал тромбин лучше, чем 15TGT, при этом его структура имела дополнительные нуклеотиды с обоих концов молекулы. Методами компьютерного моделирования была построена модель пространственной структуры 31-звенного аптамера TGT: концы молекулы замыкаются в двутяжевую структуру и соединяются с квадруплексным модулем внутренними петлями по два нуклеотида каждая (петля 2×2). Для полученной статической модели проведена симуляция МД. Внутренние петли 2×2 могут образовать дополнительное взаимодействие с петлей TGT с участием трех нуклеотидов, которые располагаются над верхним квартетом. Характерно, что нуклеотид Т9 верхней петли не участвует в формировании такой характерной структуры стэкинг-взаимодействий. Согласно патентуемому принципу стабилизации структуры за счет формирования сильных стэкинг-взаимодействий этот нуклеотид Т был заменен на нуклеотид G. Остаток гуанина образует более стабильные стэкинг-взаимодействия и имеет больше возможности для образования водородных связей. Полученная модель нового варианта аптамера была подвергнута симуляции МД. Время наблюдения (длинна траектории) составила 1 микросекунду или 50 миллионов итераций. В наблюдаемом периоде времени модель пространственной структуры нового варианта аптамера проявила повышенную стабильность в МД. Флуктуации остатков гуанина, принадлежащих квадруплексу, были заметно ниже (Фиг.4). Появление второго гуанина в центральной петле позволило создать дополнительные взаимодействия (Фиг.3). Все взаимодействия были стабильны и не менялись с момента достижения молекулой равновесия и до конца траектории. Участок петли формирует структуру в которой все элементы вовлечены во взаимодействия. G-квартеты стабильны и находятся в параллельных плоскостях. Дуплексный участок также проявляет повышенную стабильность.
Определена эффективность ингибирующего действия на тромбин нового варианта аптамера, в основу структуры которого был положен патентуемый принцип. Для этого проведен химический синтез варианта аптамера и определена его ингибирующая способность в реакции гидролиза фибриногена тромбином.
Модифицированному аптамеру с последовательностью NxGTAGGTTGGTGGGGNTGGRRCNx был присвоен индекс D11-P91.
Аналогичным образом, путем компьютерного моделирования методом МД были получены аптамеры DTI-G84, DTI-33, DTI-r91, DTI-A6 и DTI-Fx7, нуклеотидные последовательности которых раскрыты ранее.
Пример 2
Синтез ДНК-аптамеров по изобретению осуществляли по стандартной методике на твердофазном носителе (Oligonucleotide Synthesis, M.J.Gait ed, 1984; Sambrook, Fntsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989).
Синтез проведен твердофазным методом на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных нуклеотидов. В качестве полимерного носителя использованы стеклянные шарики CPG (control pore glass) с размером пор 500 и 1000 Å. Первый нуклеозид З'-гидроксильной группой был присоединен к карбоксильной группе модифицированного полимерного носителя. Каждый цикл синтеза состоял из четырех этапов:
- детритирование для удаления диметокситритильной группы обработкой трихлоруксусной кислотой и освобождения 5'-ОН группы;
присоединение нуклеотида в виде β-цианэтил-N,N-бис-диизопропиламидофосфита нуклеозида;
- β-цианэтильная группа удаляется после завершения синтеза обработкой аммиаком. Активируюпщм реагентом при конденсации является тетразол.
- кэширование. Присоединение амидофосфита на стадии конденсации не происходит количественно, поэтому около 2% 5'-ОН групп не вступают в реакцию. На последующих этапах синтеза к ним могут присоединяться нуклеотиды, что, в конечном счете, приводит к пропускам в последовательности нуклеотидов. В связи с этим необходимо проводить защиту свободных 5'-ОН групп, т.е. кэпирование, реакцией уксусного ангидрида в присутствии N-метилимидазола.
- окисление фосфитного эфира до фосфатного йодом в пиридине.
Пример 3
Для подтверждения ингибировании тромбина аптамерами по изобретению и исследованию их антикоагулянтной активности было исследовано ингибирование тромбина в секундах при температуре 270С в системе, описанной в таблице.
| Плазма человеческая | 2 мкл |
| Тромбин человеческий | 13 IU |
| NaCl | 70 mМ |
| КСl | 2.5 mМ |
| MgC12 | 0.5 mМ |
| СаС12 | 0.5 mМ |
| Tris-Ac | 10 mМ |
| рН | 7.4 |
| Аптамер | разные концентрации |
Методом спектрофотометрического исследования коагуляции человеческой плазмы в присутствии разных концентраций аптамера от 0 до 60 нМ, получены значения ингибирования тромбина в секундах (см. Фиг.1).
В связи с тем, что компьютерное моделирование представляет реалистичные варианты измененных структур, но не оценивает эффективность самосборки полимера в растворе, авторы исследовали эффективность заявленных последовательностей в качестве антикоагулянтных агентов.
Первый параметр: Протромбиновое время
Протромбиновое время - время образования сгустка фибрина в плазме при добавлении к ней хлорида кальция и тканевого стандартизированного тромбопластина. Протромбиновое время характеризует активность так называемого протромбинового комплекса (факторов V, VII, X и собственно протромбина - фактора II). Результат исследования выражают в секундах (протромбиновое время). Протромбиновый тест - скрининговый тест, имитирующий внешний путь свертывания крови, т.о. данный тест характеризует первую (протромбинообразование) и вторую (тромбинообразование) фазы плазменного гемостаза и отражает активность протромбинового комплекса. Тест используется для оценки дефицита факторов протромбинового комплекса и внешнего пути свертывания. Результаты теста, при нормальном содержании и качестве фибриногена, зависят от содержания факторов VII, V, X, II и их активности. Образование основных факторов протромбинового комплекса происходит в печени, поэтому этот тест часто используют для оценки ее активности при биосинтезе белка.
Более стандартизованным тестом является международное нормализационное отношение (MHO). В большинстве случаев при лечении притивосвертывающими препаратами (антикоагулянтами) непрямого действия достаточно добиться увеличения MHO в пределах от 2 до 3, что соответствует увеличению протромбинового времени в 1,3-1,5 раза по сравнению с исходным значением. На Фиг.6 показана зависимость протромбинового времени от концентрации разных аптамерных ДНК в плазме человеческой крови.
Второй параметр: Тромбиновое время
Тромбиновый тест показывает время, необходимое для образования сгустка фибрина в плазме при добавлении к ней тромбина. Этот тест характеризует кинетику конечного этапа свертывания крови - скорость превращения фибриногена в фибрин. Тромбиновое время зависит только от концентрации фибриногена и активности ингибиторов тромбина (антитромбина III, гепарина, парапротеинов). Используется для оценки третьей фазы свертывания крови - образование фибрина, и состояния естественных и патологических антикоагулянтов. Определение тромбинового времени является одним из наиболее распространенных методов контроля за гепаринотерапией и лечением фибринолитиками, а также используется для диагностики гиперфибринолитических состояний, афибриногенемии и дисфибриногенемии. Полная несвертываемость наблюдается сразу же после внутривенного введения большой дозы гепарина и в терминальной фазе острого ДВС - синдрома. На Фиг.7 показана зависимость тромбинового времени от концентрации разных аптамерных ДНК в плазме человеческой крови.
Обсуждение результатов
Установлено, что при низких концентрациях новый вариант аптамера DTI-Р91 является более эффективным ингибитором тромбина в реакции гидролиза фибриногена, чем исходный аптамер 31TGT (Фиг.1).
Вывод
Для обоснования важности вклада стэкинг-взаимодействия гетероциклических оснований петли TGT с верхним G-квартетом в общую структуру антитромбинового аптамерного G-квадруплекса проведено сравнение свойств аптамеров, содержащих замену остатка G на С петле TGT. Полученные данные ярко демонстрируют важность стэкинг-взаимодействия. Прямая замена центрального пурина G в петле TGT на меньший гетероцикл, пиримидин С, по определению резко снижает степень стэкинг-взаимодействия, что приводит к существенному уменьшению степени ингибирования. И наоборот, замена соседнего с центральным пиримидина Т петли TGT на больший пурин G приводит к возрастанию ингибирующей активности аптамера - возрастанию тромбинового времени. Подобный эффект влияния стэкинг-взаимодействия может модулироваться и производными гетероциклических оснований, а также аналогичными ароматическими системами.
Важность описываемых стэкинг-взаимодействий с верхним G-квартетом для стабилизации общей структуры G-квадруплекса косвенно подтверждается еще одним фактом. Как уже отмечалось ранее, традиционным фактором стабилизации квадруплекса является ион К+, который координируется атомами кислорода в центре квадруплекса и, тем самым стабилизирует общую структуру. Координация иона носит динамический характер, т.е. ион подвижен и может обмениваться с внешней средой. Наличие дополнительных стэкинг-взаимодействий блокируют выход иона из квадруплекса в раствор через верхний квартет. Поведение иона бария, Ва2+, отличается от поведения иона К+ тем, что его собственная координация более эффективна и он стабилен в структуре квадруплекса. При этом дополнительные стэкинг-взаимодействия, расположенные сверху квартета, не оказывают существенного влияния на стабилизацию общей структуры.
1. Способ стабилизации структуры ДНК-аптамера, основная субструктура которого состоит из квадруплекса и двух латеральных петель ТТ, и который способен специфически связывать тромбин, предусматривающий: формирование дополнительной системы стэкинг - взаимодействий с помощью гетероциклов или их аналогов посредством увеличения поверхности ароматической системы гетероциклов или их аналогов, вследствие применения методов определения третичной структуры или молекулярного моделирования с подтверждением факта образования контакта ароматической системы гетероциклических оснований или их аналогов с квартетом G - квадруплекса, который прилежит к латеральной петле.
2. Аптамерный олигонуклеотид DTI - G84, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxGGGTTGGGTGTGGGNTGGGNY,где N - любой нуклеотид из ряда G, А, Т, С, а x и у - любое количество нуклеотидов, которое не равно между собой, и который специфически и высокоаффинно связывается с тромбином.
3. Аптамерный олигонуклеотид DTI - Р91, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxGTAGGTTGGTGGGGNTGGRRCNx,где N - любой нуклеотид из ряда G, А, Т, С, x - любое количество нуклеотидов, a R - обозначает нуклеотид с пуриновым основанием, и который специфически и высокоаффинно связывается с тромбином.
4. Аптамерный олигонуклеотид DTI - А6, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxGTAGGTTGGTGNGGNTGGGGCNYx,где N - любой нуклеотид из ряда G, А, Т, С, а x и у - любое количество нуклеотидов, которое не равно между собой, и который специфически и высокоаффинно связывается с тромбином.
5. Аптамерный олигонуклеотид DTI - r91, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:TNxGTAGGTTGGTGGGGNTGGRRCNxAGNyGTAGGTTGGTGGGGNTGGRRCNyC,где N - любой нуклеотид из ряда G, А, Т, С, x и у - любое количество нуклеотидов, которое не равно между собой, a R - обозначает нуклеотид с пуриновым основанием, и который специфически и высокоаффинно связывается с тромбином.
6. Аптамерный олигонуклеотид DTI - Fx7, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:NxCTAGGTTGGATGGGNTGGTGNzGTAGGTTGGATGGGNTGGTCNy,где N - любой нуклеотид из ряда G, А, Т, С, а x, у и z - любое количество нуклеотидов, которое не равно между собой, и который специфически и высокоаффинно связывается с тромбином.
7. Аптамерный олигонуклеотид DTI - 33, обладающий антитромботической активностью, который содержит стабилизированную субструктуру, полученную способом по п.1, представляющий собой олигодезоксирибонуклеотид, содержащий нуклеотидную последовательность общей формулы:GGTTGGTGTGGNTGG-Tx-GGTTGGTGTGGNTGG,где N - любой нуклеотид из ряда G, А, Т, С, а x - любое количество нуклеотидов, и который специфически и высокоаффинно связывается с тромбином.