Способ иммунофлуоресцентного анализа эстрогеновых рецепторов в солидных опухолях человека
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для анализа эстрогеновых рецепторов β (ЭРβ) в солидных опухолях. Для этого готовят одноклеточные суспензии из опухолевой ткани и культуры сравнения, в качестве которой используют монослойную культуру рака молочной железы человека линии MCF-7. Фиксируют клетки в 4% растворе формальдегида, инкубируют с Tween 20, отмывают с помощью фосфатного буфера pH 7,4. Затем инкубируют их с первичными и вторичными антителами, дважды отмывают с помощью фосфатного буфера pH 7,4 и проводят измерение флуоресценции на проточном цитофлуориметре. Анализ данных проводят путем расчета значения D статистического теста Колмогорова-Смирнова. За процент специфически окрашенных клеток принимают значение D, умноженное на 100. Изобретение позволяет дифференциально и строго количественно оценить экспрессию ЭРβ в опухолевой ткани. 2 ил.
Реферат
Изобретение относится к области медицины, а именно к способам диагностики эстрогенового статуса, и позволяет количественно определять эстрогеновые рецепторы β в солидных опухолях.
Эстрогены являются одними из ключевых регуляторов роста и дифференцировки клеток, инициируя повышение чувствительности клеток к пролиферативным сигналам. По этой причине эстрогены могут индуцировать гиперпластические процессы. Так, эстрогеновая регуляция опухолевого роста впервые была обнаружена при раке молочной железы, что позволило использовать для лечения этого заболевания терапевтические стратегии, основанные на представлениях о клеточном действии эстрогенов. Одной из таких стратегий является препятствие образованию комплекса эстрогенов с их внутриклеточными рецепторами (ЭР), благодаря которому реализуется биологическое действие эстрогенов. В связи с этим в клинической практике противоопухолевой терапии широко используются как селективные модуляторы эстрогеновых рецепторов (тамоксифен, ралоксифен), способствующие образованию функционально неактивного гормон-рецепторного комплекса, так и селективные супрессоры эстрогеновых рецепторов (фульвестрант), действие которых направлено на подавление активности и деградации эстрогеновых рецепторов.
Назначение антиэстрогеновой терапии требует корректного определения эстрогенового статуса опухоли. Клиническое определение эстрогенового статуса проводится путем регистрации только ЭРα, хотя известно, что в клетках человека присутствует еще и вторая изоформа эстрогеновых рецепторов - ЭРβ. В настоящее время не представляется возможным считать, что ЭРβ является мишенью для антиэстрогеновой терапии. Однако этот белок способен образовывать гетеродимерные комплексы с ЭРα, блокируя действие эстрогена. Кроме того, существуют данные о том, что экспрессия ЭР типа β в некоторых опухолях является благоприятным прогностическим фактором течения заболевания [Wu С.Т., Chang Y.L., Shih J.Y., Lee Y.C. The significance of estrogen receptor beta in 301 surgically treated non-small cell lung cancers. J. Thorac Cardiovasc Surg 2005; 130: 4: 979-986; Kawai H., Ishii A., Washiya K. et al. Estrogen receptors alpha and beta are prognostic factors in non-small cell lung cancer. Clin Cancer Res 2005; 11: 14:5084-5089]. Но уровень презентации обоих ЭР и их соотношение в опухолях подвержено значительной индивидуальной вариабельности. Все это свидетельствует о необходимости клинического определения ЭР обоих типов.
Экспрессию ЭРα, на основании которой прогнозируют чувствительность опухоли к антиэстрогеновой гормонотерапии, определяют с помощью биохимического и иммуногистохимического способов. С помощью этих способов получают информацию о количестве анализируемого белка в исследуемой опухолевой ткани. Способ биохимического анализа экспрессии ЭРα сводится к замораживанию и гомогенизации опухолевой ткани, отделению белковой фракции и определению содержания ЭР в ней с помощью угля, покрытого декстраном, или в градиенте сахарозы [Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Ann. Biochem., 1976, 72: 248-254]. Данный способ является точным и надежным, однако имеет ряд существенных недостатков, а именно невозможность определять тип клеток, экспрессирующих анализируемый белок, и локализацию белка в клетке [Budwit-Novotny D., McCarty K., Сох Е., Soper J., Mutch D., Creasman W., Flowers J., McCarty K. Immunohistochemical Analyses of Estrogen Receptor in Endometrial Adenocarcinoma Using a Monoclonal Antibody. Cancer Research, 1986, 46: 5419-5425].
Прототипом заявляемого способа является способ иммуногистохимического определения ЭР. Способ иммуногистохимического анализа, идентифицирующий в клетке белок, позволяет дифференцировать экспрессию ЭР именно в опухолевых клетках, а также характеризовать его внутриклеточное распределение. Он требует меньшего количества опухолевой ткани для проведения анализа, экономичен и удобен [Parker R., Huntsman D., Lesack D., Cupples J., Grant D., Akbari M., Gilks C. Assessment of Interlaboratory Variation in the Immunohistochemical Determination of Estrogen Receptor Status Using a Breast Cancer Tissue Microarray. Am J Clin Pathol 2002, 117: 723-728]. Присутствие ЭР в опухоли оценивается визуально по положительной реакции окрашенных срезов ткани, то есть рассматриваемый способ оценки экспрессии ЭР является качественным, то есть субъективным.
Способ иммуногистохимического определения ЭР заключается в следующем:
опухолевую ткань фиксируют и помещают в парафиновый блок, готовят срез ткани для окрашивания, депарафинизируют и обезвоживают ткань, проводят процесс восстановления антигена, инкубируют с Tween 20 для увеличения проницаемости клеточной мембраны, инкубируют с первичными антителами, инкубируют с вторичными антителами и дважды отмывают.
Недостатками прототипа являются:
- трудоемкость, которая ограничивает его применение в клинической практике;
- противоречивость заключений об уровне экспрессии ЭР в солидных опухолях человека, которые носят оценочный субъективный характер;
- невозможность унификации полученных результатов при проведении межлабораторного сравнения, т.к. эти результаты являются полуколичественными и не предоставляют точной информации о доле клеток, экспрессирующих анализируемый белок, а также о степени этой экспрессии в каждой клетке;
- значительные затраты времени на подготовку материала для исследования, при этом процесс фиксации, обезвоживания и депарафинизации ткани могут нарушать структуру изучаемого белкового маркера, что снижает точность и специфичность анализа.
Заявляемый способ иммунофлуоресцентного анализа ЭРβ в солидных опухолях человека позволяет решить следующие задачи, возникающие в клинической практике:
- проводить дифференциальную оценку экспрессии ЭРβ в анализируемой опухолевой ткани;
- количественно (процент клеток и в каждой клетке) определять уровень экспрессии ЭРβ в фиксированной клеточной суспензии;
- свести к минимуму «человеческий фактор» за счет использования ряда концентраций специфического антитела для данного маркера;
- сократить время проведения исследования;
- повысить точность и специфичность анализа;
- предоставить информацию о вероятности формирования метастазов с положительным статусом ЭРβ.
Для решения поставленных задач предложен способ иммунофлуоресцентного анализа ЭРβ в солидных опухолях человека путем окрашивания специфическими моноклональными антителами клеточных суспензий из операционных опухолевых образцов ткани и культуры линии MCF-7 (линия клеток рака молочной железы).
Заявляемый способ осуществляется следующим образом:
готовят одноклеточную суспензию из опухолевой ткани, полученную суспензию фиксируют в 4% растворе формальдегида, инкубируют с Tween 20 для увеличения проницаемости клеточной мембраны, отмывают фосфатным буфером pH 7,4, инкубируют с первичными антителами, инкубируют с вторичными антителами и дважды отмывают фосфатным буфером pH 7,4.
Приготовление одноклеточной суспензии культуры сравнения (рак молочной железы человека линии MCF-7)
Для получения суспензии клеток MCF-7 из культурального матраца сливают питательную среду, дважды промывают монослой раствором фосфатного буфера pH 7,4, добавляют раствор Версена до покрытия клеток тонким слоем жидкости и помещают в термостат на 30 мин при t=37°С. Раствор Версена осторожно сливают, клетки снимают со дна матраца рабером, переносят в пробирку с раствором фосфатного буфера pH 7,4 и пипетируют до получения одноклеточной суспензии. Количество клеток в полученной суспензии подсчитывают в камере Горяева и доводят до концентрации 500 тыс/мл путем разведения с дополнительным центрифугированием при 3000 об/мин в течение 10 мин или без него. Затем добавляют раствор формальдегида до 4% конечной концентрации.
Приготовление одноклеточной суспензии из операционного материала солидных опухолей различных локализаций
Для получения суспензии клеток из хирургического биопсийного материала опухолевую ткань разрезают ножницами на мелкие кусочки (объемом <1 мм3) в чашке Петри и добавляют в полученную кашицу раствор Версена. Затем инкубируют в течение 30 мин в термостате при t=37°C. После инкубации содержимое чашки Петри гомогенизируют в цилиндрическом стеклянном гомогенизаторе (пятикратное движение пестиком) и переносят в пробирку, объемом 50 мл, доводя фосфатным буфером pH 7,4 объем жидкости в ней до 40 мл. Далее проводят фильтрацию суспензии с помощью фильтров на 100 мкм и на 40 мкм. Очищенную от крупных фрагментов ткани суспензию центрифугируют 10 мин при 3000 об/сек. Надосадочную жидкость удаляют пипеткой, а осадок ресуспендируют в 3-7 мл раствора фосфатного буфера pH 7,4. Количество клеток в полученной суспензии подсчитывают в камере Горяева и доводят до концентрации 500 тыс/мл путем разведения с дополнительным центрифугированием при 3000 об/мин в течение 10 мин или без него. Затем добавляют раствор формальдегида до 4% конечной концентрации.
Окрашивание одноклеточных суспензий антителами к ЭРβ
Для определения ЭРβ используют мышиные моноклональные антитела фирмы Abcam (ab 288), клон 14С8. Данные антитела характеризуются специфичностью к N-терминальному домену белка ЭРβ человека. В исследовании используют четыре концентрации антител, выраженные в объемных единицах разведенного в соответствии с протоколом коммерческого раствора: 0,5; 1,3; 2,5 и 5 мкл на 100 мкл клеточной суспензии. В качестве изотипического контроля используют мышиные моноклональные антитела IgG2a (ab18414, Abcam), в эквивалентных специфическим антителам концентрациях. В качестве вторичных антител используют мышиные моноклональные антитела F2772 (Sigma), меченные FITC, разведенные согласно коммерческому протоколу и добавляемые в соответствии с концентрациями первичных антител.
Необходимое количество суспензии исследуемых клеток центрифугируют в течение 10 мин при 3000 об/мин, отбирают надосадочную жидкость и инкубируют в 1 мл 1% раствора Tween 20 в течение 20 мин при комнатной температуре. После окончания инкубации в пробирку добавляют 10 мл фосфатного буферного раствора pH 7,4 и центрифугируют при 3000 тыс.об/мин в течение 10 мин. Надосадочную жидкость отбирают и доводят суспензию до необходимого объема фостафтным буферным раствором pH 7,4. В пластиковые пробирки для проточного цитофлуориметра к 100 мкл суспензии исследуемых клеток добавляют соответствующие разведения специфических и изотипических антител и инкубируют при t=4°C в течение 18 часов. Затем добавляют вторичные антитела и инкубируют при t=4°C в течение 1,5 часов. После окончания инкубации для отмывания свободных антител в каждую пробирку добавляют по 2 мл фосфатного буферного раствора pH 7,4 и центрифугируют при 3000 тыс.об/мин в течение 10 мин. Надосадочную жидкость отбирают и процедуру отмывки проводят повторно. Осадок ресуспендируют в 200 мкл фосфатного буферного раствора pH 7.4.
Измерение флуоресценции проводят на проточном цитофлуориметре при λех=488 нм, λем=576 нм. Число анализируемых событий - 5 тысяч. Анализ гистограмм проводят по количеству специфически окрашенных клеток, которое оценивают статистическим методом Колмогорова-Смирнова.
Для оценки экспрессии белков ЭРβ используют значение D статистического теста Колмогорова-Смирнова, который отражает количество окрашенных клеток. Значение D рассчитывается по двум гистограммам, первая из которых является результатом измерения на проточном цитофлуориметре средней флуоресценции изотипического контроля, а вторая - аналогичного показателя после окрашивания специфическими антителами (одинаковой концентрации с изотипическими). Значение D умножают на 100 и полученное число принимают за процент специфически окрашенных клеток.
Формула для расчета процента специфически окрашенных клеток:
Процент специфически окрашенных клеток = D×100,
где D - значение статистического теста Колмогорова-Смирнова, полученное при наложении гистограммы, отражающей окраску специфическими антителами на гистограмму, отражающую окраску изотипическими антителами.
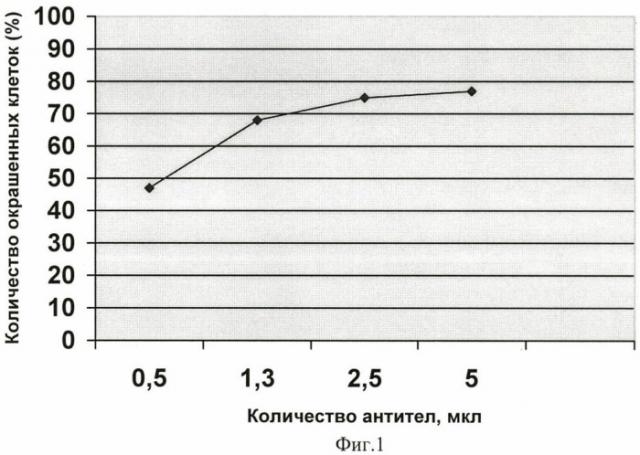
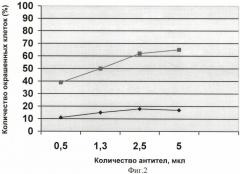
Для иллюстрации полученных данных на графике строят кривую зависимости количества специфически окрашенных клеток от количества антител к ЭРβ. График для культуры сравнения MCF-7 изображен на фиг.1. Фиг.2 демонстрирует результаты окрашивания клеток, полученных из хирургических фрагментов солидных опухолей человека различных локализаций (немелкоклеточный рак легкого и рак молочной железы). Кривая 1 (-■-) - пример высокого уровня экспрессии ЭРβ. Кривая 2 (-♦-) - пример низкого уровня экспрессии ЭРβ. На обоих графиках по оси абсцисс - количество антител в мкл. По оси ординат - количество окрашенных клеток (%), рассчитанное при помощи теста Колмогорова-Смирнова.
Технический результат изобретения заключается в том, что заявляемый способ позволяет дифференциально и строго количественно оценить в опухолевой ткани экспрессию ЭРβ, что исключает субъективную трактовку степени окрашивания. Подготовка материала по заявляемому способу исключает процедуры обезвоживания и депарафинизации ткани и возможность нарушить структуру анализируемого белка. Способ требует минимальное количество манипуляций. Использование ряда концентраций антител существенно снижает возможность ошибки определения ЭРβ. Заявляемый способ обладает высокой специфичностью и имеет доступную стоимость проведения анализа. Таким образом, высокая точность, надежность и скорость определения ЭРβ делают пригодным заявляемый способ для рутинного использования в клинической практике.
Способ иммунофлуоресцентного анализа эстрогеновых рецепторов β в солидных опухолях человека, включающий приготовление одноклеточных суспензий из опухолевой ткани и культуры сравнения, фиксацию в 4%-ном растворе формальдегида, инкубацию с Tween 20, отмывание с помощью фосфатного буфера pH 7,4, инкубацию с первичными и вторичными антителами, двойное отмывание с помощью фосфатного буфера pH 7,4, проведение анализа данных на проточном цитофлуориметре; в качестве культуры сравнения используют монослойную культуру рака молочной железы человека линии MCF-7; рассчитывают значение D статистического теста Колмогорова-Смирнова, умножают на 100 и полученное число принимают за процент специфически окрашенных клеток.