Средство, стимулирующее экспрессию матричной рнк триптофанил-трнк-синтетазы
Иллюстрации
Показать всеИзобретение относится к медицине, фармакологии и биологии и касается применения трекрезана в качестве средства, стимулирующего экспрессию матричной РНК триптофанил-тРНК-синтетазы. Изобретение позволяет расширить ассортимент лекарственных средств. 2 ил.
Реферат
Изобретение относится к фармакологии и биологии, медицине, и конкретно может быть использовано, например, для контроля ангиогенеза, при дислипопротеинозах различного происхождения.
В последние годы установлено, что воспаление воздействует на обмен липопротеидов в стенках сосудов. При этом в процесс вовлекаются как системы неспецифического (макрофаги моноцитарного происхождения), так и специфического иммунитета (Т-клетки). Моноциты и Т-клетки мигрируют из кровотока в интиму артерий, где они дифференцируются в макрофаги, а затем, поглощая модифицированные липопротеины, трансформируются в тучные клетки [1].
Макрофаги моноцитарного происхождения широко представлены на всех стадиях развития заболевания [2]. Последние данные по молекулярному механизму атерогенеза через развитие местного воспалительного процесса и экспрессии цитокинов и белковых факторов в атеросклеротических бляшках свидетельствуют, что существует определенный баланс между провоспалительными и антивоспалительными цитокинами и этот баланс критичен для развития повреждения.
В последнее время с целью регуляции цитокиновых функций внимание привлекают другие белковые и ферментные системы, действующие по механизму стимуляции и торможения атерогенеза. Это, в частности, аминоацил-тРНК-синтетазы (АРСазы). Установлено мощное про- и антиангиогенное действие пары: тирозил-тРНК-синтетаза и триптофанил-тРНК-синтетаза (ТРСазы) [3]. Причем, крайне важной представляется роль ТРСазы, не только в связи с ее антиангиогенной, следовательно, и антиатерогенной активностью (через прорастание «сосудов в сосудах») и способностью подавлять, так называемый «shia stress» повреждения в местах разветвления сосудов [4], но и в связи с участием в синтезе мощных регуляторов функций ССС - диаденозинполифосфатов [5]. С другой стороны, установлено мощное противовоспалительное, антионкогенное и антиатерогенное действие комплекса полифенолов растительного происхождения, причем их действие направлено, в том числе, и на поддержание оптимального соотношения цитокинов и белковых факторов, и сопровождается заметным увеличением синтеза АРСаз в соответствующих клетках экспериментальных животных [6].
В последние годы выявлен ряд дополнительных неканонических функций у ферментов класса аминоацил-тРНК-синтетаз (АРСаз) - ключевых для обмена веществ. В частности - тирозил-тРНК-синтетаза (ТирРСаза), будучи расщепленной, обладает цитокинной активностью и стимулирует ангиогенез, способствуя, тем самым, атерогенезу [3, 4]. Гомолог ТирРСазы - триптофанил-тРНК синтетаза (ТРСаза) в клетках существует в двух формах: 1) основной полноразмерной; 2) частично усеченной (миниТРСаза), лишенной N-концевого фрагмента в процессе альтернативного сплайсинга (или эндогенного регулируемого протеолиза) при созревании пре-мРНК [7]. Образование обеих форм фермента может быть резко ускорено у всех млекопитающих при воздействии ряда факторов, например γ-интерферона. При этом ТРСаза, особенно в виде миниТРСазы, в отличие от ТирРСазы, обладает выраженным антиангиогенным и антиатерогенным действием [3, 4]. Известна также взаимосвязь между высокомолекулярными комплексами АРСаз и белокстимулирующим действием этого важного для регуляции обмена веществ (компонента белоксинтезирующего) аппарата клетки [8].
В литературе имеются сведения об активации ТРСазы различными соединениями, как химического, так и природного происхождения [7, 9]. Это, в частности, гемин [10], форболовые эфиры [11] и эритропоэтин [12].
Можно отметить стимулирующее действие эритропоэтина или/и форболовых эфиров на экспрессию мРНК ТРСазы, имеющих частично общий механизм (протеинкиназу С). Однако эти активирующие воздействия имеют свою специфику. В первом случае - общий пролиферативный анаболический эффект, во втором - узкоспецифический эффект по стимуляции возможных защитных реакций организма на воздействия онкостимулирующего препарата - форболовых эфиров (для создания моделей животных с опухолями).
В качестве ближайшего аналога может быть указан источник: Нурбеков М.К., Фаворова О.О., Дмитренко С.Г., Болотина И.А., Киселев Л.Л. Роль ионов цинка в функционировании бычьей триптофанил-тРНК-синтетазы. // Молекулярная биология, 1981, т.15, №5, стр.1000-1010 [9].
Однако хотя возможность использования воздействия на цитокиновую активность аминоацил-тРНК-синтетаз с лечебными или диагностическими целями активно исследуется, в настоящее время практически отсутствуют готовые препараты, используемые в клинической практике, обладающие указанной активностью.
Задачей изобретения является разработка нового средства, повышающего цитокинную активность суммарной триптофанил-мРНК синтетазы (ТРСазы) через стимуляцию синтеза специфической мРНК.
Поставленная задача решается тем, что в качестве активатора синтеза мРНК ТРСазы применяют новый отечественный препарат трекрезан, что позволяет расширить область его применения.
Трекрезан обладает широким спектром терапевтического действия. В частности, известно применение трекрезана как препарата, повышающего иммунитет и адаптивные свойства организма [13, 14].
Применение трекрезана по новому назначению стало возможным благодаря выявленным нами его новым свойствам. Впервые показано, что введение трекрезана стимулирует экспрессию специфической мРНК.
Новая, ранее неизвестная фармакологическая (физиологическая) активность трекрезана - увеличение экспрессии мРНК одного из ключевых ферментов внерибосомного этапа белкового синтеза триптофанил-тРНК синтетазы (ТРСазы). ТРСаза запускает каскад последующих регуляторных цитокинных функций, реализуемых в ходе «вызревания» фермента и включения его в контроль ангиогенеза. Сложнейшие процессы в клетке, обеспечивающие регуляции целого спектра дополнительных функций ТРСазы, протекают в 2 стадии: а) посттранскрипционную и б) пострансляционную. Активированный фрагмент ТРСазы не только обладает активностью подавляющей патологические процессы аномальной агрессивной пролиферации сосудов но и, одновременно, способен стимулировать восстанавливающее физиологическое развитие сосудов, благотворно воздействующее на состояние сосудистой системы.
Свойства трекрезана повышающего цитокинную активность суммарной триптофанил-тРНК синтетазы (ТРСазы) через стимуляцию синтеза специфической мРНК в литературе не описаны.
Возможность осуществления изобретения может быть проиллюстрирована следующими ниже представленными данными.
Пример 1.
Методика. Эксперименты проводились «in vitro» для установления стимулирующего эффекта трекрезана на белковый синтез и связанных с ним ведущих систем регуляции процессов развития, дифференцировки, регенерации и поддержания как клеточного, так и тканевого гомеостаза.
Эффекты трекрезана изучали на культуре мононуклеарных клеток периферической крови (МНПК) человека.
Схема опыта включала следующие этапы:
1) получение МНПК;
2) культивирование МНПК в присутствии трекрезана в различных концентрациях;
3) экспресс-выделение через определенные промежутки времени препаратов суммарной РНК;
4) синтез на матрице РНК кДНК;
5) количественное определение специфической мРНК триптофанил-тРНК-синтетазы методом РТ-ПЦР.
1. Получение мононуклеарных клеток. Периферическую кровь из локтевой вены в объеме 10 мл берут в стерильных условиях в пробирку, содержащую гепарин, в конечной концентрации 25 ед. в 1 мл крови. Затем кровь стерильно переносят в пластиковую пробирку объемом около 50 мл. Туда же добавляют 10 мл стерильного PBS буфера. Разбавленную кровь аккуратно наслаивают на 3-5 мл градиента фиколл-уротраст в центрифужной пробирке. Соотношение объемов градиент - плазмы выдерживают в пределах 1:2-1:4.
Пробирки центрифугируют в течение 40 мин в бакет-роторе с ускорением 200 g (1500-1800 об/мин) при температуре 20°С. В процессе центрифугирования эритроциты и гранулоциты "проваливаются" в градиент и оседают на дно пробирки. На верхней границе градиента при правильном разделении образуется рыхлое кольцо беловатого цвета, состоящее из мононуклеарных клеток. Супернатант представлен плазмой. Последовательность фракций крови в градиенте: плазма - тромбоциты - мононуклеарные клетки - фиколл - эритроциты (на дне). Плазму удаляли. Остаток фиколла с эритроцитами удаляли. Осторожно собирали клетки интерфазы (слой между плазмой - вверху и собственно фиколлом и осадком - внизу) пипеткой в пробирку с небольшим объемом среды, ресуспендировали. Заполнили пробирку PBS, центрифугировали при 800 или 1000 об/мин в течение 8-10 мин. Отсасывали и удаляли надосадок, ресуспендировали осадок в среде или PBS, заполнили пробирку PBS, повторно центрифугироватли 800 (1000) об/мин в течение 8-10 мин. Удаляли надосадок, осадок ресуспендировали в среде и приступали к подсчету клеток. После подсчета готовили рабочую концентрацию МК, содержащую 2×106 клеток в 1 мл.
2. Культивирование клеток. Культивирование проводили в полной культуральной среде: RPMI-1640, 0,01 М HEPES, 10% фетальной бычьей сывороткой (Sigma) 200 мМ L-глутамина, 100 мг/мл гентамицина. Раствор трекрезана фильтровали через фильтры с диаметром пор 0,22 мкМ и вносили в культуру мононуклеаров в конечной концентрации 20 мкг/мл (оптимальную дозу определяли предварительно).
Контрольные пробы инкубировали с полной культуральной средой без трекрезана. Оптимальное время подбирали экспериментально, отбирая для анализа из отдельных лунок планшеты аликвоты клеток через 1, 2, 3, 4, 6, 12 и 24 часа. Основные этапы выделения и культивирования МНПК проводили, как описано [15, 16]. Концентрации трекрезана в культуральной среде и время инкубации подбирали в отдельной серии опытов.
3. Экспресс-выделение суммарных препаратов РНК. Для выделения суммарных препаратов РНК из аликвот культуры МНПК использовали набор фирмы «Силекс-М» «YellowSolve» и процедуру выделения осуществляли по рекомендуемому протоколу фирмы с учетом специфики экспериментов и поставленных задач. Для выделения суммарной РНК отбирали приблизительно 106 клеток из 12-луночной культуральной планшеты. Суспензию клеток (1-10 млн) гомогенизировали в 1 мл лизирующего раствора Yellow Solve до полного исчезновения комочков клеточного материала. Объем пробы не превышал 10% от объема лизирующего раствора YellowSolve (т.е. не более 0,1 мл пробы на 1 мл YellowSolve). Для удаления возможных примесей внеклеточного материала, полисахаридов и т.д. лизат центрифугировали при 10-15 тыс. об/мин, в течение 5 мин. Отбирали прозрачный супер-натант в стерильную пробирку. Добавляли к супернатанту 0,1 мл хлороформа, энергично перемешали смесь на вортексе и оставили на столе на 20 минут, встряхивая пробирку примерно каждые 5 минут. При стоянии содержимое пробирки расслаивается на две фазы. Если этого не произошло, добавляли еще 0,1 мл хлороформа и повторяли процедуру. Пробирку центрифугировали при 10-15 тыс. об/мин, в течение 5 мин. По окончании центрифугирования в пробирке образуются два слоя жидкости. Переносили верхний, содержащий РНК слой жидкости в чистую пробирку, стараясь не захватить белую белковую интерфазу, если таковая присутствует. Нижний слой жидкости, содержащий фенол, удаляли. К отобранному верхнему слою добавляли равный объем депротеинизирующего раствора GreenClean и энергично встряхивали смесь на вортексе 2-3 минуты, после чего центрифугировали, как описано выше. Отбирали верхний, содержащий РНК, слой жидкости в чистую пробирку, замеряли его объем, добавляли к нему 2 объема 96%-ного этанола, хорошо перемешали содержимое пробирки и помещали на 20-30 мин в морозильную камеру при -20°С для формирования осадка РНК. РНК осаждали центрифугированием при 10-15 тыс. об/мин в течение 10-20 мин. Спиртовой супернатант удаляли. К осадку РНК осторожно, по стенке пробирки, добавляли 0,5 мл 80%-ного этанола и центрифугировали при 10-15 тыс. об/мин в течение 15 мин. Следили, чтобы в процессе промывки осадок РНК не был смыт со дна пробирки и утерян. После удаления этанола еще раз откручивали (30 с) пробирку с осадком РНК для полного удаления остатков спирта со стенок пробирки. Растворили осадок РНК в воде (теперь - все процедуры при 4°С, т.е. во льду), концентрацию и нативность полученного препарата РНК определяли спектрофотометрически с последующим электрофорезом в 1,2-1,5%-ной агарозе, приготовленной на однократном трис-боратном буфере (ТБЕ) и содержащем 0.3 мкг/мл бромистого этидия. Хранили препарат РНК при -20°С или ниже, либо в виде спиртового осадка при -20°С.
4. Синтез на матрице РНК кДНК. Для синтеза кДНК с использованием полученных препаратов суммарной РНК применяли реактивы фирмы Силекс М и прилагающиеся протоколы. Для синтеза кДНК в пробирке, помещенной в лед, смешивали следующие компоненты:
а) РНК матрица - 2 мкл (тотальная РНК 0.1-5 мкг) (поли(А)+РНК 10-0,5 нг или специфическая РНК - 0,01 пг и меньше)
б) праймер - 1 мкл (специфический 15-20 пмолей, случайный гексапраймер 0,5 нг),
в) вода, свободная от рНаз - до 18 мкл.
1. Перемешивали, осаждали капли кратковременным центрифугированием. Смесь инкубировали 5 мин при 70°С, переносили пробирку в лед и собирали капли кратковременным центрифугированием.
2. Помещали пробирку в лед и добавляли следующие компоненты:
- ×10-кратный ОТ буфер (фирма «Силекс-М» - 2,5 мкл;
- 1,5 мМ смесь дезоксинуклеотидтрифосфатов (dNTP) - 4 мкл;
- обратная транскриптаза вируса лейкемии мышей Молони - M-MLV (Moloney Murine Leukemia Virus) - 0,5 мкл.
3. Смесь инкубировали в течение 60 мин при 37°С (при использовании случайных гексапраймеров перед инкубацией при 37°С смесь инкубировали в течение 10 мин при 25°С). Реакцию останавливали прогреванием смеси в течение 10 мин при 70°С.
4. Смесь переносили в лед. Полученную кДНК использовали либо сразу же для проведения РТ ПЦР, либо для синтеза второй цепи и последующего клонирования. Хранили полученную кДНК при -20°С, либо при -70°С.
5. Количественный анализ специфической мРНК триптофанил-mРНК-синтетазы. Количественный анализ специфической экспрессии гена ТРСазы проводили через оценку уровня специфической мРНК. При этом критерием оценки уровня мРНК служил количественный анализ суммарной кДНК, проводимый методом РТ-ПЦР. Реакцию РТ ПЦР проводили с использованием наборов реактивов фирмы «Синтол» (Комплект реагентов для проведения ПЦР-РВ в присутствии SYBR Green I Кат.номер R-402). Количественное определение уровня специфических кДНК для ТРСазы проводили на РТ-ПЦР приборе. Условия амплификации: денатурация при 95°С в течение 15 с, отжиг при 60°С - 15 с, и полимеризация при 72°С в течение 15 с (сбор данных осуществляли на стадии полимеризации). Затравки были сконструированы с использованием программы «Праймер Экспресс Версия 2.0», с применением дополнительной приставки к РТ-ПЦР прибору ABI Prism 7900HT
для β-актина:
- прямая = 5'-CTGGAACGGTGAAGGTGACA-3'
- обратная = 5'-CGGCCACATTGTGAACTTTG-3';
для кДНК копии мРНК ТРСазы:
- прямая = 5'-GAAAGGCATTTTCGGCTTCA-3'
- обратная = 5'-CAGCCTGGATGGCAGGAA-3''.
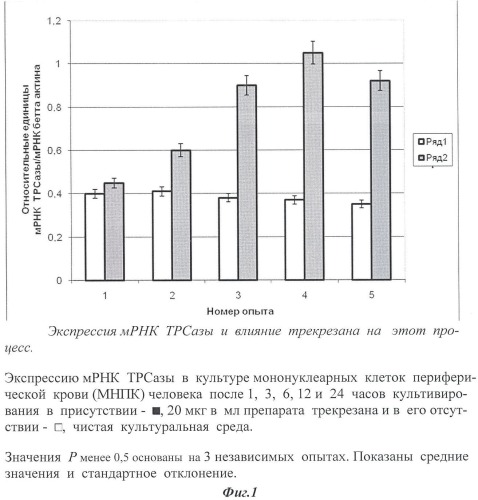
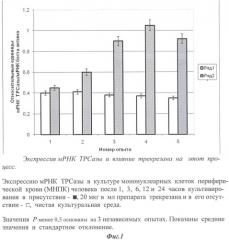
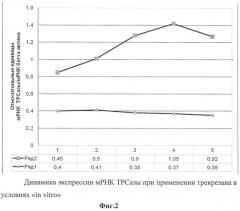
Все реакции проводились в сериях по 3 раза. Анализ полученных данных проводили с тем же пакетом программ (SDS2.1), прилагающихся к прибору ABI Prism 7900HT. Уровень отклонений рассчитывали по программе с учетом оптимизации. Стандарты получали путем амплификации контрольных образцов в ПЦР реакции с теми же затравками, реактивами и условиями, оптимизированными для РТ-ПЦР. Измерения осуществляли относительно стандартных значений, при этом делали 4-кратные последовательные разбавления с целью получения стандартной кривой из 8 точек. Результаты представлены на фиг.1 и 2 в виде соотношения между изучаемым геном-мишенью и мРНК β-актина.
Как следует из представленных графических данных, при введении трекрезана значительно увеличивается экспрессия мРНК ТРСазы.
ЛИТЕРАТУРА
1. Hansson G.K., Libby P. The immune response in atherosclerosis: a double-edged sword // Nat. Rev. Immunol., 2006, v.6, p.508-519.
2. Mangge H., Hubmann H., Pilz S., Schauenstein K., Renner W., Marz W. Beyond cholesterol-inflammatory cytokines, the key mediators in Atherosclerosis // Clin. Chem. Lab. Med, 2004, v.42, p.467-474.
3. Wakasugi K., Slike B.M., Hood J., Otani A., Ewalt K.L., Friedlander M., Cheresh D.A., Schimmel P.A human aminoacyl-tRNA synthetase as a regulator of angiogenesis // Proc. Natl. Acad. Sci. USA. 2002, v.99(1), p.173-177.
4. Tzima E., Reader J.S., Irani-Tehrani M., Ewalt K.L., Schwartz M.A., Schimmel P. Biologically active fragment of a human tRNA synthetase inhibits fluid shear stress-activated responses of endothelial cells // Proc. Natl. Acad. Sci. USA. 2003, v.100(25), p.14903-14907.
5. Kisselev L.L., Justesenc J., Wolfson A.V., Frolova L.Yu. Diadenosine oligophosphates (ApnA), a novel class of signalling molecules? // FEBS Letters, 1998, v.427, N2, p.157-163.
6. Gaube F., Wolf S., Pusch L., Kroll T.C. and Hamburger M. Gene expression profiling reveals effects of Cimicifuga racemosa (L.) NUTT. (black cohosh) on the estrogen receptor positive human breast cancer cell line MCF-7 // BMC Pharmacology 2007, v.7, p.1471-1478.
7. Liu, J., Shue, E., Ewalt, K.L., Schimmel, P. A new γ-interferon-inducible promoter and splice variants of an anti-angiogenic human tRNA synthetase // Nucleic Acids Res. V.32, N 2, p.719-727, 2004.
8. Lee S.W., Cho B.H., Park S.G., Kim S. Aminoacyl-tRNA synthetase complexes: beyond translation // J. Cell. Sci. 2004; V.117, N 17, p.3725-34.
9. Нурбеков М.К., Фаворова О.О., Дмитренко С.Г., Болотина И.А., Киселев Л.Л. Роль ионов цинка в функционировании бычьей триптофанил-тРНК-синтетазы. // Молекулярная биология, 1981, т.15, №5, стр.1000-1010.
10. Wakasugi K. Human tryptophanyl-tRNA synthetase binds with heme to enhance its aminoacylation activity // Biochemistry. 2007, v.46(40), p.11291-11298.
11. Забазарных М.Ю., Литвинов Д.Ю. Форболовые эфиры стимулируют экспрессию гена триптофанил-тРНК-синтетазы человека // Биохимия, 2003, т.68, №4, с.592-597.
12. Smith K.J., Bleyer A.J., Little W.C., Sane D.C. The cardiovascular effects of erythropoietin. // Cardiovasc Res. 2003, v.59(3), p.538-548.
13. Воронков М.Г., Расулов М.М. Трекрезан - родоначальник нового класса адаптогенов и иммуномодуляторов // ХФЖ, 2007, №1, с.3-9.
14. Воронков М.Г., Мирскова А.Н., Расулов М.М. Иммуномодуляторная эффективность трекрезана // ХФЖ, 2007, №5, с.7-11.
15. Смолина Т.П., Запорожец Т.С., Горшкова Р.П., Назаренко Е.Л. Ранняя активация лимфоцитов и моноцитов периферической крови человека компонентами проеобактерий Pseudoalteromonas nigrifaciens // Тихоокеанский медицинский журнал, 2009, №3, С.45-48.
16. Nair M.P., Mahajan S., Reynolds J.L., et al. The Flavonoid Quercetin Inhibits Proinflammatory Cytokine (Tumor Necrosis Factor Alpha) Gene Expression in Normal Peripheral Blood Mononuclear Cells via Modulation of the NF-B System // Clinical and Vaccine Immunology, 2006, Vol.13, No.3, p.319-328.
Применение трекрезана в качестве средства, стимулирующего экспрессию матричной РНК триптофанил-тРНК-синтетазы.