Средство, предотвращающее трансформацию нормальных клеток млекопитающих в опухолевые
Иллюстрации
Показать всеГруппа изобретений относится к медицине, конкретно к онкологии, и касается веществ, предотвращающих злокачественное перерождение нормальных клеток млекопитающих (в том числе человека) в опухолевые. Из губки Aaptos sp. получен аналог ааптамина, а именно 3-N-морфолинил-9-деметилоксиааптамин, обладающий способностью предотвращать трансформацию нормальных клеток млекопитающих в опухолевые. Предложено применение 3-N-морфолинил-9-деметилоксиааптамина, а также его аналогов 9-деметилоксиааптамина, изоааптамина, 3-фенетиламино-9-деметилоксиааптамина и 3-изопентиламино-9-деметилоксиааптамина в качестве подобных средств. Эти вещества также применяют для приготовления фармацевтических композиций, предотвращающих трансформацию нормальных клеток млекопитающих в опухолевые. 3-N-морфолинил-9-деметилоксиааптамин и его аналоги оказывают раково-профилактическое действие в нетоксических для нормальных клеток концентрациях, что значительно снижает риск токсического действия на организм при длительном их применении. 3 н.п. ф-лы, 1 ил., 10 табл.
Реферат
Изобретение относится к медицине, конкретно к онкологии, и касается веществ, обладающих способностью предотвращать злокачественное пререрождение нормальных клеток млекопитающих (в том числе человека) в опухолевые.
Проблема опухолевых заболеваний является одной из острейших проблем современного здравоохранения. Рак (злокачественные опухолевые заболевания) является одной из основных причин смерти в мире. По данным ВОЗ в настоящее время на онкологию приходится 13% от общего числа смертей. За последние 25 лет заболеваемость раком выросла в 1,5-2,0 раза, а к 2030 году по прогнозам вырастет еще втрое, причем особенно тревожно положение в развитых странах. Для различных разновидностей рака характерна одна общая черта - эти болезни чрезвычайно трудно излечить. Следует признать, что лечение онкологических заболеваний в настоящее время высоко затратно и сравнительно малоэффективно. В то же время считается, что до 40% случаев заболевания раком можно предотвратить с помощью здорового рациона питания, физической активности и воздержания от употребления табака. Профилактика может включать употребление различных продуктов и биопрепаратов, содержащих вещества, предотвращающие перерождение нормальных клеток в раковые.
Противоопухолевые хемопревентивные вещества - это обычно природные вторичные метаболиты или их синтетические аналоги, которые ингибируют трансформацию нормальных клеток в прораковые или тормозят прогрессию прораковых клеток в раковые [Hong W.K., Sporn М.В. (1997) Recent advances in chemoprevention of cancer. Science 278:1073-1077; Sporn M.B. (1976) Approaches to prevention of epithelial cancer during the preneoplastic period. Cancer Res 36:2699-2702; Umar A, Viner J.L., Hawk E.T. (2001) The future of colon cancer prevention. Ann NY Acad Sci 952:88-108].
Следовательно, эффективное канцер-превентивное вещество должно вклиниваться в процесс канцерогенеза с тем, чтобы уничтожить прораковые клетки до того, как они трансформируются в раковые [Wattenberg L.W. (1995) What are the critical attributes for cancer chemopreventive agents? Ann NY Acad Sci 768:73-81; Smith T.J., Hong J-Y, Wang Z-Y, Yang C-S (1995) How can carcinogenesis be inhibited? Ann NY Acad Sci 768:82-90; Kelloff G.J., Crowell J.A., Steele V.E., Lubet R.A., Boone C.W., Malone W.A., et al. (1999) Progress in cancer chemoprevention. Ann NY Acad Sci 889:1-13].
Некоторые противораковые хемопревентивные вещества, к примеру ретиноиды и антиэстрогены, оказывают цитостатическое действие на трансформированные клетки путем воздействия на клеточную пролиферацию или дифференциацию [Hong W.K., Sporn М.В. (1997) Recent advances in chemoprevention of cancer. Science 278:1073-1077; Wattenberg L.W. (1995) What are the critical attributes for cancer chemopreventive agents? Ann N.Y Acad Sci 768:73-81; Kelloff G.J., Crowell J.A., Steele V.E., Lubet R.A., Boone C.W., Malone W.A., et al. (1999) Progress in cancer chemoprevention. Ann NY Acad Sci 889:1-13]. Такие вещества должны в течение долгого времени вводиться в организм людей, подверженных повышенному риску раковых заболеваний. В этом случае токсичность веществ, в течение долгого времени вводимых в организм, а также возможность развития резистентности к ним могут ограничить возможность использования данных хемопревентивных веществ [Wattenberg L.W. (1995) What are the critical attributes for cancer chemopreventive agents? Ann NY Acad Sci 768:73-81]. Альтернативный подход заключается в поиске веществ, которые быстро удаляют прораковые клетки путем индукции в них апоптоза.
Публикуются данные о все увеличивающемся числе хемопревентивных противораковых веществ, которые стимулируют апоптоз прораковых и раковых клеток in vitro и in vivo [Gupta S, Hastak K, Ahmad N, Lewin J.S., Mukhtar H (2001) Inhibition of prostate carcinogenesis in TRAMP mice by oral infusion of green tea polyphenols. Proc Natl Acad Sci USA 98:10350-10355; Lu Y-P, Lou Y-R, Li X-H, Xie J-G, Brash D., Huang M-T, et al. (2000) Stimulatory effect of oral administration of green tea or caffeine on ultraviolet light-induced increases in epidermal wild-type p53, p21 (WAFI/CIPI), and apoptotic sunburn cells in SKH-1 mice. Cancer Res 60:4785-4791; Lu Y-P, Lou Y-R, Li X-H, Xie J-G, Yen P, Huang M-T, Conney A.H. (1997) Inhibitory effect of black tea on the growth of established skin tumors in mice: effects on tumor size, apoptosis, mitosis and bromodeoxyuridine incorporation into DNA. Carcinogenesis 18:2163-2169; Samaha H.S., Kelloff G.J., Steele V., Rao C.V., Reddy B.S. (1997) Modulation of apoptosis by sulindac, curcumin, phenylethyl-3-methylcaffeate and 6-phenylhexyl isothiocyanate apoptotic index as a biomarker in colon cancer chemoprevention and promotion. Cancer Res 57:1301-1305; Yang K., Lamprecht S.A., Liu Y, Shinozaki H., Fan K., Leung D., et al. (2000) Chemoprevention studies on the flavonoids quercetin and rutin in normal and azoxymethane-treated mouse colon. Carcinogenesis 21:1655-1660; Tanaka Т., Kohno H., Sakata K., Yamada Y, Hirose Y, Sugie S., et al. (2002) Modifying effects of dietary capsaicin and rotenone on 4-nitroquinoline-l-oxide-induced rat tongue carcinogenesis. Carcinogenesis 23:1361 -1367].
При использовании такого подхода долговременный прием хемопревентивных веществ становится ненужным, что снижает риск проявления токсического эффекта данных препаратов или развития резистентности по отношению к ним [Wattenberg L.W. (1995) What are the critical attributes for cancer chemopreventive agents? Ann NY Acad Sci 768:73-81; Smith T.J., Hong J-Y, Wang Z-Y, Yang C-S (1995) How can carcinogenesis be inhibited? Ann NY Acad Sci 768:82-90; Kelloff G.J., Crowell J.A., Steele V.E., Lubet R.A., Boone C.W., Malone W.A., et al. (1999) Progress in cancer chemoprevention. Ann NY Acad Sci 889:1-13].
Широко известными хемопревентивными веществами, предотвращающими перерождение нормальных клеток в опухолевые, являются полифенолы из зеленого чая, флавоноиды из ягод, ресвератрол из красного винограда, капсаицин из перца, куркумин из тропического растения куркума и многие другие [Lu Y-P, Lou Y-R, Li XH, Xie J-G, Brash D, Huang M-T, et al. (2000) Stimulatory effect of oral administration of green tea or caffeine on ultraviolet light-induced increases in epidermal wild-type p53, p21 (WAFI/CIPI), and apoptotic sunburn cells in SKH-1 mice. Cancer Res 60:4785-4791; Samaha H.S., Kelloff G.J., Steele V, Rao C.V., Reddy B.S. (1997) Modulation of apoptosis by sulindac, curcumin, phenylethyl-3-methylcaffeate and 6-phenylhexyl isothiocyanate apoptotic index as a biomarker in colon cancer chemoprevention and promotion. Cancer Res 57:1301-1305; Yang K., Lamprecht S.A., Liu Y, Shinozaki H., Fan K., Leung D., et al. (2000) Chemoprevention studies on the flavonoids quercetin and rutin in normal and azoxymethane-treated mouse colon. Carcinogenesis 21:1655-1660; Tanaka Т., Kohno H., Sakata K., Yamada Y, Hirose Y, Sugie S., et al. (2002) Modifying effects of dietary capsaicin and rotenone on 4-nitroquinoline-l-oxide-induced rat tongue carcinogenesis. Carcinogenesis 23:1361-1367].
В качестве веществ, предупреждающих злокачественное перерождение нормальных клеток, в последнее время все большее внимание привлекают морские природные соединения и их синтетические аналоги и производные, которые способны вызывать апоптоз трансформированных и раковых клеток.
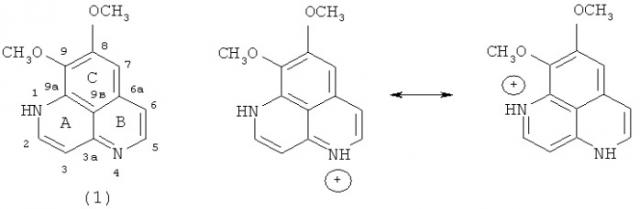
Впервые ааптамин (1) был выделен группой японских исследователей в 1982 году из тропической губки Aaptos aaptos как компонент, отвечающий за α-адреноблокирующую активность водно-метанольного экстракта этой губки. Ааптамин (1) выделен в виде гидрохлорида и представлял собой ярко-желтые кристаллы tпл=110~113°C. По химической структуре соединение представляет собой производное 1Н-бензо[dе]-1,6-нафтиридина [Nakamura Н., Kobayashi J., Ohizumi Y. Isolation and structure of aaptamine, a novel heteroaromatic substance possessing α-blocking activity from the sea sponge Aaptos aaptos. // Tetrahedron Lett. 1982. V.23, №52. P.5555-5558].
Ааптамин (1) и его протонированная форма
В 1987 году та же группа японских исследователей сообщила о выделении из губки Aaptos aaptos двух новых соединений - 9-деметилоксиааптамина (2) и 9-деметилааптамина (3) и синтезе частично гидрированного производного ааптамина - дигидроааптамина (4) [Nakamura Н., Kobayashi J., Ohizumi Н., Hirata Y. (1987) Aaptamines. Novel benzo[de][1,6]naphthyridines from the Okinawan marine sponge, Aaptos aaptos. J. Chem. Soc. Perkin Trans. 1987. V.14, №1. P.173-176].
В 1988 году был выделен изоааптамин (5) [Федореев С.А.., Прокофьева Н.Г., Денисенко В.А., Ребачук Н.М. Цитотоксическая активность ааптаминов из морских губок семейства Suberitidae. // Хим.-фармацевт. журн. 1988. №8. С.943-946], а в 2002 году - 4-метилааптамин (6) [Coutinho A.F., Chanas В., Souza Т.Е., Frugrulhetti I., Epifanio R.de A. Anti HSV-1 alkaloids from a feeding deterrent marine sponge of the genus Aaptos. // Heterocycles. 2002. V.57, №7. P.1265-1272].
В 2003 году было выделено еще одно производное, диметилкеталь 9-деметилоксиааптамина (7) [Calcut L., Longeon A., Mourabit A., Guyot М., Bourguet-Kondracki М. L. Novel alkaloids of the aaptamine class from an Indonesian marine sponge of the genus Xestopongia. // Tetrahedron. 2003. V.59, №34. P.6539-6544].
В 2004 году были выделены бисдеметилааптамин (8) и первый сульфатированный ааптамин - бисдеметилааптамин-9-О-сульфат (9) [Herlt A., Mander L., Rombang W., Rumampuk R., Soemitro S., Steglich W., Tarigan P., von Nussbaum F. Alkaloids from marine organisms. Part 8: Isolation of bisdemethylaaptamine and bisdemethylaaptamine-9-O-sulfate from an Indonesian Aaptos sp.marine sponge. // Tetrahedron. 2004. V.60, №29. P.6101-6104].
Также в литературе имеются сообщения о тетрациклических производных ааптамина (10)-(13) [Calcut L., Longeon A., Mourabit A., Guyot М., Bourguet-Kondracki М. L. Novel alkaloids of the aaptamine class from an Indonesian marine sponge of the genus Xestopongia. // Tetrahedron. 2003. V.59, №34. P.6539-6544] и его структурном изомере, ааптазине (14) [Rudi A., Kashman Y. Aaptasine - a new cytotoxic 5,8-diazabenz[cd]azulene alkaloid from the Red Sea sponge Aaptos aaptos. // Tetrahedron Lett. 1993. V.34, №29. P.4683-4684].
Ааптамин и его производные являются таксономическим маркером отряда Hadromerida [Bergquist P.R., Cambie R.C., Kernan M.R. Chemistry of sponges. 14. Aaptamine, a taxonomic marker for sponges of the order Hadromerida. // Bioch. Syst. Ecol. 1991. V.19, №4. P.289-290] и обладают цитотоксической, противомикробной, противовирусной, противогрибковой и антиоксидантной активностью. Так, наиболее сильной цитотоксической и противомикробной активностью из всех известных производных ааптамина обладает 9-деметилоксиааптамин (2), для которого IC50 (inhibition concentration) по отношению к клеткам HeLa (рак шейки матки) составила 4,09 мкМ a MIC (minimum inhibitory concentration) против Staphylococcus aureus составила 14,71 мкМ, против Bacillus subtilis - 29,38 мкМ, против Proteus vulgaris - 58,76 мкМ. В то же время деметилааптамин (3) по своим аналогичным свойствам был приблизительно в 2 раза менее активен [Nakamura Н., Kobayashi J., Ohizumi Н., Hirata Y. (1987) Aaptamines. Novel benzo[de][1,6]naphthyridines from the Okinawan marine sponge, Aaptos aaptos. J. Chem. Soc. Perkin Trans. 1987. V.14, №1 P.173-176]. 4-Метилааптамин (6) в концентрации 8,3 мкМ и 9-деметилоксиааптамин (2) в концентрации 9,4 мкМ способны ингибировать рост вируса герпеса HSV-1 в зараженных клетках на 80% и 78% соответственно [Coutinho A.F., Chanas В., Souza Т.Е., Frugrulhetti I., Epifanio R.de A. Anti HSV-1 alkaloids from a feeding deterrent marine sponge of the genus Aaptos. // Heterocycles. 2002. V.57, №7. P.1265-1272]. Ааптамин (1) и его производные показали цитотоксическую активность in vitro против мышиных опухолевых клеток Р-388 (лейкемия), а также человеческих опухолевых клеток KB 16 (эпидермоидная карцинома), А549 (аденокарцинома легких) и НТ-29 (аденокарцинома кишечника) [Shen Y, Lin Т., Sheu J., Duh С. Structures and Cytotoxicity Relationship of Isoaaptamine and Aaptamine derivatives. // J. Nat. Prod. - 1999. - V.62, №9. P.1264-1267].
Также было установлено, что наличие гидроксильной группы в положении 9 усиливает цитотоксические свойства соединения, а ацилирование этого положения приводит к снижению цитотоксических свойств. Так, при замене водорода 9-ОН гидроксильной группы изоааптамина (5) на остаток карбоновой кислоты с различной длиной цепи, с образованием 9-ацилизоааптаминов (15)-(26), цитотоксическая активность резко падает [Shen Y, Lin Т., Sheu J., Duh С. Structures and Cytotoxicity Relationship of Isoaaptamine and Aaptamine derivatives. // J. Nat. Prod. - 1999. - V.62, №9. P.1264-1267]. При этом с ростом длины цепи карбоновой кислоты закономерного изменения активности не наблюдается (таблица 1).
Также было показано, что гидрирование кольца В приводит к снижению цитотоксичности, как в случае полученного синтетически дигидроааптамина (4) [Shen Y, Lin Т., Sheu J., Duh С. Structures and Cytotoxicity Relationship of Isoaaptamine and Aaptamine derivatives. // J. Nat. Prod. - 1999. - V.62, №9. P.1264-1267]. При изомеризации скелета, как это можно видеть для ааптазина (14), цитотоксичность также резко понижается (таблица 1).
| Таблица 1 | ||||
| Цитотоксическая активность ааптамина (1), 9-деметилоксиааптамина (2), дигидроааптамина (4), изоааптамина (5) и ааптазина (14), а также ацильных производных изоааптамина (15)-(26) против клеток линий Р-388, КВ16, А549 и НТ-29 | ||||
| IС50, мкМ | ||||
| Р-388 | КВ16 | А549 | НТ-29 | |
| Ааптамин (1) | 2,632 | 17,105 | 12,281 | 30,263 |
| 9-Деметилоксиааптамин (2) | 0,047 | 0,47 | 1,415 | Не тестирован |
| Дигидроааптамин (4) | 8,4 | 102,8 | 107,5 | 219,6 |
| Изоааптамин (5) | 0,175 | 1,754 | 1,316 | 1,754 |
| Ааптазин (14) | Не тестирован | Не тестирован | >219 | >219 |
| (15) | 15,6 | >185,2 | >185,2 | >185,2 |
| (16) | 4,9 | 98,6 | 63,4 | 45,8 |
| (17) | 5,8 | 112,2 | 41,7 | 28,8 |
| (18) | 2,1 | 101,2 | 39,9 | 36,8 |
| (19) | 2,1 | 111,8 | 32,4 | 38,2 |
| (20) | 4,2 | 42,4 | 39,5 | 34.0 |
| (21) | 0,109 | 89,7 | 32,6 | 8,2 |
| (22) | 0,0785 | 52,4 | 16,0 | 6,5 |
| (23) | 0,0732 | 48,8 | 9,0 | 6,1 |
| (24) | 0,685 | 7,5 | 12,8 | 13,0 |
| (25) | 0,215 | 17,2 | 15,7 | 19,3 |
| (26) | 2,2 | >101,2 | >101,2 | 42,5 |
В 2003 году было проведено исследование некоторых антибактериальных (против грамм-положительных бактерий S. aureus, грамм-отрицательных бактерий Е. coli и V. Anguillarum), противогрибковых (против С. tropicalis) и цитотоксических (против клеток KB) свойств ааптамина (1), 9-деметилоксиааптамина (2), изоааптамина (5), диметилкеталя 9-деметилоксиааптамина (7) и тетрациклических производных ааптамина (10)-(13) [Calcut L., Longeon A., Mourabit A., Guyot М., Bourguet-Kondracki M.L. Novel alkaloids of the aaptamine class from an Indonesian marine sponge of the genus Xestopongia. // Tetrahedron. 2003. V.59, №34. P.6539-6544]. Показано, что при замыкании четвертого цикла соединения цитотоксичность резко снижается (таблица 2).
| Таблица 2 | |||||
| Антибактериальная, противогрибковая и цитотоксическая активность ааптамина (1), 9-деметилоксиааптамина (2), изоааптамина (5), диметилацеталя 9-деметилоксиааптамина (7) и тетрациклических производных ааптамина (10)-(13) | |||||
| MIC, мкМ | IС50, мкМ | ||||
| S. aureus | Е. coli | V. anguillarum | С. tropicalis | Клетки KB | |
| Ааптамин (1) | 109,6 | >438,6 | 52,6 | 109,6 | 16,2 |
| 9-Деметилоксиааптамин (2) | 117,9 | 471,7 | 471,7 | >471,7 | 16,1 |
| Изоааптамин (5) | 26,3 | >438,6 | 52,6 | 52,6 | 2,2 |
| Диметилацеталь 9-деметилоксиааптамина (7) | >387,6 | >387,6 | >387,6 | >387,6 | 13,6 |
| (10) | >341,3 | >341,3 | >341,3 | >341,3 | >34,1 |
| (11) | >374,5 | >374,5 | >374,5 | >374,5 | >37,5 |
| (12) | >362,3 | >362,3 | >362,3 | >362,3 | >36,2 |
| (13) | >429,2 | >429,2 | 429,2 | >429,2 | >42,9 |
Цитотоксическая активность ааптамина (1), 9-деметилоксиааптамина (2) и изоааптамина (5) также была исследована по отношению к опухолевым клеткам лейкемии (Р388), рака яичника (OVCAR-3), рака центральной нервной системы (SF-295), рака почки (А498), рака легкого (NCI-H460), рака кишечника (KM20L2) и меланомы (SK-MEL-5) [Pettit G.R., Hoffmann Н., McNulty J., Higgs K.C., Murphy A., Molloy D.J., Herald D.L., Williams M.D., Pettit R.K., Doubek D.L., Hooper J.N. A., Albright L., Jean M., Schmidt J. M, Chapuis J., Tackett L.P. Antineoplastic agents. 380. Isolation and X-ray crystal structure determination of isoaaptamine from the Republic of Singapore Hymeniacidon sp.and conversion to the phosphate prodrug hystatin 1. // J. Nat. Prod. 2004. V.67, №3. P.506-509; Pettit G R., Hoffmann H., Herald D.L., McNulty J., Murphy A., Higgs K.C., Hamel E., Lewin N.E., Pearce L.V., Blumberg P.M., Pettit R.K., Knight J. C. Antineoplastic agents 491. Synthetic conversion of aaptamine to isoaaptamine, 9-demethylaaptamine, and 4-methylaaptamine. // J. Org. Chem. - 2004. V.69, №7. P.2251-2256]. Результаты представлены в таблице 3.
| Таблица 3 | |||
| Противоопухолевая цитотоксическая активность ааптамина (1), 9-деметилоксиааптамина (2) и изоааптамина (5) | |||
| Клеточная линия | IC50, мкМ | ||
| Ааптамин (1) | 9-Деметилоксиааптамин (2) | Изоааптамин (5) | |
| Р388 | 15,78 | 1,46 | 1,23 |
| OVCAR-3 | 21,49 | 1,84 | 5,26 |
| SF-295 | 17,98 | 13,21 | 11,40 |
| А498 | 14,0 | 19,81 | 9,65 |
| NCI-H460 | 14,0 | 10,85 | 10,53 |
| KM20L2 | 15,79 | 9,91 | 10,092 |
| SK-MEL-5 | 18,86 | 4,72 | 7,02 |
Была также установлена цитотоксическая активность 9-деметилоксиааптамина (2) для клеток лейкемии Р388, равная IC50=7,55 мкМ [Longley R.E., McConnell O.L., Essich Е., Harmody D. Evaluation of marine sponge metabolites for cytotoxicity and signal transduction activity. // J. Nat. Prod. 1993. V.56, №6, P.915-920]. Кроме того, ааптамин (1) показал сильную антиоксидантную активность в экспериментах с использованием 2,2-дифенил-1-пикрилгидразил радикала (DPPH) и относительно слабую в опыте с 2',7'-дихлородигидрофлуоресцеин диацетатом (DCFH-DA) [Takamatsu S. Marine natural products as novel antioxidant prototypes. // J. Nat. Prod. 2003. V.66, №5. P.605-608].
В последней по времени из опубликованных статей, касающихся структуры и биологической активности производных ааптамина, были приведены структуры двух новых производных ааптамина, 3-фенетиламино-9-деметилоксиаапамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28) [Shaari К., Ling К.С., Rashid Z.M., Jean Т.P., Abas R, Raof S.M., Zainal Z., Lajis N.H., Mohamad H., Ali A.M. Cytotoxic aaptamines from Malaysian Aaptos aaptos. // Mar. Drugs. 2009. V.7. P.1-8].
Для этих соединений, а также для ааптамина (1) была сообщена цитотоксическая активность по отношению к клеткам лимфобластической лейкемии CEM-SS. Так, для соединения (27) IC50=5.3 мкг/мл, для (28) IC50=6.7 мкг/мл и для ааптамина IC50=15.0 мкг/мл.
Механизм биологического действия ааптамина и его производных на клетки мало изучен. Установлено, что ааптамин и некоторые его производные способны нарушать проницаемость цитоплазматической мембраны, чем, возможно, и обусловлен его цитотоксический эффект [Федореев С.А., Прокофьева Н.Г., Денисенко В.А., Ребачук Н.М. Цитотоксическая активность ааптаминов из морских губок семейства Suberitidae. // Хим.-фармацевт. журн. 1988. №8. С.943-946]. Также известно, что ааптамин способен индуцировать экспрессию белка р21, ингибитора циклин-зависимой киназы, ответственного за остановку клеточного цикла [Aoki S., Kong D., Suna H., Sowa Y., Sakai T, Setiawan A., Kobayashi M. Aaptamine, a spongean alkaloid, activates p21 promoter in a p53-independent manner. // Biochem. Biophys. Res. Commun. 2006. V.342, №1. P.101-106] и ингибировать активность протеин-киназы РКС [Patil A. D., et al., Aaptamines as protein kinase С inhibitors, PCT Int. App.; WO 95/0584, 1995].
В литературе также были опубликованы различные подходы к синтезу ааптамина и его производных [Pettit G.R., Hoffmann Н., Herald D.L., Blumberg P.M., Hamel E., Schmidt J.M., Chang Y, Pettit R.K., Lewin N.E., Pearce L.V. Antineoplastic agents. 499. Synthesis of hystatin 2 and related lH-benzo[de][l,6]-naphthyridinium salts from aaptamine. // J. Med. Chem. 2004. V.47, №7. P.1775-1782; Walz A.J., Sundberg R.J. Synthesis of 8-methoxy-1-methyl-lH-benzo[de][l,6]naphthyridin-9-ol (isoaaptamine) and analogues. // J. Org. Chem. 2000. V.65, №23. P.8001-8010].
Опубликован также американский патент, в котором описаны выделение, установление структуры изоааптамина (5) и его химическая конверсия в родственные соединения, «которые, по-видимому, обладают антимикробными и/или противораковыми свойствами» [US 2005/0187240 Al, pub. Date: Aug. 25, 2005; Inventors: Pettit G.R., Herald D.L., Hoffman H. Aaptamine and isoaaptamine and strucrural modifications thereof].
Из уровня техники известно применение ааптамина и его аналогов, а именно 9-деметилоксиааптамина (2) и изоааптамина (5) к лечению уже имеющихся раковых заболеваний [WO 95/05824 A1, 02.03.1995], в том числе к преодолению так называемого «drug resistance», когда уже имеющаяся раковая опухоль сопротивляется применяемым лекарственным средствам, при этом говорится об именно опухолевых клетках (target neoplastic cells) как цели применения патентуемых производных ааптамина.
Известны раково-профилактические свойства ааптамина [Дышловой С.А. Создание биологически активной добавки с канцерпревентивными свойствами на основе ааптамина. 1 Far-Eastern International Symposium on life Sciences. Молодежная секция «Актуальные проблемы химии и биологии». Материалы. Часть II, кокурс «У.М.Н.И.К.». Владивосток, 2008, с.22-25]. Однако недостаток ааптамина заключается в том, что он обладает сравнительно высокой цитотоксической активностью по отношению к нормальным клеткам млекопитающих.
Задача изобретения - расширение арсенала средств и фармацевтических композиций на основе аналогов ааптамина, способных избирательно предотвращать злокачественное перерождение нормальных клеток млекопитающих в опухолевые.
Задача решена созданием средства, предотвращающего трансформацию нормальных клеток млекопитающих в опухолевые, представляющее собой 3-N-морфолинил-9-деметилоксиааптамин (29).
Задача решена также применением 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) или 3-изопентиламино-9-деметилоксиааптамина (28) в качестве средства, предотвращающего трансформацию нормальных клеток млекопитающих в опухолевые.
Назначение 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28) в качестве средств, обладающих способностью предотвращать злокачественное перерождение нормальных клеток млекопитающих в опухолевые, в доступной патентной и другой научно-технической литературе не обнаружено.
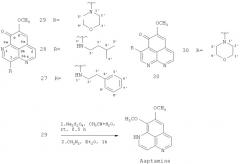
Новое производное ааптамина, 3-N-морфолинил-9-деметилоксиааптамин (29), наряду с ранее известными 9-деметилоксиааптамином (2), изоааптамином (5), 3-фенетиламино-9-деметилоксиааптамином (27) и 3-изопентиламино-9-деметилоксиааптамином (28) выделены из собранной у побережья Вьетнама морской губки Aaptos sp. Эти соединения могут быть получены также путем химического синтеза.
Процесс выделения ааптаминовых производных из губок является стандартной процедурой, описанной, к примеру, Shaari К. и соавторами [Shaari К., Ling К.С., Rashid Z.M., Jean T.P, Abas F., Raof S.M., Zainal Z., Lajis N.H., Mohamad H., Ali A.M. Cytotoxic aaptamines from Malaysian Aaptos aaptos. // Mar. Drugs. 2009. V.7. P.1-8].
Сущность способа заключается в следующем: животных измельчают и экстрагируют метанолом (или этанолом); экстракт упаривают на роторном испарителе до полного испарения спиртовой составляющей и из оставшегося водного слоя удаляют липиды и неполярные вещества путем экстракции гексаном. Водный слой обессоливают путем хроматографии на колонке с тефлоновым порошком или другим гидрофобным носителем, уравновешенным в воде. Неорганические соли вымывают с колонки водой, а фракцию, содержащую ааптаминовые производные, смывают 10-20%-ным этанолом в воде. После упаривания досуха на роторном испарителе фракцию наносят на колонку с силикагелем; элюент - хлороформ с добавлением возрастающих количеств этанола. В результате, как правило, выделяют в чистом виде ааптамин (1), 9-деметил(оксиа)аптамин (2), изоааптамин (5) и смеси других ааптаминовых производных. Полученные смеси производных ааптамина разделяют методом жидкостной хроматографии высокого давления (ЖХВД) с применением силикагельных или обращенно-фазовых колонок. Так мы разделяли смесь, содержащую ааптамины 27-29, методом ЖХВД на обращенно-фазовой колонке YMC-Pack ODS-A (10×250 мм), используя 60% метанол в качестве элюента. При этом новое производное ааптамина, 3-N-морфолинил-9-деметилоксиааптамин (29), и его аналоги 3-фенетиламино-9-деметилоксиааптамин (27) и 3-изопентиламино-9-деметилоксиааптамин (28) были получены в чистом виде.
Задача решена также применением 3-N-морфолинил-9-деметилоксиааптамина (29) или 9-деметилоксиааптамина (2) или изоааптамина (5) или 3-фенетиламино-9-деметилоксиааптамина (27) или 3-изопентиламино-9-деметилоксиааптамина (28) для приготовления фармацевтической композиции, предотвращающей трансформацию нормальных клеток млекопитающих в опухолевые.
Фармацевтические композиции, предотвращающие трансформацию нормальных клеток млекопитающих в опухолевые, получают смешивая эффективное количество 3-N-морфолинил-9-деметилоксиааптамина (29) или его аналогов 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28) с традиционными фармацевтически или фармакологически приемлемыми наполнителями. Выражение «фармацевтически или фармакологически приемлемый» обозначает молекулярные компоненты и композиции, которые не вызывают негативных, аллергических или иных нежелательных реакций при введении их животному или человеку. Природа наполнителя зависит от способа введения. Например, если желательным является пероральное введение, то может быть выбран твердый наполнитель, тогда как для внутривенного введения может быть использован жидкий солевой раствор.
Технический результат, обеспечиваемый изобретением, заключается в способности 3-N-морфолинил-9-деметилоксиааптамина (29), 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28) предотвращать трансформацию нормальных клеток в опухолевые, а также в возможности использования этих веществ для приготовления фармацевтических композиций, предотвращающих трансформацию нормальных клеток млекопитающих в опухолевые. 3-N-морфолинил-9-деметилоксиааптамин (29) и его аналоги 9-деметилоксиааптамин (2), изоааптамин (5), 3-фенетиламино-9-деметилоксиааптамин (27) и 3-изопентиламино-9-деметилоксиааптамин (28) оказывают раково-превентивное действие в нецитотоксических для нормальных клеток концентрациях, что значительно снижает риск токсического действия на организм при длительном его применении.
Изобретение расширяет арсенал средств и фармацевтических композиций, предотвращающих трансформацию нормальных клеток млекопитающих в опухолевые.
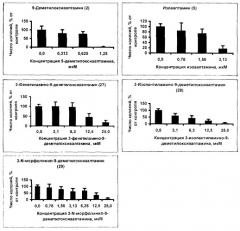
На чертеже представлено ингибирование 3-N-морфолинил-9-деметилоксиааптамином (29) и его аналогами 9-деметилоксиааптамином (2), изоааптамином (5), 3-фенетиламино-9-деметилоксиааптамином (27) и 3-изопентиламино-9-деметилоксиааптамином (28) EGF-индуцированной опухолевой трансформации мышиных эпителиальных клеток JB6 P+ C141.
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1. Выделение и установление структуры нового аналога ааптамина, 3-N-морфолинил-9-деметилоксиааптамина (29), а также ранее известных 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28).
I. Материалы и методы.
1. Приборы.
1Н и 13С ЯМР спектры регистрировали на спектрометре Bruker DRX-500 (Германия) при 500 и 125 МГц соответственно с тетраметилсиланом в качестве внутреннего стандарта. ИК-спектры регистрировали на спектрометре Bruker Vector 22 (Германия) и УФ-спектры - на спектрометре Shimadzu UV-1601 (Япония). Масс-спектр высокого разрешения получали на масс-спектрометре Agilent 6510 Q-TOF (Agilent, США). Простую колоночную хроматографию проводили с использованием сорбентов Полихром-1 (тефлоновый порошок, Biolar, Latvia) и силикагель КСК (50-100 микрон, Россия). Для тонкослойной хроматографии использовали силикагельные пластинки 4.5×6.0 cm (5-17 µm, Sorbfil, Россия). Жидкостную хроматографию высокого давления выполняли на хроматографе Agilent 1100 (Agilent, США), снабженном рефрактометрическим детектором и колонкой YMC-Pack ODS-A (10×250 mm).
2. Животные.
Губки Aaptos sp.были собраны водолазным методом в течение 30-й научной экспедиции на борту НИС «Академик Опарин» в январе 2005 г. у побережья Вьетнама (бухта Ванг Фонг, глубина 5-10 м, координаты места сбора 12°35'68''N, 109°18'62''E). Образец губки хранится в коллекции, находящейся в ТИБОХ ДВО РАН (Владивосток, Россия).
3. Экстракция и выделение.
Губка (сухой вес 500 г) была проэкстрагирована этанолом немедленно после сбора. Этанольный экстракт после упаривания под вакуумом досуха был заново растворен в системе EtOH-Н2О (5:1) и экстрагирован гексаном. Водно-этанольный слой после упаривания был помещен на колонку с полихромом-1. Колонку элюировали сначала водой, а затем 10% этанолом. После упаривания досуха на роторном испарителе фракцию, элюированную 10% этанолом, хроматографировали на колонке с силикагелем; элюент - хлороформ с добавлением возрастающих количеств этанола. В результате выделили в чистом виде ааптамин (1, 160 мг, 0,03% от сухого веса губки), 9-деметилоксиаапатмин (2, 80 мг, 0,015% от сухого веса губки), изоааптамин (5, 98 мг, 0,023% от сухого веса губки) и смесь алакалоидов 27-29. Полученную смесь производных ааптамина разделяли методом жидкостной хроматографии высокого давления (ЖХВД) с применением обращенно-фазовой колонки YMC-Pack ODS-A (10×250 мм), используя 60% метанол в качестве элюента. При этом все три производных (27, 5 мг, 0,001%; 28, 7 мг, 0,0014%; 29, 15 мг, 0,003%), одно из которых (29) оказалось новым по структуре, были получены в чистом виде.
4. Спектральные данные выделенных веществ (27-29).
3-N-Морфолинил-9-деметилоксиааптамин (29)
Оранжевый аморфный порошок.
ИК-спектр (CHCl3), 1652, 1620, 1505, 1109 см-1.
УФ-спектр (λmax) (EtOH) нм (log ε): 249 (3,89), 280 (3.66).
1Н ЯМР (500 MГz, CD3OD): Таблица 4.
13С ЯМР (125 MГz CD3OD): Таблица 4.
HRESI-MS: m/z [M+H]+ вычислено для C16H15N3O3: 298,1186; найдено: 298,1185.
3-Фенетиламино-9-деметилоксиааптамин (27).
Оранжевый аморфный порошок.
УФ-спектр (λmax) (EtOH) нм (log ε): 246 (3,15), 280 (2,99).
HRESI-MS: m/z [M+H]+ вычислено для C20H17N3O2: 332,1394; найдено: 332,1381.
ЯМР спектры аналогичны опубликованным [Shaari К., Ling К.С., Rashid Z.M., Jean Т.Р., Abas F, Raof S.M., Zainal Z., Lajis N.Н., Mohamad Н., Ali A.M. Cytotoxic aaptamines from Malaysian Aaptos aaptos. // Mar. Drugs. 2009. V.7. P.1-8].
3-Изопентиламино-9-деметилоксиааптамин (28).
Оранжевый аморфный порошок.
УФ-спектр (λmax) (EtOH) нм (log ε): 244 (3,41), 279 (3,23).
HRESI-MS: m/z [M+H]+ вычислено для C17H19N3O2: 298,1550; найдено: 298,1549.
ЯМР спектры аналогичны опубликованным [Shaari К., Ling K.C., Rashid Z.M., Jean Т.Р, Abas F., Raof S.M., Zainal Z., Lajis N.H., Mohamad Н., Ali A.M. Cytotoxic aaptamines from Malaysian Aaptos aaptos. // Mar. Drugs. 2009. V.7. P.1-8].
5. Химическое превращение 3-N-Морфолинил-9-деметилоксиааптамина (29) в ааптамин (1).
К суспензии 29 (5 мг) в смеси ацетонитрила (10 мл) и воды (1 мл) был добавлен трехкратный (моль/моль) избыток Na2S2O4. Полученную смесь перемешивали в течение 30 мин при комнатной температуре. Затем к смеси добавили 1 мл насыщенного раствора NaHCO3. Через 10 мин добавили избыток диазометана в Et2O и смесь перемешивали в течение 1 часа. Затем реакционную смесь разбавили водой (10 мл) и экстрагировали этилацетатом (3×5 мл). Объединенные органические слои сушили над безводным Na2SO4, концентрировали под вакуумом и очищали колоночной хроматографией на силикагеле (CHCl3: МеОН, 3:1), растворили в метаноле и подкислили HCl. Полученный ааптамина гидрохлорид идентифицировали с помощью сравнения данных ЯМР спектров с литературными [Nakamura H., Kobayashi J., Ohizumi H. (1982) Isolation and structure of aaptamine, a novel heteroaromatic substance possessing α-blocking activity from the sea sponge Aaptos aaptos. Tetrahedron Letters, 23, 5555-5558].
II. Результаты выделения и установления структуры нового аналога ааптамина - 3-N-морфолинил-9-деметилоксиааптамина (29), а также ранее известных 9-деметилоксиааптамина (2), изоааптамина (5), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28) и их обсуждение.
В продолжение изучения противораковой и канцер-превентивной активности морских природных соединений нами был изучен этанольный экстракт губки, принадлежащей к роду Aaptos (семейство Suberitidae, отряд Hadromerida), собранной у берегов Вьетнама в течение научной экспедиции на борту НИС «Академик Опарин». Этот экстракт показал цитотоксическую активность против клеток лейкемии человека HL-60. С помощью хроматографических методов из данного экстракта нами был выделен новый алкалоид ааптаминового ряда - 3-N-морфолинил-9-деметилоксиааптамин (29), наряду с ранее известными 9-деметилоксиааптамином (2), изоааптамином (5), 3-фенетиламино-9-деметилоксиааптамином (27) и 3-изопентиламино-9-деметилокси-ааптамином (28). Структуры известных алкалоидов 2, 5, 27, 28 были определены на основе спектральных данных (УФ, ИК, 1D и 2D ЯМР) и при сравнении их с ранее опубликованными данными [Nakamura H., Kobayashi J., Ohizumi H. (1982) Isolation and structure of aaptamine, a novel heteroaromatic substance possessing α-blocking activity from the sea sponge Aaptos aaptos. Tetrahedron Letters, 23, 5555-5558; Nakamura H., Kobayashi J., Ohizumi H., Hirata Y. (1987) Aaptamines. Novel benzo[de] [1.6] naphthyridines from the Okinawan marine sponge, Aaptos aaptos. Journal of the Chemical Society, Perkin Transactions 1, 14, 173-176; Fedoreev S.A., Prokofeva N.G., Denisenko V.A., Rebachuk N.M. (1988) Cytotoxic activities of aaptamines from marine sponges of the family Suberitidae. Khimiko-Farmatsevticheskii Zhurnal, 24, 943-947 (in Russian); Shaari K, Ling K.C., Rashid Z.M., Jean T.P., Abas F., Raof S.M., Zainal Z., Lajis N.H., Mohamad H., Ali A.M. (2009) Cytotoxic aaptamines from Malaysian Aaptos aaptos. Marine Drugs, 7, 1-8].
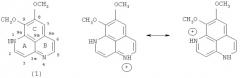
Новый аналог ааптамина, 3-N-морфолинил-9-деметилоксиааптамин (29), был выделен в виде аморфного вещества оранжевого цвета. Его молекулярная формула C16H15N3O3 была определена на основе масс-спектра высокого разрешения HRESI-MS, в котором был ион [М+Н]+ при m/z 298,1185; Δ 0,1 ppm. В ИК-спектре присутствовала полоса поглощения при 1652 см-1, принадлежащая карбонильной группе хиноидного типа. Все ЯМР-данные (таблица 4) свидетельствовали о том, что данное вещество принадлежит к ряду бензо[де][1,6]-нафтиридинов и структурно родственно 9-деметилоксиааптамину (2), хотя нельзя было исключить его принадлежность и к ряду бензо[де][1,8]-нафтиридинов (30).
Схема химической реакции превращения 3-N-морфолинил-9-деметилоксиааптамина (29) в ааптамин
Однако превращение выделенного соединения 29 в ааптамин (1) после восстановления с помощью Na2S2O4 с последующей обработкой диазометаном исключило структуру 30 и подтвердило, что соединение 29 имеет ту же скелетную систему, что и 9-деметилоксиааптамин (2).
Наряду с характерными для ааптамина сигналами, в 1Н- и 13С ЯМР спектрах вещества 29 присутствовали сигналы четырех дополнительных метиленовых групп, связанных с гетероатомами: δH 3.96 (2Н, м), 3.96 (2Н, м), 4.12 (2Н, м), 4.12 (2Н, м); δC 52.4, 52.4, 67.9, 67.9.
1H-1H COSY корреляция H2-2' и Н2-3', а также Н2-4' и Н2-5', НМВС кросс-пики H-2'/C-3', С-5' и Н-3'/С-2', С-4', а также молекулярная формула указывали на присутствие морфолинильного фрагмента в структуре соединения 29.
| Таблица 4 | |||
| Данные ЯМР для 3-N-морфолинил-9-деметилоксиааптамина (29) | |||
| № атома углерода | δH, мультиплетность, (J, Гц) | δC* | НМВС (Н→С) |
| 2 | 8,52 с | 137,3 | 3, 3а, 9а |
| 3 | 148,5 | ||
| 3а | 140,8 | ||
| 5 | 8,89 д | 151,9 | 3а, 6, 6а |
| 6 | 7,68 д (4,4) | 123,7 | 5, 7, 9в |
| 6а | 137,6 | ||
| 7 | 7,00 с | 109,5 | 6, 8, 9, 9в |
| 8 | 158,0 | ||
| 9 | 177,7 | ||
| 9а | 137,4 | ||
| 9в | 120,3 | ||
| 2' | 4,15 м | 52,3 | 3, 3', 5' |
| 3' | 3,96 м | 67,9 | 2', 4' |
| 4' | 3,96 м | 67,9 | 3', 5' |
| 5' | 4,15 м | 52,3 | 3, 2', 4' |
| ОМе | 3,96 с | 56,7 | 8 |
| * Отнесения сделаны на основании данных HSQC и НМВС |
На основании вышеуказанных доказательств структура вновь выделенного алкалоида была установлена как 3-N-морфолинил-9-деметилоксиааптамин (29). Насколько нам известно, это первый случай обнаружения морфолинильного фрагмента в структуре морского природного соединения.
Пример 2. Исследование биологической активности 9-деметилоксиааптамина (2), изоааптамина (5), 3-N-морфолинил-9-деметилоксиааптамина (29), 3-фенетиламино-9-деметилоксиааптамина (27) и 3-изопентиламино-9-деметилоксиааптамина (28).
I. Материалы и методы.
1. Принятые сокращения.
EGF - Epidermal growth factor (эпидермальный фактор роста)
FBS - Fetal bovine serum (сыворотка бычьих эмбрионов)
HPLC - High performance liquid chromatography (высокоэффективная жидкостная хроматография)
IC50 - Inhibition concentration 50% (концентрация, вызывающая гибель 50% клеток)
INCC50 - Inhibition of number of colonies concentration 50% (концентрация, ингибирующая злокачественную трансформацию 50% клеток)
PBS - Phosphate-buffered saline (фосфатно-солевой буфер)
ТРА - 12-O-Tetradecanoylphorbol-13-acetate (12-O-тетрадеканоилфорбол-13-ацетат)
мкМ - микромоль/литр
мМ - миллимоль/литр
М - моль/литр
мкл - микролитр
мл - миллилитр
SD - стандартное отклонение
PBS - фосфатно-солевой буферный раствор
ВМЕ - basal medium Eagle (питательная среда Игла для культивирования клеток млекопитающих)
RPMI, DMEM, MEM - питательные среды для культивирования клеток млекопитающих, изготовленные на основе среды Игла ВМЕ
МТТ - 3-(4,5-диметилтиазолил)-2,5-дифенилтетразолиум бромид (реагент для определения цитотоксичности)
MTS - 5-(3-Карбоксиметоксифенил)-2-(4,5-диметилтиазолил)-3-(4-сульфофенил) тетразолиум, внутренняя соль (реагент для определения цитотоксичности)
2. Клеточные культуры.
Мышиные эпителиальные клетки JB6 P+ Cl41, а также опухолевые клетки человека, HeLa (рак шейки матки), ТНР-1 (лейкемия, моноциты), HL-60 (лейкемия, промиелоциты), SNU-C4 (рак кишечника), SK-MEL-28 (меланома), MDA-MB-231 (рак молочной железы), Neuro 2a (нейробластома) из коллекции АТСС, Rockville, MD, США выращивались в инкубаторе Sanyo MCO-15AC в монослое для прикрепленных (линии JB6 Р+ С141, SK-MEL-28, HeLa, SNU-C4, MDA-MB-231, Neuro2a) или в суспензии для неприкрепленных клеток (линии ТНР-1 и HL-60) при 37°С и в атмосфере 5% CO2.
Для клеток линий JB6 P+ С141 и SK-MEL-28 использовалась среда MEM, содержащая 5% FBS, 2 mM раствора L-глутамина и 15 мкг/мл гентамицина.
Для клеток линий SK-MEL-28 и Neuro 2a использовалась среда MEM, содержащая 10% FBS, 2 mM раствора L-глутамина и 15 мкг/мл гентамицина.
Для клеток линий HeLa, ТНР-1, HL-60, SNU-C4 использовалась среда RPMI-1640, содержащая 10% FBS, 2 mM раствора L-глутамина и 15 мкг/мл гентамицина.
Для клеток линии MDA-MB-231 использовалась среда DMEM, содержащая 10% FBS, 2 mM раствора L-глутамина и 15 мкг/мл гентамицина.
3. Приготовление растворов веществ.
Базовые (стоковые) растворы 9-деметилоксиааптамина (2), изоааптамина (5), 3-N-морфолинил-9-деметилоксиааптамина (29), 3-фе