Система инкапсуляции
Иллюстрации
Показать всеИзобретение относится к композиции, включающей альгинат с высоким содержанием маннуроновой кислоты и поликатион, имеющий индекс полидисперсности менее 1,5. Композиция является особенно пригодной для изготовления биологически совместимых микрокапсул, содержащих живые клетки для алло- или ксенотрансплантации. Указанные микрокапсулы являются более долговечными и могут сохранять свою структурную и функциональную целостность в течение длительных периодов времени по сравнению с известными альгинатными микрокапсулами. 9 н. и 48 з.п. ф-лы, 11 ил., 6 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к системе инкапсуляции, включающей в себя альгинатные биокапсулы для иммунологической изоляции живых клеток или лекарственных средств. Особенно, но ни в коем случае не исключительно, система инкапсуляции предназначена для использования в случаях алло- и ксенотрансплантации. Изобретение относится также к способам изготовления и применения системы инкапсуляции.
УРОВЕНЬ ТЕХНИКИ
Трансплантация клеток становится все более успешной, как экспериментально, так и клинически. Один цикл трансплантации клеток пользуется развитием материальной науки, клеточной биологии и доставки лекарственных средств для разработки основных принципов лечения микро- и макроинкапсулированными клетками. Они включают в себя сконструированные двухмерные и трехмерные тканевые структуры, состоящие из неразлагаемых термопластичных полимеров, биологически разлагаемых материалов и гибридных комбинаций. Указанные конструкции позволяют осуществлять контролируемую доставку терапевтических молекул для лечения острых и хронических заболеваний, но их широкому применению препятствует необходимость частого введения в случае разлагаемых материалов и проблемы с извлечением и постоянной биологической совместимостью в случае неразлагаемых материалов. В случае биологически разлагаемых материалов успех терапии инкапсулированными клетками в большой степени будет зависеть от понимания стабильности материала после трансплантации и, в конечном итоге, от того, как указанная стабильность влияет на способность трансплантата обеспечивать выживание клеток, секрецию и диффузию белка, иммунологическую изоляцию, биологическую совместимость, физическое расположение и фиксацию, деградацию и эффективность и фармакодинамику секретируемого продукта. Одним из наиболее распространенных материалов, используемых для указанных биокапсул для клеточной терапии, является альгинат, биологически разлагаемый углевод.
Альгинат долго изучался как биологический материал для широкого применения в области физиологии и терапии. Его возможности в качестве биологически совместимого имплантируемого материала впервые были изучены в 1964 г. в области хирургии в качестве плазмозаменителя (1). Спустя более десяти лет возможности альгината в качестве матрикса для носителя клеток были реализованы in vitro в серии экспериментов, которые показали выживание микробных клеток в течение 23 дней (2). В течение последних двадцати лет отмечался значительный прогресс в области альгинатной микроинкапсуляции клеток для лечения диабета (3-10), хронической боли (11), гемофилии (12, 13), заболеваний центральной нервной системы (ЦНС) (14-24) и т.п. Несмотря на успешность при использовании многочисленных моделей на экспериментальных животных и в ограниченных клинических аллотрансплантациях, наблюдалась изменчивая кинетика деградации, влияющая на диффузию, иммунологическую изоляцию и, в конечном итоге, приводящая к гибели и отторжению трансплантата. Было проведено несколько хорошо разработанных экспериментов для изучения свойств и контроля определенных аспектов деградации альгината in vitro (25-30) и in vivo (31, 32), однако общее понимание стабильности альгинатно-поликатионных капсул in vivo с точки зрения перспективы использования определенных материалов остается ограниченным, и это, в свою очередь, ограничивает их использование.
Целью настоящего изобретения является продвинуться по пути дальнейшего понимания стабильности альгинатно-поликатионных биокапсул для изготовления более стабильных биокапсул для применения in vivo и/или обеспечения эффективного выбора для общества.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к композиции длительного использования в биологическом окружении, включающей в себя альгинат, который имеет высокое содержание маннуроновой кислоты, и поликатион, не являющийся поли-L-лизином, имеющий среднюю молекулярную массу 10-40 кДа и индекс полидисперсности < 1,5, для изготовления микрокапсул. Указанные микрокапсулы можно изготавливать стандартными способами. Композиция по настоящему изобретению имеет преимущества перед известными композициями, поскольку ее можно использовать для изготовления микрокапсул, которые являются более долговечными, чем известные микрокапсулы, и, таким образом, могут обеспечивать более длительную защиту от иммунной системы хозяина, в случае, когда в них инкапсулированы дискордантные клетки. Это продемонстрировано в настоящем документе уменьшенной скоростью разложения in vivo микрокапсул, составленных из композиции по настоящему изобретению. Микрокапсулы также имеют усиленную морфологию поверхности, и их можно вводить в области, которые ранее отличались повышенной склонностью к воспалению, как описано ниже.
В первом аспекте изобретение относится к композиции, включающей в себя альгинат, содержащий приблизительно от 50 до95%, предпочтительно, приблизительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты, и поликатион, не являющийся поли-L-лизином. Предпочтительно, поликарбон представляет собой поли-L-орнитин. В предпочтительном варианте осуществления настоящего изобретения соотношение альгината с высоким содержанием маннуроновой кислоты и поликатиона составляет приблизительно от 5:1 до 10:1, предпочтительно приблизительно 7:1. Помимо этого, композиция по настоящему изобретению может включать в себя хлорид кальция и хлорид натрия. В одном варианте осуществления настоящего изобретения композиция может включать в себя альгинат с высоким содержанием маннуроновой кислоты в концентрации приблизительно от 80 до 90% и предпочтительно приблизительно от 85 до 90% и более предпочтительно приблизительно 87%; поли-L-оринитин в концентрации приблизительно от 10 до 15%, предпочтительно приблизительно 13%; хлорид кальция в концентрации приблизительно менее 1%; и хлорид натрия в концентрации приблизительно менее 1%.
Поликатион, например поли-L-оринитин, присутствует в композиции в относительно чистой форме, причем пределы видов с различной молекулярной массой ограничен, а индекс полидисперсности (т.е., средняя ММ + медиана ММ) составляет менее 1,5, предпочтительно менее 1,2, наиболее предпочтительно менее 1,1.
Во втором аспекте изобретение относится к биологически совместимым микрокапсулам, изготовленным с использованием композиции по настоящему изобретению и включающим в себя ядерный слой из альгината с высоким содержанием маннуроновой кислоты, поперечно сшитой с использованием сшивающего агента, такого как ионы кальция, промежуточный слой из поликатионов, имеющих индекс полидисперсности < 1,2, формирующих полупроницаемую мембрану, и внешний слой из альгината с высоким содержанием маннуроновой кислоты. Ядерный слой и внешний слой могут включать в себя один и тот же или разные альгинаты с высоким содержанием маннуроновой кислоты.
Микрокапсулы могут дополнительно включать в себя живые клетки в ядерном слое. Клетки могут включать в себя нативные или полученные методами генной инженерии клетки, которые могут быть в форме отдельных клеток или клеточных кластеров, выбранные из группы, состоящей из островковых β-клеток, гепатоцитов, нейрональных клеток, таких как клетки хороидного сплетения, гипофизарные клетки, хромаффинные клетки, хондроциты, и любого другого типа клеток, способных секретировать факторы, которые будут пригодными для лечения заболевания или состояния.
В третьем аспекте настоящее изобретение относится к способу изготовления биологически совместимых микрокапсул, включающему в себя этапы:
а) растворение альгината с высоким содержанием маннуроновой кислоты в изотоническом солевом растворе;
b) распыление раствора альгината с этапа а) посредством воздушного или частотного генератора капель в перемешиваемый раствор избыточного количества сшивающего агента, такой как, например, приблизительно от 15 до 120 мМ, более предпочтительно приблизительно от 40 до 110 мМ и еще более предпочтительно приблизительно от 90 до 110 мМ хлорид кальция, в течение приблизительно от 5 до 30 минут, предпочтительно, от 5 до 10 минут, с получением гелевых капсул;
с) нанесение на гелевые капсулы с этапа b) поликатиона, не являющегося поли-L-лизином, имеющего среднюю молекулярную массу 10-40 кДа и индекс полидисперсности < 1,5, в концентрации приблизительно от 0,02 до 0,01% (мас./об.), предпочтительно, 0,05% (мас./об.), в течение приблизительно от 5 до 30 минут (предпочтительно, в течение приблизительно 10 минут);
d) нанесение окончательного покрытия из альгината с высоким содержанием маннуроновой кислоты на капсулу с этапа с) в течение приблизительно от 5 до 30 минут (предпочтительно, в течение приблизительно от 5 до 10 минут); и
е) сбор микрокапсул;
в котором альгинат, используемый на этапах а) и d), представляет собой один и тот же альгинат или различные альгинаты и содержит приблизительно от 50 до 95% остатков маннуроновой кислоты, предпочтительно приблизительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты.
Альгинатный раствор с этапа а) имеет концентрацию альгината приблизительно от 1,0 до 2,0% мас./об.
Альгинатный раствор с этапа d) имеет концентрацию альгината приблизительно от 0,01 до 1,7% мас./об.
В четвертом аспекте настоящее изобретение относится к способу получения микроинкапсулированных клеток, включающему в себя этапы:
а) инкубирование живых клеток с раствором альгината с высоким содержанием маннуроновой кислоты, растворенного в изотоническом солевом растворе;
b) распыление раствора клеток-альгината с этапа а) посредством воздушного или частотного генератора капель в перемешиваемый раствор избыточного количества сшивающего агента, такой как, например, приблизительно от 15 до 120 мМ хлорид кальция (предпочтительно, 110 мМ), в течение приблизительно от 5 до 30 минут (предпочтительно, 5-10 минут), с получением содержащих клетки гелевых капсул;
с) нанесение на содержащие клетки гелевые капсулы с этапа b) поликатиона, имеющего среднюю молекулярную массу 10-40 кДа и индекс полидисперсности <1,5, такого как поли-L-оринтин, в концентрации приблизительно от 0,02 до 0,1% (мас./об.) (предпочтительно, 0,05% мас./об.), в течение приблизительно от 5 до 30 минут (предпочтительно, в течение приблизительно 10 минут);
d) нанесение окончательного альгинатного покрытия на содержащие клетки капсулы с этапа с) в течение приблизительно от 5 до 30 минут (предпочтительно, в течение приблизительно 10 минут); и
е) сбор содержащих клетки микрокапсул;
в котором альгинат, используемый на этапах а) и d), представляет собой один и тот же альгинат или различные альгинаты и содержит приблизительно от 50 до 95% остатков маннуроновой кислоты, предпочтительно приблизительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты, и в котором поликатион не является поли-L-лизином.
Альгинатный раствор с этапа а) имеет концентрацию альгината приблизительно от 1,0 до 2,0% мас./об.
Альгинатный раствор с этапа d) имеет концентрацию альгината приблизительно от 0,01 до 1,7% мас./об.
Пятая особенность настоящего изобретения относится к способу нанесения покрытия на неразлагаемые конструкции для доставки клеток, включающему в себя этапы: а) погружение неразлагаемых конструкций для доставки клеток в раствор альгината, содержащего приблизительно от 50 до 95% остатков маннуроновой кислоты (предпочтительно приблизительно от 50 до 90%, более предпочтительно, приблизительно от 50 до 70% и наиболее предпочтительно приблизительно 60 и 70% маннуроновой кислоты), и изотонического солевого раствора; b) поперечная сшивка остатков маннуроновой кислоты посредством инкубирования с избыточным количеством сшивающего агента, таким как от 15 до 120 мМ раствор хлорида кальция (предпочтительно, 110 мМ), в течение приблизительно от 5 до 30 минут (предпочтительно, приблизительно от 5 до 10 минут), с получением гелевого покрытия; с) дополнительное нанесение на гелевые конструкции с этапа b) поликатиона, имеющего среднюю молекулярную массу 10-40 кДа и индекс полидисперсности менее 1,5, например поли-L-орнитина, в концентрации приблизительно от 0,02 до 0,1% мас./об. (предпочтительно, 0,05% мас./об.), в течение приблизительно от 5 до 30 минут (предпочтительно, в течение приблизительно 10 минут); d) нанесение окончательного альгинатного покрытия в течение приблизительно от 5 до 30 минут (предпочтительно, приблизительно 10 минут), с получением покрытых иммуноизолирующей мембраной неразлагаемых конструкций для доставки клеток; и е) выделение окончательных покрытых иммуноизолирующей мембраной неразлагаемых конструкций для доставки клеток; в котором поликатион не является поли-L-лизином.
Альгинатный раствор с этапа а) имеет концентрацию альгината приблизительно от 1,0 до 2,0% мас./об.
Альгинатный раствор с этапа d) имеет концентрацию альгината приблизительно от 0,01 до 1,7% мас./об.
В шестом аспекте настоящее изобретение относится к способу инкапсулирования лекарственного средства, представляющего собой малую молекулу, белок или ДНК, включающему в себя этапы: а) диспергирование лекарственного средства в растворе альгината, содержащего большую долю остатков маннуроновой кислоты, растворенного в изотоническом солевом растворе; b) поперечная сшивка остатков маннуроновой кислоты посредством инкубирования с избыточным количеством сшивающего агента, таким как от 15 до 120 мМ раствор хлорида кальция (предпочтительно, 110 мМ), в течение приблизительно от 5 до 30 минут (предпочтительно, приблизительно 10 минут), с получением содержащих лекарственное средство гелевых капсул; с) нанесение на содержащие лекарственное средство гелевые капсулы поликатиона, имеющего среднюю молекулярную массу 10-40 кДа и индекс полидисперсности менее 1,5, например поли-L-оринтина, в концентрации приблизительно от 0,02 до 0,1% мас./об. (предпочтительно, 0,05% мас./об.), в течение приблизительно от 5 до 30 минут (предпочтительно, 10 минут); d) нанесение окончательного альгинатного покрытия на содержащие лекарственное средство капсулы с этапа с) в течение приблизительно от 5 до 30 минут (предпочтительно, приблизительно 10 минут), и е) сбор содержащих лекарственное средство микрокапсул; в котором поликатион не является поли-L-лизином.
Альгинат, используемый на этапах а) и d), представляет собой один и тот же альгинат или различные альгинаты и содержит приблизительно от 50 до95% остатков маннуроновой кислоты, предпочтительно, приблизительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты.
Альгинатный раствор с этапа а) имеет концентрацию альгината приблизительно от 1,0 до 2,0% мас./об.
Альгинатный раствор с этапа d) имеет концентрацию альгината приблизительно от 0,01 до 1,7% мас./об.
В седьмом аспекте настоящее изобретение относится к способу облегчения или лечения заболевания или состояния у животного, включая человека, предусматривающему трансплантацию эффективного количества содержащих клетки микрокапсул по настоящему изобретению указанному животному, в котором указанные клетки секретируют лекарственное средство, которое является эффективным для облегчения или лечения указанного заболевания или состояния.
В восьмом аспекте настоящее изобретение относится к способу облегчения или лечения заболевания или состояния у животного, включая человека, предусматривающему трансплантацию эффективного количества содержащих лекарственное средство микрокапсул по настоящему изобретению указанному животному, в котором указанное лекарственное средство является эффективным для облегчения или лечения указанного заболевания или состояния.
В девятом аспекте настоящее изобретение относится к применению альгината, содержащего приблизительно от 50 до 95% остатков маннуроновой кислоты, и поликатиона для изготовления препарата микрокапсул для применения в случаях алло- и ксенотрансплантации.
Препараты микрокапсул по настоящему изобретению можно вводить субъекту. Термин «субъект», используемый в настоящем документе, означает человека или позвоночное млекопитающее, включая, без ограничения, собаку, кошку, лошадь, корову, свинью, овцу, козу или примата, например обезьяну. Препараты микрокапсул включают в себя клетки, которые секретируют терапевтические агенты, или содержат сами терапевтические агенты, и вводятся в количестве, достаточном для обеспечения субъекту эффективного количества терапевтического агента. Эффективное количество конкретного агента будет зависеть от таких факторов, как тип агента, цель введения, тяжесть заболевания, если осуществляют лечение заболевания, и т.п. Специалисты будут способны определить эффективные количества.
Термин «включающий в себя (содержащий)», используемый в настоящем описании и формуле изобретения, означает «состоящий, по меньшей мере, частично, из»; иначе говоря, при интерпретации пунктов формулы изобретения, включающих указанный термин, признаки, предваряемые указанным термином в каждом пункте, обязательно должны присутствовать, но также могут присутствовать и другие признаки.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение далее будет описано с использованием прилагаемых фигур, на которых:
Фигура 1 показывает белковый ЯМР-спектр альгината при 90°С, на котором пики сдвинуты книзу, благодаря температуре и химической структуре альгината (см. вставку в рамке), с расположением протонов, ответственных за пики ЯМР;
Фигура 2а показывает инфракрасную спектроскопию компонентов материала до инкапсуляции и поглощение карбонильной области с большим увеличением (см. вставку в рамке);
Фигура 2b показывает смеси альгинатов с различными концентрациями поли-L-оринитина (PLO), где выделенная область представляет поглощение амида II PLO;
Фигура 2с показывает количественную инфракрасную спектроскопию, измеряющую соотношение поглощения амида PLO и поглощения альгината.
Фигура 3 показывает фазово-контрастное изображение капсул VPMG с 5-кратным увеличением перед имплантацией;
Фигура 4 показывает фазово-контрастные микрофотографии с 5-кратным увеличением образцов 60-дневных эксплантатов различных типов альгинатов;
Фигура 5 показывает однородность на поперечном срезе (А) и % исходного диаметра (В) для образцов 60-дневных эксплантатов с фигуры 4, средний ISD. (∆) VPMG; (◊) VPLG; (-) pKel; (□) pFlu; (●) pMan;
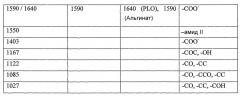
Фигура 6 показывает инфракрасную спектроскопию, пики 1590 см-1 и 1550 см-1 для каждой группы капсул за 90-дневный период исследований;
Фигура 7 показывает индекс стабильности количественной инфракрасной спектроскопии как единицу измерения пика альгината карбоновой кислоты по отношению к амидному пику II орнитина (∆) VPMG; (◊) VPLG; (-) pKel; (□) pFlu; (●) pMan;
Фигура 8 показывает микрофотографии поверхностей лиофилизированных альгинатных капсул для каждого из типов альгината VPMG, VPLG, pKel, pFlu и pMan за 90-дневный период исследований; и
Фигура 9 показывает более сильное увеличение микрофотографии, чтобы показать точечную коррозию поверхности микрокапсулы pKel на 30 день.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе инкапсуляции для живых клеток и лекарственных средств, которая имеет улучшенную биологическую стабильность, когда инкапсулированные клетки и лекарственные средства имплантируют субъекту. Указанная улучшенная биологическая стабильность дает возможность инкапсулированным клеткам и лекарственным средствам оставаться в живом организме в течение более продолжительных периодов времени, чем это происходит в настоящее время, что улучшит доставку лекарственных средств и, таким образом, эффективность лечения.
Система инкапсуляции включает в себя композицию длительного использования в биологическом окружении, включающую в себя альгинат, который имеет высокое содержание маннуроновой кислоты.
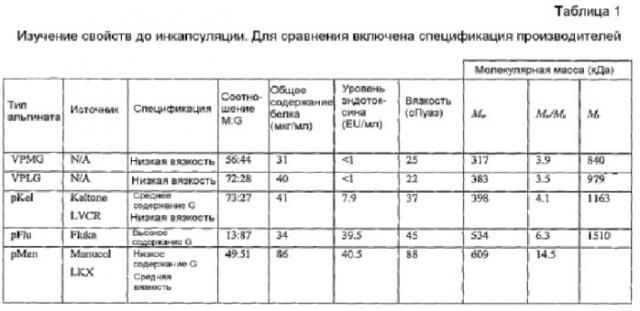
Альгинат представляет собой полисахарид, состоящий из гулуроновой (G) и маннуроновой (М) кислоты, связанных посредством (1,4)-α- и -β-гликозидных связей (см. вставку в рамке на фигуре 1). Соотношение указанных мономеров вносит свой вклад непосредственно в конкретные физические характеристики полисахарида. Впервые было установлено, что после катионной поперечной сшивки альгинаты с высоким содержанием G, благодаря более сетчатой структуре, возникающей из-за α(1-4) связей, являются более хрупкими, с более высоким модулем упругости, в то время как те, у которых имеется высокое содержание М, с более линейными β(1-4) связями, демонстрируют пониженную трехмерную сшивку и более высокую упругость и образуют очень стабильные при испытании in vivo микрокапсулы.
Таким образом, настоящее изобретение относится к композиции, включающей в себя альгинат с высоким содержанием маннуроновой кислоты, конкретно, содержащий приблизительно от 50 до 95% остатков маннуроновой кислоты, и поликатион, не являющийся поли-L-лизином и имеющий среднюю молекулярную массу 10-40 кДа и индекс полидисперсности < 1,5. Предпочтительно, поликатион представляет собой поли-L-оринитин. Предпочтительно, альгинат с высоким содержанием маннуроновой кислоты содержит приблизительно от 50 до 90% остатков маннуроновой кислоты, более предпочтительно приблизительно от 50 до 70% остатков маннуроновой кислоты и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты. В предпочтительном варианте осуществления настоящего изобретения массовое соотношение альгината с высоким содержанием маннуроновой кислоты и поликатиона составляет приблизительно от 5:1 до 10:1, предпочтительно приблизительно 7:1. Кроме того, композиция по настоящему изобретению может включать в себя хлорид кальция и хлорид натрия. Предпочтительно, композиция включает в себя альгинат с высоким содержанием маннуроновой кислоты в концентрации приблизительно от 80 до 90%, предпочтительно приблизительно 87%, поли-L-орнитин в концентрации приблизительно от 10 до 15%, предпочтительно приблизительно 13%, хлорид кальция в концентрации менее приблизительно 1% и хлорид натрия в концентрации менее приблизительно 1%.
Средняя молекулярная масса альгината составляет более приблизительно 400 кДа, предпочтительно более приблизительно 600 кДа.
Альгинат с высоким содержанием маннуроновой кислоты, используемый в пропорциях по настоящему изобретению, может включать в себя глюкуроновую кислоту в количестве приблизительно от 10 до 40%. Таким образом, соотношение M:G в альгинате, пригодном для настоящего изобретения, составляет приблизительно от 1,25:1 до 9,5:1.
Источник альгината очищен и содержит менее 1 эндотоксиновой единицы/мл 1,7% (мас./об.) альгината. Примеры имеющихся в продаже альгинатов, пригодных для использования в настоящем изобретении, включают в себя Keltone LVCR и Pronova SLM20. Однако любой другой альгинат с подходящим высоким содержанием маннуроновой кислоты (или подходящими соотношениями M:G) можно использовать в качестве исходного материала для использования в настоящем изобретении.
Альгинат может иметь рН 7,0±0,4 после растворения в 1,7% (мас./об.) солевом растворе.
Молекулярная масса поликатиона также играет важную роль в структурном и функциональном составе микрокапсул по настоящему изобретению. Впервые было установлено, что при использовании поликатиона, имеющего индекс полидисперсности менее приблизительно 1,2, более предпочтительно менее приблизительно 1,1, вместе с альгинатом с высоким содержанием маннуроновой кислоты можно получить превосходные микрокапсулы, которые имеют высокую стабильность и могут оставаться in vivo в течение длительных периодов времени, и, с определенностью, более одного месяца.
При использовании поликатионных агентов, имеющих высокий индекс полидисперсности и, таким образом, включающих в себя широкий ряд видов ММ, как было показано, получают худшие по качеству микрокапсулы. Полагают, что это происходит из-за более крупных по ММ молекул, которые неспособны диффундировать в альгинатное покрытие, что приводит к образованию слабого покрытия. Более маленькие по ММ молекулы, с другой стороны, могут диффундировать слишком быстро в альгинатное покрытие и могут проникать в ядерный слой и вытеснять из него клетки или гранулы. Поликатион с ограниченным рядом видов ММ, как было показано, обеспечивает получение превосходных микрокапсул.
Например, когда поликатион представляет собой поли-L-оринитин, предпочтительная средняя ММ поликатиона составляет приблизительно от 10 до 40 кДа, более предпочтительно приблизительно от 15 до 30 кДа и наиболее предпочтительно приблизительно 20-25 кДа.
Предпочтительно, поли-L-оринитин будет содержать < приблизительно 20% молекул, имеющих ММ 10 кДа или менее, и, более предпочтительно, < приблизительно 10% молекул, имеющих ММ 10 кДа или менее.
Изобретение относится также к биологически совместимым микрокапсулам, изготовленным с использованием композиции по настоящему изобретению и включающим в себя ядерный слой из альгината с высоким содержанием маннуроновой кислоты, сшитого катионным сшивающим агентом, промежуточный слой поликатионов, имеющих индекс полидисперсности менее приблизительно 1,2, образующий полупроницаемую мембрану, и внешний слой из альгината с высоким содержанием маннуроновой кислоты.
Альгинат с высоким содержанием маннуроновой кислоты может включать в себя приблизительно от 50 до 95% остатков маннуроновой кислоты, предпочтительно приблизительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты.
Альгинат, используемый в ядерном слое и во внешнем слое, может быть одним и тем же или это могут быть разные альгинаты.
Ядерный слой может включать в себя альгинат, состоящий из 50-70% остатков маннуроновой кислоты, а внешний слой может включать в себя альгинат, состоящий из 10-40% остатков глюкуроновой кислоты.
Катионный сшивающий агент может быть выбран из группы, состоящей из Ag+, Al3+, Ba2+, Ca2+, Cd2+, Cu2+, Fe2+, Fe3+, H+, K+, Li+, Mg2+, Mn2+, Na+, NH4+, Ni2+, Pb2+, Sn2+ и Zn2+. Предпочтительно, катионный сшивающий агент представляет собой хлорид кальция. Сшивающий агент предпочтительно находится в избытке, например, от 15 мМ до 120 мМ хлорида кальция. Более предпочтителен 110 мМ хлорид кальция.
Поликатионный агент может быть выбран из группы, состоящей из глутамата хитозана, хитозангликоля, модифицированного декстрана, лизоцима, поли-L-орнитина, сальмин-сульфата, протамин-сульфата, полиакрилимида, сополимера полиакрилимида и бромида метакрилоксиэтилтриметиламмония, полиаллиламина, полиамида, полиамина, полибрена, сополимера полибутилакрилата и бромида метакрилоксиэтилтриметиламмония (80/20), хлорида поли-3-хлор-2-гидроксипропилметакрилоксиэтилдиметиламмония, полидиаллилдиметиламмония, хлорида полидиаллилдиметиламмония, сополимера хлорида полидиаллилдиметиламмония и акриламида, сополимера хлорида полидиаллилдиметиламмония и N-изопропилакриламида, сополимера полидиметиламина и эпихлоргидрина, сополимера полидиметиламиноэтилакрилата и акриламида, полидиметиламиноэтилметакрилата, полиэтиленимина, модифицированного полиэтиленимин-эпихлоргидрина, полиэтиленимина, хлорида поли-2-гидрокси-3-метакрилоксипропилтриметиламмония, поли-2-гидрокси-3-метакрилоксиэтила, хлорида триметиламмония, хлорида полигидроксипропилметакрилоксиэтилдиметиламмония, полиимидазолина (четвертичного), бромида поли-2-метакрилоксиэтилтриметиламмония, бромида/хлорида полиметакрилоксиэтилтриметиламмония, сополимера полиметилдиэтиламиноэтилметарилата и акриламида, бромида поли-1-метил-2-винилпиридиния, бромида поли-1-метил-4-винилпиридиния, сополимера полиметилена и гидрохлорида гуанидина, поливиниламина, сополимера поли-N-винилпирролидона и диметиламиноэтилметакрилата и хлорида поли-4-винилбензилтриметиламмония.
Предпочтительно, поликатионный агент представляет собой поли-L-орнитин в концентрации от 0,02 до 0,1% мас./об.
Поли-L-орнитин предпочтительно очищают для удаления видов с более высокой или низкой ММ, чтобы получить индекс полидисперсности предпочтительно менее 1,1. Конкретно, средняя ММ для поликатионного агента поли-L-орнитина составляет от 10 до 40 кДа, более предпочтительно от 15 до 30 кДа и наиболее предпочтительно приблизительно от 20 до 25 кДа. Любые молекулы с молекулярной массой менее 10 кДа и более 40 кДа можно удалить диализом и другими известными способами. Предпочтительно, поли-L-орнитин, используемый в настоящем изобретении, включает в себя менее приблизительно 20% молекул, имеющих ММ 10 кДа или менее, и более предпочтительно менее 10% молекул, имеющих ММ 10 кДа или менее.
Промежуточный слой, который формируют из поликатионов вокруг ядерного слоя, включает в себя полупроницаемую мембрану толщиной приблизительно от 10 до 80 мкм.
Альгинат ядерного слоя может быть твердым или может быть деполимеризован хелатирующим агентом с образованием полого ядра. Примерами подходящих хелатирующих агентов являются цитрат натрия и EDTA.
Полагают, что хелатирование альгинатного ядра (дежелатинизация) солюбилизирует внутреннюю структурную поддержку капсулы, что неблагоприятно влияет на долговечность микрокапсулы. Ранее указанная проблема была решена тем, что не осуществляли этап хелатирования так, что ядро оставалось твердым (см., например, патент США № 6 365 385). Однако использование альгината с высоким содержанием маннуроновой кислоты в микрокапсулах по настоящему изобретению, вместе с использованием поликатиона, имеющего индекс полидисперсности менее 1,2, значимо увеличивает долговечность микрокапсул, даже если ядро превращено в жидкость хелатированием. Микрокапсулы по настоящему изобретению могут также иметь твердое ядро для дополнительного повышения стабильности и долговечности.
Массовое соотношение ядерного слоя альгината и поликатионного агента составляет приблизительно от 7:1 до 8:1.
Массовое соотношение внешнего слоя альгината и поликатионного агента составляет приблизительно от 1,2:1 до 1,4:1.
Полученные микрокапсулы набухают приблизительно на 10% или более по объему, когда их помещают in vitro в физиологические условия приблизительно на один месяц или более. Набухание микрокапсул, как полагают, вызывается избытком двухвалентных катионов, которые обеспечивают осмотический градиент, приводящий к поглощению воды. Это может представлять собой проблему и приводит к деградации микрокапсул. Указанную проблему можно преодолеть ликвидацией избытка катионов с использованием анионов (как, например, в патенте США № 6 592 886). Однако в настоящем изобретении использование альгината с высоким содержанием маннуроновой кислоты вместе с использованием поликатионного агента, имеющего индекс полидисперсности менее 1,2, обеспечивает меньший избыток катионов, и микрокапсулы по настоящему изобретению имеют высокую стабильность и меньшую вероятность деградации, хотя, как было описано, имеет место некоторое ограниченное набухание.
Поверхность микрокапсулы после формирования является нейтральной в ионном отношении.
Микрокапсулы могут дополнительно включать в себя живые клетки внутри ядерного слоя. Клетки могут включать в себя нативные или полученные методами генной инженерии клетки, которые могут быть в форме отдельных клеток и/или клеточных кластеров, выбранные из группы, состоящей из островковых β-клеток, гепатоцитов, нейрональных клеток, таких как клетки хороидного сплетения, гипофизарные клетки, хромаффинные клетки, хондроциты, и любого другого типа клеток, способных секретировать факторы, которые будут пригодными для лечения заболевания или состояния.
Например, клетки могут представлять собой островковые клетки, способные секретировать инсулин, пригодный для лечения диабета.
Клетки могут, альтернативно, включать в себя гепатоциты и клетки, не являющиеся гепатоцитами, способные секретировать секреторные факторы печени, пригодные для лечения заболеваний или нарушений функции печени.
Клетки могут, альтернативно, включать в себя нейрональные клетки, такие как клетки хороидного сплетения, гипофизарные клетки, хромаффинные клетки, хондроциты, и любые другие клетки, способные секретировать нейрональные факторы, пригодные для лечения нейрональных заболеваний, таких как болезнь Паркинсона, болезнь Альцгеймера, эпилепсия, болезнь Хантингтона, инсульт, заболевание моторных нейронов, боковой амиотрофический склероз (ALS), рассеянный склероз, старение, сосудистое заболевание, синдром курчавых волос Менкеса, болезнь Вильсона, травма или повреждение нервной системы.
Микрокапсулы по настоящему изобретению могут иметь диаметр от 50 до 2000 микрон. Предпочтительно, микрокапсулы имеют диаметр приблизительно от 100 до 1000 микрон и более предпочтительно приблизительно от 500 до 700 микрон.
Ожидается, что микрокапсулы по настоящему изобретению будут способны оставаться функциональными in vivo в организме субъекта в течение значительного периода времени и, с определенностью, в течение периодов времени, превышающих один месяц.
Функциональную долговечность микрокапсул можно контролировать одним или более из следующих способов:
путем варьирования полидисперсности ряда альгинатов, используемых во внутреннем и/или внешнем слоях микрокапсулы;
путем варьирования общего содержания белка во внутреннем и/или внешнем альгинатных слоях;
путем индуцирования кальцификации альгинатных слоев;
путем варьирования пределов и распределения молекулярной массы поликатионного агента;
путем варьирования концентрации поликатионного непрореагировавшего контаминанта с концентрациями приблизительно от 0,01 до 0,25% (мас./мас.);
путем варьирования однородности концентрации поликатиона, что создает градиент вдоль промежуточного слоя микрокапсулы;
путем варьирования количества взаимодействия клетка-поверхность нанесением покрытия на внешнюю поверхность из ингибирующих агентов, таких как поверхностно-активные агенты, включая типы Рluronic F127, антифиброзных агентов и других подходящих агентов.
Настоящее изобретение также относится к способу изготовления биологически совместимых микрокапсул по настоящему изобретению, включающему в себя этапы:
а) растворение альгината с высоким содержанием маннуроновой кислоты в изотоническом солевом растворе;
b) распыление раствора альгината с этапа а) посредством воздушного или частотного генератора капель в перемешиваемый раствор избыточного количества сшивающего агента в течение приблизительно 5-30 минут (предпочтительно, от 5 до 10 минут), с получением гелевых капсул;
с) нанесение на гелевые капсулы с этапа b) поликатиона, имеющего среднюю молекулярную массу 10-40 кДа и индекс полидисперсности менее приблизительно 1,5, такого как поли-L-орнитин, в концентрации от 0,01 до 0,2% мас./об. (предпочтительно, 0,05% мас./об.), в течение 5-30 минут (предпочтительно, 10 минут);
d) нанесение окончательного покрытия из альгината с высоким содержанием маннуроновой кислоты на капсулу с этапа с) в течение приблизительно 5-30 минут (предпочтительно, в течение приблизительно от 5 до 10 минут); и
е) сбор микрокапсул;
в котором альгинат с высоким содержанием маннуроновой кислоты, используемый на этапах а) и d), представляет собой один и тот же альгинат или различные альгинаты и содержит приблизительно от 50 до 95% остатков маннуроновой кислоты, предпочтительно от 50 до 90%, более предпочтительно приблизительно от 50 до 70% и наиболее предпочтительно приблизительно от 60 до 70% остатков маннуроновой кислоты, и в котором поликатион не является поли-L-лизином.
Альгинатный раствор с этапа а) имеет концентрацию альгината приблизительно от 1,0 до 2,0% мас./об.
Альгинатный раствор с этапа d) имеет концентрацию альгината приблизительно от 0,01 до 1,7% мас./об.
Сшивающий агент может быть выбран из группы, перечисленной выше, и предпочтительно представляет собой хлорид кальция в концентрации приблизительно 110 мМ.
Окончательное альгинатное покрытие предпочтительно содержит приблизительно от 10 до 40% остатков глюкуроновой кислоты.
Альгинат я