Средство "гепатобиол", обладающее гепатопротекторным действием
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой средство, обладающее гепатопротекторным действием, на основе биомассы бактерий и продуктов их метаболизма, отличающееся тем, что в качестве биомассы бактерий оно содержит бактериальные клетки Bacillus subtilis штамм 3/28 (59Т) в количестве (1-3)·109 кл·см-3, а также содержит метаболиты бактериальных клеток Bacillus subtilis штамм 3/28 (59Т), полученные путем стерилизующей фильтрации культуральной жидкости, и глицерин, ароматизатор и воду, при этом компоненты средства находятся в определенном соотношении в мас.%. Изобретение обеспечивает хорошую всасываемость в желудочно-кишечном тракте, способность нормализовать биохимические функции печени, предупреждать образование высокоактивных токсических и повреждающих клетки соединений, или способность связывать такие соединения, обладает противовоспалительными и иммуномодулирующими свойствами, а также способностью стимулировать регенеративные и препаративные процессы в печени, является не токсичным. 1 табл., 2 ил.
Реферат
Изобретение относится к медицине и может быть использовано для производства лекарственных средств, обладающих гепатопротекторным действием.
Известно средство, обладающее гепатопротекторным действием, на растительной основе, содержащее в качестве активного ингредиента экстракт из плодов расторопши пятнистой или экстракт из листьев артишока полевого, или экстракт из семян тыквы и активные бактерии нормофлоры кишечника в виде бифидобактерий или лактобактерий или их смесь, сорбированные на носителе (патент РФ №2310463, МКИ А61К 35/74, 2007 г.). В качестве бактерий средство содержит штамм Bifidobaterium bifidum №1 или штамм Lactobacillus fermentum 90ОT-C4 или вдс смесь. Известное средство нормализует функции и обменные процессы печени, способствует нормализации биоценоза желудочно-кишечного тракта.
Однако недостатком известного средства является использование штаммов Bifidobaterium bifidum №1 и Lactobacillus fermentum 90ОT-C4, поскольку эти штаммы проявляют свое действие в основном в просвете кишечника, вследствие чего их биодоступности к клеткам печени не высока. Кроме того, известное средство представлено в двух капсулах, что влечет раздражение слизистых желудочно-кишечного тракта и создает затруднения при приеме средства.
Известен гепатопротектор и фармакологическая композиция на его основе (патент РФ №2290941, МКИ А61К 35/74, 2007 г.). В качестве гепатопротектора применяют биомассу лактобактерий Lactobacillus acidophilus и продукты их метаболизма. Известная фармакологическая композиция содержит биомассу указанных бактерий, а также микрокристаллическую целлюлозу, стеарат кальция или магния, аэросил и арабиногалактан в определенном соотношении компонентов. Композиция обладает антитоксической активностью и способствует повышению устойчивости организма к бактериальным эндотоксинам, вследствие чего она может быть использована для профилактики и лечения острых токсических поражений печени, включая алкогольную интоксикацию.
Однако недостатком известной фармакологической композиции на основе биомассы лактобактерий Lactobacillus acidophilus и продуктов их метаболизма являются низкий уровень антагонистической активности в отношении различных видов условно-патогенных и патогенных микроорганизмов, незначительное количество и сравнительно невысокий уровень активности продуцируемых этими микроорганизмами биологически активных веществ и их недостаточно выраженное разнообразие.
Таким образом, перед авторами стояла задача разработать эффективное средство с выраженным гепатопротекторным действием, обладающее совокупностью следующих свойств:
- хорошей всасываемостью в желудочно-кишечном тракте;
- способностью нормализовать биохимические функции печени;
- способностью предупреждать образование высокоактивных токсических и повреждающих клетки соединений или способностью связывать такие соединения;
- противовоспалительными и иммуномодулирующими свойствами;
- способностью стимулировать регенеративные и репаративные процессы в печени;
- отсутствием токсичности.
Поставленная задача решена путем применения предлагаемого средства "Гепатобиол", обладающего гепатопротекторным действием, на основе биомассы пробиотических бактерий и продуктов их метаболизма, которое в качестве биомассы бактерий содержит бактериальные клетки штамма Bacillus subtilis 3/28 (59Т) в количестве (1-3)·109 KOE·см-3 и дополнительно содержит глицерин, пищевой аромати-затор и воду при следующем соотношении, мас.%:
| бактериальные клетки штамма | |
| Bacillus subtilis 3/28 (59Т) | 3÷5 |
| метаболиты бактериальных клеток | |
| Bacillus subtilis 3/28 (59Т) | 3÷5 |
| глицерин, хч | 10÷15 |
| пищевой ароматизатор | 0,05÷0,1 |
| дистиллированная вода | остальное |
В настоящее время из патентной и научно-технической литературы не известно лечебное средство, обладающее гепатопротекторным действием, которое на основе биомассы бактерий содержит бактериальные клетки штамма Bacillus subtilis 3/28 (59Т) и дополнительно содержит глицерин, ароматизатор и воду в предлагаемом соотношении ингредиентов.
Разработка новых высокоэффективных гепатопротекторных препаратов для лечения и профилактики токсических поражений печени различной этиологии представляет собой актуальную задачу современной практической медицины. Воздействие на организм человека неблагоприятных экологических, климатических, социальных (алкоголизация населения, бытовые отравления и др.) и профессиональных факторов, а также неблагополучная эпидобстановка могут приводить к нарушению функций ряда органов и систем макроорганизма (в том числе гепатобилиарной системы детоксикации), что обусловливает, в конечном итоге, рост заболеваемости и смертности. Так, заболевания гепатобилиарной системы являются одной из наиболее распространенных патологий органов пищеварения, имеющих в настоящее время выраженную тенденцию к росту.
Гепатопротекторы представляют собой фармакологическую группу лекарственных средств, которые обладают избирательным защитным действием в отношении печени. Их системное действие направлено на восстановление гомеостаза в органе, повышение устойчивости гепатоцитов к воздействию патогенных факторов, нормализацию функциональной активности и стимуляцию репаративно-регенерационных процессов в печени. Авторами предлагается новое лечебное средство "Гепатобиол", обладающее гепатопротекторным действием, на основе пробиотических микроорганизмов рода Bacillus и комплекса продуцируемых ими биологически активных веществ (протеины, аминокислоты, нуклеиновые кислоты, витамины, α-интерферон, антибиотики, ферменты и др.). Механизм гепатозащитного действия средства заключается в его положительном действии на репаративную функцию клеточной ткани печени за счет стимулирования синтеза рибосомальной РНК и активизации общего клеточного обмена веществ. Кроме того, препарат снижает в сыворотке крови уровень трансамитаз, уменьшает клеточную дегенерацию и токсическое поражение печени. Средство обладает и мембраностабилизирующим действием, восстанавливает поврежденные мембраны клеток и, возможно, предохраняет их от аутоиммунной агрессии.
Основой предлагаемого средства являются аэробные споровые клетки пробиотического штамма Bacillus subtillis 3/28 (59Т), который находится официально на хранении в музейной коллекции филиала ФГУ "48 ЦНИИ МО РФ - ЦВТП БЗ" с 2004 года и систематически репродуцируется. Клетки - аэробные спорообразующие грамположительные палочки. На питательных средах клеточная культура растет обильно, образуя через сутки большие до 15-20 мм в диаметре желтовато-бежевые шероховатые колонии с выростами, край колоний волнистый, колонии в агар не врастают, легко снимаются петлей. В жидких средах культура клеток образует плотную пленку с ярко выраженной складчатостью, бульон в течение всего срока культивирования остается прозрачным, при встряхивании пленка плохо разбивается. В мазках из суточной культуры, выращенной на среде Гаузе 2, обнаруживаются прямые палочковидные клетки размером 2,3-2,3×0,9-1,2 мкм, располагающиеся одиночно или в виде коротких цепочек. Клетки подвижные, содержат центрально расположенные споры овальной формы. При спорообразовании клетки не раздуваются. Культура не растет в анаэробных условиях. Диапазон рН для роста 6,5-7,5; оптимальная температура 32°С. Продуцирует каталазу, реакция Фогес-Проскуэра положительная, хорошо растет в присутствии 7% NaCl. Гидролизует крахмал, казеин, желатину разжижает медленно, не разлагает мочевину, не образует сероводород и индол. Нитраты восстанавливает, цитрат натрия не утилизирует. Ферментирует с образованием кислоты без газа глюкозу, сахарозу, фруктозу. Галактозу и мальтозу не использует. Не обладает лецитиназной и коагулазной активностью, не нуждается для роста в аминокислотах и витаминах. Культура обладает выраженной ферментативной активностью, характеризуется высокой антагонистической активностью по отношению к различным видам патогенных и условно-патогенных микроорганизмов. Антагонистические свойства штамма, выявленные с помощью метода перпендикулярных штрихов на агаризированной среде Гаузе 2, в отношении тест-культур составляют: Е.Coli 6-8 мм, S.typhimurium 8-10 мм, S.aureus 13-16 мм, P.aeruginosa 6-8 мм, С.albicans 5-10 мм. Штамм является продуцентом биоспорицина. Не является генетически модифицированным. Согласно классификации микроорганизмов, приведенных в Санитарных правилах СП 1.2.731-99, штамм относится к микроорганизмам, непатогенным для человека, и поэтому работа с ним не требует специальных мер предосторожности.
В предлагаемом техническом решении авторами разработана жидкая лекарственная форма гепатопротекторного средства для перорального применения, включающая действующее начало и дополнительные вспомогательные вещества (глицерин, ароматизатор и дистиллированная вода). При разработке состава предлагаемого средства авторами учитывались рекомендации национальных и международных органов контроля медицинских иммунобиологических препаратов.
На основании этих рекомендаций были обоснованы следующие требования к разработанному средству:
- жидкая лекарственная форма средства "Гепатобиол" не должна снижать терапевтическую эффективность основного действующего начала, нарушать физиологические функции слизистых, изменять свои физико-химические свойства под воздействием таких факторов внешней среды как кислород, влажность и др., а также вызывать аллергические реакции, оказывать токсическое, раздражающее и сенсибилизирующее действие на макроорганизм;
- жидкая лекарственная форма средства "Гепатобиол" должна обладать устойчивостью к возможному деструктивному действию входящих в ее состав микроорганизмов, способностью сохранять жизнеспособность микробных клеток в композиции, возможность продуцирования ими биологически активных веществ, а также препятствовать контаминации их посторонней микрофлорой.
Для обеспечения максимального фармакотерапевтического эффекта предлагаемого гепатопротекторного средства авторами были проведены экспериментальные исследования, обосновывающие его качественный и количественный ингредиентный состав.
С целью определения оптимальной концентрации клеток Bacillus subtillis в составе предлагаемого средства была изучена антагонистическая активность суспензии спор бацилл в разных концентрациях на рост тест-культур. При этом оптимальная концентрация Bacillus subtilis составляет (1-3)·109 КОЕ·см-3. Уменьшение или дальнейшее увеличение количества живых микробных клеток в составе биокомпонента существенно не влияет на величину его антагонистической активности, которая отражает функционально-матаболический потенциал бактерий в целом. Кроме того, исследования по оценке цитопротекторного действия БАВ (протеины, аминокислоты, нуклеиновые кислоты, витамины, α-интерферон, антибиотики, ферменты и др.), входящих в состав стерильного фугата, полученного из культуральной жидкости штамма Bacillus subtilis 3/28 (59Т), на линию перевиваемых клеток Л-41 и выделенных гепацитов позволили установить, что БАВ в составе фугата штамма не только обладают выраженным цитопротекторным действием, но и положительно влияют на регенеративные способности клеток печени.
В качестве дисперсионной среды для приготовления жидкой лекарственной формы предлагаемого средства использован глицерин, относящийся к группе формообразующих веществ. Как известно, глицерин улучшает адгезионные и консистентные свойства лекарственных препаратов. Путем экспериментальных исследований авторами было установлено количественное содержание глицерина в составе предлагаемого средства, обеспечивающее получение раствора оптимальной концентрации, которая способствует сохранению количества биомассы бактерий в одном и том же объеме. Полученные результаты свидетельствуют, что оптимальной концентрацией является концентрация 10-15% от общего объема, которая обеспечивает вязкость готовой композиции, обусловливающую максимально возможное количество биомассы бактерий на единичный объем раствора. При этом уменьшение содержания глицерина менее 10 мас.% ведет к уменьшению вязкости и, как следствие, к уменьшению в процессе хранения количества биомассы бактерий на единичный объем раствора. При увеличении содержания глицерина более 15 мас.% увеличивается вязкость раствора, что также ведет к уменьшению срока сохранности бактерий.
Для обеспечения аромата в состав лекарственного средства введен ароматизатор, например ароматизатор "Зеленое яблоко", обладающий приятным, легко узнаваемым ароматом. При этом его содержание в количестве 0,5-1,0% от общего объема, придавая приятный аромат предлагаемому средству, не оказывает отрицательного влияния на его лечебно-терапевтические свойства.
Предлагаемое лечебное средство "Гепатобиол", обладающее гепатопротекторным действием, может быть получено следующим образом.
Для выращивания культуры клеток Bacillus subtilis штамма 3/28 (59Т) используют плотную (агаризованную) питательную среду Гаузе 2 (мясопептонный агар), а также мясопептонный бульон. Культуру пробиотических клеток сенной палочки выращивают в ферментах (например, БИОР - 0,1) глубинным способом в жидких питательных средах. Для культивирования сенной палочки используют среду на основе соляно-кислотного гидролизата казеина или панкреатического гидролизата соевой муки с добавлением солей кальция хлорида, сульфатов магния и марганца, хлорида натрия и сульфата железа. Глюкозу и раствор кальция хлорида вносят непосредственно при посеве с соблюдением асептических условий. Выращивание проводят при температуре (37±1)°С. Контроль за развитием культуры клеток осуществляют визуально, путем микроскопии мазков, окрашенных по Цилю-Нильсену. Через 36±4 часов культивирования, что соответствует окончанию стационарной фазы роста, процесс биосинтеза прекращают, культуральную жидкость охлаждают до температуры (12±3)°С. Концентрирование микробной биомассы осуществляют на сепараторе АСГ-3.
Получение комплекса биологически активных веществ (БАВ), продуцируемых клетками Bacillus subtilis, осуществляют путем стерилизующей фильтрации культуральной жидкости. Культивирование бактериальных клеток Bacillus subtilis проводят глубинным способом на качалке (220 об·мин-1 при 37°С) в течение 30 ч. Посевной материал готовят в концентрации не менее 1·106КОЕ·см-3. В колбы вносят питательную среду, после чего добавляют посевной материал и помещают в качалку. Состав питательной среды:
- панкреатический гидролизат соевой муки (общий азот 120-140 мг/%; аминный азот 20 мг/%);
MgSO4 - 0,1 г·дм-3
NaCl - 1,0 г·дм-3
CaCl - 7,5 мг/%
FeSO4 - 0,001 г·дм-3
глюкоза - 20,0 г·дм-3
дистиллированная вода - до 1,0 дм3
По окончании цикла глубинного культивирования содержимое колб сливают в одну емкость, определяют концентрацию КОЕ в 1,0 см3 культуральной жидкости и помещают ее в холодильник на 24 ч (4±2°С). Перед этапом стерилизующей фильтрации проводят центрифугирование культуральной жидкости на центрифуге ОПН-3 при 3000 об·мин-1 в течение 10 мин. Для получения стерильного фугата монтируют системы для фильтрации и стерилизуют их в автоклаве в стандартном режиме. Вакуумную фильтрацию осуществляют последовательно, через целлюлозные фильтры. Стерильность полученного фильтрата проверяют путем высева на тиогликолевую среду. Срок наблюдения составляет 5 суток. Полученный фугат считают стерильным, если по окончании срока наблюдения не наблюдается рост микрофлоры в указанной среде (замутнение во флаконах).
Далее предлагаемое средство получают смешиванием в расчетных количествах исходных ингредиентов: микробной массы Bacillus subtilis, комплекса биологически активных веществ (метаболитов), продуцируемых этими пробиотическими бактериальными клетками. Далее добавляют глицерин и дистиллированную воду. Все тщательно перемешивают при температуре (12±3)°С в течение 10 мин в смесителе роторного типа. Затем добавляют пищевой ароматизатор, например, "Зеленое яблоко", после чего снова добавляют дистиллированную воду до требуемого объема. Полученную суспензию еще раз тщательно перемешивают в течение 15 мин.
Получают суспензию беловато-серого цвета с запахом и вкусом зеленого яблока со значением рН 7,0-7,54, состав которой соответствует, мас.%:
| бактериальные клетки Bacillus subtilis | |
| штамма 3/28 (59Т) в количестве (1-3)·109 КОЕ·см-3 | 3÷5 |
| метаболиты бактериальных клеток | |
| Bacillus subtilis 3/28 (59Т) | 3÷5 |
| глицерин | 10÷15 |
| ароматизатор | 0,05÷1,0 |
| дистиллированная вода | остальное |
Аттестацию полученного продукта проводят химико-аналитическим методом.
Предлагаемое техническое решение иллюстрируется следующими примерами.
Пример 1. 5 г (5 мас.%) бактериальных клеток Bacillus subtilis штамма 3/28 (59Т) в количестве 1·10 КОЕ·см-3, полученных путем глубинного способа с использованием питательной среды на основе соляно-кислотного гидролизата казеина с добавлением солей кальция хлорида, сульфатов магния и марганца, хлорида натрия и сульфата железа, и 5 г (5 мас.%) метаболитов бактериальных клеток Bacillus subtilis 3/28 (59Т), полученных путем стерилизующей фильтрации культуральной жидкости, смешивают и добавляют 15 г (15 мас.%) глицирина и 50 г дистиллированной воды. Все тщательно перемешивают при температуре 12°С в течение 10 мин. в смесителе роторного типа. Затем добавляют 0,05 г (0,05 мас.%) пищевого ароматизатора "Зеленое яблоко", после чего снова добавляют 24,95 г дистиллированной воды (всего 74,95 мас.%). Полученную суспензию еще раз тщательно перемешивают в течение 15 мин.
Получают суспензию беловато-серого цвета с запахом и вкусом зеленого яблока со значением рН 7,0, состав которой соответствует, мас.%:
| бактериальные клетки Bacillus subtilis | |
| штамма 3/28 (59Т) в количестве 1·109 КОЕ·см-3 | 5; |
| метаболиты бактериальных клеток | |
| Bacillus subtilis 3/28 (59Т) | 5 |
| глицерин | 15 |
| ароматизатор | 0,05 |
| дистиллированная вода | 74,95 |
Пример 2. 3 г (3 мас.%) бактериальных клеток Bacillus subtilis штамма 3/28 (59Т) в количестве 3·109 КОЕ·см-3, полученных путем глубинного способа с использованием питательной среды на основе соляно-кислотного гидролизата казеина с добавлением солей кальция хлорида, сульфатов магния и марганца, хлорида натрия и сульфата железа, и 3 г (3 мас.%) метаболитов бактериальных клеток Bacillus subtilis 3/28 (59Т), полученных путем стерилизующей фильтрации культуральной жидкости, смешивают и добавляют 10 г (10 мас.%) глицирина и 50 г дистиллированной воды. Все тщательно перемешивают при температуре 12°С в течение 10 мин в смесителе роторного типа. Затем добавляют 0,05 г (0,1 мас.%) пищевого ароматизатора "Зеленое яблоко", после чего снова добавляют 33,9 г дистиллированной воды (всего 83,9 мас.%). Полученную суспензию еще раз тщательно перемешивают в течение 15 мин.
Получают суспензию беловато-серого цвета с запахом и вкусом зеленого яблока со значением рН 7,54, состав которой соответствует, мас.%:
| бактериальные клетки Bacillus | |
| subtilis штамма 3/28 (59Т) в количестве 3·109 КОЕ·см-3 | 3 |
| метаболиты бактериальных клеток | |
| Bacillus subtilis 3/28 (59Т) | 3 |
| глицерин | 10 |
| ароматизатор | 0,1 |
| дистиллированная вода | 83,9 |
С целью выявления возможного повреждающего действия на организм предлагаемого гепатопротекторного средства были проведены доклинические токсикологические исследования острой и хронической токсичности.
Острую токсичность определяли на двух видах лабораторных животных (белые мыши и белые крысы) путем внутрижелудочного и внутрибрюшинного введения предлагаемого средства. Средство состава, см. пример 1 вводили однократно в объеме 0,5 см3 двум группам животным по 10 особей в каждой группе. В качестве контроля использовали две группы животных по десять особей в каждой, которым вводили физиологический раствор (0,9% NaCl) в объеме 0,5 см3. Продолжительность наблюдения за животными после введения составляла 7 суток. В процессе наблюдения за животными ежедневно фиксировали следующие показатели: общее состояние животных, двигательную активность, потребление корма и воды, изменение массы тела, а также регистрация гибели животных. В результате изучения острой токсичности предлагаемого средства установлено, что животные всех групп оставались живыми и признаков интоксикации у них не выявлено в течение всего срока наблюдения. В отношении остальных исследуемых показателей животные подопытных групп не отличались от животных контрольных групп.
Согласно полученным данным можно констатировать, что предлагаемое средство в рекомендуемых разовых лечебных дозах при исследуемых путях введения не оказывает токсического действия на экспериментальных животных (белые мыши и белые крысы).
Хроническую токсичность предлагаемого средства изучали на белых мышах при его ежедневном внутрижелудочном и внутрибрюшинном введении в объеме 0,5 см3 на животное (подопытная группа 10 животных) и физиологического раствора в том же объеме (контрольная группа 10 животных) в течение 30 суток. Наблюдения за животными проводили в течение всего периода введения испытуемого средства и последующих 7 суток. На протяжении всего времени животные находились под ежедневным наблюдением, при этом регистрировали потребление корма и воды, изменение массы и температуры тела, состояние волосяного покрова и слизистых оболочек, поведенческие реакции. Также регистрировали выживаемость (гибель) животных.
В результате изучения хронической токсичности установлено, что в течение всего срока наблюдения гибели животных не наблюдалось. При наблюдении за поведением белых мышей после ежедневного применения исследуемого средства не отмечено каких-либо отрицательных изменений. Внешний вид животных подопытной группы, состояние шерстного покрова, интенсивность потребления корма и воды не имели отличий от животных контрольной группы. Динамика изменения массы и температуры тела подопытных мышей за время наблюдения также практически не отличались от таковых в контрольной группе животных.
Экспериментальные данные свидетельствуют о том, что количество форменных элементов крови, лейкоцитарная формула, содержание гемоглобина, скорость оседания эритроцитов у подопытных животных после внутрижелудочного введения предлагаемого средства в течение всего срока наблюдения практически не отличаются от аналогичных показателей у контрольной группы животных и не выходят за пределы нормы.
Морфологические изменения внутренних органов оценивали путем макроскопического осмотра и последующей микроскопии гистологических препаратов на 1 и 7-е сутки после завершения применения средства.
Необходимо констатировать, что на все сроки наблюдения макроскопическая картина внутренних органов подопытных животных была сопоставима с контролем. Также на все сроки наблюдения не выялено и каких-либо патоморфических изменений во внутренних органах подопытных животных.
Таким образом, изучение острой и хронической токсичности предлагаемого средства "Гепатобиола" свидетельствуют об отсутствии у него токсического действия.
Для оценки терапевтической эффективности предлагаемого средства у лабораторных животных моделировали хроническое токсическое поражение печени посредством подкожного введения по 1,0 мл 40%-ного масляного раствора четыреххлористого углерода (CCU) дважды в неделю в течение месяца. Критерием хронического токсического поражения печени являлись следующие морфологические изменения: расширение синусоидальных капилляров и пространства Диссе, жировая дистрофия печеночных клеток, лимфогистиоцитарная инфильтрация стромы печени и очаговые внутридольные бионекротические изменения гепацитов. После развития хронического токсического поражения печени на протяжении 30 суток ежедневно 1 группе подопытных животных вводили внутрижелудочно предлагаемое средство с концентрацией микроорганизмов, входящих в его состав, (1-3)·109 КОЕ в объеме 0,5 см3. В качестве препарата сравнения был выбран широко применяемый и наиболее эффективный из существующих в настоящее время гепатопротекторный препарат урсосан, в состав которого входит урсодеоксихолевая кислота. Препарат сравнения вводили II группе экспериментальных животных. Подопытным животным III группы (контрольная) вводили 0,9% раствор NaCl внутрибрюшинно. Через 3 суток после введения CCl4 в I, II и III группах наблюдали развитие острого токсического гепатита, что подтверждалось патоморфическими исследованиями. Продолжительность наблюдения за животными после начала исследований составляла 30 суток. Забор биологического материала для исследований проводили на 3-и и 30-е сутки после начала лечения предлагаемым средством и препаратом сравнения.
Для подтверждения антитоксических и гепатозащитных свойств предлагаемого средства исследовали выживаемость подопытных животных при однократном внутрижелудочном введении предлагаемого средства и препарата сравнения урсосана на фоне острого токсического гепатита (см. табл.1).
| Таблица 1 | |||||
| Группа животных | Препарат | Количество животных в группе, шт. | Количество павших животных, шт. | Количество выживших животных, шт. | Выживаемость, % |
| I | Предлагаемое средство "Гепатобиол" | 20 | 5,3±0,6 | 14,6±0,3 | 73,2±0,4 |
| II | Урсосан | 20 | 8,3±0,5 | 11,7±0,5 | 58,5±0,5 |
| III (контроль) | - | 20 | 12,6±0,4 | 7,9±0,3 | 39,8±0,2 |
Как видно из представленных в таблице 1 данных, в I группе подопытных животных, которым вводили предлагаемое средство, регистрировали наиболее высокую выживаемость белых мышей - 73,2±0,4%, что выше аналогичного показателя (58,5±0,5) во II группе животных на 14,7% и значительно выше этого показателя в контрольной группе на 33,4%.
Для подтверждения терапевтической эффективности предлагаемого средства оценивали патоморфические изменения печени в группах подопытных животных (I, II и III) путем макроскопического осмотра и последующей микроскопии гистологических срезов органа на 3 и 30-е сутки после воспроизведения модели токсического поражения печени.
Так, на 3-и сутки исследований в группах подопытных животных с воспроизведенной моделью острого токсического гепатита (I, II и III группы) отмечали типичную патоморфологическую картину поражения печеночной ткани. Макроскопически печень была увеличена в объеме, дряблой консистенции, неравномерно полнокровна, на разрезе рисунок долек сглажен, цвет органа пестрый (красно-коричневый).
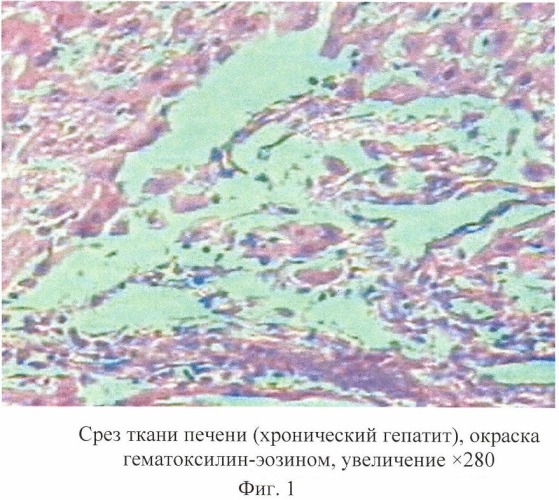
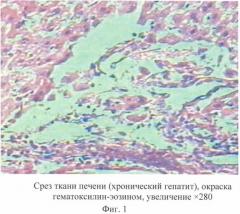
На гистологических срезах выявлены выраженные деструктивные процессы в печеночной ткани, которые проявлялись значительным нарушением цитоархитектоники. Характерной особенностью деструктивного процесса явилось наличие очагов разрушения гепатоцитов, исчезновение границ между гепатоцитами. Нарушение целостности печеночных пластин сопровождалось разрушением синусоидальных гемокапилляров без выраженных признаков кровоизлияний. В кровеносных сосудах долек печени наблюдались явления застоя, что было связано с расширением венозной системы печени. Необходимо также отметить, что наиболее выраженные деструктивные процессы наблюдали в группе животных с воспроизведенной моделью токсического гепатита без лечения (группа III - фиг.1).
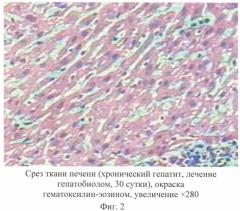
На 30-е сутки исследований в I группе животных, получавших предлагаемое средство, отмечали выраженные позитивные изменения в структуре печеночной ткани. Цитоархитектоника структуры органа была сохранена, соелинительнотканных тяжей не наблюдалось. Дистрофических изменений гепатоцитов не выявлено. Ядра эпителиоцитов и клетки Купфера находились в пределах нормы. Ядра гепатоцитов округлой формы. Хроматин в ядре располагается равномерно, цитоплазма создает четкую границу гепатоцитов и имеет базофильный оттенок. Внутридольковые синусоидальные гемокапилляры умеренного кровенаполнения. Лимфоидная ткань представлена в виде мелких очагов, диффузно расположенных по ходу синусоидных гемокапилляров (фиг.2).
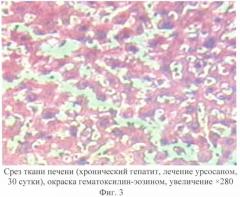
На 30-е сутки исследований во II группе (лечение препаратом сравнения урсосаном) наблюдали редукцию дистрофических и некротических процессов в паренхиме печени, уменьшение лейкоцитарно-макрофагальной инфильтрации печеночной ткани, микроциркуляторных изменений выявлено не было (фиг.3). Макроскопически размеры и цвет органа представляли собой вариант нормы.
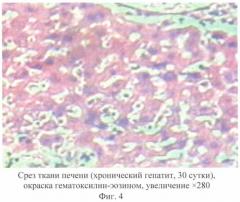
В III группе подопытных животных на 30-е сутки наблюдали патоморфологические проявления острого токсического гепатита, которые оставались без значительных изменений. Имеют место дистрофические и некротические изменения паренхимы печени, выявлены множественные соединительнотканные тяжи, венозное полнокровие, а также лейкоцитарно-макрофагальная инфильтрация (фиг.4). При визуальной оценке органа отмечали увеличение объема печени.
Таким образом, проведенные патоморфологические исследования печени позволяют сделать заключение о нормализации паренхимы органа на 30-е сутки наблюдения при введении животных с острым токсическим гепатитом предлагаемого средства "Гепатобиол".
Результаты проведенных исследований позволяют сделать вывод о том, что предлагаемое гепатопротекторное средство обладает полифункциональным механизмом действия и позволяет эффективно восстанавливать угнетенные функции печени с одновременной нормализацией иммунологических показателей.
Средство, обладающее гепатопротекторным действием, на основе биомассы бактерий и продуктов их метаболизма, отличающееся тем, что в качестве биомассы бактерий оно содержит бактериальные клетки Bacillus subtilis штамм 3/28 (59Т) в количестве (1-3)·109 кл·см-3, а также содержит метаболиты бактериальных клеток Bacillus subtilis штамм 3/28 (59Т), полученные путем стерилизующей фильтрации культуральной жидкости, и глицерин, ароматизатор и воду при следующем соотношении, мас.%:
| бактериальные клетки Bacillus subtilis | |
| штамм 3/28 - В 3679 (59Т) | 3÷5 |
| метаболиты бактериальных клеток Bacillus subtilis | |
| штамм 3/28 - В 3679 (59Т) | 3÷5 |
| глицерин | 10÷15 |
| ароматизатор | 0,05÷0,1 |
| дистиллированная вода | остальное |