Перорально биодоступные пролекарства (+)-3- гидроксиморфинана для профилактики или лечения болезни паркинсона
Иллюстрации
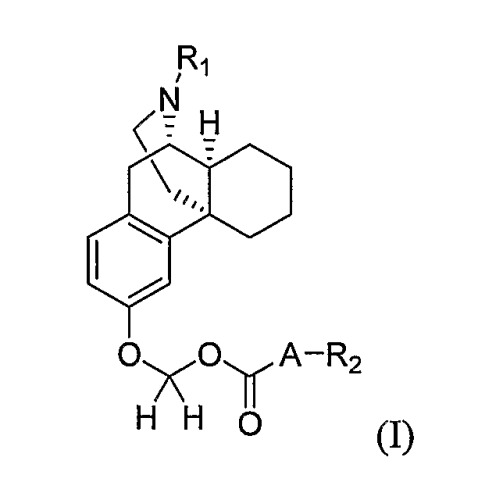
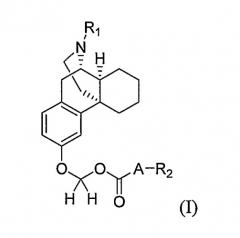
Показать всеНастоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли
где А представляет собой простую связь или кислород; R1 выбирают из группы, включающей водород, -С(O)ОС1-10алкил и -С(O)ОС1-10алкил-фенил; и R2 выбирают из группы, включающей С1-10алкил, (СH2)n-фенил, адамантинил, С1-10алкил, замещенный С3-10карбоциклом, и С3-10карбоцикл, где n имеет значение от 0 до 4. Также изобретение относится к фармацевтической композиции, обладающей нейрозащитным действием, на основе соединения формулы I и к применению данного соединения, для получения лекарственного средства для лечения или профилактики болезни Паркинсона. Технический результат: получены и описаны новые соединения, а также их соли, которые могут быть полезны для профилактики или лечения болезни Паркинсона. 3 н. и 3 з.п. ф-лы, 3 табл., 2 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к перорально биодоступному новому пролекарству (+)-3-гидроксиморфинана, которое является эффективным в качестве нейрозащитного средства для лечения болезни Паркинсона.
Предпосылки создания изобретения
Приблизительно 100 миллионов человек в мире и 800000 человек только в США страдают болезнью Паркинсона (PD).
Болезнь Паркинсона является результатом хронической прогрессивной дегенерации нейронов, причина которой на данный момент полностью не ясна. Хотя основная причина болезни Паркинсона неизвестна, она характеризуется дегенрацией допаминергических нейронов черного вещества (substantia nigra (SN)). Черное вещество является частью нижнего отдела головного мозга или ствола головного мозга, которая помогает контролировать произвольные движения. Полагают, что нехватка допамина в головном мозге, вызванная потерей этих нейронов, вызывает видимые симптомы заболевания. Клинически это проявляется в форме основных симптомов: тремора в состоянии покоя, озноба, замедленности движений и постуральной неустойчивости.
Леводопа, допаминовые агонисты, такие как ротиготин, прамипексол, бромокриптин, ропинирол, каберголин, перголид, апоморфин и лисурид, антихолинергические средства, антагонисты NMDA, β-блокатор, а также ингибитор MAO-B селегилид и ингибитор COMT энтакапон, применяются в качестве лекарственных средств для облегчения двигательных симптомов. Действие большинства из этих средств заключается во вмешательстве в сигнальный каскад допамина и/или холина, и, таким образом, они симптоматически влияют на типичные для болезни Паркинсона двигательные расстройства.
В существующей терапии болезни Паркинсона лечение начинают после возникновения главных симптомов. Как правило, считается, что болезнь Паркинсона является клинически подтвержденной, если наблюдаются, по меньшей мере, два из четырех главных симптомов (замедленность движений, тремор покоя, озноб и постуральная неустойчивость) и ответ на L-допа (Hughes, J Neurol Neurosurg Psychiatry 55, 1992, 181). К сожалению, расстройства двигательной функции у пациентов с болезнью Паркинсона становятся очевидными только после того, как около 70-80% допаминергических нейронов в черном веществе (SN) являются необратимо поврежденными (Becker et al, J Neurol 249, 2002, Suppl 3:111, 40; Hornykiewicz, Encyclopedia of Life Science 2001, 1). В этом момент шансы терапевтического лечения с продолжительным эффектом очень малы. Следовательно, желательно начинать лечение как можно раньше.
Существующие клинические наблюдения, а также анатомические и генетические исследования показывают, что диагностика болезни Паркинсона на ранней стадии и идентификация пациентов с высоким риском возможны. При этом возникает возможность влияния на процесс заболевания в том момент, когда сохраняется бόльшая часть нейронов, а не в момент возникновения некоторых основных двигательных симптомов болезни Паркинсона, и, следовательно, защиты значительно большего количества нейронов. Можно ожидать, что введение эффективного нейрозащитного средства на ранней стадии в значительной степени отсрочит процесс развития заболевания: чем быстрее начнется лечение, тем больше шансов предотвратить на долгое время возникновение симптомов, снижающих качество жизни.
Следовательно, необходимы такие лекарственные средства, которые не только влияют на допаминергическую трансмиссию и облегчают симптомы болезни Паркинсона на поздних стадиях, но также обладают действие по обращению в обратную сторону, предотвращению или, по меньшей мере, существенному замедлению экстинкции допаминергических нейронов на ранней стадии до продвинутой двигательно-асимптоматической стадии болезни Паркинсона (Dawson, Nature Neuroscience Supplement 5, 2002, 1058).
(+)-3-Гидроксиморфинан ((+)-3-HM) и его производные показали нейрозащитное действие в 1-метил-4-фенил-1,2,3,6-тетрагидропиридиновых (MPTP) моделях болезни Паркинсона. В этой животной модели ежедневные инъекции (+)-3-HM или его аналогов показали, что допаминовые (DA) нейроны в черном веществе pars compacta защищены и уровни DA в полосатом теле восстановлены (Патентная публикация США №. 2005-0256147 A1; Международная патентная публикация № WO2005/110412; Zhang et al, FASEB J. 2006 Dec. 20(14):2496-2511; Zhang et al, FASEB J. 2005 Mar. 19(3):395-397; и Kim et al. Life Science 72(2003) 1883-1895). Однако (+)-3-HM и его производные эффективны только, если их вводят интраперитонеально или внутривенно.
Настоящее изобретение относится к получению новых пролекарств (+)-3-гидроксиморфинана, которые являются эффективными в качестве нейрозащитного средства при болезни Паркинсона при их пероральном введении.
Краткое изложение изобретения
Главная цель настоящего изобретения - обеспечить новое пролекарство (+)-3-гидроксиморфинанового соединения формулы (I) или его фармацевтически приемлемую соль, которое является эффективным в качестве нейрозащитного средства для лечения болезни Паркинсона.
Другая цель настоящего изобретения - обеспечить способ получения соединения по настоящему изобретению.
Еще одна цель настоящего изобретения - обеспечить фармацевтическую композицию для лечения или профилактики болезни Паркинсона, включающую в качестве активного ингредиента соединение по настоящему изобретению.
Краткое описание чертежей
Указанные выше и другие цели и отличительные признаки настоящего изобретения станут понятны из следующего далее описания настоящего изобретения, взятого вместе с прилагаемыми далее сопроводительными чертежами, которые соответственно показывают следующее:
Фиг. 1 иллюстрирует фармакокинетический профиль соединения Примера 2 у мышей и
Фиг. 2 иллюстрирует действие введенного интраперитонеально (+)-3-HM и введенного перорально соединения Примера 2 на модели животного с MPTP-индуцированной болезнью Паркинсона.
Подробное описание изобретения
В соответствии с одним аспектом настоящего изобретения, представлено соединение формулы (I) или его фармацевтически приемлемая соль и способ для их получения
где A представляет собой простую связь или кислород;
R1 выбирают из группы, включающей водород, -C(O)OC1-10 алкил, замещенный -C(O)OC1-10 алкил, -C(O)OC1-4 алкил-Ar и замещенный -C(O)OC1-4 алкил-Ar, при этом Ar выбирают из группы, включающей фенил, нафтил, фурил, пиридил, тиенил, тиазолил изотиазолил, пиразолил, триазолил, тетразолил, имидазолил, имидазолидинил, бензофуранил, индолил, тиазолидинил изоксазолил, оксадиазолил, тиадиазолил, морфолинил, пиперидинил, пиперазинил, пирролил и пиримидинил, которые все необязательно замещены одной или несколькими Z группами, где Z независимо выбран из группы, включающей C1-4 алкил, C1-4 алкокси, -(CH2)mC(O)OR3, C(O)NR3R4, -CN, -(CH2)nOH, -NO2, F, Cl, Br, I, -NR3R4 и NHC(O)R3, где m имеет значение от 0 до 4, n имеет значение от 0 до 4, R3 представляет собой водород, C1-6 алкил или замещенный C1-6 алкил, и R4 выбран из группы, включающей C1-6 алкил, замещенный C1-6 алкил, -CH2Ar и Ar, Ar имеет значение, определенное выше; и R2 выбран из группы, включающей C1-10 алкил, замещенный C1-10 алкил, C3-10 карбоцикл, замещенный C3-10 карбоцикл, (CH2)n-фенил и замещенный (CH2)n-фенил, где n имеет значение от 0 до 4.
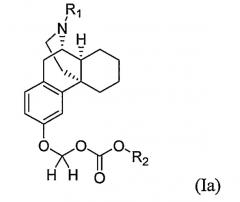
Один вариант воплощения настоящего изобретения включает обеспечение соединения формулы (Ia) или его фармацевтически приемлемой соли
где R1 и R2 имеют такие же значения, как определены выше.
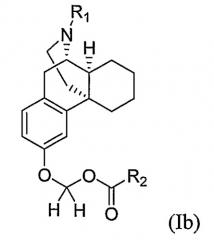
Другой вариант воплощения настоящего изобретения включает обеспечение соединения формулы (Ib) или его фармацевтически приемлемой соли
где R1 и R2 имеют такие же значения, как определены выше.
Предпочтительными соединениями формулы (I) являются такие соединения, в которых R1 представляет собой водород, -C(O)OC1-4алкил-Ar или замещенный -C(O)OC1-4алкил-Ar, Ar представляет собой фенил или нафтил, оба из которых необязательно замещены одной или несколькими Z группами, при этом Z независимо выбран из группы, включающей C1-4 алкил, C1-4 алкокси, -(CH2)mC(O)OR3, C(O)NR3R4, -CN, -(CH2)nOH, -NO2, F, Cl, Br, I, -NR3R4 и NHC(O)R3, где m имеет значение от 0 до 4, n имеет значение от 0 до 4, R3 представляет собой водород, C1-6 алкил или замещенный C1-6 алкил, и R4 выбран из группы, включающей C1-6 алкил, замещенный C1-6 алкил, -CH2Ar и Ar, где Ar имеет значение, определенное выше; и R2 выбирают из группы, включающей C1-10 алкил, замещенный C1-10 алкил, C3-10 карбоцикл, замещенный C3-10 карбоцикл, (CH2)n-фенил и замещенный (CH2)n-фенил, где n имеет значение от 0 до 4.
Как он использован в настоящей заявке, термин "алкил" относится к насыщенному углеводородному радикалу с прямой или разветвленной цепью. Примеры "алкила", как он использован в настоящей заявке, включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил и гексил.
Как он использован в настоящей заявке, термин "замещенный алкил" относится к насыщенному углеводородному радикалу с прямой или разветвленной цепью, который необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей C1-3 алкил, необязательно содержащий от одного до трех фторных заместителей, C2-3 алкенил, C2-3 алкинил, C1-2 алкокси, необязательно содержащий от одного до трех фторных заместителей.
Как он использован в настоящей заявке, термин "карбоцикл" относится к неароматическому циклическому углеводородному радикалу, содержащему от трех до семи атомов углерода, или конденсированному бициклическому углеводородному радикалу, в котором каждый цикл относится к неароматическому циклическому углеводородному радикалу, состоящему из трех-семи атомов углерода. Пяти-семичленные кольца могут содержать двойную связь в кольцевой структуре. Типичные "карбоциклические" группы включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогептил. Типичные "конденсированные бициклические" группы включают, но не ограничиваются этим, декагидронафтил.
Как он использован в настоящей заявке, термин "замещенный карбоцикл" относится к неароматическому циклическому углеводородному радикалу, содержащему от трех до семи атомов углерода, который необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей C1-3 алкил, необязательно содержащий от одного до трех фторных заместителей, C2-3 алкенил, C2-3 алкинил, C1-2 алкокси необязательно содержащий от одного до трех фторных заместителей, арил и арилокси.
Как он использован в настоящей заявке, термин "арил" относится к необязательно замещенному бензольному кольцу или относится к кольцевой системе, которая может являться результатом конденсирования одного или нескольких необязательных заместителей.
Типичные необязательные заместители включают замещенный C1-3 алкил, замещенный C2-3 алкенил, замещенный C2-3 алкинил, гетероарил, гетероциклический арил, алкокси, необязательно содержащий от одного до трех фторных заместителей, арилокси, аралкокси, ацил, ароил, гетероароил, ацилокси и ароилокси. Такое кольцо или кольцевая система, необязательно, могут быть конденсированы с арильными кольцами (включая бензольные кольца), необязательно содержащими один или несколько заместителей, карбоциклическими кольцами или циклическими кольцами. Примеры "арильных" групп включают, но не ограничиваются этим, фенил, нафтил, тетрагидронафтил, бифенил, инданил, антраацил и фенантрил, а также их замещенные производные.
Как он использован в настоящей заявке, термин "алкокси" относится к группе -OR3, где R3 представляет собой алкил, определенный выше. Типичные алкоксигруппы, используемые в настоящем изобретении включают, но не ограничиваются этим, метокси, дифторметокси, трифторметокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси.
Как он использован в настоящей заявке, термин "аралкокси" относится к группе -ORaRb, где Ra представляет собой алкил и Rb представляет собой арил, определенный выше.
Как он использован в настоящей заявке, термин "арилокси" относится к группе -ORb, где Rb представляет собой арил, определенный выше.
Должно быть понятно, что настоящее изобретение также включает фармацевтически приемлемую соль и кислотно-аддитивную соль соединения по настоящему изобретению, такую как гидрохлорид, кислотно-аддитивную соль трифторуксусной кислоты, муравьиной кислоты, лимонной кислоты, фумаровой кислоты, моно-натрий фумарат, пара-толуолсульфоновой кислоты, стеариновой кислоты, ди-натрий цитрат, винной кислоты, яблочной кислоты, молочной кислоты, янтарной кислоты или салициловой кислоты. Соединения по настоящему изобретению могут содержать один или несколько асимметричных атомов углерода и могут существовать в рацемических и оптически активных формах. Все эти соединения и диастереомеры включены в объем настоящего изобретения.
Соединения, особенно полезные в настоящем изобретении, выбирают из группы, включающей:
(+)-Изопропил (морфинан-3-илокси)метилкарбонат;
(+)-(Морфинан-3-илокси)метил пропилкарбонат;
(+)-Циклопропилметил (морфинан-3-илокси)метилкарбонат;
(+)-Циклопентил (морфинан-3-илокси)метилкарбонат;
(+)-Циклогексил (морфинан-3-илокси)метилкарбонат;
(+)-Циклогексилметил (морфинан-3-илокси)метилкарбонат;
(+)-Гептан-4-ил (морфинан-3-илокси)метилкарбонат;
(+)-Декагидронафталин-2-ил(морфинан-3-илокси)метилкарбонат;
(+)-Декагидронафталин-1-ил(морфинан-3-илокси)метилкарбонат;
(+)-Циклопентилметил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Циклобутилметил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-2-Этилгексил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Бутил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Изобутил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-втор-Бутил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Циклогептил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-(Морфинан-3-илокси)метилфенэтилкарбонат.ТФУК;
(+)-(Морфинан-3-илокси)метил 1-фенилпропан-2-илкарбонат.ТФУК;
(+)-Этил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Метил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Циклобутил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Гексил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-(Морфинан-3-илокси)метил пентан-2-илкарбонат.ТФУК;
(+)-Децил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-(Морфинан-3-илокси)метилизобутират;
(+)-(Морфинан-3-илокси)метилпивалат;
(+)-(Морфинан-3-илокси)метилпивалат.ТФУК;
(+)-(Морфинан-3-илокси)метил 3,3-диметилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилгексаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 2-пропилпентаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 2-этилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилциклогексаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилциклопентаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 2-этилгексаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилпентаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 2-метилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метилциклопропанкарбоксилат.ТФУК;
(+)-(Морфинан-3-илокси)метил 3-метилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 2-фенилбутаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 1-адамантанкарбоксилат.ТФУК;
(+)-(Морфинан-3-илокси)метил ацетат.ТФУК;
(+)-(Морфинан-3-илокси)метил 3-циклогексилпропаноат.ТФУК;
(+)-(Морфинан-3-илокси)метил 3,5,5-триметилгексаноат.ТФУК;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат.ТФУК;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль L-(+)-винной кислоты;
(+)-Изопропил (Морфинан-3-илокси)метилкарбонат.HCl;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль муравьиной кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль лимонной кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль фумаровой кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль фумаровой кислоты моно-Na;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль 4-метилбензолсульфоновой кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль стеариновой кислоты;
(+)-Изопропил (Морфинан-3-илокси)метилкарбонат, соль лимонной кислоты ди-Na;
(+)-Изопропил (Морфинан-3-илокси)метилкарбонат, соль L-(-)-яблочной кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль L-(+)-молочной кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль янтарной кислоты;
(+)-Изопропил (морфинан-3-илокси)метилкарбонат, соль салициловой кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль янтарной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат.HCl;
(+)-(Морфинан-3-илокси)метилпивалат, соль муравьиной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль лимонной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль фумаровой кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль фумаровой кислоты моно-Na;
(+)-(Морфинан-3-илокси)метилпивалат, соль 4-метилбензолсульфоновой кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль стеариновой кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль лимонной кислоты ди-Na;
(+)-(Морфинан-3-илокси)метилпивалат, соль L-(+)-винной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль L-(-)-яблочной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль L-(+)-молочной кислоты;
(+)-(Морфинан-3-илокси)метилпивалат, соль салициловой кислоты;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилизопропилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклопентилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклогексилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилдекагидронафталин-1-илкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклопентилметилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклобутилметилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-этилгексилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилбутилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилизобутилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил втор-бутилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклогептилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилфенэтилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 1-фенилпропан-2-илкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилэтилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилметилкарбонат;
(+)-[N-(Бензилоксикарбонил)Морфинан-3-илокси] метилциклобутилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилгексилкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил пентан-2-илкарбонат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилизобутират;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метилпивалат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метилгексаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-пропилпентаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-этилбутаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклогексаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси] метилциклопентаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-этилгексаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метилбутаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метилпентаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-метилбутаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил циклопропанкарбоксилат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 3-метилбутаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил 2-фенилбутаноат;
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил
1-адамантанкарбоксилат и
(+)-[N-(Бензилоксикарбонил)морфинан-3-илокси]метил
3,5,5-триметилгексаноат.
Общий синтез соединений формулы (I)
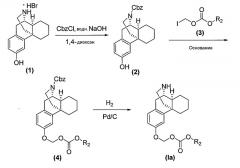
Соединение формулы (Ia) можно получить, например, путем (i) взаимодействия гидробромида (+)-3-гидроксиморфинана ((+)-3-HM) (1) с CbzCl в водном растворе NaOH, с получением (+)-N-17-Cbz-3-гидроксиморфинана формулы (2), и (ii) алкилирования полученного продукта с использованием йодметилалкилкарбоната (3) в присутствии подходящего основания, такого как карбонат цезия, или гидрид натрия, или DBU, с получением алкилфеноксиметилкарбоната формулы (4), и в конце (iii) удаления защитной группы N-17-Cbz у полученного продукта с получением соединения формулы (Ia), как показано на Схеме реакции 1.
Схема реакции 1
где R2 имеет те же значения, как определено выше.
Йодметилалкилкарбонатное производное (3), используемое в качестве исходного вещества в получении соединения формулы (Ia), можно получить обычным способом, например, путем обработки хлорметилового эфира хлормуравьиной кислоты (5) спиртом в безводном простом эфире с органическим основанием, таким как пиридин или DMAP, с получением соответствующего хлорметилалкилкарбоната (6), взаимодействия полученного продукта с йодидом натрия в подходящем растворителе, таком как ацетон или ацетонитрил, с получением соответствующего йодметилалкилкарбоната (3) (см. Rigel Pharmaceuticals, Inc., US2006/247287 A1), как показано на Схеме реакции 2.
Схема реакции 2
Схема реакции 3
где R2 имеет те же значения, как определено выше.
Соединение формулы (Ib) можно получить путем (i) взаимодействия гидробромида (+)-3-гидроксиморфинана (1) с CbzCl в водном растворе NaOH с получением (+)-N-17-Cbz-3-гидроксиморфинана формулы (2) и (ii) алкилирования полученного продукта с использованием йодметилового эфира (7) в присутствии подходящего основания, такого как карбонат цезия или гидрид натрия или DBU, с получением феноксиметилового эфира формулы (8), и в конце (iii) удаления защитной группы N-17-Cbz у полученного продукта с получением соединения формулы (Ib), как показано на Схеме реакций 3.
Схема реакции 4
где R2 имеет те же значения, как определено выше.
Производное йодметилового эфира (7), используемое в качестве исходного вещества при получении соединения формулы (Ib), можно получить путем обработки хлорметилового эфира (9) йодидом натрия в подходящем растворителе, таком как ацетон или ацетонитрил, с получением соответствующего йодметилового эфира (7), как показано на Схеме реакции 4 (см. Bristol-Myers Squibb Company, US5470845 A1).
Альтернативно, получение соединений формулы (Ib) проиллюстрировано на Схеме реакции 5, где R2 имеет те же значения, как определено выше. Осуществляют депротонирование соединения формулы (2) при помощи основания, такого как гидрид натрия, в подходящем растворителе, таком как HMPA, и затем алкилирование с использованием хлорметилметилсульфида с получением тиометилметилового эфира (9). Обработка соединения формулы (9) хлорирующим агентом, таким как сульфурилхлорид, обеспечивает хлорметиловый эфир формулы (10), который затем обрабатывают карбоновой кислотой в присутствии подходящего основания, такого как карбонат цезия, с получением феноксиметилового эфира формулы (8). Наконец, удаление защитной группы N-17-Cbz у полученного продукта с использованием Pd на угле в атмосфере водорода приводит к получению соединения формулы (Ib).
Схема реакции 5
Образование солевой формы этих соединений можно осуществить, как проиллюстрировано на Схеме реакции 6. Так, Cbz-защищенное соединение структуры (4) можно подвергнуть гидрированию на Pd/C в IPA. Реакционную смесь можно отфильтровать через целит. К раствору IPA можно добавить нужную кислоту, например, L-(+)-винную кислоту (11). После тщательного перемешивания этих ингредиентов (например, при перемешивании при 40°C в течение 30 минут) IPA можно заменить на EtOAc для получения улучшенных характеристик твердого состояния. Твердое вещество затем можно отфильтровать и промыть при помощи EtOAc с получением лекарственного вещества, такого как (1a') с минимальными примесями.
Схема реакции 6
Соединения в соответствии с формулой (I) могут содержать оснόвную функциональную группу и, следовательно, быть способными к образованию фармацевтически приемлемых кислотно-аддитивных солей при их обработке соответствующей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Типичные фармацевтически приемлемые кислотно-аддитивные соли включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат, сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат, пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, пара-аминосалицилат, гликолат, лактат, гептаноат, фталат, оксалат, сукцинат, бензоат, орто-ацетоксибензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, манделат, таннат, формат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глютарат, глютамат, эстолат, метансульфонат (мезилат), этансульфонат (эзилат), 2-гидроксиэтансульфонат, бензолсульфонат (безилат), пара-аминобензолсульфонат, пара-толуолсульфонат (тозилат) и нафталин-2-сульфонат.
Соединения по настоящему изобретению могут существовать в твердой или жидкой форме. В твердом состоянии соединения по настоящему изобретению могут существовать в кристаллической или некристаллической форме или в виде их смеси. Специалистам в данной области должно быть понятно, что для соединений по настоящему изобретению, которые находятся в кристаллической форме, фармацевтически приемлемые сольваты могут быть образованы, когда молекулы растворителя внедряются в кристаллическую решетку в процессе кристаллизации. Сольваты могут включать неводные растворители, такие как ацетон, этанол, н-пропанол, изопропанол, н-бутанол, трет-бутанол, ДМСО, уксусную кислоту, этаноламин и этилацетат, или они могут включать воду в качестве растворителя, который внедряется в кристаллическую решетку. Сольваты, в которых вода является растворителем, который является внедренным в кристаллическую решетку, обычно относят к "гидратам". Гидраты включают стехиометрические гидраты, а также композиции, содержащие различные количества воды. Настоящее изобретение включает все такие сольваты.
Специалистам в данной области также должно быть понятно, что определенные соединения по настоящему изобретению, которые существуют в кристаллической форме, включая их различные сольваты, могут проявлять полиморфизм (то есть способность к существованию в различных кристаллических структурах). Эти различные кристаллические формы обычно известны как "полиморфы." Изобретение включает все такие полиморфы. Полиморфы имеют один и тот же химический состав, но отличаются по упаковке, геометрическому расположению и другим дескриптивным характеристикам кристаллического твердого состояния. Полиморфы, таким образом, могут иметь различные физические свойства, такие как форма, плотность, твердость, способность к деформации, стабильность и растворимость. Полиморфы обычно показывают различные точки плавления, ИК-спектры и порошковые рентгенограммы, которые можно использовать для идентификации. Специалистам в данной области должно быть понятно, что различные полиморфы могут быть получены, например, путем изменения или регулирования реакционных условий или реагентов, используемых для получения соединения. Например, изменения температуры, давления или растворителя могут в результате привести к полиморфам. Кроме того, при определенных условиях один полиморф может самопроизвольно преобразоваться в другой полиморф.
Соединение формулы (I) подвергали гидролизу in vivo с последующим преобразованием в его исходное соединение, то есть (+)-3-HM, которое является эффективным в качестве нейрозащитного средства для лечения болезни Паркинсона. Следовательно, соединение формулы (I) используют для лечения или профилактики болезни Паркинсона.
Фармацевтическую композицию можно вводить перорально, внутримышечно или подкожно. Композиция для перорального введения может быть в различных лекарственных формах, таких как сироп, таблетка, капсула, крем и пастилка. Лекарственная форма в виде сиропа, в основном, содержит суспензию или раствор соединения или его соли в жидком носителе, например этаноле, арахисовом масле, оливковом масле, глицерине или воде, необязательно, с ароматизатором или красителем. Когда композиция представлена в форме таблетки, может быть использован любой из фармацевтических носителей, обычно используемых для получения твердых лекарственных форм. Примеры таких носителей включают стеарат магния, сульфат кальция, тальк, желатин, аравийскую камедь, стеариновую кислоту, крахмал, лактозу и сахарозу. Когда композиция представлена в форме капсулы, можно использовать любую из обычно используемых процедур капсулирования, например, с использованием указанных выше носителей в желатиновой капсуле с твердой оболочкой. Когда композиция лекарственного средства представлена в форме желатиновой капсулы с мягкой оболочкой, может быть использован любой из фармацевтических носителей, обычно используемых для приготовления дисперсий или суспензий, с использованием смолы на водной основе, целлюлозы, силиката или масла. Лекарственные формы для внутримышечного или подкожного введения могут быть в жидкой форме, такой как раствор, суспензия и эмульсия, которые включают водные растворители, такие как вода, физиологический раствор и раствор Рингера; или лиофильные растворители, такие как жирное масло, кунжутное масло, кукурузное масло и синтетический эфир жирной кислоты.
Предпочтительно, композицию получают в виде специальной лекарственной формы для конкретного пациента.
Каждая разовая доза для перорального введения предпочтительно содержит 0,1 мг - 500 мг/кг, и предпочтительно от 1 мг до 100 мг/кг соединения формулы (I) или его фармацевтически приемлемой соли.
Подходящая суточная доза для перорального введения составляет около 0,1 мг/кг - 3 г/кг соединения формулы (I) или его фармацевтически приемлемой соли, и ее можно вводить от 1 до 3 раз в день или через каждые два дня, в зависимости от состояния пациента.
Настоящее изобретение далее описано и проиллюстрировано в представленных ниже Примерах, которые, однако, не предназначены для ограничения объема изобретения.
Примеры
Если не указано иное, все исходные вещества получали от коммерческих поставщиков и использовали без дальнейшей очистки.
Как это использовано в настоящей заявке, символы и условные обозначения, используемые для описания способов, схем и примеров настоящего изобретения, соответствуют тем символам и условным обозначениям, которые используются в современной научной литературе, например, Journal of the American Chemical Society или Journal of Biological Chemistry. В Примерах использованы следующие аббревиатуры:
Hz (Герц)
ТСХ (тонкослойная хроматография)
Tr (время удерживания)
RP (обращенная фаза)
MeOH (метанол)
i-PrOH (изопропанол)
ТФУК (трифторуксусная кислота)
TEA (триэтиламин)
EtOH (этанол)
ТГФ (тетрагидрофуран)
ДМСО (диметилсульфоксид)
EtOAc (этилацетат)
ДХМ (дихлорметан)
HOAc (уксусная кислота)
ДМФА (N,N-диметилформамид)
Ac (ацетил)
CDI (1,1-карбонилдиимидазол)
Bn (бензил)
HOSu (N-гидроксисукцинимид)
HOBT (1-гидроксибензотриазол)
Boc (трет-бутилоксикарбонил)
mCPBA (мета-хлорпербензойная кислота)
FMOC (9-флуоренилметоксикарбонил)
DCC (дициклогексилкарбодиимид)
Cbz (бензилоксикарбонил)
NMM (N-метилморфолин)
HOAt (1-гидрокси-7-азабензотриазол)
TBAF (тетра-n-бутиламмонийфторид)
THP (тетрагидро-2H-пиран-2-ил)
DMAP (4-диметиламинопиридин)
HPLC (высокоэффективная жидкостная хроматография)
BOP (бис(2-оксо-3-оксазолидинил)фосфиниевый хлорид);
EDCI (1-этил-3-[3-диметиламинопропил]карбодиимидгидрохлорид)
HBTU (гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония)
DBU (1,8-диазабицикло[5,4,0]ундец-7-ен)
IPA (2-пропанол)
Все ссылки на эфир относятся к диэтиловому эфиру; насыщенный солевой раствор относится к насыщенному водному раствору NaCl. Если не указано иное, все температуры выражены в °C (градусы Цельсия). Все реакции осуществляли в инертной атмосфере при комнатной температуре, если не указано иное, и все растворители являются растворителями с наиболее возможной высокой чистотой, если не указано иное.
Реакцию при микроволновом нагреве осуществляли с использованием микроволнового реактора Biotage.
Спектры 1H ЯМР записывали либо на Jeol ECX-400, либо Jeol JNM-LA300 спектрометре. Химические сдвиги выражали в миллионных долях (м.д., δ единицы). Константы взаимодействия представлены в герцах (Hz). Картины расщепления описывают выраженные мультиплетности и обозначены как с (синглет), д (дуплет), т (триплет), кв (квартет), квинт (квинтет), м (мультиплет), шир (широкий).
Масс-спектры получали либо на спектрометре Micromass, Quattro LC Triple Quadrupole Tandem Mass Spectometer, ESI, либо Agilent, 6110 Quadrupole LC/MS, ESI.
Для препаративной ВЭЖХ приблизительно 100 мг продукта вводили в 1 мл ДМСО на колонке SunFire™ Prep C18 OBD 5 мкм 19×100мм, с 10 мин градиентом от 10% CH3CN до 90% CH3CN в H2O. Флэш-хроматографию осуществляли с использованием силикагеля 60 Merck (230-400 меш.). Большинство реакций отслеживали при помощи тонкослойной хроматографии на пластинах с силикагелем 0,25 мм Å. Merck (60F-254), визуализировали с использованием УФ-излучения, используя 5% раствор фосфорномолибденовой кислоты в этонале или раствор пара-анисальдегида.
Эксперимент 1. Измерение проницаемости путем осуществления анализа транспорта лекарственного средства с использованием монослоев MDCK
(+)-3-HM растворяли в ДМСО при концентрации 10 мМ и хранили при 4°C. Клетки MDCK получали от ATCC (American Type Culture Collection, CCL-34). Клетки MDCK поддерживали в DMEM (минимальная поддерживающая среда (MEM) Дульбекко с высоким содержанием глюкозы), содержащей 1 X NEAA (заменимые аминокислоты), 10 мМ HEPES, 100 единиц пенициллина, 0,1 мг/мл стрептомицина и 8% FBS. Клетки культивировали в колбах T-75 в инкубаторе для клеточной культуры при 37°C. Клетки MDCK пересевали два раза в неделю. Когда клетки достигали 90% конфлюэнтности, клетки высевали при плотности 1×105 клеток/лунка в лунки для анализа транспорта. Клетки подпитывали свежей средой через день. Клетки выращивали до конфлюэнтности в лунках для анализа транспорта в течение 5 дней. Когда клетки достигали конфлюентности и дифференцировали, их можно было использовать для анализа транспорта. TEER (трансэпителиальное электрическое сопротивление) в каждой лунке измеряли при помощи омметра системы Millicell-ERS. Электрод погружали в 70% этанол и PBS на 15 минут. Затем систему регулировали при помощи отвертки на потенциометре до тех пор, пока измерительный прибор не показывал напряжение 0,0, и регистрировали электрическое сопротивление для каждой лунки. Использовали монослои MDCK со значениями TEER >400 Ω. Затем каждую лунку промывали стерильным раствором HBSS (сбалансированный солевой раствор Хэнка) и осуществляли 100-кратное разведение (+)-3-HM в HBSS, апикальные лунки заполняли 200 мкл испытываемых соединений. Базолатеральные лунки заполняли 1 мл HBSS буфера. Подготавливали для анализа лунки, обработанные только 0,1% ДМСО. Клетки инкубировали при 37°C в течение 1 часа. По окончании периода транспорта полученные образцы извлекали из апикальных (150 мкл) и базолатеральных (900 мкл) лунок. Репрезентативные соединения Примеров испытывали в аналогичных условиях.
Эксперимент 2. ВЭЖХ анализ и определение P app
ВЭЖХ анализы осуществляли с использованием системы ВЭЖХ WATERS. Использовали колонку ZORBAX Eclipse XDB-C18 (4,6×250 мм, размер частиц 5 мкм). Оптимальные рабочие условия были следующими: подвижная фаза A состояла из дистиллированной воды-ацетонитрила (ACN) (9:1, об/об) с 0,1% трифторуксусной кислоты (ТФУК), а подвижная фаза B состояла из 90% ацетонитрила с 0,1% ТФУК. Все буферы использовали после 0,45 мкм фильтрации.
УФ-де