Способ выявления пациентов, облученных малыми дозами ионизирующей радиации
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к диагностическим способам выявления пациентов, облученных малыми дозами ионизирующей радиации. Способ выявления пациентов, облученных малыми дозами ионизирующей радиации, осуществляется путем добавления перекиси водорода в культивируемую кровь in vitro, затем полученный препарат делят на две равные части, одну из которых культивируют в среде PRMI, а другую в модифицированной среде PRMI-1640, с последующим выявлением в полученных образцах хромосомных аберраций, по спектру которых судят о дозе полученной радиации. Вышеописанный способ позволяет повысить диагностику патологических нарушений на хромосомном уровне. 2 ил.
Реферат
Изобретение относится к клеточной биологии и может быть использовано в экспериментальной и клинической практике для уточнения групп риска и формирования системы профилактических и лечебных мероприятий для людей, подверженных хроническому воздействию ионизирующего излучения в малых дозах.
Известен способ экспресс-выявления облученных пациентов с повышенными частотами хромосомных аберраций. В качестве критерия хромосомных аберраций регистрируют лимфоциты с аномалиями ядер типа "хвостов" и по повышенной частоте встречаемости таких лимфоцитов (0,8% и выше) выявляют пациентов с повышенными частотами хромосомных аберраций в популяциях лимфоцитов периферической крови (RU №2141658, МПК 6 G01N 33/48, опубл. 20.11.1997 г.).
Недостатком известного способа является выявление имеющихся в кариотипе мутаций, являющихся последствиями воздействия мутагенных факторов, нарушения в кариотипе, связанные с нарушением работы репарационной системы, недостаточностью антиоксидантной защиты при таких подходах не регистрируются, что приводит к недостаточной диагностике патологических нарушений на хромосомном уровне.
Технический результат заключается в улучшении диагностики патологических нарушений на хромосомном уровне путем учета частоты и спектра хромосомной нестабильности у людей, подверженных хроническому воздействию ионизирующего излучения.
Технический результат достигается тем, что в способе выявления пациентов, облученных малыми дозами ионизирующей радиации, включающем определение хромосомных аберраций в лимфоцитах периферической крови, в культивируемую кровь in vitro добавляют перекись водорода в концентрации 20-50 мкМоль, затем полученный препарат делят на две равные части, одну из которых культивируют в среде PRMI, а другую в модифицированной среде PRMI-1640, в полученных образцах выявляют хромосомные аберрации, по спектру которых судят о дозе полученной радиации.
Используется природная способность перекиси водорода к окислительной модификации биомолекул, в том числе ДНК и белков. Создаются условия для развития «мягкого» окислительного стресса, не приводящего к угнетению физиологической активности лимфоцитов, а напротив, стимулирующего пролиферативные процессы в клетках крови.
При наличии нарушений в репарационной системе, недостаточности антиоксидантной системы развивается окислительный стресс, способствующий проявлению широкого спектра мутаций, не реализуемых в обычных условиях метафазного теста.
Используют лимфоциты периферической крови людей, подвергающихся хроническому воздействию ионизирующей радиации в малых дозах.
Для усиления генотоксической нагрузки в опытах in vitro применяют перекись водорода в концентрации 20-50 мкМоль. Если концентрация перекиси водорода будет меньше 20 мкМоль, то прооксидантное действие будет недостаточным для выявления хромосомной нестабильности. Если концентрация перекиси водорода будет выше 50 мкМоль, то вследствие повышения прооксидантной активности в кариотипе лимфоцитов будут проявляться индуцированные хромосомные нарушения, расширяющие спектр мутаций, вызванный хроническим воздействием ионизирующей радиации в малых дозах.
Способ осуществляется следующим образом.
К 1 мл культивируемой крови in vitro добавляют перекись водорода до концентрации 20-50 мкМоль. Далее для получения клеток на стадии метафазы по 0,5 мл цельной крови культивируют в одноразовых пластиковых шприцах.
В первом шприце культуральная среда состоит из 6 мл среды для культивирования PRMI (ПанЭко, Россия), 1,5 мл сыворотки крупного рогатого скота, 0,1 мл ФГА-П (фитогемаглютинин - фракция-П) из стандартного флакона (ПанЭко, Россия) и смеси антибиотиков (10 ед. пенициллина и 100 ед. стрептомицина на 1 мл среды).
Во втором шприце культуральная среда состоит из 6 мл среды для культивирования RPMI-1640 (ПанЭко, Россия), 1,5 мл сыворотки крупного рогатого скота, 0,1 мл ФГА-П (фитогемаглютинин - фракция-П) из стандартного флакона (ПанЭко, Россия) и смеси антибиотиков (10 ед. пенициллина и 100 ед. стрептомицина на 1 мл среды).
Питательная среда RPMI-1640 без глутамина представляет собой растворенную в очищенной воде смесь неорганических солей, аминокислот, витаминов, глюкозы и фенолового красного, простерилизованную фильтрованием через фильтры с размером пор 0.1 мкм. В ее состав входят: D-Ca-пантотенат (25 мг/л), хлорид холина (300 мг/л), i-инозитол (3500 мг/л), ниацинамид (100 мг/л), пиридоксин HCl (100 мг/л), рибофлавин (20 мг/л), тиамин (HCl 100 мг/л), П-аминобензойная кислота (100 мг/л), В12 (0,5 мг/л), D-биотин (20 мг/л), фолиевая кислота (100 мг/л) и аскорбиновая кислота (до 400 мкМоль, что соответствует повышенной концентрации витамина С в плазме крови).
Культивирование в обоих шприцах проводят при t +37°C в течение 72 часов. Для накопления лимфоцитов в стадии метафазы за 1-1,5 ч до окончания культивирования добавляют колхицин (ПанЭко, Россия) в конечной концентрации по 0,5 мкг/мл в каждый шприц. По окончании культивирования, клетки из шприцов вместе с питательной средой переносят в пластиковые центрифужные пробирки, осаждают центрифугированием при 200 g в течение 15 мин. Затем подвергают гипотонизации теплым раствором хлорида калия в концентрации 0,075 моль/л, в течение 15 минут в термостате при t +37°C. Полученный после центрифугирования при 200 g в течение 15 мин осадок клеток фиксируют свежеприготовленной смесью этанол (96-98%) - ледяная уксусная кислота в соотношении 3:1. Проводят фиксацию 3 раза до полного разрушения эритроцитов и гемоглобина. К зафиксированной культуре клеток добавляют небольшой объем свежего фиксатора и раскапывают на обезжиренные, холодные, влажные стекла. Фиксатор поджигают в пламени горелки. Препараты высушивают и хранят несколько дней для дозревания.
Каждое стекло с микропрепаратом метафазных хромосом окрашивают по методу Гимза с использованием красителя Гимза (ПанЭко), приготовленного разбавлением 4 мл концентрата в 200 мл фосфатного буферного раствора, pH 6,8. Окрашивание проводят в специальной камере для окрашивания стекол в течение 30 минут.
Исследование анализируют по степени окраски препарата хромосом, с помощью светового микроскопа проводят увеличение в 1350 раз с использованием иммерсионного объектива. Учитывают все типы аберраций, фиксируемых без кариотипирования, включая одиночные фрагменты, парные фрагменты, маркеры радиационного воздействия (ацентрические кольца, кольцевые и дицентрические хромосомы), атипичные хромосомы (прочие аберрации), общее число аберраций, число аберрантных клеток, а также частоту полиплоидных клеток.
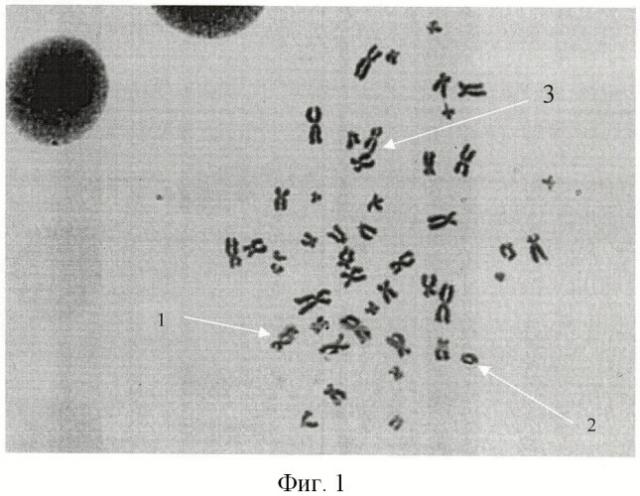
В качестве маркеров хронического облучения в малых дозах используют аберрации хромосом генотоксического характера: одиночные фрагменты, обмены хроматидного типа (фиг.1). Их преобладание над маркерами прямого радиационного воздействия (дицентрики, кольцевые хромосомы, полицентрические хромосомы) свидетельствует о влиянии на кариотип (при исключении других генотоксических воздействий) ионизирующего излучения в малых дозах.
Маркеры радиационного (1, 2) и генотоксического риска (3) в метафазных пластинках тестируемых доноров. Увеличение ×15×90×15: 1 - дицентрик; 2 - кольцевая хромосома; межхромосомный обмен хроматидного типа (фиг.1).
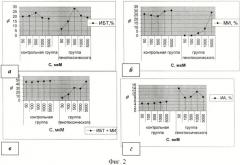
Выявлены существенные различия в действии перекиси водорода на лимфоциты людей 1 - контрольной группы и 2 - тестируемой группы (фиг.2).
Изменение митотических параметров культуры лимфоцитов доноров контрольной (1) и тестируемой (2) групп при дополнительной генотоксической нагрузке: а - индекс бластной трансформации лимфоцитов, б - митотический индекс, в - сумма индекса бластной трансформации и митотического индекса, г - индекс апоптоза (фиг.2).
Перекись водорода в диапазоне концентраций 20-50 мкМоль приводит к общей стимуляции митогенного ответа в опыте и контроле. Однако в среднем уровень митогенного ответа тестируемых образцов культуры лимфоцитов был более чем в два раза ниже, чем в контроле.
Стимуляция бласттрансформации лимфоцитов доноров тестируемой группы под влиянием перекиси водорода была более выраженной по сравнению с контролем, достигая максимума при действии перекиси водорода в концентрации 500 мкМоль.
Перекись водорода in vitro стимулировала интенсивную апоптотическую гибель лимфоцитов доноров тестируемой группы с двумя максимумами при концентрации 50 мкМоль и 1 мМоль, что свидетельствует о наличии значительного числа репродуктивно дефектных клеток.
В основе эффективного выявления клеток с генетическими дефектами в метафазном тесте с дополнительной генотоксической нагрузкой лежит хромосомная нестабильность, приобретаемая лимфоцитами людей, подвергающихся хроническому воздействию ионизирующего излучения в малых дозах.
Культивирование клеток крови людей с хромосомной нестабильностью, обусловленной воздействием ионизирующего излучения в малых дозах в модифицированной среде RPMI-1640 уменьшало генотоксическое действие перекиси водорода на кариотип. При этом наблюдалось снижения общей частоты аберрантных клеток в опытных образцах в 1,5 раза по сравнению с контролем. Все это позволит улучшить диагностику патологических нарушений на хромосомном уровне.
Способ выявления пациентов, облученных малыми дозами ионизирующей радиации, включающий определение хромосомных аберраций в лимфоцитах периферической крови, отличающийся тем, что в культивируемую кровь in vitro добавляют перекись водорода в концентрации 20-50 мкМоль, затем полученный препарат делят на две равные части, одну из которых культивируют в среде PRMI, а другую в модифицированной среде PRMI-1640, в полученных образцах выявляют хромосомные аберрации, по спектру которых судят о дозе полученной радиации.