Устройство для неинвазивного измерения давления текучей среды в регулируемом сужающем устройстве
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения ожирения. Сужающая система содержит сужающее устройство для имплантации пациенту; имплантируемый порт, соединенный с сужающим устройством и содержащий рабочую текучую среду для воздействия на размер сужения; и систему датчика давления, выполненную с возможностью измерения давления упомянутой рабочей текучей среды и передачи данных измерения давления на наружный монитор. Давление рабочей среды пропорционально степени созданного сужения. Система датчика давления содержит датчик давления, расположенный внутри корпуса указанного имплантируемого порта, находящийся в сообщении с упомянутой рабочей текучей средой. Система датчика давления содержит механически деформируемую поверхность в жидкостном контакте с упомянутой рабочей текучей средой. Поверхность выполнена с возможностью деформироваться пропорционально давлению упомянутой рабочей текучей среды. Раскрыт второй вариант системы, отличающийся выполнением системы датчиков. Технический результат состоит в обеспечении измерения размера стомы. 2 н. и 10 з.п. ф-лы, 18 ил.
Реферат
Область техники изобретения
Настоящее изобретение относится, в общем, к имплантируемым сужающим устройствам, в частности к наполняемым текучей средой сужающим устройствам. Настоящее изобретение дополнительно относится к устройствам ограничения приема пищи для лечения патологического ожирения.
Уровень техники изобретения
Ожирение вызывает растущее беспокойство, особенно в США, так как количество тучных людей продолжает увеличиваться, и становится больше известно о вредных последствиях ожирения для здоровья. Патологическое ожирение, при котором масса на 100 фунтов или более превосходит идеальную массу тела, порождает, в частности, значительные риски тяжелых проблем со здоровьем. Поэтому лечению тучных пациентов уделяют значительное внимание. Один из способов лечения патологического ожирения состоял в установке суживающего устройства, например удлиненного бандажа, вокруг верхней части желудка. Бандаж размещают так, чтобы создать небольшой изолированный желудочек над бандажом и суженное отверстие стомы в желудке. Действие бандажа состоит в уменьшении доступного объема желудка и, следовательно, количества пищи, которое можно принять до «пресыщения». Желудочные бандажи обычно содержали наполняемые текучей средой высокоэластичный баллон с фиксированными концевыми точками, который охватывает желудок чуть ниже пищеводно-желудочного перехода. Когда текучая среда нагнетается в баллон, бандаж расширяется в упор к желудку с созданием сужения при приеме пищи или стому в желудке. Для ослабления данного препятствия, текучую среду выводят из бандажа.
Устройства ограничения приема пищи содержали также механически регулируемые бандажи, которые сходным образом охватывают верхний участок желудка. Данные бандажи содержат любое число упругих материалов или передаточных механизмов, а также приводных элементов для регулировки бандажей. Кроме того, разработаны желудочные бандажи, которые содержат как гидравлические, так и механические приводные элементы. Пример такого регулируемого желудочного бандажа описан в патенте США № 6067991, “Mechanical Food Intake Restriction Device”, который выдан 30 мая 2000 г. и включен в настоящую заявку путем отсылки. Известно также, что объем, доступный для пищи в полости желудка, ограничивают имплантацией надувного высокоэластичного баллона непосредственно в полость желудка. Баллон наполняют текучей средой для расширения к стенкам желудка и тем самым уменьшения объема, доступного для пищи в желудке.
С каждым из вышеописанных устройств ограничения приема пищи безопасное и эффективное лечение требует периодического контроля и регулирования устройства для изменения степени сужения желудка. С бандажными устройствами изолированный желудочек над бандажом будет существенно увеличиваться в размере после первоначальной имплантации. Соответственно, отверстие стомы в желудке необходимо сначала сделать достаточно большим, чтобы пациент мог принимать достаточно пищи, пока желудок адаптируется к бандажному устройству. По мере того как изолированный желудочек увеличивается в размере, бандаж можно подрегулировать для изменения размера стомы. Кроме того, желательно изменять размер стомы для согласования с изменениями тела пациента или режима лечения или, в более неотложном случае для облегчения непроходимости или тяжелого расширения пищевода. По традиции регулировка гидравлического желудочного бандажа требовала планового посещения врача, во время которого применялись игла для подкожных инъекций и шприц для проникания под кожу пациента, и жидкость добавлялась в баллон или откачивалась из него. Недавно разработаны имплантируемые насосы, которые обеспечивают неинвазивные регулировки бандажа. Наружный программатор устанавливает связь с имплантированным насосом с использованием телеметрии для управления насосом. Во время планового посещения врач располагает ручную часть программатора вблизи желудочного имплантата и передает мощность и командные сигналы в имплантат. Имплантат, в свою очередь, регулирует уровень текучей среды в бандаже и передает ответную команду в программатор.
Во время описанных регулировок желудочного бандажа существовала проблема определения, как выполняется регулировка, и будет ли достигнут искомый результат. Для определения эффективности регулировки некоторые врачи применяли рентгеноскопию с помощью бариевой смеси при выполнении регулировки. Однако рентгеноскопия дорого стоит и нежелательна из-за доз облучения, получаемых как врачом, так и пациентом. Другие врачи предписывали пациенту выпивать стакан воды во время или после регулировки для определения, может ли вода проходить через отрегулированную стому. Данный способ, однако, показывает только, что у пациента отсутствует непроходимость, и не дает никакой информации об эффективности регулировки. Часто врач может применять способ типа «проверьте, что получилось» исходя из своего предшествующего опыта, и результаты регулировки могут не обнаруживаться, пока не пройдет несколько часов или суток, в течение которых пациент испытывает полную непроходимость в полость желудка или бандаж вызывает эрозию ткани желудка.
Следовательно, желательно создание эффективного способа для оценки регулировки устройства ограничения приема пищи во время или непосредственно после регулировки. В частности, желательно создание устройства сужения желудка, которое содержит систему измерения давления для измерения давления в сужающем устройстве и, следовательно, размера стомы. Кроме того, желательно создание неинвазивного способа для измерения давления жидкости во время регулировки и передачи измеренного давления на наружный монитор.
Сущность изобретения
В соответствии с настоящим изобретением предлагается сужающая система, например регулируемый желудочный бандаж, для создания сужения у пациента и неинвазивной передачи данных давления, касающихся сужения, на наружный монитор. Система содержит сужающее устройство, подлежащее имплантации пациенту для создания сужения. Система дополнительно содержит имплантируемый порт, соединенный с сужающим устройством. Порт содержит рабочую текучую среду для воздействия на размер сужения. Система дополнительно содержит систему датчика давления, сообщающуюся с рабочей текучей средой для измерения давления рабочей текучей среды и передачи данных измерения давления на наружный монитор.
Краткое описание чертежей
Фиг.1 - схематическая иллюстрация устройства ограничения приема пищи согласно настоящему изобретению.
Фиг.2 - более подробный вид в перспективе примерного имплантируемого участка устройства ограничения приема пищи, показанного на фиг.1.
Фиг.3 - вид в перспективе регулируемого желудочного бандажа, показанного на фиг.2, с демонстрацией бандажа, расположенного вокруг пищеводно-желудочного перехода пациента.
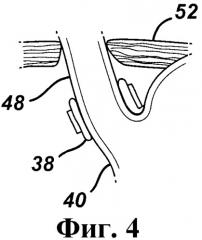
Фиг.4 - сечение регулируемого желудочного бандажа, показанного на фиг.2, изображенного в спущенной конфигурации.
Фиг.5 - сечение регулируемого желудочного бандажа, показанного на фиг.2, изображенного в наполненной конфигурации для создания сужения, ограничивающего прием пищи.
Фиг.6 - вид сбоку с частичным разрезом нагнетательного порта, показанного на фиг.2.
Фиг.7 - вид в изометрии прижимной крышки, показанной на фиг.6.
Фиг.8 - вид в изометрии датчика давления, показанного на фиг.6.
Фиг.9 - вид сбоку в сечении первого варианта осуществления системы датчика давления согласно настоящему изобретению.
Фиг.10 - упрощенное схематическое изображение схемы с регулируемым сопротивлением по первому варианту осуществления.
Фиг.11 - вид сбоку в сечении второго варианта осуществления системы датчика давления согласно настоящему изобретению.
Фиг.12 - блок-схема, представляющая систему измерения давления, относящуюся к первому и второму вариантам осуществления изобретения.
Фиг.13 - вид сбоку в сечении третьего варианта осуществления системы датчика давления согласно настоящему изобретению.
Фиг.14 - блок-схема, представляющая систему измерения давления, относящуюся к третьему варианту осуществления изобретения.
Фиг.15 - вид сбоку в сечении четвертого варианта осуществления системы датчика давления согласно настоящему изобретению.
Фиг.16 - вид сбоку в сечении пятого варианта осуществления системы датчика давления согласно настоящему изобретению.
Фиг.17 - блок-схема, представляющая систему измерения давления, относящуюся к четвертому и пятому вариантам осуществления изобретения.
Фиг.18 - график, показывающий сигнал давления системы датчика давления, например такой сигнал, который может появляться на дисплее наружного монитора во время запроса пользователя.
Подробное описание изобретения
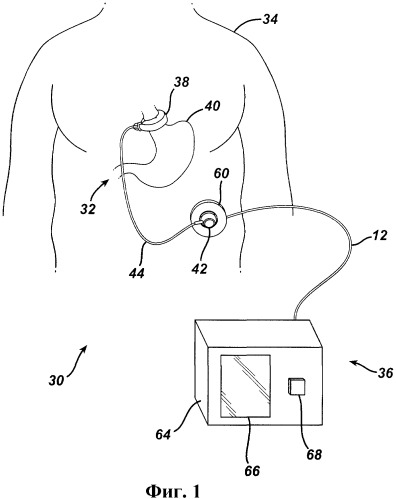
На чертежах, где одинаковыми позициями обозначены одни и те же элементы на всех видах, фиг.1 изображает систему 30 ограничения приема пищи. Система 30 содержит первый участок, обозначенный в целом позицией 32, имплантированный внутрь пациента 34, и второй участок, обозначенный в целом позицией 36, расположенный снаружи пациента. Имплантированный участок 32 содержит регулируемый желудочный бандаж 38, расположенный на верхнем участке желудка 40 пациента. Регулируемый бандаж 38 может содержать полость, выполненную из силиконового каучука или биосовместимого материала другого типа, которая раздувается внутрь к желудку 40 при наполнении текучей средой. В качестве альтернативы бандаж 38 может быть выполнен в виде механически регулируемого устройства с полостью для текучей среды, которая претерпевает изменения давления при регулировках бандажа, или комбинированного гидравлически/механически регулируемого бандажа. Нагнетательный порт 42, который ниже описан более подробно, имплантирован в область тела, доступную для нагнетаний иглой и/или сигналов телеметрической передачи. В показанном варианте осуществления нагнетательный порт 42 гидравлически сообщается регулируемым бандажом 38 через катетер 44. Хирург может расположить и на длительное время имплантировать нагнетательный порт 42 в тело пациента для выполнения регулировок ограничения приема пищи или стомы. Специалистам в данной области техники очевидно, что в последнее время хирургические способы установки желудочных бандажных систем, имплантируемого участка 32, получили значительное развитие, так что пациент может получить оптимальный терапевтический эффект с минимальными осложнениями. Хирург, например, обычно имплантирует нагнетательный порт 42 в латеральную подреберную область живота пациента под кожу и слои жировой клетчатки. Хирург может также имплантировать нагнетательный порт 42 на грудину пациента.
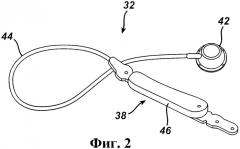
На фиг.2 более подробно изображен примерный регулируемый желудочный бандаж. В данном варианте осуществления бандаж 38 содержит полость 46 с регулируемым объемом, которая расширяется к внешней стенке желудка или контактирует с данной стенкой, чтобы формировать регулируемую стому для контролируемого ограничения поступления пищи в желудок. Врач может уменьшать размер отверстия стомы добавлением текучей среды в полость 46 с регулируемым объемом или, наоборот, может увеличивать размер стомы отбором текучей среды из полости. Текучую среду можно добавлять или отбирать при введении иглы в нагнетательный порт 42. В качестве альтернативы текучую среду можно перекачивать неинвазивным способом между бандажом 38 и нагнетательным портом 42 с использованием телеметрических командных сигналов. Текучая среда может представлять собой, но без ограничения, 0,9-процентный физиологический раствор.
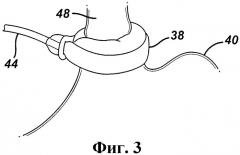
На фиг.3 представлен регулируемый желудочный бандаж 38, показанный на фиг.2, наложенный вокруг пищеводно-желудочного перехода пациента. Как показано на фиг.3, бандаж 38, по меньшей мере, по существу, охватывает верхний участок желудка 40 около перехода от пищевода 48. На фиг.4 представлено сечение бандажа 38, с изображением бандажа в спущенном состоянии. На данном виде бандаж 38 содержит немного, вплоть до полного отсутствия, текучей среды, чем увеличивает до максимума размер отверстия стомы в желудке 40. На фиг.5 представлено сечение бандажа 38 и желудка 40, аналогичное сечению на фиг.4, с изображением бандажа 38 в расширенной, наполненной текучей средой конфигурации. На данном виде давление бандажа 38 на желудок 40 увеличено из-за текучей среды в бандаже, что уменьшает отверстие стомы для создания препятствия приему пищи. На фиг.5 также схематически показано расширение пищевода 48 над бандажом 38 с образованием верхнего желудочка 50 под диафрагменной мышцей 52 пациента.
Как показано на фиг.1, наружный участок 36 системы 30 ограничения приема пищи содержит устройство 60 считывания давления, электрически соединенное (в данном варианте осуществления, посредством электрического кабельного узла 62) с блоком 64 управления. Блок 64 управления содержит дисплей 66, по меньшей мере, один управляющий переключатель 68 и наружный управляющий модуль, который ниже дополнительно рассмотрен более подробно. Блок 64 управления может быть выполнен с возможностью применения, например, в кабинете врача или в кабинете для обследования. Некоторые способы установки блока 64 управления заключаются в настольной установке, закреплении на столике для исследований или в подвешивании на переносной стойке. Блок 64 управления может быть также выполнен с возможностью ношения в кармане халата врача, удерживания в руке или размещении на столике для исследований или на полулежащем пациенте. Электрический кабельный узел 62 можно подключать с возможностью разъема к блоку 64 управления или устройству 60 считывания давления для облегчения чистки, технического обслуживания, применения и хранения наружного участка 36 системы 30. Устройство 60 считывания давления неинвазивно измеряет давление текучей среды в имплантированном участке 32, даже когда нагнетательный порт 42 имплантирован под толстой (по меньшей мере, свыше 10 сантиметров) подкожной жировой ткани. Врач может фиксировать устройство 60 считывания давления на коже пациента вблизи места расположения нагнетательного порта 42 в пациенте и наблюдать показание давления на дисплее 66 блока 64 управления. Устройство 60 считывания давления можно также закреплять с возможностью съема к пациенту, например, во время продолжительного исследования, с помощью тесемок, адгезивов и другими широко известными способами. Устройство 60 считывания давления действует через обычную одежду или бумажные хирургические салфетки и может также содержать одноразовый чехол (не показан), который можно заменять для каждого пациента.
Как показано на фиг.6, который представляет собой вид сбоку с частичным разрезом нагнетательного порта 42, содержащего систему датчика давления для неинвазивного измерения давления текучей среды внутри имплантированного порта 32. Как показано на фиг.6, нагнетательный порт 42 содержит жесткий корпус 70 с кольцевым фланцем 72, содержащим множество крепежных отверстий 74 для крепления нагнетательного порта к ткани пациента. Хирург может прикрепить нагнетательный порт 42 к ткани, например, фасции, покрывающей мышцу живота, с использованием какого-либо из многочисленных хирургических средств крепления, включая хирургические шовные нити, скобки и зажимы. Нагнетательный порт 42 дополнительно содержит перегородку 76, обычно выполняемую из силиконового каучука и удерживаемую обжимом в корпусе 70. Перегородку 76 протыкают иглой с наконечником Хубера или инъекционным инструментом аналогичного типа для добавления или отбора жидкости из порта. Перегородка 76 самоуплотняется после извлечения иглы шприца для сохранения объема жидкости внутри нагнетательного порта 42. Нагнетательный порт 42 дополнительно содержит резервуар 80 для удерживания рабочей текучей среды и катетерный штуцер 82. Штуцер 82 присоединяется к катетеру 44, показанному на фиг.2, для образования закрытой гидравлической линии между резервуаром 80 внутри нагнетательного порта 42 и полостью 46 внутри регулируемого бандажа 38. Текучая среда из резервуара 80 может служить для расширения объема полости 46 бандажа. И наоборот, текучая среда может отбираться из полости 46 и удерживаться в резервуаре 80 для временного уменьшения объема полости 46. Корпус 70 и соединитель 82 могут быть прессованы одним целым из биосовместимого полимера или изготовлены из такого металла, как титан или нержавеющая сталь.
В составе нагнетательного порта 42 обеспечена система датчика давления для измерения давления текучей среды в закрытой гидравлической линии имплантированного порта 32. Давление в линии соответствует величине сужения, прилагаемого регулируемым бандажом 38 к желудку пациента. Соответственно, измерение давления текучей среды позволяет врачу оценивать сужение, создаваемое при регулировке бандажа. Давление текучей среды можно измерять до, во время и/или после регулировки для проверки правильности регулировки бандажа. В варианте осуществления, показанном на фиг.6, система датчика давления содержит датчик 84, расположенный на дне резервуара 80 для текучей среды в корпусе 70. Прижимная крышка 86 проходит над датчиком 84 давления для, по существу, отделения поверхности датчика от резервуара 80 и защиты датчика от проникающей иглы. Прижимная крышка 86 может быть выполнена из такого керамического материала, как, например, оксид алюминия, который препятствует прониканию иглы, но не препятствует связи электронными средствами между датчиком 84 и устройством 60 считывания давления. Прижимная крышка 86 содержит проходное отверстие 90, которое позволяет текучей среде протекать внутрь резервуара 80 и действовать на поверхность датчика 84 давления.
На фиг.7 показана в изометрии прижимная крышка 86 с проходным отверстием 90 в нижней поверхности крышки. На фиг.8 представлена в изометрии внешняя часть датчика 84 давления. Как показано на фиг.8, внешняя часть датчика 84 давления содержит деформационный элемент с деформируемой поверхностью. В показанном варианте осуществления деформационный элемент представляет собой диафрагму 92. Диафрагма 92 может быть выполнена утонением части стенки в титановом резервуаре 80. Диафрагма 92 может быть выполнена из титана или другого аналогичного материала и иметь толщину от 0,001 дюйма до 0,002 дюйма. Хотя в вариантах осуществления показано, что деформационным элементом является диафрагма, в соответствии с настоящим изобретением изготавливать и применять на практике можно также другие деформационные элементы для преобразования давления текучей среды в механическое смещение. Примеры других подходящих деформационных элементов включают в себя, но без ограничения, трубки Бурдона и мембранные гофрированные узлы. Датчик 84 давления герметизирован в корпусе 94 для предотвращения просачивания текучей среды и ее воздействия на работу датчика. Корпус 94 уплотнен относительно корпуса 70 порта для предотвращения потери текучей среды из нагнетательного порта 42. Диафрагма 92 герметически уплотнена к корпусу 94 датчика для предотвращения пропускания текучей среды по краям диафрагмы во внутренние компоненты системы датчика. Когда текучая среда протекает сквозь проходное отверстие 90 в резервуаре 80, она оказывает воздействие на поверхность диафрагмы 92. Поток текучей среды сквозь проходное отверстие 90 обеспечивает реакцию диафрагмы 92 на изменения давления текучей среды в гидравлической линии и преобразование изменений давления в механическое смещение.
На фиг.9 представлен вид сбоку датчика 84 давления в сечении, взятом по линии A-A на фиг.8, изображающий первый вариант осуществления 88 для измерения давления текучей среды. В соответствии с вариантом осуществления, показанным на фиг.9, механическое смещение диафрагмы 92 преобразуется в электрический сигнал парой резистивных кремниевых тензометрических датчиков 96, 98. Тензометрические датчики 96, 98 прикреплены к диафрагме 92 на стороне, противоположной рабочей текучей среде, в резервуаре 80. Тензометрический датчик 96 прикреплен к центральному участку диафрагмы 92 для измерения смещения диафрагмы. Второй согласованный тензометрический датчик 98 прикреплен вблизи внешнего края диафрагмы 92. Тензометрические датчики 96, 98 могут быть прикреплены к диафрагме 92 клеями или могут быть встроены в структуру диафрагмы. Когда давление текучей среды в бандаже 38 изменяется, поверхность диафрагмы 92 деформируется вверх или вниз в пределах поверхности корпуса 94. Данная деформация диафрагмы 92 вызывает изменение сопротивления в центральном тензометрическом датчике 96.
Как показано на фиг.10, тензометрические датчики 96, 98 образуют два верхних резистивных элемента схемы 100 полууравновешенного моста Уитстона. Когда тензометрический датчик 96 реагирует на механические деформации диафрагмы 92, изменяющееся сопротивление датчика изменяет напряжение на верхнем участке схемы моста. Тензометрический датчик 98 согласован с тензометрическим датчиком 96 и нейтрализует температурные погрешности схемы моста Уитстона. К схеме 100 моста подключены дифференциальные усилители 102, 104 для измерения изменения напряжения в схеме моста, вызываемого резистивными тензометрическими датчиками. В частности, дифференциальный усилитель 102 измеряет напряжение на схеме моста в целом, тогда как дифференциальный усилитель 104 измеряет разность падений напряжения на образованной тензометрическими датчиками половине схемы 100 моста. Чем больше разность между напряжениями на тензометрических датчиках при фиксированном напряжении, подаваемом на мост, тем больше разность давлений. При необходимости можно также воспользоваться схемой полностью уравновешенного моста Уитстона для повышения чувствительности и точности системы датчика давления. В схеме полностью уравновешенного моста к поверхности диафрагмы 92 прикреплены четыре тензометрических датчика вместо всего двух тензометрических датчиков, показанных на фиг.9.
Выходные сигналы от дифференциальных усилителей 102, 104 подаются в микроконтроллер 106. Микроконтроллер 106 интегрирован в печатную плату 110 в корпусе 94. Температурный датчик 112 измеряет температуру внутри имплантированного порта и вводит сигнал температуры в микроконтроллер 106. Микроконтроллер 106 использует сигнал температуры от датчика 112 для компенсации изменений температуры тела и остаточных температурных погрешностей, не учтенных тензометрическим датчиком 98. Компенсация сигнала измерения давления с учетом изменений температуры тела повышает точность системы датчика давления. Кроме того, в корпусе 94 расположена катушка 114 TET (чрескожной передачи энергии) и телеметрической связи. Катушка 114 соединена с конденсатором 116 для создания настроенного резонансного контура для приема энергии от наружного участка 36 и передачи измеренного давления в устройство 60 считывания давления.
На фиг.11 представлен вид сбоку сечения, аналогичного сечению на фиг.9, изображающего второй вариант осуществления 118 системы датчика давления в соответствии с настоящим изобретением. Во втором варианте осуществления 118 в корпусе 94 обеспечен датчик 120 микроэлектромеханической системы (MEMS) для измерения механической деформации диафрагмы 92 и формирования электрического сигнала, пропорционального давлению в регулируемом бандаже 38. Между диафрагмой 92 и датчиком 120 MEMS обеспечена герметичная камера 122 с силиконовым маслом. Масляная камера 122 защищает датчик 120 MEMS и передает механическое перемещение диафрагмы 92 датчику. Датчик 120 MEMS выводит в микроконтроллер 106 электрический сигнал, характеризующий давление текучей среды в резервуаре 80. Микроконтроллер 106 вводит сигнал от датчика 120 MEMS и сигнал температуры от температурного датчика 112 и вычисляет измеренное давление. Измеренное давление передается в устройство 60 считывания давления на наружном участке 36 с помощью телеметрических сигналов, как подробно описано ниже.
На фиг.12 приведена блок-схема системы измерения давления для первого и второго вариантов 88, 118 осуществления изобретения. Как показано на фиг.12, наружный управляющий модуль 126 системы содержит первичную катушку 130 TET для передачи сигнала мощности во внутренний управляющий модуль, обозначенный в целом позицией 132. Первичная катушка 130 TET расположена в устройстве 60 считывания давления, показанном на фиг.1. Схема 134 возбуждения TET управляет подачей сигнала мощности в первичную катушку 130 TET. Схема 134 возбуждения TET управляется микропроцессором 136, содержащим соответствующую память 138. Графический интерфейс 140 пользователя подключен к микропроцессору 136 для управления данными, показываемыми на дисплее 66. Наружный управляющий модуль 126 также содержит первичный телеметрический приемопередатчик 142 для команд запроса в имплантированный управляющий модуль 132 и приема ответных данных, включая показания давления текучей среды от упомянутого модуля. Первичный приемопередатчик 142 электрически соединен с микропроцессором 136 для ввода и приема командных сигналов и сигналов данных. Первичный приемопередатчик 142 резонирует на выбранной радиочастоте передачи для создания переменного магнитного поля 146 нисходящего канала, которое передает командные данные в имплантированный управляющий модуль 132. Источник 150 питания подает энергию в наружный управляющий модуль 126 для питания энергией системы 30. Датчик 152 давления окружающей среды подключен к микропроцессору 136. Микропроцессор 136 использует сигнал от датчика 152 давления окружающей среды для коррекции показаний давления на изменения атмосферного давления, обусловленные, например, изменениями барометрических условий или высоты, чтобы повысить точность измерения давления.
На фиг.12 изображен также внутренний управляющий модуль 132, имплантированный под кожу 154 пациента. Внутренний управляющий модуль 132 расположен в корпусе 94 нагнетательного порта 42. Как показано на фиг.12, вторичная катушка 156 TET/телеметрической связи во внутреннем управляющем модуле 132 принимает энергию и связные сигналы от наружного управляющего модуля 126. Катушка 156 образует настроенный резонансный контур, который индуктивно связан с первичной катушкой 130 TET для подвода энергии к имплантанту или первичной телеметрической катушке 144 для приема и передачи данных. Телеметрический приемопередатчик 158 управляет обменом данных с катушкой 156. Кроме того, внутренний управляющий модуль 132 содержит выпрямитель/регулятор 160 мощности, вышеописанный микроконтроллер 106, память 162, относящуюся к микроконтроллеру, температурный датчик 112, датчик 84 давления и схему 164 формирования сигнала для усиления сигнала от датчика давления. Внутренний управляющий модуль 132 передает измеренное давление, с поправкой на температуру, из датчика 84 давления в наружный управляющий модуль 126. В наружном модуле 126 принятый сигнал измеренного давления корректируется с учетом изменений давления окружающей среды и отображается на дисплее 66.
На фиг.13 представлен вид сбоку в сечении третьего варианта 170 осуществления измерения давления текучей среды в соответствии с настоящим изобретением. В третьем варианте осуществления 170 внутренний управляющий модуль 132 питается от внутреннего источника питания, например от батареи 172. Батарея 172 заменяет первичную и вторичную катушки 130, 156 TET для питания микроконтроллера 106 и других внутренних компонентов. В данном варианте осуществления система датчика давления содержит пару тензометрических датчиков 96, 98, как в первом варианте осуществления 88, для измерения механических деформаций диафрагмы 92, соответствующих изменениям давления в бандаже 38. Тензометрические датчики 96, 98 объединены в схему уравновешенного, температурно-скомпенсированного моста для измерения разностей давлений внутри закрытой гидравлической линии имплантата.
На фиг.14 представлена блок-схема системы измерения давления по изобретению в соответствии с третьим вариантом 170 осуществления, показанным на фиг.13. В варианте 170 осуществления применяется внутренний источник питания для питания внутреннего управляющего модуля 176 вместо системы питания на основе TET, примененной в первом варианте осуществления. Источник питания для имплантированного участка 32 представляет собой батарею 172 вместо первичной катушки 130 TET и вторичной катушки 156 TET, изображенных на фиг.12. В варианте осуществления, показанном на фиг.14, вторичная имплантированная катушка 156 применяется исключительно для обмена данными между внутренним и наружным управляющими модулями. Регулятор 174 мощности обеспечен для регулирования мощности, подаваемой батареей 172 для сохранения и продления срока службы батареи.
На фиг.15 изображен четвертый вариант 180 осуществления измерения давления текучей среды в регулируемом бандаже 38, в соответствии с которым применяют пассивную систему для измерения изменений давления в рабочей текучей среде. В данном четвертом варианте 180 осуществления к диафрагме 92 присоединен переменный конденсатор 182 для измерения механических деформаций диафрагмы. Переменный конденсатор 182 содержит первую обкладку 184, прикрепленную вблизи центра диафрагмы 92 на стороне, противоположной резервуару 80 для текучей среды. Вторая обкладка 186 конденсатора зафиксирована в положении внутри корпуса 94 посредством держателя 188 конденсатора. Каждая из обкладок 184, 186 конденсатора подсоединена к катушке 190 индуктивности, как показано линиями 192, для формирования резонансного контура. Когда давление текучей среды в резервуаре 80 повышается или снижается вследствие, например, изменений перистальтического давления на бандаж 38, то положение обкладки 184 конденсатора изменяется при деформации диафрагмы 92. Когда давление текучей среды увеличивается, диафрагма 92 нажимает на первую обкладку 184 конденсатора и тем самым увеличивает емкость и снижает резонансную частоту. Аналогично, когда гидравлическое давление в закрытой имплантированной линии снижается, первая обкладка 184 конденсатора движется вместе с диафрагмой 92 в направлении от второй обкладки 186, что уменьшает емкость резонансного контура и повышает резонансную частоту.
На фиг.16 изображен пятый вариант 196 осуществления измерения давления текучей среды в соответствии с настоящим изобретением. Пятый вариант 196 осуществления представляет собой альтернативный вариант осуществления пассивной системы датчика давления, в которой катушка 200 переменной индуктивности преобразует механические деформации диафрагмы 92 в измерительный сигнал давления. Как показано на фиг.16, катушка 200 индуктивности представляет собой плоскую катушку, расположенную с зазором под диафрагмой 92. Постоянный конденсатор 202 подсоединен к катушке 200 индуктивности, как показано линиями 204, для формирования резонансного индуктивно-емкостного (LC) контура 206. Когда диафрагма 92 деформируется вверх и вниз в ответ на изменения давления рабочей текучей среды, индуктивность катушки 200 изменяется. Когда давление текучей среды повышается, диафрагма 92 деформируется в направлении катушки 200, и вследствие этого индуктивность катушки 200 возрастает из-за связи на основе вихревых токов между металлической диафрагмой и катушкой. Напротив, когда давление текучей среды снижается, диафрагма 92 деформируется от катушки 200, и вследствие этого связь на основе вихревых токов ослабляется, и индуктивность катушки снижается. Соответственно, индуктивность катушки 200 обратно пропорциональна давлению рабочей текучей среды. Когда индуктивность катушки 200 изменяется, то изменяется резонансная частота LC-контура 206.
На фиг.17 представлена блок-схема системы измерения давления для четвертого и пятого вариантов 180, 196 осуществления изобретения. В данной системе микропроцессор 136 управляет схемой 208 индукционной катушки и индукционной катушкой 210. Микропроцессор 136 изменяет частоту индукционной катушки 210 для индуктивной связи катушки с LC-контуром 206 в имплантированном участке 32, как показано линией 212. Частота, на которой связаны внутренняя и наружная катушки, будет изменяться вместе с резонансной частотой имплантированного LC-контура 206. Резонансная частота имплантированного LC-контура будет изменяться вместе с давлением текучей среды в бандаже 38. Изменение резонансной частоты измеряется микропроцессором 136 посредством схемы 208 индукционной катушки. После определения, резонансную частоту можно сравнивать с известными давлениями на заданных частотах для определения давления текучей среды в бандаже 38. Графический интерфейс 140 пользователя в наружном модуле 214 отображает измеренное давление текучей среды на дисплее 66.
На фиг.18 графически представлен сигнал 216 давления от системы датчика давления согласно изобретению, например такой сигнал, который может представляться на дисплее 66 во время запроса пользователя. В примере, показанном на фиг.18, давление текучей среды первоначально измеряется устройством 60 считывания давления, когда пациент в стабильном состоянии, что дает, в результате, представленное установившееся показание давления. Далее, выполняется регулировка бандажа 38 для уменьшения размера стомы. Во время регулировки бандажа система датчика давления продолжает измерять давление текучей среды и передавать показания давления сквозь кожу пациента в устройство 60. Как видно из графика на фиг.18, показание давления немного повышается после регулировки бандажа. В приведенном примере пациенту впоследствии предписывают выпить жидкость для проверки точности регулировки. Когда пациент принимает питье, система датчика давления продолжает измерение пиков давления, обусловленных перистальтическим давлением глотания жидкости, и передает показания давления в наружный модуль 36 для отображения. В соответствии с настоящим изобретением измерение и визуальное отображение нагрузки сужающего устройства в зависимости от перистальтического движения желудка как во время, так и после регулировки, снабжает врача в реальном времени точным визуальным представлением реакции пациента на регулировку. Данное мгновенное текущее отображение регистрируемых данных давления позволяет врачу более точно выполнять регулировки бандажа. Данные можно отображать в течение времени для представления динамики изменения давления в зависимости от времени.
В дополнение к применению во время регулировок систему датчика давления по изобретению можно также использовать для измерения колебаний давления в сужающем устройстве через различные интервалы во время лечения. Периодический съем показаний давления допускает функционирование системы датчика давления в качестве диагностического инструмента, чтобы обеспечивать эффективную работу устройства ограничения приема пищи. В частности, систему датчика давления можно использовать для обнаружения состояния отсутствия давления в бандаже, что указывает на утечку текучей среды. И наоборот, систему можно использовать для обнаружения чрезмерных подъемов давления в бандаже, что указывает на излом катетера 44 или закупоривание внутри стомы.
Система датчика давления согласно изобретению также позволяет пациенту следить за собственным лечением с использованием наружного монитора, например наружного устройства 36, в домашних условиях. При использовании наружного устройства пациент может регулярно загружать показания давления в кабинете своего врача и тем самым сокращать количество посещений кабинета, необходимых для контроля за лечением пациента. Кроме того, пациент мог бы снимать показания давления в домашних условиях и информировать своего врача, когда давление в бандаже падает ниже заданного базового уровня, что указывает на потребность в регулировке устройства. Таким образом, система датчика давления согласно изобретению обладает преимуществами как инструмент не только диагностики, но и контроля во время лечения пациента устройством для лечения от ожирения.
Специалистам в данной области техники очевидно, что вышеописанное изобретение равным образом применимо к имплантируемым бандажам других типов. Например, бандажи применяются для лечения энкопреза. Один из таких бандажей описан в патенте США № 6461292, который включен в настоящее описание путем отсылки. Бандажи можно также применять для лечения энуреза. Один из таких бандажей описан в заявке на патент США № 2003/0105385, которая включена в настоящее описание путем отсылки. Бандажи можно также