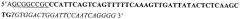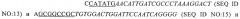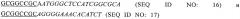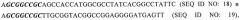Агенты и способы, основанные на применении домена eda фибронектина
Иллюстрации
Показать всеИзобретение относится к области медицины и касается агентов и способов, основанных на применении домена EDA фибронектина. Сущность изобретения включает применение полипептида, включающего аминокислотную последовательность домена EDA фибронектина, или его фрагмента, способного к связыванию TLR4, или варианта указанного домена для производства фармацевтической композиции, стимулирующей антиген-специфический иммунный ответ. Преимущество изобретения заключается в повышении стимулирующей способности. 9 н. и 27 з.п. ф-лы, 11 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение касается белкового вектора для молекулярного транспорта к клеткам, которые экспрессируют рецептор TLR4 (Toll-подобный рецептор 4), получения указанного белкового вектора и его применения, с определенным охватом области получения и применения фармацевтических композиций, особенно иммунотерапевтических композиций, для лечения и профилактики инфекционных и опухолевых болезней.
ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
Патогены и рак остаются лидирующими причинами смерти во всем мире. Разработка вакцин для профилактики болезней, для которых в настоящее время не существует ни одной вакцины, таких как СПИД или малярия, или для лечения хронических инфекций или рака, а также улучшение эффективности и безопасности существующих вакцин имеют приоритетное значение. В большинстве случаев разработка таких вакцин требует стратегий, обладающих способностью к специфическому стимулированию CD8+ цитотоксических Т-лимфоцитов (CTL).
CTL активируются путем презентации Т-клеточным рецепторам (TCR) коротких пептидов, связанных с молекулами класса I MHC. Эти комплексы пептидов МНС класса I присутствуют на поверхности антиген-презентирующих клеток (АРС), которые также способны к обеспечению костимулирующих сигналов, требуемых для оптимальной активации CTL.
Дендритные клетки (DC) представляют собой самые мощные АРС с уникальной способностью взаимодействовать с наивными Т-лимфоцитами и инициировать первичные иммунные ответы, активируя хелперные CD4+ и цитотоксические CD8+ Т-лимфоциты. Презентация антигена и Т-клеточная стимуляция ВС рассмотрены Guermonprez et al. ("Antigen presentation and Т cell stimulation by DC". Annu. Rev. Immunol. 2002, 20 : 621-627), который включен авторами путем ссылки.
В отсутствие продолжающихся воспалительных и иммунных ответов дендритные клетки патрулируют через кровь, периферические ткани, лимфу и вторичные лимфатические органы. В периферических тканях дендритные клетки захватывают собственные и несобственные антигены. Затем усвоенные антигены обрабатываются в протеолитические пептиды, и эти пептиды загружаются на молекулы класса I и II MHC (для активации CD8+ или CD4+ Т-лимфоцитов соответственно). Этот процесс захвата антигена, деградации и загрузки называют презентацией антигена. Однако, в отсутствие стимуляции, периферические дендритные клетки представляют антигены весьма неэффективно. Экзогенный(ые) сигнал(ы) от патогенов или эндогенный(ые) сигнал(ы) индуцирует(ют) вхождение дендритных клеток в программу развития под названием созревание, которая преобразовывает дендритные клетки в АРС и активаторы Т-лимфоцитов. Бактериальные и вирусные продукты, а также воспалительные цитокины и другие самомолекулы индуцируют созревание дендритных клеток путем прямого взаимодействия с собственными рецепторами поверхности дендритных клеток. Т-лимфоциты, через CD40-зависимые и независимые пути, и эндотелиальные клетки вносят свой вклад в окончательное созревание дендритных клеток через прямой контакт клетка-к-клетке и секрецию цитокинов. Вскоре после столкновения с опасным сигналом изменяется эффективность захвата антигена, внутриклеточный транспорт и деградация, а также внутриклеточное движение молекул МНС. Загрузка пептида, а также период полужизни и доставка к поверхности клетки молекул МНС увеличиваются. Поверхностная экспрессия Т-клеточных костимуляторных молекул также повышается. Таким образом, дендритные клетки становятся самыми мощными АРС и единственными, способными к активированию наивных Т-лимфоцитов и к инициированию адаптивных иммунных ответов. Одновременно с изменениями их антиген-презентирующих способностей, созревание также вызывает обширную миграцию дендритных клеток из периферических тканей. Изменения в экспрессии хемокиновых рецепторов и молекул адгезии, а также глубокие изменения организации цитоскелета способствуют миграции дендритных клеток, через лимфу, к вторичным лимфатическим органам.
Индукция созревания дендритных клеток
Дендритные клетки отвечают на два типа сигналов: прямое распознавание патогенов (через специфические рецепторы распознавания) и непрямое ощущение инфекции (через воспалительные цитокины, внутренние клеточные соединения и действующие специфические иммунные ответы). В ответ на эти сигналы дендритные клетки активируются и входят в программу созревания, которая преобразовывает дендритные клетки в эффективные стимуляторы Т-клеток. По крайней мере пять типов поверхностных рецепторов, как сообщалось, запускают созревание дендритных клеток: (i) Toll-подобные рецепторы (TLR), (ii) цитокиновые рецепторы, (iii) молекулы семейства TNF-рецепторов (TNF-R), (iv) FcR и (v) сенсоры для клеточной смерти. Некоторые из самых эффективных стимулов созревания опосредуются TLR (TLR1-9) взаимодействием с их соответствующими лигандами. Kaisho и Akira сделали обзор данных о Toll-подобных рецепторах ("Toll-like receptors as adjuvant receptors". Biochimica et Biophysica Acta, 2002, 1589: 1-13). TLR экспрессируются на макрофагах и дендритных клетках, а также на других клетках, таких как В-лимфоциты. Были также идентифицированы лиганды для нескольких TLR. Большинство этих лигандов получены из патогенов, но не обнаружены у хозяина, что свидетельствует о том, что TLR являются критическими для ощущения инвазии микроорганизмов. Распознавание лигандов с помощью TLR вызывает быструю активацию врожденного иммунитета путем индуцирования выроботки провоспалительных цитокинов и положительной регуляции костимуляторных молекул. Активированный собственный иммунитет впоследствии приводит к эффективному адаптивному имуннитету. Относительно TLR4, молекулярные типы, которые специфически распознаются, представляют собой LPS (Грам- бактерии), липотейхоевые кислоты (Грам+ бактерии), таксол, F белок (респираторносинцитиальный вирус), белок термического шока 60 и домен Фибронектина EDA.
Поэтому вакцина-кандидат, способная к индукции оптимальных ответов Т-клеток, должна соответствовать нескольким условиям. Во-первых, она должна нацеливаться на АРС для поставки антигенных Т-клеточных эпитопов молекулам класса I и/или II MHC. Таким образом, нацеливание на DC могло бы представлять главную цель в создании новых систем доставки для разработки вакцины. Кроме того, вектор должен доставлять соответствующие сигналы к DC, чтобы индуцировать их активацию. Доставка антигена к DC без сигнала созревания могла бы индуцировать толерантность, а не активацию Т-хелперных и цитотоксических клеток. Кроме того, на ее эффективность не должен влиять предварительно существующий иммунитет против вектора непосредственно.
Первый подход к доставке антигенных пептидов молекулам класса I и/или II МНС базируется на синтетических пептидных вакцинах, содержащих отобранные эпитопы, способные к связыванию непосредственно с этими молекулами на поверхности АРС. В некоторых случаях эти пептиды приводили к защите от опухоли или вирусной очистке на мышиных моделях, тогда как на других они привели к индукции толерантности. Испытания при участии людей, проводимые с различными типами пептидов, вызывали умеренные клинические ответы на рак.
В настоящее время разрабатывается большое количество различных стратегий. В основном их можно разделить на две категории. Первый тип основан на синтезе антигена АРС или его активной доставке в цитоплазму этих клеток и использует "классический" путь процессинга антигена МНС I. Второй тип использует возможность перекрестной презентации АРС и базируется на свободных или связанных с клеткой экзогенных антигенах. Доставка антигена в цитоплазму АРС была выполнена посредством бактериальных токсинов (Moron et al. "New tools for antigen delivery to the MHC class I pathway". TRENDS in Immunology, 2004; 25: 92-97). Например, ЕР 1188446 А1 касается белкового вектора, который основан на аденилатциклазном токсине Bordetella pertussis, для доставки молекул к CD11b экспрессирующим клеткам.
Настоящее изобретение касается экстра домена А фибронектина (EDA), возможного природного лиганда для TLR4, как теоретического средства для доставки антигена к TLR4 экспрессирующим клеткам, которые могли индуцировать соответствующий выбор и созревание АРС и, наконец, привести к эффективному специфическому ответу CTL. Фибронектиновые молекулы представляют собой продукты единственного гена, и полученный белок может существовать во множественных формах, которые являются результатом альтернативного сплайсинга одной пре-мРНК Pankov R. and Kenneth M.Y., "Fibronectin at a glance". Journal of Cell Science, 2002; 115: 3861-3863). Главный тип сплайсинга происходит в пределах центрального набора повторений типа III. Использование экзона или пропускание приводит к включению или исключению любого из двух повторений типа III: экстра домену В (также называемому EDB, EIIIB или EDII) и экстра домену А (также называемому EDA, EIIIA или EDI). Клеточные фибронектины, которые содержат полученные в результате альтернативного сплайсинга EDA и EDB, производятся в ответ на поражение ткани. Среди других биологических функций, показано, что EDA индуцирует высвобождение протеогликанов и экспрессию металлопротеиназ (ММР 1, 3, и 9) и провоспалительных цитокинов (для обзора см. Saito S. et al. "The Fibronectin Extradomain A activates matrix metalloproteinase gene expression by an interleukin-1-dependent mechanism", J. Biol. Chem. 1999; 161: 3071-3076). Также описано, что EDA способен к активированию TLR4, таким образом индуцируя LPS-подобные ответы (Okamura Y. et al., "The extra domain A of fibronectin activates Toll-like receptor 4", J. Biol. Chem. 2001; 276: 10229-10233).
Как указано прежде, разработка стратегий для укрепления иммунного ответа на антиген открывает дверь в область разработки вакцин для лечения рака или инфекционных болезней. Определенно, в случае вирусной инфекции гепатита С было описано, что иммунный ответ играет существенную роль в очистке от инфекции, поэтому использование усиливающих иммунитет стратегий составляет альтернативу для лечения и профилактики этой инфекции.
Вирус гепатита С (HCV) представляет собой вирус с однонитевой РНК, который принадлежит к семейству Flaviviridae (Miller R.H. and Purcell R.H. 1990. PNAS. 87: 2057). Этот вирус был признан одним из главных причинных агентов хронического гепатита и болезней печени, и по оценкам, он поражает 170 миллионов человек во всем мире (World-Health-Organisation. Hepatitis С. Wkly Epidemiol Rec. 1997; 72: 65). Одна из главных особенностей инфекции HCV состоит в ее высокой тенденции к хроническому течению (70% инфекций) и развитию цирроза печени (20%) с высоким риском развития карцином печени (Dienstag et al. Gastroenterology. 1983; 85: 439). Лечение с помощью IFN-α представляет наиболее распространенную терапию при инфекциях HCV, но она эффективна только у 20-30% пациентов, получающих лечение (Camps et al. J. Hepatol. 1993; 17: 390). Комбинация IFN-α и рибавирина улучшила эти результаты (30-40% пациентов очистились от вируса на длительный период), но все еще остается высоким процент пациентов, устойчивых к терапии (Poynard et al. Lancet. 1998; 352: 1426). Таким образом, разработка новых терапевтических стратегий для лечения хронического гепатита С имеет жизненно важное значение.
Геном HCV состоит из 9.6 килооснований, он содержит высококонсервативные некодирующие области на 5' и 3' концах, обрамляя достаточную рамку считывания, которая кодирует 3 структурных белка (ядро, Е1 и Е2) и по крайней мере 6 неструктурных белков (NS2, NS3, NS4a, NS5a и NS5b) (Major, ME and Feinstone SM. (1997). Hepatology, 25, 1527).
Вирусная очистка после острой инфекции HCV или после лечения с помощью IFN-α связана с присутствием сильного клеточного CD4 и CD8 иммунного ответа на вирусные белки. Особенно ответ CD4 на неструктурный белок NS3 HCV связан с вирусной очисткой после острой инфекции, тогда как отсутствие этого Т-клеточного ответа включает вирусную персистенцию и установление хронической инфекции (Diepolder et al. Lancet, 1995; 346: 1006, Раре et al. J. Viral Hepat, 1999; 6, Suppl 1: 26-40). Кроме того, различные исследования идентифицировали различные цитотоксические эпитопы в пределах белка NS3 у пациентов, инфицированных HCV. Эти данные свидетельствуют, что белок NS3 мог бы быть хорошей мишенью для индукции анти-HCV клеточного ответа.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение касается использования полипептида, включающего аминокислотную последовательность, соответствующую:
- домену EDA фибронектина (EDA), или
- фрагменту указанного домена EDA, обладающего способностью к связыванию TLR4, или
- варианту указанного домена EDA или фрагмента, обладающего способностью к связыванию TLR4 и имеющего более чем 70% гомологичности с какой-либо из природных форм или фрагментов домена EDA,
при создании иммунного клеточного ответа на антигенстимулирующий агент.
В настоящем изобретении этот агент включает и домен EDA фибронектина, и антиген, к которому желательно генерировать имунный ответ, причем эти компоненты присутствуют как отдельные объекты или связаны ковалентно.
В конкретном осуществлении изобретения указанный вариант домена EDA или фрагмента, способного к связыванию TLR4, процитированного в элементе с), отличается тем, что его аминокислотная последовательность получается в результате замены, добавления или делеции одной или нескольких аминокислот в полипептиде, определенном в элементах а) и b).
В предпочтительном осуществлении изобретения указанный фрагмент, способный к связыванию элемента с), отличается тем, что он имеет более чем 85% степень гомологичности с любой природной формой домена EDA или его соответствующим фрагментом, и в более предпочтительном осуществлении он имеет более чем 95% степень гомологичности с указанной природной формой домена EDA фибронектина или его соответствующим фрагментом.
Согласно изобретению в конкретном осуществлении аминокислотная последовательность домена EDA фибронектина представляет собой последовательность любой природной формы EDA, обладающей способностью к связыванию TLR4. Этот домен EDA может быть выбран среди природных форм домена у любых видов животных, особенно млекопитающих, например грызунов (мышей, крыс и т.д) или приматов (особенно людей).
В другом конкретном осуществлении иммуностимуляторные агенты включают частичную аминокислотную последовательность домена EDA, которая отличается тем, что обладает способностью к связыванию TLR4.
В еще одном конкретном осуществлении изобретения домен EDA представляет собой модифицированный вариант любой из природных форм или фрагментов указанного домена EDA и также отличается тем, что сохраняет способность связывания с TLR4. В конкретном варианте осуществления такой вариантный домен EDA имеет более чем 70% гомологичность с любой из природных форм домена EDA. Соответствующий модифицированный вариант может быть отобран путем первого сравнения последовательности природной формы домена EDA фибронектина или ее фрагмента с другими кандидатами полипептидных последовательностей. Любой алгоритм выравнивания (например, FASTA, Lipman DJ, Pearson WR. Rapid and sensitive protein similarity searches. Science. 1985 Mar 22; 227 (4693): 1435-41) или программное обеспечение (например, Jellifish от Labvelocity Inc или программное обеспечение Blast от NCBI) может использоваться для анализа гомологичности. Впоследствии кандидаты полипептидных последовательностей, имеющие больше чем 70% гомологичность, проверяются на их способность к TLR4 связыванию. Свойства связывания TLR4 можно оценить с помощью любого стандартного определения связывания, например при использовании проточной цитометрии, как описано в The Current Protocols in Immunology и в The current protocols in Protein Science, опубликованных John Wiley & Sons (под редакцией: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober) (периодически обновляемые. Обновление по состоянию на 1 мая 2005 года).
В одном варианте осуществления изобретения домен EDA включает последовательность, отобранную из:
a) полной аминокислотной последовательности мышиного домена EDA (Entrez Protein: NM_010233, аминокислоты 1721-1810; SEQ. ID. NO: 2, аминокислоты 2-91);
b) полной аминокислотной последовательности человеческого домена EDA (Entrez Protein NM_002026, аминокислоты 1631-1716; SEQ. ID. NO: 4); и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
В другом конкретном осуществлении указанный домен EDA включает последовательность, отобранную из:
a) аминокислот 2-57 из SEQ. ID. NO: 6, которая соответствует альтернативно соединенной форме домена EDA мышиного фибронектина;
b) SEQ. ID. NO: 8, которая является альтернативно соединенной формой человеческого домена EDA; и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
В некоторых вариантах осуществления иммуностимуляторный агент может дополнительно включать одну или несколько рассматриваемых молекул. При присутствии в иммуностимуляторном агенте рассматриваемая молекула может вводиться в количестве, которое, в комбинации с другими компонентами агента, является эффективным для создания иммунного ответа против молекулы.
В предпочтительном осуществлении домен EDA (или его фрагмент или вариант) и рассматриваемая молекула соединены вместе в той же самой гибридной молекуле или белковом векторе.
В другом аспекте настоящее изобретение касается белкового вектора, описаного выше, в котором указанная рассматриваемая молекула выбирается из группы, состоящей из полипептидов, липопептидов, олигосахаридов, полисахаридов, нуклеиновых кислот, липидов и химических веществ.
В конкретном осуществлении белкового вектора указанная рассматриваемая молекула представляет собой антиген или эпитоп. В одном варианте осуществления изобретения антиген, соединенный с вектором, представляет собой вирусный антиген, бактериальный антиген, антиген гриба или паразитарный антиген. В конкретном осуществлении указанный вирусный антиген представляет собой вирусный антиген из вируса гепатита С и в предпочтительном осуществлении указанный антиген вируса гепатита С представляет собой NS3 белок или его антигенный фрагмент. Белок NS3 относится к неструктурному белку NS3 вируса гепатита С, 67 кДа белку, который включает два домена, серинпротеазу, которая включает 189 аминокислот с N-конца и геликазо-нуклеозид трифосфатазу, которая включает 442 аминокислоты с С-конца. Последовательность белка NS3, включенная в белковый вектор изобретения, может соответствовать любому штамму или изоляту из человеческого вируса гепатита С.
В другом варианте осуществления указанный антиген представляет собой опухолевый антиген или опухолевую антигенную детерминанту. Используемый авторами термин «эпитоп» касается пептидной последовательности, которая связывается с молекулами класса I или класса II МНС и может быть распознана Т-клеточными рецепторными молекулами CD8+ или CD4+ Т-клеток соответственно и индуцировать иммунный ответ.
В конкретном осуществлении указанная рассматриваемая молекула представляет собой антигенную цитотоксическую Т-детерминанту из яичного альбумина (OVA 257-264) или SIINFEKL (SEQ. ID. NO: 2, аминокислоты 95-102, которая фланкирована 3 дополнительными аминокислотами на С-конце и N-конце эпитопа, QLE-SIINFEKL-TEW).
Антиген может представлять собой любой материал, способный к созданию Th иммунного ответа, CD8+ Т лимфоцитарного ответа, NK клеточного ответа, γ/δ Т лимфоцитарного ответа или ответа антител. Не ограничиваясь ими, соответствующие антигены включают пептиды, полипептиды, липиды, гликолипиды, полисахариды, углеводы, полинуклеотиды, прионы, бактерии, вирус или живые или инактивированные грибы; и антигены, полученные из бактерий, вирусов, грибов, простейших, опухолей или микроорганизмов, токсинов или токсоидов.
В другом конкретном осуществлении белкового вектора указанная рассматриваемая молекула представляет собой аллерген.
Таким образом, домен EDA действует так же как вектор для доставки антигена к TLR4 экспрессирующим клеткам.
В другом особенно интересном осуществлении изобретения указанная рассматриваемая молекула представляет собой химическое вещество или препарат, химически или генетически соединенный с белковым вектором. Таким образом, указанный белковый вектор используется для специфического нацеливания препарата на TLR4 экспрессирующие клетки.
В конкретном осуществлении белковый вектор также отличается тем, что он также содержит Tag последовательность, например, N-терминальный гистидиновый хвост. Это упростит процесс очистки при получении белкового вектора с помощью методов генной инженерии. Например, последовательности SEQ. ID. NO: 2 и SEQ. ID. NO: 6 представляют собой конкретное осуществление белкового вектора изобретения. В конкретном неограничивающем осуществлении настоящего изобретения белковый вектор включает последовательность SEQ ID. NO: 10, которая содержит фрагмент белка NS3.
Домен EDA, включенный в белковый вектор, отличается тем, что он связывается с TLR4 и, кроме того, облегчает перемещение рассматриваемой молекулы в цитозоль TLR4 экспрессирующих клеток.
Изобретение также касается использования белкового вектора для нацеливания и перемещения рассматриваемой молекулы к TLR4 экспрессирующим клеткам. В конкретном осуществлении TLR4 экспрессирующие клетки представляют собой любой вид антиген-презентирующих клеток (АРС). В предпочтительном варианте осуществления такие АРС представляют собой дендритные клетки.
В конкретном осуществлении изобретения белковый вектор отличается тем, что он облегчает перемещение рассматриваемого антигена или эпитопа, дополнительно улучшая процессинг и погрузку на молекулы МНС для презентации антигена Т-лимфоцитам.
В другом осуществлении белковый вектор отличается тем, что он обладает способностью к стимулированию созревания нацеливаемых АРС, таким образом увеличивая экспрессию молекул МНС и костимулирующие сигналы. В конкретном преимущественном варианте осуществления белковый вектор отличается тем, что он обладает способностью к одновременному индуцированию презентации антигена и стимулированию созревания АРС, таким образом индуцируя эффективный антиген-специфический имунный ответ. В более предпочтительном варианте осуществления этот антиген-специфический имунный ответ представляет собой ответ CTL.
Белковый вектор изобретения может быть получен рекомбинантной технологией ДНК. Таким образом, в другом аспекте изобретение касается модифицированной нуклеиновой кислоты, кодирующей белковый вектор изобретения. Эта нуклеиновая кислота может легко быть выведена из аминокислотной последовательности белкового вектора.
Эта модифицированная нуклеиновая кислота может содержаться в пределах конструкции ДНК. Таким образом, изобретение предлагает конструкцию ДНК, включающую нуклеиновую кислоту, которая кодирует белковый вектор изобретения. Эта конструкция ДНК может включать контрольную последовательность, оперативно связанную с нуклеиновой кислотой, кодирующей белковый вектор изобретения. «Оперативно связанный», по отношению к нуклеиновым кислотам, означает, что нуклеиновые кислоты расположены в функциональной взаимосвязи с другой последовательностью нуклеиновых кислот. «Контрольные последовательности» представляют собой сигналы экспрессии, распознаваемые определенной клеткой-хозяином, которые регулируют функции, такие как транскрипция и трансляция определенных кодирующих последовательностей (к примерам контрольных последовательностей принадлежат промотеры, усилители, терминаторы транскрипции, рибосом-связывающиеся участки, сигнальные пептиды для секреции белка или для других подклеточных расположений). Соединение желательных последовательностей достигается путем лигации на удобных сайтах рестрикции. Если такие сайты не существуют, используются синтетические олигонуклеотидные адаптеры или линкеры в соответствии со стандартными методами. Преимущество в этом смысле представляет собой тот факт, что эта конструкция ДНК также включает маркер или ген, который кодирует мотив или фенотип, который позволяет выбирать трансформированную клетку-хозяина посредством конструкции ДНК. Модифицированная нуклеиновая кислота и конструкция ДНК, предоставленная в соответствии с этим изобретением, могут быть получены с помощью известных стандартных методов, которые подытожены во многих лабораторных руководствах (например, "Molecular Cloning: a Laboratory manual". Joseph Sambrook, David W. Russel Eds. 2001, 3rd ed. Cold Spring Harbor, New York).
В конкретном осуществлении модифицированная нуклеиновая кислота или конструкция ДНК, предложенная в соответствии с изобретением, включает SEQ ID. NO: 1, SEQ. ID. NO: 5, SEQ. ID. NO: 9 (EDA-NS3) или SEQ. ID. NO: 11 (EDA-OVA).
Модифицированная нуклеиновая кислота или конструкция ДНК, предложенная в соответствии с этим изобретением, может быть вставлена в соответствующий вектор. Таким образом, в другом аспекте изобретение касается вектора, такого как вектор экспрессии, который включает упомянутую модифицированную нуклеиновую кислоту или конструкцию ДНК. Выбор вектора будет зависеть от клетки-хозяина, в которую он должен быть вставлен. Например, вектор, в который вставляется нуклеиновая кислота, может представлять собой плазмиду или вирус, которые, при инсерции в клетку, могут или нет интегрироваться в геном клетки. Вектор может быть получен обычными методами (Sambrook и др., 2001, процитированный выше).
В другом аспекте изобретение касается клетки-хозяина, такой как трансформированная клетка-хозяин, которая включает модифицированную нуклеиновую кислоту или конструкцию ДНК, предложенную в соответствии с этим изобретением. Согласно изобретению клетка-хозяин экспрессии представляет собой прокариоту, например Escherichia coli, или эукариотического хозяина, то есть дрожжи (например, Saccharomyces cerevisiae, Pichia Pastoris), клетки насекомого или клетки млекопитающих.
В другом конкретном осуществлении изобретения вектор экспрессии, включающий модифицированную нуклеиновую кислоту или конструкцию ДНК, которая кодирует белковый вектор изобретения, предназначен для in vivo генного переноса или терапии. В более конкретном варианте осуществления указанный вектор экспрессии представляет собой вирусный вектор. Соответствующие вирусные векторы для этой цели включают: полученные из аденовируса векторы, аденоассоциированные векторы, полученные из ретровируса, лентивируса, альфавируса, гермевируса, коронавируса и т.д.
В другом аспекте изобретение касается способа для получения белкового вектора изобретения, включающего культивирование клетки-хозяина, содержащей модифицированную нуклеиновую кислоту или конструкцию ДНК изобретения, при условиях, позволяющих экспрессию белкового вектора. Условия для оптимизации культуры клетки-хозяина будут зависеть от типа применяемой клетки-хозяина. Если желательно, процедура для получения белкового вектора изобретения включает его выделение и очистку.
Альтернативно, белковый вектор изобретения может быть получен другими стандартными способами. Такие способы включают, например, твердофазный химический синтез; очистку с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ); и, если предпочтительно, анализ обычными методами, такими как секвенирование или масс-спектрометрия, аминокислотный анализ, методы магнитного резонанса и т.д.
В другом осуществлении белковый вектор изобретения может быть получен ковалентным связыванием полипептида с аминокислотной последовательностью, соответствующей домену EDA фибронектина (EDA), или фрагменту указанного домена EDA, способного к связыванию TLR4, или варианту указанного домена EDA, с рассматриваемой молекулой (например, полипептидами, липопептидами, олигосахаридами, полисахаридами, нуклеиновыми кислотами, липидами или другими химическими веществами). Это можно выполнить путем использования стандартных методов, подытоженных в лабораторных руководствах, например "The current protocols in protein chemistry", опубликованных John Wiley & Sons (periodically updated. Updated up to May 1, 2005), или "Immobilized affinity ligand Techniques", GT Hermanson, AK Mallia and PK. Smith, Academic Press, Inc. San Diego, CA, 1992.
Впоследствии согласно изобретению белковый вектор или модифицированная нуклеиновая кислота и конструкции ДНК, кодирующие его, или векторы экспрессии и клетки-хозяины экспрессии, включающие указанные нуклеиновые кислоты или конструкции ДНК, могут использоваться для получения фармацевтической композиции.
В другом варианте осуществления настоящее изобретение касается использования полипептида с аминокислотной последовательностью, соответствующей домену фибронектина EDA (EDA), или его фрагменту, или варианту, как предварительно описано, для получения иммуностимуляторного агента, отличающегося тем, что указанный агент представляет собой фармацевтическую композицию.
В определенных вариантах осуществления фармацевтическая композиция изобретения может использоваться для стимуляции созревания антиген-презентирующих клеток или для индукции эффективного иммунного ответа, специфического для рассматриваемой молекулы. В конкретном варианте осуществления указанная фармацевтическая композиция может использоваться для индукции Th1 иммунного ответа у субъекта, которому вводят иммуностимуляторную композицию. Используемый авторами термин "индуцирование Th1 иммунного ответа" может включать случаи, в которых иммуностимуляторная композиция индуцирует смешанный Th1/Th2 ответ. В других случаях, однако, иммуностимуляторная композиция может индуцировать Th1 имунный ответ с маленькой или практически отсутствующей индукцией Th2 иммунного ответа. В конкретном варианте осуществления указанная фармацевтическая композиция может использоваться для создания ответа CTL.
В некоторых вариантах осуществления иммуностимуляторная композиция может использоваться в качестве иммуностимуляторного адъюванта, например, в комбинации с одним или несколькими антигенами, с или без дополнительных адъювантов. Таким образом, в некоторых случаях иммуностимуляторная композиция может формировать вакцину. В других случаях иммуностимуляторная композиция может служить в качестве адъюванта, который может использоваться в связи с вакциной.
Иммуностимуляторная композиция, которая включает полипептидсодержащий домен фибронектина EDA (или его фрагмент или вариант), может увеличить развитие активизированных CD8+ Т-лимфоцитов, образование CD8+ Т-лимфоцитов памяти или и то, и другое. Таким образом, иммуностимуляторная композиция изобретения может увеличить антиген-специфический клеточный иммунитет у субъекта, который получает иммуностимуляторную композицию.
В конкретном осуществлении иммуностимуляторная композиция, включающая домен EDA фибронектина (или его фрагмент или вариант), используется для лечения и профилактики инфекционной болезни, опухолевой болезни или аллергической болезни. В конкретном варианте осуществления настоящего изобретения указанная композиция используется для лечения и профилактики гепатита С.
Иммуностимуляторная композиция, включающая домен EDA фибронектина (или его фрагмент или вариант), может дополнительно содержать носители, вспомогательные вещества и другие известные фармацевтически приемлемые компоненты.
Иммуностимуляторную композицию изобретения можно вводить животным, например млекопитающим (человеку или не человеку), домашней птице и т.п., согласно обычным методам, которые известны квалифицированным специалистам в данной области (например, перорально, подкожно, назально, местно).
Изобретение также предлагает терапевтический и/или профилактический способ, который включает введение иммуностимуляторной композиции, включающей домен EDA фибронектина (или его фрагмент или вариант), субъекту.
Подходящие пути введения включают трансдермальное или трансмукозальное всасывание, инъекцию (например, подкожную, внутрибрюшинную, внутримышечную, внутривенную и т.д.), пероральный прием, ингаляцию и т.п.
В другом дальнейшем аспекте изобретение касается фармацевтической композиции, которая включает по крайней мере один приемлемый фармацевтический носитель и эффективное количество белкового вектора в по крайней мере одной из его форм экспрессии или вариантах осуществления:
a) белковый вектор в полипептидной форме;
b) модифицированная нуклеиновая кислота, кодирующая указанный белковый вектор;
c) вектор экспрессии, включающий указанную модифицированную нуклеиновую кислоту; или
d) клетки-хозяины экспрессии, также включающие указанную модифицированную нуклеиновую кислоту.
В другом конкретном осуществлении фармацевтическая композиция отличается тем, что она включает эффективное количество дендритных клеток, указанные дендритные клетки были инкубированы in vitro с белковым вектором в по крайней мере одной из его форм экспрессии или вариантов осуществления. В более конкретном варианте осуществления указанная фармацевтическая композиция представляет собой вакцину или иммунотерапевтическую композицию.
Кроме того, авторами предлагаются некоторые дополнительные виды использования белкового вектора. В одном варианте осуществления изобретения белковый вектор в любой из его форм экспрессии используется для получения фармацевтической композиции, эффективной для индуцирования созревания дендритных клеток in vitro или in vivo.
В другом варианте осуществления указанный белковый вектор используется для получения фармацевтической композиции для индуцирования специфического иммунного ответа, специфического против рассматриваемой молекулы (антигена или эпитопа), соединенной с белковым вектором. Этот имунный ответ представляет собой гуморальный имунный ответ (продукцию антител против рассматриваемой молекулы), Т-хелперный ответ или цитотоксический Т-клеточный ответ. В предпочтительном варианте осуществления указанный иммунный ответ представляет собой ответ CTL.
В более конкретном осуществлении изобретение касается использования белкового вектора для получения фармацевтической композиции для лечения и профилактики инфекционной болезни. Указанная инфекционная болезнь может быть бактериальной, вирусной, грибковой или паразитарной инфекционной болезнью.
В другом конкретном осуществлении изобретение касается использования белкового вектора изобретения для получения фармацевтической композиции, полезной для лечения и профилактики опухолевой болезни.
В еще одном конкретном осуществлении изобретение касается использования белкового вектора для получения фармацевтической композиции, полезной для лечения и профилактики аллергической болезни. Множество аллергических болезней связано с активацией Th2 иммунного ответа. Таким образом, отклонение или переключение из Th2 на Th1 ответ при использовании белкового вектора, несущего специфический аллерген, могло бы иметь защитный или терапевтический эффект на аллергическую болезнь.
Согласно конкретному варианту осуществления изобретения предложенная фармацевтическая композиция используется для введения животному или человеческому хозяину. Может использоваться любой подходящий путь введения. В конкретном осуществлении фармацевтическая композиция вводится парентеральным путем (то есть внутривенным, подкожным, внутримышечным), трансдермальным путем или трансмукозальным путем.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Анализ SDS-PAGE полученных и очищенных EDA и EDA-SIINFEKL белков. Одна аликвота EDA и EDA-SIINFEKL белков была загружена на 15% полиакриламидный гель и подвергнута электрофорезу. Маркеры молекулярной массы (MWM) обозначены в кДа. Наблюдается полоса, соответствующая предполагаемой молекулярной массе EDA и EDA-SIINFEKL белков (13-14 кДа).
Фигура 2. Связывание белкового вектора EDA-SIINFEKL с TLR4. 2А. Прямое определение связывания. Клетки HEK293-LacZ (HEK293-LacZ) и клетки HEK293-TLR4/MD2/CD14 (HEK293-TLR4) пульсировали с помощью 1 мкМ EDA-SIINFEKL, зафиксировали параформальдегидом, промаркировали анти-His и анти-EDA антителами, образовавшимися с помощью IgG-FITC анти-мышь, и проанализировали проточной цитометрией. 2В. Способность EDA ингибировать связывание анти-TLR4 антител с TLR4-экспрессирующими клетками. Клетки HEK-TLR4 были инкубированы в течение 2 часов при 4°С в присутствие или отсутствие 500 нМ белка EDA-SIINFEKL. Клетки были промыты и инкубированы с анти-TLR4 антителами, окрашены с помощью FITC и проанализированы проточной цитометрией. 2С. Процент ингибирования связывания анти-TLR4 антитела с TLR4-экспрессирующими клетками посредством использования различных концентраций белка EDA-SIINFEKL. 2D. Испытания клеточной адгезии. HEK-hTLR4 или HEK-LacZ клетки, окрашенные с помощью меченного тритием тимидина, были диспергированы в лунке 96-лункового микропланшета, предварительно покрытого белком EDA, и инкубировались в течение 2 часов при 37°С. Неприлипающие клетки были устранены, тогда как прилипающие клетки были собраны, и определялась объединенная радиоак