Способ получения нейрональной матрицы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу получения нейрональной матрицы. Способ включает наращивание биомассы эмбриональных стволовых клеток человека безфидерной линии hESKM-05 с использованием основной среды mTeSR во флаконах, покрытых 0.1% раствором желатина. Наращивание осуществляют с использованием и ежедневной сменой основной среды коДМЕМ, содержащей 10% заменитель сыворотки SR, 100 мкг/мл канамицина сульфата, 1 мМ раствора L-глутамина, 4 нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствора незаменимых аминокислот. Получают кондиционированную среду от культуры эмбриональных нейрональных клеток мышей. Проводят перенос наращенной биомассы с помощью 0,5% раствора коллагеназы во флаконы, содержащие подготовленную коллаген-хитозановую матрицу в кондиционированной среде или в полной питательной среде с добавлением нейронального фактора N2. Среду меняют каждые трое суток. Предложенное изобретение позволяет получать нейрональную матрицу, пригодную для прямой трансплантации. 1 з.п. ф-лы, 16 ил.
Реферат
Изобретение относится к биологии и медицине, а именно к неврологии и нейрохирургии, к клеточной нанобиотехнологии и биоинженерии, трансплантологии, и может быть использовано для культивирования, пролиферации и дифференцировки стволовых клеток в клетки нейрональной природы с целью трансплантации.
Ежегодно в РФ число людей с осложненной травмой позвоночника и выживших после нее составляет 1500 человек. Данные пациенты нуждаются в оперативном вмешательстве в связи с прямыми показаниями к реконструкции спинного мозга. В настоящее время методы лечения таких больных, особенно если травма осложнена анатомическим разрывом спинного мозга, малоэффективна. Кардинальным решением данной проблемы может стать пересадка аутологичной нервной ткани или же создание при использовании клеточных технологий нейрональных эквивалентов с высокой пролиферативной активностью из стволовых клеток. Цель заявляемой клеточной инженерии - создать условия в клеточной культуре для формирования пула клеток нейронального направления. Это может быть достигнуто с помощью подложки или трехмерной матрицы со специальным микроокружением, создающим в процессе пролиферации и дифференцировки структуру нервной ткани.
Известны способы формирования клеточных матриц с целью лечения спинальной травмы путем использования наномикросферной системы доставки биологических активных факторов, а также путем применения мезенхимальных клеток из пупочной вены. Первый способ основан на использовании нано- и микросфер из искусственных биодеградируемых и биосовместимых полимеров и сополимеров. Использование данной разработки направлено на индукцию восстановления нервов в области травмы за счет фермента хондрайтиназы, который разрушает гликозаминогликаны, являющиеся основными ингибиторами элонгации аксонов [1-3]. Кроме того, в полимерные наноструктуры включены антитела, нейротропины, гормональные факторы роста, которые также способствуют удлинению аксонов [4-6].
Известен способ, основанный на создании из биодеградируемых полимерных матриц спинномозговых хирургических имплантантов [7]. Такие матрицы образуют трубку для соединения концов разрыва спинного мозга и включают в свой состав хондрайтиназу, факторы роста или же шванновские клетки, пересаживаемые на субстрат перед трансплантацией.
Известен способ, основанный на получении фетальных стволовых клеток, посаженных на фибриновый гель, для целей трансплантации в область разрыва спинного мозга. Кроме того, для пересадки используют тот же фибриновый гель, содержащий фетальный спинной мозг, обогащенный клетками выстилки луковицы обонятельного нерва [8]. Использование такого метода обусловлено тем, что пересаживаемые клетки способны выделять различные факторы роста аксонов, а также способствуют быстрому восстановлению связей между нейронами. [9].
Известно использование в качестве подложки для аутологических стволовых клеток гетерогенного коллагенового матрикса «Сферогель», который включает в себя антибактериальные препараты, факторы роста и дифференцировки [10, 11]. Известно, что используют тканеинженерные конструкции для восстановления ЦНС и периферической НС. Так, Брюховецкий с соавторами [12] использовали гелеобразный полимерный матрикс для доставки СК в зону повреждения при спинальной травме [13]. Трехмерные конструкции из биополимеров способствуют созданию трансплантата с приближенными по свойствам к биологическим тканям. В частности, были получены трубки из коллагена или ПГА с гелем коллагена внутри и имплантированными нервными и швановскими клетками [14, 15]. Использование лиофилизированного геля коллагена 1 типа и хондроитин сульфата в качестве трехмерной матрицы для инжиниринга ткани легких было описано в 2005 году [16].
Однако все указанные способы не ставят своей задачей предварительную дифференцировку эмбриональных стволовых клеток на матрицах в клетки нейрональной природы, а используют по назначению на различных матрицах уже готовые аллогенные стволовые клетки или готовые нейроны, или замещающие их клетки. Кроме того, применяемые матрицы не используют подложки с включенными в них компонентами полной и кондиционированной нейрональной питательных сред, обладающие биосовместимостью, биодеградируемостью, исключающие цито- и генотоксичность. В результате такого подхода стволовые клетки не получают полноценного микроокружения из внеклеточного матрикса за счет иммобилизованных факторов роста и дифференцировки с помощью кондиционированной среды, что не создает условий для направленной дифференцировки и пролиферации стволовых клеток. Кроме того, использование указанных матриц не создает условий для высокой адгезии клеток к матрице и сопровождается их потерей при культивировании на подложке в результате недостаточной биосовместимости с ингредиентами подложки. Предлагаемые авторами матрицы не создают условий для высокой пролиферации и дифференцировки стволовых клеток в нейрональные клетки, кроме того, матрицы не обладают трехмерной структурой для построения функциональной ткани из продуктов распада носителя.
Одно из возможных негативных последствий при имплантации ЭСК в организм - это формирование тератом, что показано на иммунодефицитных (безтимусных) мышах. В этой связи наиболее вероятное использование этих клеток в медицине в виде их дифференцированных производных. В работе Анисимова и научной группы Павловой было показано, что использование трехмерных матриц с культивируемыми на них ЭСК позволяет дифференцировать последние в нейрональные клетки при подсадке в головной мозг и при этом не образуются тератомы. Однако дифференцировка ЭСК в нейрональные клетки на матрицах идет с предварительным культивированием их в специальной среде с последующим переносом этих клеток на матрицу, что усложняет работу и увеличивает риск контаминации.
Существуют различные способы стимулирования эмбриональных стволовых клеток к образованию нейронов, олигодендроцитов или клеток шванновской оболочки.
В работах McDonald с сотрудниками [17] и Wichterle [18] была показана дифференцировка ЭСК в олигодендроциты с последующей миелинизацией у крыс со спинальной травмой.
Однако предложенные способы культивирования нейрональных клеток, несмотря на высокий выход специализированных клеток, не могут быть эффективно использованы для трансплантации, поскольку в этих протоколах для переноса клеток с культуральных флаконов используют растворы энзимов (трипсина, коллагеназы, деспазы и т.п.), что приводит к увеличению уровня апоптоза, клеточной гибели, повреждению поверхностных клеточных рецепторов [19, 20]. Возрастает вероятность контаминации и усложняется процедура трансплантации, что существенно снижает их число и жизнеспособность в результате повреждения поверхностных рецепторов при переносе и активации реакции запрограммированной клеточной гибели.
Общими недостатками известных способов получения клеток нейрональной природы из стволовой клеточной массы являются низкое их содержание при культивировании, наличие опасности малигнизации стволовых клеток при их трансплантации без предварительной дифференцировки в нейроны или олигодендроциты, ожидаемого тератогенного эффекта по причине отсутствия полного микроокружения, формируемого из внеклеточного матрикса. К серьезным недостаткам можно отнести опасность тромбообразования в массе культивируемых стволовых и нейрональных клеток, адгезированных на поверхности матрицы. Применение рекомбинантных белков или генетически трансформированных клеток, повышающих стоимость производства таких матриц, сопровождается формированием иммунного ответа на трансплантацию матрицы не только при использовании аллоклеточной массы, но и в случае использования аутоклеток. Кроме того, известные матрицы не обладают антибактериальными свойствами и не индуцирует неоваскуляризацию, необходимую для формирования нервной ткани при повреждениях центральной нервной системы, в частности спинного мозга.
Наиболее близкими к предлагаемому по составу являются матрицы, в качестве подложки которых используют коллаген-хитозановую конструкцию, содержащую полную и кондиционированную питательные среды. Подложка обладает антибактериальными свойствами и индуцирует неоваскуляризацию, создает высокую биосовместимость благодаря присутствию хитозана с высокой степенью деацетилирования, хондроитинсульфата, гиалуроновой кислоты и гепарина. Кроме того, коллаген-хитозановая подложка повышает качество и стабильность культивирования, пролиферативную активность стволовых плюрипотентных клеток различного происхождения, исключает цито-генотоксичность клеточной подложки и обработку клеток ферментами в процессе пассирования при смене питательной среды, повышает прикрепление клеток к поверхности матрицы, обеспечивает получение клеточной матрицы, пригодной для прямой трансплантации, исключает тромбообразование при культивировании стволовых клеток в присутствии гепарина [19]. Однако матрица, предложенная авторами, относится к способу получения клеточной матрицы кожи, а не клеток нервной системы, так как микроокружение, создаваемое для стволовых клеток, направлено на дифференцировку их в клетки кожи (фибробласты, эпидермобласты).
Задача изобретения - повысить качество и стабильность культивирования, пролиферативную активность стволовых плюрипотентных клеток с их дифференцировкой в нейрональные клетки, исключить иммуногенность микроокружения клеток и обеспечить получение нейрональной матрицы, пригодной для прямой трансплантации. Задачу достигают за счет того, что биомассу эмбриональных стволовых клеток человека безфидерной линии hESKM-05 первоначально наращивают во флаконах, покрытых 0.1% раствором желатина, с использованием и ежедневной сменой основной среды коДМЕМ, содержащей 10% заменитель сыворотки SR, 100 мкг/мл капамицина сульфата, 1 мМ раствора L-глутамина, 4 нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствора незаменимых аминокислот, а затем переносят с помощью 0,5% раствора коллагеназы во флаконы, содержащие коллаген-хитозановую матрицу в кондиционированной от эмбриональных нейрональных клеток мышей среде или полной питательной среде с добавлением нейронального фактора N2, которую меняют каждые трое суток, при этом матрицу используют в виде губки, пленки, микросфер, геля или волокон.
Способ осуществляют следующим образом. На первом этапе культивируют плюрипотентные клетки человека линии hESKM-05 (безфидерная animal-free линия, полученная центром репродуктивного здоровья (ЦРМ) г.Красноярска совместно с Институтом общей генетики РАН г.Москвы). Первоначально для наращивания биомассы используют основную среду коДМЕМ с добавлением 10% SR (заменитель сыворотки), 100 мкг/мл канамицина сульфата, 1 мМ L-глутамина, 4 нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствора незаменимых аминокислот. Наращивание клеточной биомассы проводят во флаконах, покрытых 0.1% раствором желатина. Смену среды осуществляют ежедневно. Состояние колоний оценивают визуально с помощью микроскопа Olympus BX51. На втором этапе получают кондиционированную питательную среду от культуры эмбриональных нейрональных клеток, полученных из 7-10-дневных фетусов беспородных мышей. Для этого культивирование клеток проводят при 37°С в среде ДМЕМ с добавлением 10% эмбриональной телячьей сыворотки (ЭТС), 100 мкг/мл сульфата, 1 мМ L-глутамина. Среду на третьи сутки собирают, фильтруют через 0,22 мкм ацетат-целлюлозный фильтр. На третьем этапе используют коллаген-хитозановое раневое покрытие «Коллахит-бол» [21, 22]. Для этого раневое покрытие предварительно замачивают в стерильном бикарбонатном буфере для понижения его кислотных свойств. После фазы нейтрализации покрытие промывают трижды стерильным фосфатным буфером Дульбекко, помещают во флаконы, добавляют кондиционированную среду, полученную от культуры эмбриональных нейрональных клеток мышей, либо среду ДМЭМ с добавлением нейронального компонента N2 согласно инструкции производителя. Сверху на коллаген-хитозановое раневое покрытие наслаивают суспензию эмбриональных стволовых клеток человека линии hESKM-05.
По истечении 5-7 суток культивирования проводят формальдегидную фиксацию клеток с последующим иммуноцитохимическим анализом с помощью антител против глиального фибриллярного кислого белка (GFAP) - маркера астроцитов, нейрофиламента и нестина. Выявление маркеров осуществляют методом согласно инструкции производителя антител. Ядра клеток окрашивают DAPI (0,1 мкг/мл) в течение 10 мин. Для получения изображений и анализа используют флюоресцентный микроскоп «Olympus ВХ-51» и программные продукты «Applied Spectral Imaging» (USA). Для анализа каждого маркера эксперимент повторяют трижды, наращивая нейрональные клетки в трех флаконах, в каждом из которых случайным образом выделяют 6 зон для проведения анализа иммуноцитохимической реакции. Микроскопирование проводят по каждой зоне в 30 полях зрения.
Результаты морфологического анализа матрицы показали, что содержание клеток нейрональной природы на одной подложке площадью 30 кв.см, составляет около 7 миллионов.
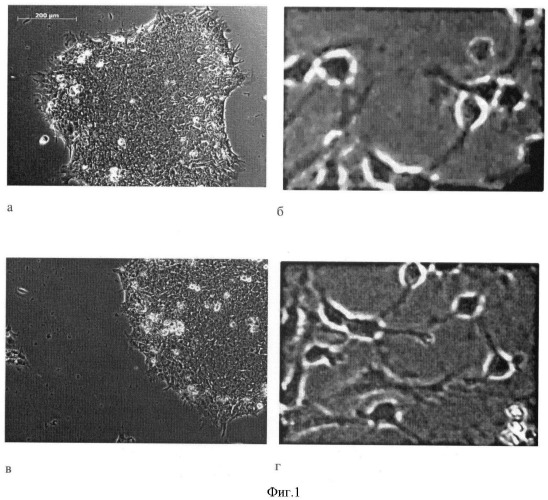
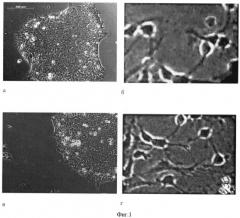
На фиг.1 показаны результаты фазово-контрастной микроскопии культивируемых ЭСК человека, пассированных на коллаген-хитозановых матрицах в течение 1-14 дней в присутствии кондиционированной среды (а - 1-й день, б - 14-й день). При использовании нейрональной кондиционированной среды или среды ДМЭМ с добавлением нейронального компонента N2 на 1 и 14-е сутки культивирования на коллаген-хитозановой матрице происходит дифференцировка ЭСК в нейрональном направлении: появление жизнеспособных клеток с веретенообразной формой, характерными отростками, формирующими межклеточные связи (в -1-й день, г - 14-й день).
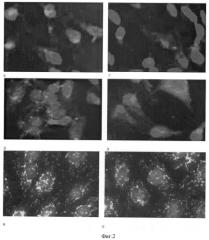
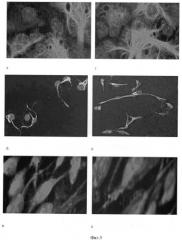
На фиг.2 показана динамика экспрессии нейрофиламента на 1, 7 и 14 сутки в клетках, культивируемых на коллаген-хитозановом комплексе в присутствии кондиционированной среды (а, б, в) или при добавлении N2 комплекса (г, д, е). Исследование морфологии клеток показало, что ЭСК после культивирования в вышеописанных условиях способны приобретать нейрональный фенотип. Иммуноцитохимический анализ ЭСК в процессе дифференцировки подтверждает экспрессию одного из нейрональных маркеров - нейрофиламента. Было выявлено, что на 1-е сутки в обоих случаях отсутствуют сигналы флюоресценции по указанному маркеру. Появление нейрофиламента регистрируется на 5-7-е сутки культивирования как в кондиционированной среде, так и в среде с добавлением фактора N2 (фиг.2). На фиг.3 показан иммуноцитохимический анализ ЭСК в кондиционированной среде, полученной от культивирования эмбриональных нейрональных клеток мышей (а, б, в), или в среде с добавлением N2 компонента (г, д, е). Клетки фиксировали 1% формальдегидом в фосфатном буфере, обрабатывали антителами против глиального фибриллярного кислого белка (а, г), нестина (б, д) и нейрофиламента (в, е) с последующим мечением вторичными антителами и детекцией флюоресценции. Уже на 5-е сутки появляется экспрессия GFAP, нестина и нейрофиламента при культивировании ЭСК в кондиционированной эмбриональными нейрональными клетками среде, а на 7-й день - и в клетках, культивируемых в среде с добавлением N2 компонента.
Таким образом, предлагаемый способ получения нейрональной матрицы повышает качество, стабильность культивирования и пролиферативную активность стволовых плюрипотентных клеток с их дифференцировкой в клетки нейрональной природы, исключает иммуногенность микроокружения клеток и обеспечивает получение клеточной матрицы, пригодной для прямой трансплантации.
Источники информации
1. Zuo J. Degradation of chondroitin sulfate proteoglycan enhances the neurite-promoting potential of spinal cord tissue / J. Zuo, D.Neubauer, K.Dyess, T.A.Ferguson, D.Muir // Exp. Neurol - 1998. - Vol.154. - P. 654-662.
2. Moon L.D., Regeneration of CNS axons back to their target following treatment of adult rat brain with chondroitinase ABC / L.D.Moon, R.A.Asher, K.E.Rhodes, J.W.Fawcett // Nat. Neurosci. - 2001. - Vol.4. - P.465-466.
3. Bradbury E.J. Chondroitinase ABC promotes functional recovery after spinal cord injury / E.J.Bradbury, L.D.Moon, R.J.Popat, V.R.King, G.S.Bennett, P.N.Patel, J.W.Fawcett, S.B.McMahon // Nature - 2002. - Vol.416. - P.636-640.
4. Bregman B.S. NeurotiOphic factors increase axonal growth after spinal cord injury and transplantation in the adult rat / B.S.Bregman, M.McAtee, H.N.Dai, P.L.Kuhn / Exp. Neurol. - 1997. - Vol.148. - P.475-494.
5. Kobayashi BDNF and NT-4/5 prevent atrophy of rat rubrospinal neurons after cervical axotomy, stimulate GAP-43 and Tal- tubuln mRNA expression and promote axonal regeneration / Kobayashi et. al. // J Neurosci. - 1997. - Vol.17. - P.9583-9595.
6. Liu Y. Transplants of fibroblasts genetically modified to express BDNF promote regeneration of adult rubrospinal axons and recovery of forelimb recovery / Y.Liu, D.Kim, B.T.Himes, S.Y.Chow, T.Schallert, M.Murray, A.Tessler, I.Fischer // J.Neurosci. - 1999. - Vol.19. - P.4370-4387.
7. Патент US №7163545 от 16.01.2007, www.freepatentsonline.
8. Патент РФ №2195941, МПК7 A61K 35/48, A61K 35/54, A61B 17/00, БИПМ №1, 10.01.2003.
9. Рабинович С.С.Трансплантация стволовых клеток при лечении повреждений спинного мозга / С.С.Рабинович, В.И.Селедцов, О.В.Повлеченко, В.В.Сеньюков, С.А.Савченко, И.А.Волчек, В.И.Ярохно, Н.Г.Колосов, В.А. // Вестник военно-медицинской академии. - 2003. - Т.2. - С. 121-126.
10. Патент РФ №2249462, МПК7 А61К 38/39, А61К 35/12, БИПМ №10, 10.04.2005.
11. Патент РФ №2316334, МПК8 А61К 35/64, А61К 36/18, А61В 5/05, БИПМ №4, 10.02.2008.
12. Брюховецкий И.С., Ушаков С.О. Клинико-патогенетическое обоснование применения фетальных тканей человека при заболеваниях центральной нервной системы. // В сборнике статей «Трансплантация фетальных тканей и клеток человека». М. - 1996. - С.53-56.
13. Брюховецкий И.С., Дюйзен И.В., Мотавин П.А. Морфохимическая характеристика спинного мозга крыс после торакальной сегментэктомии и трансплантации полимерного коллагенового матрикса «Сферогель-Э» с инкорпорированными обкладочными нейроэпителиальными клетками. // Клеточная трансп. и тканевая инж. - 2008. - Т.3. - №2. - С.57-62.
14. Bryan D.J., Tang J.B., Doherty S.A., Hile D.D., Trantolo D.J., Wise D.L., Summerhayes I.C. Enhanced peripheral nerve regeneration through a poled bioresorbable poly(lactic-co-glycolic acid) guidance channel. // J. Neural. Eng. - 2004. - Vol.1 (2). - P.91-98.
15. Rutkowski G.E., Miller C.A., Jeftinija S., Mallapragada S.K. Synergistic effects of micropatterned biodegradable conduits and Schwann cells on sciatic nerve regeneration. // J.Neural. Eng. - 2004. - Vol.1. - P.151-157.
16. Chen P., Marsilio E., Goldstein R.H., Yannas I.V., Spector M. Formation of lung alveolar-like structures in collagen-glycosaminoglycan scaffolds in vitro. // J.Tissue Eng. - 2005. - Vol.11(9-10). - P.1436-1448.
17. McDonald J.W., Liu X.Z., Qu Y. Transplanted embryonic stem cells survive, diffentiate, and promote recovery in injured rat spinal cord. // Nat. Med. - 1999. - 5(12). - P.1410-1412.
18. Wichterle H, Lieberam I, Porter JA, Jessell TM. Directed differentiation of embryonic stem cells into motor neurons. //Cell.- 2002. - Vol.110(3). - P.385-397.
19. Еремеев А.В., Зотова Н.В., Власов А.А., Большаков И.Н., Светлаков А.В. Способ получения клеточной матрицы кожи. Заявка на изобретение №2008131742/15, МПК8 C12N 5/00, БИПМ №4, 10.02.2010.
20. Еремеев А.В., Светлаков А.В., Большаков И.Н., Власов А.А., Арапова В.А. Жизнеспособность и функции плюрипотентных клеток и фибробластов дермально-эпидермального слоя животных в условиях их культивирования на коллаген-хитозановых покрытиях // Сибирское медицинское обозрение. - 2008, №6(54). - С.24-27.
21. Патент РФ №2252787, МПК7 A61L 15/28, A61L 15/32, A61L 27/60, БИПМ №15, 27.05.2005.
22. Патент РФ №2254145, МПК7 A61L 15/28, A61L 15/32, A61L 26/00, БИПМ №17, 20.06.2005.
1. Способ получения нейрональной матрицы, отличающийся тем, что биомассу эмбриональных стволовых клеток человека бесфидерной линии hESKM-05 первоначально наращивают во флаконах, покрытых 0,1%-ным раствором желатина, с использованием и ежедневной сменой основной среды коДМЕМ, содержащей 10%-ным заменитель сыворотки SR, 100 мкг/мл канамицина сульфата, 1 мМ раствора L-глутамина, 4нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствора незаменимых аминокислот, а затем переносят с помощью 0,5%-ного раствора коллагеназы во флаконы, содержащие подготовленную коллаген-хитозановую матрицу в кондиционированной среде, полученной от культуры эмбриональных нейрональных клеток мышей, или в полной питательной среде с добавлением нейронального фактора N2, которую меняют каждые трое суток.
2. Способ по п.1, отличающийся тем, что коллаген-хитозановую матрицу используют в виде губки, пленки, микросфер, геля или волокон.